文章信息
- 刘生冬, 孟庆繁, 高文韬, 李燕
- Liu Shengdong, Meng Qingfan, Gao Wentao, Li Yan
- 张广才岭南段阔叶红松林天牛科昆虫物种多样性与成虫出现期时间动态
- Cerambycidae Species Diversity and Temporal Dynamics of Adults emergence in Broad-Leaved Korean Pine Forest of Southern Zhangguangcai Mountains
- 林业科学, 2016, 52(2): 74-81
- Scientia Silvae Sinicae, 2016, 52(2): 74-81.
- DOI: 10.11707/j.1001-7488.20160209
-
文章历史
- 收稿日期:2014-08-28
- 修回日期:2015-10-14
-
作者相关文章
2. 吉林省林业调查规划院 长春 130022;
3. 北华大学林学院 吉林 132013
2. Investigation and Plan Institute of Jilin Province Changchun 130022;
3. College of Forestry, Beihua University Jilin 132013
天牛科(Cerambycidae)昆虫为鞘翅目(Coleoptera)中较大的类群,其幼虫多蛀食衰弱林木枝、干,少数危害活立木,是重要的钻蛀性害虫。部分天牛幼虫属于腐食性种类,对促进森林生态系统物质循环具有重要作用(嵇保中等,2002; 蒋书楠等,2001),还有一些种类的成虫具有访花习性,扮演着传粉者的角色(高文韬等,2005; 郭彦林,2012)。
在国外,对天牛物种多样性的研究主要集中在热带森林天牛科昆虫物种多样性和区系组成(Noguera et al., 2002; Toledo et al., 2002; Ohsawa,2004)、不同林龄的林分以及枯倒木对天牛物种多样性的影响等方面(Lassauce et al., 2013; McGeoch et al., 2007; Boucher et al., 2012; Grove,2002; Saint-Germain et al., 2006);在国内,主要集中在种类鉴定、区系分布以及不同林分天牛科昆虫物种多样性等方面(高文韬,1994;1995; 张健,2011; 刘生冬等,2015)。由于受到天牛成虫活动规律以及取样方法等限制,对天牛物种多样性以及时间动态研究较少。
飞行拦截诱捕器的应用,为包括天牛科昆虫在内的飞翔能力较强的甲虫成虫物种多样性研究提供了比较科学的采样方法(Graham et al., 2012; Boucher et al 2012., ; Lamarre et al., 2012),天牛科昆虫不同类群信息素及具有生物活性的寄主植物挥发物 与飞行拦截诱捕器结合用于天牛科昆虫调查,提高了物种多样性研究的取样效率(Hanks et al, 2012; 2013; 2014; 刘生冬等,2015)。
本研究采用漏斗式和挡板式拦截诱捕器,并配合乙醇和天牛亚科通用信息素诱芯,在张广方岭南段阔叶红松(Pinus koraiensis)林内设置诱捕器阵列连续采集天牛科昆虫成虫,以期查明该地区阔叶红松林中天牛科昆虫成虫物种组成,探索时间变化对天牛科成虫物种多样性的影响,为天牛科昆虫的种群监测和生物指示种的利用提供参考。
1 研究区概况试验地位于张广才岭南段吉林省蛟河林业实验区管理局内,地理位置127°35′—127°51′ E, 43°51′—44°05′ N。区内地势起伏大,东部和北部山高坡陡,南部山低坡缓,最高峰海拔 1 176 m,最低点海拔330 m。属温带大陆季风性气候,年平均温度3.5 ℃,平均降水量700~800 mm,集中在6—8月。植被属于长白山植物区系,植物种类丰富。主要植被类型是阔叶红松林及衍生的次生林(范春雨等,2014; 要伊桐等,2014)。
2 研究方法 2.1 调查方法样地设置: 在试验区内,根据林分因子和采伐干扰等条件选择代表性强的林分,设置5块调查样地,每块约300 m×400 m,用GPS确定坐标,样地的立地条件和树种组成、林龄、郁闭度等林分因子如表 1所示。
|
|
天牛成虫采集: 在样地设置漏斗式和挡板式飞翔拦截式诱捕器(Alpha Scents Inc,美国),并辅以天牛亚科昆虫通用信息素3-羟基-2辛醇、3-羟基-2-己醇、己二醇和乙醇控释诱芯(Contech,加拿大)诱集天牛科昆虫成虫(Hanks et al., 2012),每块样地布设48个诱捕器阵列,用铁丝将诱捕器悬挂于 2 株树之间,诱捕器距离树干大于1 m,诱捕器昆虫标本收集杯距地面30 cm左右,2个诱捕器之间距离大于30 m。样本收集杯中加入饱和盐水,以防止天牛标本腐烂(刘生冬等,2015)。
调查时间: 2012年、2013年5月中旬在各调查样地布设诱捕器阵列,9月中旬回收诱捕器,标本采集时间涵盖整个天牛成虫活跃期。每隔1~2周收集1次诱捕器内捕获的所有标本,并分别保存、编号,制成针插标本。所有标本保存在北华大学林学院昆虫标本室。
2.2 数据处理与分析方法 2.2.1 天牛成虫飞翔期分布分析为更好地描述和比较天牛成虫活跃期(飞翔期)分布的特点,采用顺序日期表示各特定物种被采集到的时间,即将1年36旬按顺序赋予顺序日期值,1月上旬赋予顺序日期值为0,中旬为10,……,5月下旬为140; 6月为150,160,170; 7月为180,190,200; 8月为210,220,230; 9月上旬为240等,仅考虑各采集时间段特定物种的有无,而不考虑个体数(Hanks et al., 2013)。
2.2.2 多样性分析多样性分析采用以下参数:物种丰富度采用Margalef指数:D=S-1/lnN;物种多样性采用Shannon-Wiener指数:H′=-∑si=1PilnPi;均匀度采用Pielou指数: J′=H′/ lnS。式中:Pi=ni/N,为第i种个体数(ni)占个体总数N的比例;S为物种数。
相似性分析采用Jaccard系数: I=C/(A+B-C)。式中: A,B分别为2种生境中的物种数,C为2种生境中共有的物种数。根据Jaccard的相似性系数原理,当I为0.00~0.25时,为极不相似,0.25~0.50时为中等不相似,0.50~0.75时为中等相似,0.75~1.00时为极相似。
物种的优势度根据个体数占群落总个体数的比例确定,大于10%的为优势种,1%~10%的为常见种,小于1%的为稀有种。
相关性分析采用Pearson相关系数,利用单因素方差分析(one-way ANOVE)和最小显著法进行多重比较(LSD)并进行显著性检验,所有数据和图形使用SPSS19.0、Excel2007和Sigmaplot12.5软件进行处理。
3 结果与分析通过2年连续高频次的诱捕,在试验地共采集到天牛科昆虫成虫标本1 252号,隶属7亚科41属 64种,其中,沟胫天牛亚科(Lamiinae)11属20种245头,花天牛亚科(Lepturinae)15属25种411头,天牛亚科(Cerambycinae)10属14种494头,锯天牛亚科(Prioninae)1属1种12头,膜花天牛亚科(Necydalinae)1属1种16头,瘦天牛亚科(Disteniinae)1属1种13头,锥天牛亚科(Aseminae)牛(Gaurotes ussuriensis)和棍腿纹虎天牛(Anaglyptus colobotheoidae)为优势种,分别占个体数的12.33%和10.36%; 稀有种(44种)占物种总数的68.75%,常见种(18种)占物种总数的28.13%。
3.1 天牛科昆虫类群组成的时间动态不同月份天牛科昆虫类群组成见表 2。从表 2可以看出,天牛科昆虫属数最多为6月34属,各月从多到少顺序为6月,7月,8月,5月,9月,物种数7月最多(53种),占总数的82.81%,各月从多到少顺序为7月,6月,8月,5月,9月。个体数量7月最多(521个),占总数的41.62%,各月从多到少顺序为7月,6月,8月,5月,9月。虽然天牛属数、种数和个体数量最高值不完全出现在同一个月份,但经相关性分析,属数与种数呈极显著正相关(R=0.977,P=0.004),与个体数呈显著正相关(R =0.910,P=0.032); 种数与个体数呈显著正相关(R=0.953,P=0.012)。
|
|
5月的优势种为棍腿纹虎天牛、黑胸短虎天(Brachyclytus singularis),分别占当月个体数的64.49%和12.71%; 6月的优势种为凹缘金花天牛、栎丽虎天牛(Plagionotus pulcher)、棍腿纹虎天牛,分别占当月个体数的18.72%,11.45%和15.42%; 7月的优势种为凹缘金花天牛,占当月个体数的19.58%; 8月的优势种为四点象天牛(Mesosa myops)、桦脊虎天牛(Xylotrechus clarinus),分别占当月个体数的11.11%和19.61%; 9月种类较少,四点象天牛、黄褐驼花天牛(Pidonia aegrota)和桦脊虎天牛均为优势种,分别占当月天牛总数16.67%,16.67%和66.67%。
3.2 天牛科昆虫种-多度分布时间动态为更好地分析天牛科昆虫种-多度关系,本研究采用Rarefaction曲线法描述物种丰富度与个体丰富度。基于不同月份构建的Rarefaction曲线如图 1所示。从图 1可以看出,5月和9月物种数量明显少于其他月份,而个体数量5月明显高于9月,这是由于5月棍腿纹虎天牛数量较大。5条曲线除了在起始点外互不相交,7月位于最上面,表明7月的天牛群落多样性最高,其次是6月,各月大小顺序为7月>6月>8月>5月>9月;同时该曲线也反映出在5个月份中,如果持续增加取样,天牛的种类还会增加,但5月增加的会相对缓慢。如果抽取等量的天牛,7月会表现出较高的多样性,其次是6月;同时各个月份的稀有种类较多。
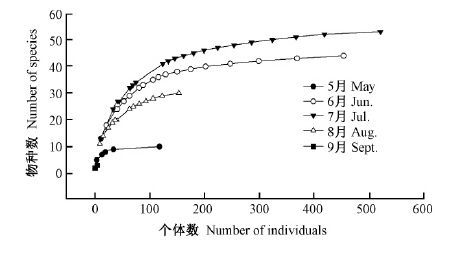
|
图1 不同月份天牛科成虫种—个体数的 Fig.1 Rarefaction curve based on species-individuals of Cerambycidae adults in different months |
采集到的64种天牛科昆虫成虫活跃期的分布如表 3所示。 从表 3可以看出,四点象天牛在5个月份均有分布; 柳角胸天牛、柳坡天牛、斑胸驼花天牛、曲纹花天牛、棍腿纹虎天牛、黑胸短虎天牛、桦脊虎天牛在4个月份中有分布; 分布在3个月份的天牛有12种; 分布在2个月份的天牛有27种;只在1个月份分布的天牛为17种,其中,只在一次捕获的种类有13种。表 3中顺序日期的平均值表示天牛出现的平均时间,值越小说明天牛出现的平均时间越早,值越大说明出现的平均时间越晚。各天牛出现顺序日期的平均值不同,也有较大波动,黑带宽花天牛出现的平均活跃时间最早,黄褐驼花天和锯天牛出现的平均活跃时间较晚。经方差分析,锯天牛亚科、瘦天牛亚科与其他5个亚科出现的平均顺序日期有显著差异(F (6,207)=2.44,P=0.026),依次为: 锯天牛亚科(220±10)=瘦天牛亚科(220±10)>天牛亚科(187±25)=沟胫天牛亚科(187±24)>花天牛亚科(183±25)>锥天牛亚科(177±15)>膜花天牛亚科(175±13)。
|
|
物种数和个体数量能够直观地反映天牛科昆虫多样性在不同时间的变化情况,不同顺序日期天牛类群的种数和个体数量如图 2,3所示。
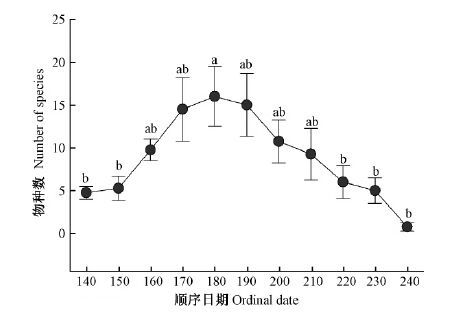
|
图2 天牛科成虫种物数顺序日期动态 Fig.2 The ordinal dates dynamics of species number of Cerambycidae adults |
由图 2可以看出,天牛种数从顺序日期140时开始逐渐上升,到180时达到最大值,然后逐渐降到240时为最低值;经方差分析,不同顺序日期天牛群落物种数差异极显著(F (10,33)=4.23,P=0.001),顺序日期180时极显著高于140,150,220,230和240时。由图 3可以看出,天牛个体数量从顺序日期140时开始下降,至150后开始逐渐升高,到达170时为最大值,然后逐渐降低;经方差分析,不同顺序日期天牛群落个体数量差异极显著(F (10,33)=3.56,P=0.003),顺序日期170时极显著高于150,160,210,220,230和240时,顺序日期180时极显著高于150,220,230和240时。从图 2和图 3中可以看出天牛群落种数和个体数出现的最高点的顺序日期并不相同,最低点相同,整体变化趋势不完全相同,但物种数与个体数呈极显著正相关(R=0.848,P=0.001)。
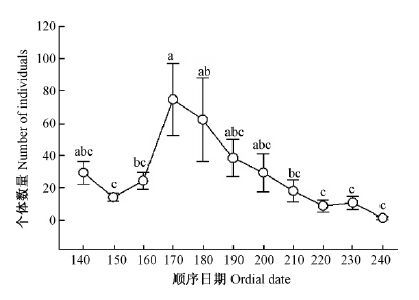
|
图3 天牛科成虫个体数顺序日期动态 Fig.3 The ordinal dates dynamics of individuals number of Cerambycidae adults |
从表 4可以看出,丰富度指数在顺序日期180时最高,其次是190,240时最低,各顺序日期大小为180>190>210>170>200>160=200>230>150>140>240;不同顺序日期丰富度指数差异极显著(F(10,29)=5.606,P=0.001),日期180和190时极显著高于140,150,230和240时,日期210极显著高于140,150和240,日期200时极显著高于140和240时。对稀有种比较敏感的Shannon-Wiener指数最高出现在顺序日期180时,其次是190时,大小顺序为180>190>170>200>160>210>220>230>150>140>240。不同顺序日期多样性指数差异极显著(F(10,31)=9.042,P=0.001),日期180,190时极显著高于140时,日期240极显著高于170和240时。均匀度指数最高出现在顺序日期220时,大小顺序为220>240>200>190=210>160>170>180>150>140,不同顺序日期均匀度指数差异极显著(F(10,28)=9.042,P=0.006),日期200和220时显著高于140和150时。
|
|
从表 5可以看出,6月与7月相似性系数(0.59)最高,而9月与其他各个月的相性系数都很低,这主要是由于9月所捕获的天牛种类(3种)少所造成的。根据Jaccard的相似性系数原理,只有6月与7月达到中等相似水平,7月与8月和6月与8月处于中等不相似水平,其他月份间都处于极不相似水平。
|
|
本研究共采集到天牛科成虫标本1 252号,隶属7亚科41属 64种。由于在各样地采用数量相同的拦截诱捕器阵列在天牛成虫期进行高频度的连续采集,因此比较客观地反映了各林分中天牛科物种的分布状况和时间变化,同时,各林分生境不同,使得各林分间天牛科昆虫的多样性表现出较大的差异(刘生冬等,2015)。在全部的天牛种类中,不同种类成虫活跃期开始时间的早晚、活跃期持续时间的长短等均不相同,只有四点象天牛在5个月份都有分布。天牛科昆虫物种数量和个体数量出现的高峰期是在顺序日期170时(6月下旬)190时(7月中旬),然后逐渐下降,日期170时天牛种群的个体数量达到最高,主要是由于凹缘金花天牛、栎丽虎天牛和棍腿纹虎天个体数量迅速增加引起,顺序日期140时(5月下旬)天牛群落的个体数量较多是由于棍腿纹虎天牛较多引起的。
4.2 讨论本次研究天牛科昆虫分布的时间规律与Hanks等(2013; 2014)研究加拿大天牛的分布时间相似,即天牛类群活动期主要从5月下旬开始,8月下旬基本结束,到9月只有个别种类在活动;然而,Hanks等研究天牛物种数和个体数最高峰出现在顺序日期190时,然后依次为170,150和210时,这可能是由于与本研究在试验地气候条件、立地条件以及天牛区系等方面的不同造成的。本研究天牛科昆虫在顺序日期170,180和190时表现出较高的多样性,主要是由于这个时间适宜的环境条件导致天牛群落羽化达到高峰或达到活跃的最高峰,这个时间也是植物开花的盛期,部分具有访花行为的天牛大量出来活动(高文韬等,2005),使天牛群落的物种多样性的各个指标都很高。从顺序日期220时开始随着温度的降低、羽化高峰的结束,天牛的种类和数量开始减少,多样性逐渐降低。由于天牛优势种较少,个体数比较均匀,使多样性较低的顺序日期210,220和230具有较高的均匀度。同时,由于天牛成虫的活动期较长,时间跨度较大,使各个月份间都存在共有种,6月和7月达到中等相似水平,这主要是由于从6月下旬开始气温升高,林内的植物生长茂盛,天牛种群羽化和活跃度都逐渐达到高峰,同时成虫的活动期较长,导致这2个月份天牛相似性最高。从7月到8月随着天牛羽化高峰的结束,一些天牛退出或活跃度降低,导致这2个月份间相似性略有降低。
各月份的天牛优势种类不完全相同,这进一步反映出天牛种类羽化时间或活跃期的多样性。 有13种天牛只在1次调查中被采集到,说明这些种类成虫活跃期相对较短,对环境变化比较敏感。对优势天牛种类成虫活跃的高峰期应该给予更多关注,尤其对一些有潜在成灾风险的种类种群进行监测具有重要的价值。本研究通过对11个天牛标本回收时间点进行系统分析,在科学描述各天牛种类成虫活跃期时间动态规律的同时,首次实现了各种天牛成虫活跃期的精确比较。掌握各天牛种群出现的时期对于害虫种类的种群监测和生物指示种的利用均具有重要的参考价值。
| [1] |
范春雨,元正龙,赵秀海.2014. 吉林蛟河近熟林树种多样性格局尺度依赖性分析. 北京林业大学学报,36(6):73-79. (Fan C Y, Yuan Z L, Zhao X H.2014. Scale dependence of species diversity pattern in a near-mature forest in Jiaohe of Jilin Province. Journal of Beijing Forestry University, 36(6):73-79.[in Chinese])(  1) 1)
|
| [2] |
高文韬,孟庆繁,郑兴波,等.2005.长白山北坡访花天牛区系研究.昆虫知识,42(6):691-694. (Gao W T, Meng Q F, Zheng X B, et al. 2005. Fauna of flower-visiting longicorn beetles in north slope of Changbai Mountain. Chinese Bulletin of Entomology, 42(6):691-694.[in Chinese])(  2) 2)
|
| [3] |
高文韬,孙万才,王旭东,等.1994.吉林省天牛科(Cerambycidae)昆虫区系初析.吉林林学院学报,10(1):25-33. (Gao W T, Sun W C, Wang X D, et al. 1994. A preliminary analysis on the Cerambycidae insect fauna in Jilin Province.Journal of Jilin Forestry Institute, 10(1):25-33.[in Chinese])(  1) 1)
|
| [4] |
高文韬,张德君,张生,等.1995.吉林林学院实验林场森林昆虫区系研究.吉林林学院学报,11(3):181-184. (Gao W T, Zhang D J, Zhang S, et al. 1995. Study on forest insect fauna in experimental forest farm of Jilin Forestry University. Journal of Jilin Forestry Institute, 11(3):181-184.[in Chinese])(  1) 1)
|
| [5] |
郭彦林,孟庆繁,高文韬.2012.长白山高山草甸植物-传粉昆虫相互作用网络可视化及格局分析.林业科学,48(12):141-147. (Guo Y L, Meng Q F, Gao W T. 2012. Visulization and pattern analysis of plant-Insect pollinator interaction networks in subalpine meadow in Changbai Mountain. Scientia Silvae Sinicae, 48(12):141-147.[in Chinese])(  1) 1)
|
| [6] |
嵇保中,魏勇,黄振裕.2002.天牛成虫行为研究的现状与展望.南京林业大学学报:自然科学版,26(2):79-83. (Ji B Z, Wei Y, Huang Z Y. 2002. Present situations and prospects of researches on adult's behavior of longicorn beetles.Journal of Nanjing Forestry Unversity:Natural Sciences Editon, 26(2):79-83.[in Chinese])(  1) 1)
|
| [7] |
蒋书楠,陈力.2001.中国动物志.昆虫纲(21).鞘翅目.天牛科.花天牛亚科.北京:科学出版社,1-223. (Jiang S N, Cheng L. 2011. China fauna. Insects(21). Coleoptera. Cerambycidae. Lepturinae.Beijing:Science Press,1-223.[in Chinese])(  1) 1)
|
| [8] |
刘生冬,高文韬, 李燕,等. 2015. 张广才岭南段不同林分天牛科昆虫物种多样性比较.北京林业大学学报,37(5):110-118. (Liu S D, Gao W T, Li Y, et al. 2015. Comparative study of Cerambycidae species diversity in different forest stands of southern Zhangguangcai Mountains. Journal of Beijing Forestry University, 37(5):110-118.[in Chinese])(  4) 4)
|
| [9] |
张健.2011.吉林省天牛科昆虫分类学研究. 长春:东北师范大学博士学位论文,13-26. (Zhang J.2011. Taxonomic Study on the Cerambycidae in Jilin Province. Changchun:PhD thesis of Northeast Normal University, 13-26.[in Chinese])(  1) 1)
|
| [10] |
要伊桐,元正龙,魏彦波,等.2014. 长白山次生杨桦林树种多样性格局多尺度分析. 北京林业大学学报,36(6):86-92. (Yao Y T, Yuan Z L, Wei Y B, et al.2014. Multi-scale analysis on tree diversity pattern in a secondary Populus davidiana-Betula platyhylla forest in Changbai Mountains, Journal of Beijing Forestry University, 36(6):86-92.[in Chinese])(  1) 1)
|
| [11] |
Boucher J, Azeria E T, Ibarzabal J, et al. 2012. Saproxylic beetles in disturbed boreal forests:Temporal dynamics, habitat associations, and community structure. Ecoscience, 19(4):328-343.( 2 2
|
| [12] |
Graham E E, Poland T M, Mccullough D G, et al. 2012. A comparison of trap type and height for capturing cerambycid beetles (Coleoptera). Journal of Economic Entomology, 105(3):837-846.( 1) 1)
|
| [13] |
Grove S J. 2002. The influence of forest management history on the integrity of the saproxylic beetle fauna in an Australian lowland tropical rainforest. Biological Conservation, 104(2):149-171.( 1) 1)
|
| [14] |
Hanks L M, Millar J G, Mongold-Diers J A, et al. 2012. Using blends of cerambycid beetle pheromones and host plant volatiles to simultaneously attract a diversity of cerambycid species. Canadian Journal of Forest Research, 42(6):1050-1059.( 2) 2)
|
| [15] |
Hanks L M, Millar J G. 2013. Field bioassays of cerambycid pheromones reveal widespread parsimony of pheromone structures, enhancement by host plant volatiles, and antagonism by components from heterospecifics.Chemoecology, 23(1):21-44.( 2) 2)
|
| [16] |
Hanks L M, Reagel P F, Mitchell R F, et al. 2014. Seasonal phenology of the Cerambycid beetles of east Central Illinois. Conservation Biology and Biodiversity,107(1):211-218.( 2) 2)
|
| [17] |
Lamarre G P A, Molto Q, Fine P V A, et al. 2012. A comparison of two common flight interception traps to survey tropical arthropods. ZooKeys, 216:43-55.( 1) 1)
|
| [18] |
Lassauce A, Larrieu L, Paillet Y, et al. 2013. The effects of forest age on saproxylic beetle biodiversity:implications of shortened and extendedrotation lengths in a French oak high forest. insect Conservation and Diversity, 6(3):396-410.( 1) 1)
|
| [19] |
McGeoch M A, Schroeder M, Ekbom B, et al. 2007. Saproxylic beetle diversity in a managed boreal forest:importance of stand characteristics and forestry conservation measures. Diversity and Distributions, 13(4):418-429.( 1) 1)
|
| [20] |
Noguera F A, Zaragoza-Caballero S, Chemsak J A, et al. 2002. Diversity of the family Cerambycidae (Coleoptera) of the tropical dry forest of Mexico I. Sierra de Huautla, Morelos. Annals of the Entomological Society of America, 95(5):617-627.( 1) 1)
|
| [21] |
Ohsawa M. 2004. Species richness of Cerambycidae in larch plantations and natural broad-leaved forests of the central mountainous region of Japan. Forest Ecology and Management, 189(3):375-385.( 1) 1)
|
| [22] |
Saint-Germain M, Buddle C M, Drapeau P. 2006. Sampling saproxylic Coleoptera:Scale issues and the importance of behavior. Environmental Entomology, 35(2):478-487.( 1) 1)
|
| [23] |
Toledo V H, Noguera F A, Chemsak J A, et al. 2002. The cerambycid fauna of the tropical dry forest of "El Aguacero", Chiapas,México (Coleoptera:Cerambycidae).The Coleopterists Bulletin, 56(4):515-532.( 1) 1)
|
 2016, Vol. 52
2016, Vol. 52

