文章信息
- 詹妮, 黄烈健
- Zhan Ni, Huang Liejian
- 大叶相思花粉离体萌发适宜条件及活力检测方法
- Conditions for in vitro Germination and Testing Method for Pollen Viability of Acacia auriculiformis
- 林业科学, 2016, 52(2): 67-73
- Scientia Silvae Sinicae, 2016, 52(2): 67-73.
- DOI: 10.11707/j.1001-7488.20160208
-
文章历史
- 收稿日期:2015-04-03
- 修回日期:2015-05-29
-
作者相关文章
金合欢属(Acacia)树种,因其速生丰产、固氮改土、材质优良等特点,从20世纪60年代我国开始引进,已有20多种引种成功,主要分布在我国广东、海南、广西、云南以及福建等地(陆道调等,2004)。大叶相思(Acacia auriculiformis)原产于澳大利亚昆士兰、巴布亚新几内亚南部和西部、伊里安岛、印度尼西亚基岛(Turnbull et al., 1986),具有生物量大、速生丰产、材质优良、适应性强、抗逆性强、根瘤发达、固氮能力强、纤维较长等特点(潘志刚等,1994),是在我国北回归线以南地区具有广阔发展前景的环境保护、荒山造林及薪炭材树种(黄世能等,1992)。作为速生抗风优良杂种马大相思(Acacia mangium× A. auriculiformis)的父本,其生殖生物学研究受到许多研究者的重视(Nor Asmah et al., 2012)。
花粉是开展人工授粉及杂交育种最基本也是最重要的材料,开展其相关研究对人工授粉及杂交育种工作具有重要意义。在进行大叶相思控制授粉时,为解决其花期不遇以及跨地区的授粉等问题,因此有大量收集及贮藏花粉的需求。大叶相思是16合花粉粒,其直径为30~40 μm,花粉极小、不易收集(李军等,2010)。Kato等(2012a)采用聚乙烯试管(直径0.5 cm,长度7 cm)收集大叶相思花粉,但其采用的收集方法受雄蕊散粉时间的限制使得收集花粉的时间十分短暂,收集的花粉数量较少,且不利于后期大量授粉等研究的用途。花粉活力对育种工作影响很大,授粉前对花粉活力检测至关重要。尽管Kato等(2012b)采用200 g·L-1蔗糖+10 g·L-1琼脂,在23 ℃下培养48 h,研究大叶相思花粉的萌发率,但其并没有经过系统试验设计来深入探讨不同的培养基处理对大叶相思花粉萌发率的影响,其花粉活力的检测方法是否最佳、是否能广泛应用,不能确定。因此,开展花粉离体萌发培养以及确定适宜的花粉活力测定方法,对开展大叶相思的育种研究具有重要意义。
本研究在成功收集大叶相思花粉的基础上,采用花粉离体萌发法、I2-KI染色法(张志良,2000)以及过氧化物酶染色法(姜雪婷等,2006),对其新鲜花粉活力进行较为系统的研究,建立了有效、快速的花粉活力检测方法,旨在为今后开展相思杂交育种等研究奠定基础。
1 材料与方法 1.1 材料供试材料取自大叶相思种子园,该种子园位于广东省江门市新会区国家重点相思良种基地,该地区属亚热带海洋性气候。该种子园是1998年1月通过嫁接建立的大叶相思无性系种子园,面积2 hm2,株行距为5 m×8 m。
1.2 方法 1.2.1 大叶相思花粉收集方法选择1株生长状况良好、开花旺盛的大叶相思植株,在9:00以前采集当天开放的花穗装入硫酸纸袋中,放入25~30 ℃的室内阴干,待次日10:00花药大量爆裂之后收集花粉,用毛笔反复轻刷大叶相思花穗,并用200目筛子过筛,然后装入加有干燥硅胶的小玻璃瓶中,盖上盖抽真空待用。用此方法可以收集到较多的、较纯净的大叶相思花粉,用来检测以及保存研究。
1.2.2 大叶相思花粉活力测定方法1)I2-KI染色法 将1 g KI溶于10 mL蒸馏水中,加入0.5 g I2待其全部溶解后,加蒸馏水至200 mL,配好试剂后,贮于棕色瓶中备用。取收集好待用的大叶相思花粉置于载玻片上,滴加1~2滴配好的I2-KI溶液,1~2 min后,在显微镜下观察统计。每个载玻片分别取3个视野,被染成蓝紫色的为活力较强的花粉粒,呈黄褐色为发育不良的花粉粒,无色的为死亡花粉粒。
2)过氧化物酶染色法 取0.5 g联苯胺溶于100 mL 50%乙醇中,配成0.5%联苯胺溶液; 取0.5 g α-萘酚溶于100 mL 50%乙醇中,配成0.5% α-萘酚溶液; 取0.25 g Na2CO3溶于100 mL蒸馏水中,配0.25% Na2CO3溶液。将上述溶液各取10 mL混合均匀配成试剂1,放于棕色瓶中。载玻片上放少量大叶相思花粉,加试剂1和0.3% H2O2各1滴,搅匀后盖上盖玻片,放入30 ℃恒温箱中30 min后,在显微镜下观察统计。每个载玻片分别取3个视野,花粉粒为深红色则表示有活力,无色则表示已失去活力。
3)花粉管离体萌发法 为筛选出大叶相思花粉离体萌发的最佳培养条件,蔗糖浓度设4个水平: 50,100,150,200 g·L-1; 硼酸浓度设3个水平: 100,200,300 mg·L-1; 培养温度设3个水平: 28,30,32 ℃。每个载玻片上取2个视野,取平均值计算,3个重复。在显微镜下观察统计培养3,6,9,12,24 h(试验中发现,培养超过24 h有真菌污染,不便于显微镜观察检测,故本试验确定最终培养时间为24 h)时花粉萌发数量,萌发的花粉以萌发的花粉管长度超过1倍复合花粉粒的长度为标准。花粉管长度计数单位: 1 D=1倍的花粉粒长度。
1.2.3 数据分析统计每个视野大叶相思花粉萌发率、最长花粉管长度以及最多花粉管萌发条数,使用Excel,SPSS19.0软件对数据进行处理和方差分析,以最小显著差数法(LSD)以及邓肯(Duncan)多重比较评价差异的显著性。
染色法的花粉活力计算公式: 花粉活力(%)=平均每视野染色的花粉数/平均每视野花粉数×100; 离体萌发法的花粉活力计算公式: 花粉活力(%)=平均每视野萌发的花粉数/平均每视野花粉数×100。
2 结果与分析 2.1 不同培养温度对大叶相思花粉离体萌发的影响从表 1可以看出,大叶相思花粉在28 ℃的培养温度下平均萌发率为71.99%,显著(P<0.05)高于其他培养温度下的平均萌发率; 花粉管平均长度可达5.3 D,平均花粉管条数为6.2条,显著(P<0.05)高于其他培养温度下的处理。
2.2 不同蔗糖浓度对大叶相思花粉离体萌发的影响从表 2可以看出,在含有不同浓度蔗糖的培养基中培养的大叶相思花粉,其平均萌发率具有显著差异。当培养基中含有200 g·L-1蔗糖时,大叶相思花粉平均萌发率最高(84.96%),花粉管平均长度可达5.8 D,平均花粉管条数为6.2条,显著(P<0.05)高于在其他蔗糖浓度下培养的大叶相思花粉。
2.3 不同硼酸浓度对大叶相思花粉离体萌发的影响表 3表明培养基中硼酸浓度不同时,大叶相思花粉管平均长度存在显著差异,在含有300 mg·L-1硼酸的培养基中培养大叶相思花粉,其平均萌发率为75.32%,花粉管平均长度可达4.8 D,显著(P<0.05)高于其他硼酸浓度的处理。在此硼酸浓度下,其花粉管平均为5.4条,高于其他硼酸浓度下培养的大叶相思花粉。
|
|
|
|
|
|
不同培养温度、不同蔗糖和硼酸浓度下花粉萌发状况的多重比较结果(表 4)表明,大叶相思花粉在培养温度30 ℃、200 g·L-1蔗糖+300 mg·L-1硼酸的培养基中萌发率最高,为98.26%,显著(P<0.05)高于其他处理(表 4)。在28 ℃与30 ℃下培养时,大叶相思花粉萌发率呈现随蔗糖浓度增加而增加的趋势; 在蔗糖浓度为200 g·L-1时,其花粉萌发率随硼酸浓度增加而增加。
从表 4可以看出: 大叶相思花粉在培养温度为30 ℃、200 g·L-1蔗糖+300 mg·L-1硼酸的培养基中,在培养温度为28 ℃、150 g·L-1蔗糖+300 mg·L-1硼酸的培养基中,在培养温度为28 ℃、200 g·L-1蔗糖+100 mg·L-1硼酸的培养基中,花粉管长度均可达到10 D,显著(P<0.05)高于其他处理。
表 4表明,大叶相思花粉在培养温度为30 ℃、200 g·L-1蔗糖+300 mg·L-1硼酸的培养基中,在培养温度为28 ℃、100 g·L-1蔗糖+100 mg·L-1硼酸的培养基中,在培养温度为28 ℃、150 g·L-1蔗糖+300 mg·L-1硼酸的培养基中,花粉最多可萌发出10条花粉管,显著(P<0.05)高于其他处理。总体来看,大叶相思花粉管萌发的条数亦有随硼酸浓度增加而增加的趋势。
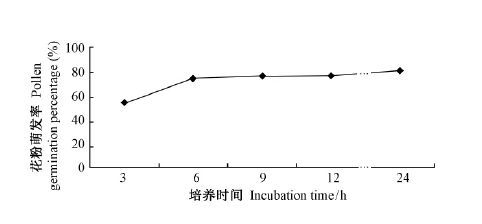
2.5 大叶相思花粉萌发过程大叶相思花粉在筛选出的最佳培养温度(30 ℃)、最适培养基(200 g·L-1蔗糖+300 mg·L-1硼酸)中培养24 h的萌发状况见图 1。大叶相思花粉在培养3 h时,观察统计其萌发率为65.74%,培养6 h时,其萌发率为90.55%,大叶相思花粉在前6 h的培养中大量萌发。大叶相思花粉在培养6 h后,花粉萌发速率减慢; 在之后的18 h培养中,其萌发率仅增加了7.71%;在培养了24 h后,其花粉萌发率趋于稳定,达到最高值98.26%。
2.6 不同方法检测的大叶相思花粉活力的比较采用3种方法检测当天收集的大叶相思花粉活力(表 5)。过氧化物酶法检测花粉活力为99.67%,I2-KI法检测花粉活力为99.00%,花粉管离体培养法检测花粉活力为98.15%。3种方法检测的花粉活力无显著差异(P>0.05)。
3 讨论在对竹子花粉的研究中,发现鹅毛竹(Shibataea chinensis)的花粉在15%的蔗糖营养液中培养4 h后,其萌发率最高为18.4%,福建茶杆竹(Arundinaria amabilis var. convexa)的花粉在20%蔗糖营养液中培养3 h后,其萌发率最高为60%(林树燕等,2008)。研究表明,刺槐(Robinia pseudoacacia)花粉适宜的培养基配比为蔗糖150 g·L-1、硼酸20 mg·L-1、硝酸钙 0.50 mg·L-1(戴丽等,2012)。桉树(Eucalyptus)花粉在25%麦芽糖、150 mg·L-1硼酸的基础培养基中加入一定量的钙离子、镁离子等,培养24 h或者48 h,其花粉萌发率最高可达59.3%(Wheeler et al., 2006)。芒果(Mangifera indica)花粉在液体培养基中培养,其最大萌发率为50.14%(Dutta et al., 2013)。Kato等(2012b)的研究结果表明: 在23 ℃,200 g·L-1蔗糖+10 g·L-1琼脂培养基上,培养48 h,大叶相思花粉的最高萌发率为95%。大量前人的研究结果均表明,不同材料的花粉,其萌发需要的适宜条件不同,因此有必要对不同的研究对象建立其相应的花粉适宜萌发条件。本研究对影响大叶相思花粉离体萌发的培养温度进行单因素分析时,在28 ℃下进行培养,效果较佳。但对培养温度、蔗糖浓度、硼酸浓度三因素进行综合分析时,得出的最佳离体萌发体系为: 200 g·L-1蔗糖+300 mg·L-1硼酸、培养温度30 ℃,花粉在该条件下的萌发率最高,为98.26%。大叶相思花粉在最佳处理下,观察其培养过程可发现,培养6 h之后,90%以上的花粉均萌发,随后的花粉萌发率增加缓慢; 培养24 h之后,其花粉萌发率趋于稳定,并达到最大值。
|
|
|
图1 大叶相思花粉萌发率随培养时间的变化情况 Fig.1 The pollen germination rates of Acacia auriculiformis changing with culture |
|
|
Kato等(2012b)对大叶相思花粉活力进行研究时,采用的是固体培养基,添加200 g·L-1蔗糖,23 ℃培养48 h,花粉的最高萌发率为95%。本研究中,采用的是液体培养基,添加了200 g·L-1蔗糖+300 mg·L-1硼酸,30 ℃培养24 h,花粉萌发率更高,为98.26%。2个研究的结果稍有不同,有可能是因为2种方法使用的培养基类型以及成分含量不同,本试验中加入了适量的硼酸; 也可能因为选择了不同的无性系,具体问题在今后的试验中还有待研究。2种方法的培养温度不同,可能是因为采用的培养基类型不同,花粉对培养温度的需求也不同; 也可能是大叶相思在不同生境条件[Kato等(2012b)研究所采用的花粉来源于种植在日本西南部的冲绳县林木育种中心,本研究的花粉来源于种植在中国广东省江门市新会区的大叶相思种子园的16年生植株]的胁迫下,其适应性发生了不同的变化而造成花粉萌发对不同温度的需求。因此,建议在不同的地方收集大叶相思离体花粉进行各项研究时,需要根据实际情况研究选取其相应的检测方法。
选择性状优良且花粉活力和萌发能力较高的亲本,是开展杂交育种的重要前提。本研究所筛选出的大叶相思花粉离体萌发适宜条件,能有效地对亲本的花粉活力和花粉萌发能力进行评价,为相思杂交育种工作中对亲本的评价提供技术支撑。对于花粉活力和花粉萌发能力均较低但性状非常优良的杂交亲本,在开展杂交授粉前,如先通过一段时间的培养,使其花粉活力和花粉萌发能力得到提升,可以提高授粉成功率。
林木花粉活力检测的方法有很多,黄烈健等(2014)对其进行了详细的阐述。Beck-Pay(2012)研究也表明,黑荆(A. mearnsii)花粉活力的活体染色法检测结果与花粉离体萌发法检测结果差异不大。针对各种花粉活力检测的优缺点(王钦丽等,2002),本研究采用过氧化物酶检测法、I2-KI检测法以及离体花粉培养法对大叶相思花粉活力进行检测,测得的花粉活力依次为99.67%,99.00%,98.15%,3种检测法所测得的花粉活力差异不显著; I2-KI法染色快、染色清晰,简单快捷,在实际育种工作中,可用于快速检测新鲜花粉活力,但有时活力弱的花粉也会被染色,其检测结果有可能略高于花粉管体外离体萌发法(赵鸿杰等,2012),对于贮藏的花粉进行检测时不建议采用此法。
赵元杰等(2009)研究表明,花粉离体萌发法能够较准确有效地测定花粉活力,而一般染色法适用于测定花粉的初始活力。Smith-Huerta等(1984)则认为,测定花粉活力比较精确的方法是测定花粉受精有效性和种子形成的比率。因此,在测定花粉活力的时候,应结合研究目的选择合适的测定方法。
4 结论采摘新鲜开放的大叶相思花穗,置于室内,于次日10:00之后,使用毛笔刷法并过200目花粉筛,可以成功收集大量大叶相思花粉。通过开展不同培养温度、不同蔗糖浓度和不同硼酸浓度对大叶相思花粉离体萌发的影响,以及使用过氧化物酶法、I2-KI法以及花粉管离体萌发法对大叶相思花粉进行活力测定等研究,成功建立大叶相思花粉离体萌发体系: 培养温度30 ℃、200 g·L-1蔗糖+300 mg·L-1硼酸的液体培养基,萌发率为98.26%,花粉管长度均可达到10倍复合花粉粒的长度,最多可萌发出10条花粉管,显著高于其他处理。过氧化物酶法检测的花粉活力为99.67%,I2-KI法检测的花粉活力为99.00%,花粉管离体培养法检测的花粉活力为98.15%,3种方法检测的花粉活力无显著差异。研究结果为今后开展大叶相思的花粉收集、贮藏及活力测定等研究,以及开展人工控制授粉选育优良马大杂种相思新品种等研究提供了重要依据。
| [1] |
戴 丽,孙 鹏,蒋晋豫,等. 2012. 刺槐、红花刺槐、四倍体刺槐花粉体外萌发对比. 东北林业大学学报, 40(1):1-5. (Dai L, Sun P, Jiang J Y, et al. 2012. Comparative analysis of pollen germination between different Black Locusts. Journal of Northeast Forestry University, 40(1):1-5. [in Chinese])(  1) 1)
|
| [2] |
黄世能, 郑海水. 1992. 不同伐桩高度和林分密度对大叶相思萌芽更新的影响. 林业科学研究, 5(5):611- 615. (Huang S N, Zheng H S. 1992. Impact of stump height and stand density on updating of Acacia auriculiformis budding. Forest Research, 5(5): 611-615.[in Chinese])(  1) 1)
|
| [3] |
黄烈健, 詹 妮. 2014. 林木花粉采集、保存及活力检测的研究进展. 广东林业科技, 30(6):77-80. (Huang L J, Zhan N. 2014. Research progress of pollen collection, preservation and viability testing in trees. Guangdong Forestry Science and Technology, 30(6):77-80. [in Chinese])(  1) 1)
|
| [4] |
姜雪婷, 杜玉虎, 张绍铃, 等. 2006. 梨43个品种花粉生活力及4种测定方法的比较. 果树学报, 23(2): 178-181. (Jiang X T, Du Y H, Zhang S L, et al. 2006. Pollen viability of 43 pear cultivars and comparison of testing methods. Journal of Fruit Science, 23(2):178-181. [in Chinese])(  1) 1)
|
| [5] |
李 军, 黄烈健, 陈祖旭, 等. 2010. 大叶相思花部形态与开花生物学研究. 热带亚热带植物学报, 18(4):379- 385.(Li J, Huang L J, Chen Z X, et al. 2010. Floral morphology, anthesis and pistil receptivity of ( 1) 1)
|
| [7] |
林树燕, 丁雨龙, 张 昊. 2008. 5种竹子花粉萌发率及开花特性. 林业科学, 44(10):159-163. (Lin S Y, Ding Y L, Zhang H. 2008. Pollen germination percentage and floral character of five bamboo species. Scientia Silvae Sinicae, 44(10):159-163. [in Chinese] )(  1) 1)
|
| [8] |
陆道调, 关保国, 王希群, 等. 2004. 相思树种研究发展综述. 福建林学院学报, 24(1): 92-96. (Lu D D, Guan B G, Wang X Q, et al. 2004. A general review on the research development of Acacia spp..Journal of Fujian College of Forestry, 24(1): 92-96.[in Chinese])(  1) 1)
|
| [9] |
潘志刚, 游应天. 1994. 中国外来树种引种栽培. 北京: 科学技术出版社, 378-406. (Pan Z G, You Y T. 1994. Introduction and cultivation of exotic tree species. Beijing: Science and Technology Press, 378-406. [in Chinese])(  1) 1)
|
| [10] |
王钦丽, 卢龙斗, 吴小琴, 等. 2002. 花粉的保存及其生活力测定. 植物学通报, 19(3):365-373. (Wang Q L, Lu L D, Wu X Q, et al. 2002. Pollen preservation and its viability test. Chinese Bulletin of Botany, 19(3): 365-373. [in Chinese])(  1) 1)
|
| [11] |
张志良. 2000. 植物生理学实验指导. 北京: 高等教育出版社.(Zhang Z L. 2000. Experimental guide of physiology of plant. Beijing: Higher Education Press. [in Chinese])( 1) 1)
|
| [12] |
赵元杰, 蒋建雄, 刘明稀, 等. 2009. 芒(Miscanthus sinensis Anderss)花粉生活力测定方法比较. 中国农学通报, 25(24):147-150. (Zhao Y J, Jiang J X, Liu M X, et al. 2009. Comparison of pollen viability determining methods for Miscanthus sinensis Anderss. Chinese Agricultural Science Bulletin, 25(24):147-150. [in Chinese])(  1) 1)
|
| [13] |
赵鸿杰, 乔龙巴图, 殷爱华, 等. 2012. 3种山茶属植物花粉活力测定方法的比较. 中南林业科技大学学报, 30(3):105-107. (Zhao H J, Qiaolong B T, Yin A H, et al. 2012. Comparison of detection methods for pollen viability of three kinds of Camellia plants. Journal of Central South University of Forestry & Technology, 30(3):105-107. [in Chinese])(  1) 1)
|
| [14] |
Beck-Pay S L. 2012. Optimization of pollen viability tests for Acacia podalyriifolia and two ploidys of Acacia mearnsii. South African Journal of Botany, 78:285-289.( 1) 1)
|
| [15] |
Dutta S K, Srivastav M, Chaudhary R, et al. 2013. Low temperature storage of mango (Mangifera indica L.)pollen. Scientia Horticulturae,161:193-197.( 1) 1)
|
| [16] |
Kato K, Yamaguchi S, Chigira O, et al. 2012a. Tube pollination using stored pollen for creating Acacia auriculiformis hybrids. Journal of Tropical Forest Science, 24(2):209-216.( 1) 1)
|
| [17] |
Kato K, Yamaguchi S, Chigira O, et al. 2012b. Flowering phenology and germination ability of pollens for Acacia mangium and A. auriculiformis. Silvea Genetica, 61(6):228-236.( 1) 1)
|
| [18] |
Nor Asmah H, Nor Hasnida H, Noraliza A, et al. 2012. In vitro propagation of( 1) 1)
|
| [19] | Acacia hybrid through alginate-encapsulated shoots and axillary buds.African Journal of Biotechnology, 11(65):12814 -12817. |
| [20] |
Smith-Huerta N L, Vasek F C. 1984. Pollen longevity and stigma-pre-emption in Clarkia. American Journal of Botany, 71(9):1183-1191.( 1) 1)
|
| [21] |
Turnbull J W, Martensz P N, Hall N. 1986. Notes on lesser-known Australian trees and shrubs with potential for fuelwood and agroforestry//Turnbull J W. Multipurpose Australian trees and shrubs: Lesser-known species for fuelwood and agroforestry. No.14. Canberra: Australian Centre for International Agricultural Research, 81-313.( 1) 1)
|
| [22] |
Wheeler M A, McComb J A. 2006. In vitro pollen viability and pollen storage in Eucalyptus marginata (Myrtaceae). Australian Forestry, 69(1): 32-37.( 1) 1)
|
 2016, Vol. 52
2016, Vol. 52

