文章信息
- 万晓, 刘秀梅, 王华田, 王渌, 王迎, 仲凤维
- Wan Xiao, Liu Xiumei, Wang Huatian, Wang Lu, Wang Ying, Zhong Fengwei
- 高矿化度灌溉水磁化处理对绒毛白蜡生理特性及生长的影响
- Effect of Magnetic Treatment of Salty Irrigation Water on Physiological and Growth Characteristics of Potted Fraxinus velutina Seedlings
- 林业科学, 2016, 52(2): 120-126
- Scientia Silvae Sinicae, 2016, 52(2): 120-126.
- DOI: 10.11707/j.1001-7488.20160215
-
文章历史
- 收稿日期:2014-12-15
- 修回日期:2015-11-3
-
作者相关文章
盐分积累过程是不同时空尺度上一系列自然和人为因素叠加作用的结果,如气候、沉积环境、土壤母质、地形、水文地质条件、灌溉、砍伐森林、各类蓄水工程等,都会显著影响盐分积累过程(范晓梅等,2010)。土壤盐渍化具有十分严重的环境风险和危害,尤其是干旱地区的灌溉农业会遭受作物减产及生产危害(李建国等,2012)。盐渍化土壤广泛分布于全球100多个国家和地区,面积约为全球陆地总面积的1/3;中国盐渍化土壤比例高于世界平均水平,面积约0.17亿hm2,近30%的灌区土壤存在盐渍化问题(蔺娟等,2007)。
液态水经过一定强度的磁场时,其物理结构、化学性质等会发生一系列改变,如氢键弱化,自由水分子增多等,其溶解能力和对土壤盐分的洗脱能力显著提高,而且磁化水还能直接对植株体本身产生作用,提高其抗逆能力(Hozayn et al., 2010;Coey et al., 2000 ; Esitken et al., 2004)。磁化水处理技术是治理盐碱地的一项新技术,与传统的改良修复方式相比,磁化水方式不仅经济节约、操作简便,而且成效显著持久,与其他盐碱地生态修复措施相结合,可以取得更好的修复效果,已在俄罗斯、乌克兰、乌兹别克斯坦、阿拉伯联合酋长国、埃及等国家的盐碱治理和开发利用中得到广泛应用。但磁化处理是否对植物的光合作用有直接影响及其影响机制如何,目前尚未见报道。
绒毛白蜡(Fraxinus velutina)为木犀科(Oleaceae)白蜡属乔木,耐干旱、耐水湿、耐盐碱,生长迅速,是盐碱地造林的重要树种之一。但研究发现,该树种在中度含盐量以上(>3‰)的立地条件下造林成活率明显下降(李秀芬,2012),其主要原因是造林初期缺少灌溉用水。本文以绒毛白蜡为试材,重点研究磁化处理高矿化度灌溉水对光合生理特性及生长的影响作用,以期说明磁化技术对促进植物生长、提高产量的生理机制以及对盐渍化地区土地资源和浅表层微咸水开发利用的重要意义。
1 材料与方法 1.1 试验设计试验地点位于山东农业大学林学试验站(117°08′ E,36°11′ N)。11月下旬落叶后将1年生绒毛白蜡实生苗栽植于泥质花盆(上口径31 cm、下口径24 cm、高26 cm)中,每盆1株,苗木高度(100±5)cm,截干后地上部分保留10 cm,地径(1.52±0.12)cm,每盆装入壤质土18 kg,栽后大田开沟埋植,沟内灌水以确保盆内土壤彻底浸润。通过测定滨海区水样,模拟海水盐分组分和比例(表 1、表 2),设置自来水(低盐水平,L)、6 g·L-1(中等盐度水平,M)和10 g·L-1(高浓度盐度水平,H)3个浓度盐分梯度,磁化处理(M)和不磁化处理(N),共形成NL,ML,NM,MM,NH,MH 6种处理组合,每处理重复3次。翌年5月上旬将盆栽试材移置于铺设塑料隔板地表的大棚内,分别用3个浓度的磁化和非磁化水进行隔天连续灌溉直至10月下旬,每次每盆灌水1 000 mL(过饱和),过量水经花盆底部排除,以确保各处理土壤溶液盐分含量符合设计浓度要求。定期测定光合特性及叶绿素荧光动力学特征,10月下旬落叶休眠前调查树高和生物量。
磁化水处理: 磁化器(U050/EXTRA1/2inch Grey)由迪拜磁化技术公司(Magnetic Technologies L.L.C.)提供,用于处理灌溉水和幼苗生长处理。该装置长160 mm,内径21 mm。在管壁上有永久性磁场的设置,水从磁化器中流过得到磁化。
|
|
|
|
绒毛白蜡实生苗在磁化水灌溉处理后的第30,48,70天当日7:00,选择并标记当年抽生新梢中部3片成熟叶片,利用FMS-2叶绿素荧光分析仪分别测定当年新梢中部叶片的F′m,Fs,Fm,Fv等叶绿素荧光动力学参数。室外自然条件下,先测定光适应下的荧光参数F′m,Fs,并计算得出实际光化学效率[ΦPSⅡ=(F′m-Fs)/F′m];然后将待测叶片夹上暗适应夹,充分适应20 min后测定暗适应的荧光参数Fm,F0,并计算得出最大光化学效率(Fv/Fm),其中,Fv=Fm-F0。连续测定3次,取其平均值作为该植株的叶绿素荧光动力学特征值(李鹏民等,2005)。灌溉水处理后晴日的第20天当日10:00—11:00,利用GIRAS-2光合作用测定系统对标记叶片同步测定Pn(净光合速率)、Tr(蒸腾速率)、Gs(气孔导度)、Ci(细胞间CO2浓度)等参数,每片叶片连续测定3次,取平均值作为该植株的光合特性特征值,以WUE=Pn/Tr作为光合作用水分利用效率。
1.3 生长和生物量调查调查所有处理绒毛白蜡的株高及生长量,利用精度1/1 000天平分别测量植株鲜质量,105 ℃烘干30 min后继续80 ℃烘干至恒质量。利用根系分析系统(Win Rhizo Pro STD4800)分析单株根系各处理细根数量、平均根粗、平均根长、根系表面积等特征。
1.4 数据分析采用SAS 9.0软件进行方差分析,检查其显著性(α=0.01,0.05),Excel 2007软件进行数据分析及图表绘制。
2 结果与分析 2.1 磁化处理对绒毛白蜡光合作用的影响光合作用是植物生长过程中干物质积累和生理代谢的基本过程,也是分析盐胁迫影响植物生长和代谢的重要方法(邱念伟等,2011)。逆境环境中,植物通过改变气孔的开度等方式来调节与环境的CO2和水汽交换,进而调节自身光合、蒸腾等进程,以适应逆境环境条件(叶子飘,2010; 郎莹等,2011)。逆境胁迫下,植物光合效率降低的因素主要有气孔限制和非气孔限制2类,前者使Ci降低,后者使Ci增高,两因素同时存在时,Ci主要取决于占优势的因素(郑国琦等,2002)。一般的判断标准为Ci和气孔限制值(Ls)的变化方向,Ci降低和Ls升高表明气孔导度是主要限制因素,而Ci增高和Ls降低表明主要是非气孔导度限制。在同一时段的光合测定中,大气的CO2浓度(Ca)基本恒定,根据公式Ls=1-Ci/Ca,可知Ci与Ls总是呈相反的变化趋势,因此本研究中,以Ci的变化趋势为主要判断标准,Ci降低表明主要受气孔限制,增高则相反(许大全,1997; Farquhar et al.,1982)。
磁化处理对绒毛白蜡光合、蒸腾作用的影响见表 3。非磁化处理植株随着盐分浓度的提高,Ci呈上升趋势,而Pn,Tr,Gs均呈下降趋势,表明非磁化处理光合作用主要受非气孔因素限制,即是由叶肉细胞的光合活性降低引起的(罗海波等,2010)。而磁化处理植株随着盐分浓度的提高,Pn,Tr,Gs呈下降趋势,Ci先上升后下降,说明在M-H浓度范围内,光合作用主要受气孔因素限制。盐分处理对磁化与非磁化处理植株的光合作用产生了一定的干扰:与NL,NM处理相比,ML,MM处理绒毛白蜡实生苗Pn分别提高37%,141.25%; MH处理植株Pn维持在1.25 μmol·m-2s-1左右,而NH处理植株Pn出现负值,说明高逍度盐度水平下,非磁化处理植株呼吸速率高于净光合速率。在相同盐分浓度下,Pn,Tr,Gs及WUE都高于对照,非磁化处理光合活性中心较磁化处理受到更大的伤害,气孔调节没有明显的作用; 而磁化处理的气孔调节依然可以在高浓度时起主导作用。磁化处理和盐浓度处理与绒毛白蜡Ci,Tr,Pn,Gs的关系极为显著,磁化处理显著提高了植株的抗盐能力(平晓燕等,2010; 张会慧等,2012; 陈根云等,2006)。
2.2 磁化处理对绒毛白蜡叶绿素荧光动力学特征的影响磁化处理对绒毛白蜡叶绿素荧光荧光动力学特征的影响见表 4。30天时,随着盐分浓度提高,磁化处理绒毛白蜡的实际光化学效率ΦPSⅡ分别比对照提高85%,50%和9%,Fv/Fm分别比对照提高17%,3%和7%; 70天时,Fv/Fm分别比对照提高8%,3%和3%。第30,48,70天测定结果显示,磁化处理植株的Fv/Fm和ΦPSⅡ均高于对照,48天时,两指标均有提高,但差异水平不显著;30天时,的指标与对照相比达到极显著差异水平。
叶绿素荧光及植物光合生理状况与各种外界因子对其的细微影响密切相关,环境因子发生变化时,叶绿素荧光的变化可在一定程度上反映环境因子对植物光合作用的影响(张永平等,2013),以此可作为评价光合机构的功能和环境胁迫对植物影响的指标。Fv/Fm反映了叶绿体中捕光色素蛋白复合体捕获光能传递给反应中心并转化为生物化学能的能力,是植物遭受逆境胁迫的重要表征值,通常Fv/Fm在0.8以上表示植物未受到胁迫,轻微的下降可能是一种光保护机制(Jee,1995)。本试验绒毛白蜡实验无盐处理第30和70天Fv/Fm低于0.8,可能是低氧或高光强等原因造成的光抑制时间过久,从而引发光氧化破坏使F0升高引起的(冯志立等,2002; 贾永霞等,2011; 廖铁,2004)。一般情况下,受到盐胁迫的植物,Fv/Fm,ΦPSⅡ都会下降,而且由于盐胁迫使叶片中的离子平衡和细胞结构遭到破坏,叶绿素活性和光酶活性下降,因此导致非光化学猝灭系数比光化学猝灭系数对盐反应更敏感(冯建灿等,2002)。
|
|
|
|
根系是植物吸收养分、水分的器官,其大小形态与植株的生活力密切相关,对植株的生长发育和生理过程具有重要影响。表 5表明,磁化处理的绒毛白蜡根系形态特征指标在长度、根体积、表面积上均显著大于对照。盐分浓度为10 g·L-1处理的根系,因受高盐胁迫严重,其植株根系分级和根系生物量减少,进行扫根的一级侧根都很长; 而在低盐下,植株分级多,扫根所用的一级侧根由于其上又继续有很多侧根,反而使一级侧根没有高盐的一级侧根长,平均值较小。
|
|
磁化处理对绒毛白蜡树高和生物量的影响见图 1。与叶绿素荧光参数、光合参数相对应,绒毛白蜡的生长也呈现相同的规律。磁化处理后,由低盐到高盐3种盐分浓度下,生物量分别提高了24%,18%和54%,树高分别提高了33%,8%和32%。磁化处理后的绒毛白蜡树高和生物量(鲜质量)均值都比对照组高,10 g·L-1盐浓度处理时,对生物量(鲜质量)和树高的影响是显著的,而在低盐水平的磁化处理是0时,对树高的影响也是显著的。随盐分浓度升高,磁化处理和对照组生物量与树高均呈减小趋势。磁化处理对绒毛白蜡实生苗鲜质量以及树高有一定程度的促进作用,对照的生物量和树高均低于磁化处理,说明磁化处理对提高绒毛白蜡抗盐能力、促进绒毛白蜡生长可起到一定作用。
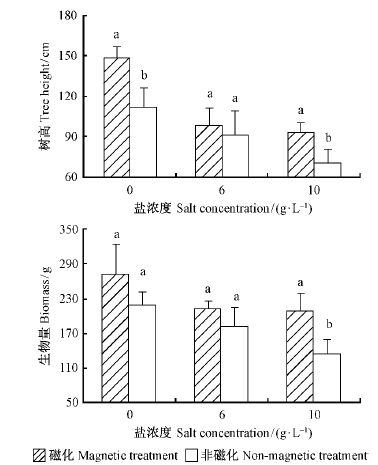
|
图1 磁化处理对绒毛白蜡树高和生物量的影响 Fig.1 The influence of magnetizing treatment on plant growth * 同一测定项目不同小写字母表示差异达1% 显著水平。Different letters indicate significant difference between families under the same condition at P < 0. 01. |
应用磁化水灌溉对提高植物抗盐能力、促进植株生长具有明显作用,但其机制尚不明确(Selim,2008; Belyavskaya,2001; 2004)。本研究通过对磁化水灌溉处理后绒毛白蜡光合参数的测定分析,表明磁化处理对植物光合作用具有显著的促进作用。磁化处理提高绒毛白蜡实生苗叶绿素荧光动力学参数的原因可能如下: 水分子极性很强,在自然状态下,缔合分子以氢键连接,以分子簇(H2O)n(n=1~6)的形式存在(王义翔等,2012)。液态水经过磁场作用后,水的团簇结构发生变化,水分子氢键断裂或者重组,产生较多自由水分子或寡聚水分子(顿珠次仁,2010),叶绿素a的分子结构由4个吡咯环通过4个甲烯基(CH—)连接形成卟啉环结构。吸收光是卟啉结构中的卟吩大环,其中心金属Mg2+主要改变大环的吸收波长(武维华等,2008)。处于较低激发态的叶绿素分子可能通过3种途径释放能量回到稳定基态,即产生荧光、热耗散和光化学反应,而这3种途径相互竞争。对于许多色素分子来说,荧光发生在纳秒级,而光化学反应发生在皮秒级,因此当植物光合作用处于正常生理状态时,叶绿素吸收的光能大部分用来进行光化学反应,荧光只占很小一部分(李鹏民等,2005)。液态水经过磁化处理后自由水分子增多,易与叶绿素a分子形成更多氢键,分子间氢键能使内转换速率增加(石英,2005; Yashihara et al., 2001),从而提高了光化学反应在光能转化中的地位; 同时,内转换速率提高本身也可以提高光合作用能力。盐分胁迫使聚光色素首先受到破坏,使得PSⅡ聚光能力减小,导致有活性的反应中心数目降低,为了维持电子传递的正常进行,PSⅡ单位反应中心效率增加,但PSⅡ受体侧接收电子的能力下降,最终导致PSⅡ功能衰退(韩彪等,2010)。磁化处理提高了被处理植株光合能力,进而提高了植株抗逆能力。
通过对绒毛白蜡叶绿素荧光及光合参数的测定,结合生物量分析可知,高矿化度灌溉水经过磁化处理后可以有效提高绒毛白蜡的光合作用,促进其生长,从而减轻盐分对植株的伤害程度。但也有研究表明,在某些磁化强度下,该处理会对某些植株产生负效应,这可能与磁化处理改变了某些生物酶活性有关,磁化处理时,植物细胞内某些酶活性中心的金属离子可能受到磁场影响,酶构象发生改变,酶活性因此升高或降低,进而影响到胞内生化反应(Maheshwari et al., 2009)。在这项技术被推广前,应了解磁化作用的机制及磁化作用范围和条件,进一步探究磁化技术在生物领域的作用机制,寻求最佳的技术参数,以便促进该项技术在农林业中更广泛的应用。
| [1] |
陈根云, 俞冠路, 陈悦, 等. 2006. 光合作用对光和二氧化碳响应的观测方法探讨. 植物生理与分子生物学学报, 32(6):691-696. (Chen G Y, Y G L, Chen Y, et al. 2006. Exploring the observation methods of photosynthetic responses to light and carbon dioxide. Journal of Plant Physiology and Molecular Biology, 32(6):691-696.[in Chinese])(  1) 1)
|
| [2] |
顿珠次仁. 2010. 磁场和冷冻作用对水团簇特性及Cu(II)跨膜行为的影响研究. 天津:天津大学硕士学位论文. (Dun Z C R. 2010. Magnetic field and freezing on the structural properties of water and trans-membrane behavior of Cu(Ⅱ). Tianjin:MS thesis of Tianjin University.[in Chinese])(  1) 1)
|
| [3] |
范晓梅, 刘高焕, 唐志鹏, 等. 2010.黄河三角洲土壤盐渍化影响因素分析. 水土保持学报, 24(1):139-144. (Fan X M, Liu G H, Tang Z P, et al. 2010. Analysis on main contributors influencing soil salinization of yellow river delta. Journal of Soil and Water Conservation, 24(1):139-144.[in Chinese])(  1) 1)
|
| [4] |
冯建灿, 胡秀丽, 毛训甲. 2002. 叶绿素荧光动力学在研究植物逆境生理中的应用. 经济林研究, 20(4):14-18, 30. (Feng J C, Hu X L, Mao X J. 2002. Application of chlorophyll fluorescence dynamics to plant physiology in adverse circumstance. Economic Forest Researches, 20(4):14-18, 30.[in Chinese])(  1) 1)
|
| [5] |
冯志立, 冯玉龙, 曹坤芳. 2002. 光强对砂仁叶片光合作用光抑制及热耗散的影响. 植物生态学报, 26(1):77-82. (Feng Z L, Feng Y L, Cao K F. 2002. Effects of light intensity on photoinhibition of photosynthesis and thermal dissipation in Amomum Villosum Lour. Acta Phytoecologica Sinica, 26(1):77-82.[in Chinese])(  1) 1)
|
| [6] |
韩彪, 陈国祥, 高志萍, 等. 2010. 银杏叶片衰老过程中PSⅡ荧光动力学特性变化. 园艺学报, 37(2):173-178. (Han B, Chen G X, Gao Z P, et al. 2010. The changes of PSⅡ chlorophyll fluorescence dynamic characteristic during leaf senescence of Ginkgo. Acta Horticulturae Sinica, 37(2):173-178.[in Chinese])(  1) 1)
|
| [7] |
贾永霞, 孙锦, 王丽萍, 等. 2011. 低氧胁迫下黄瓜植株热耗散途径. 应用生态学报, 22(3):707-712. (Jia Y X, Sun J, Wang L P, et al. 2011. Thermal dissipation pathway in cucumber seedling leaves under hypoxia stress.Chinese Journal of Applied Ecology, 22(3):707-712.[in Chinese])(  1) 1)
|
| [8] |
郎莹, 张光灿, 张征坤, 等. 2011. 不同土壤水分下山杏光合作用光响应过程及其模拟. 生态学报, 31(16):4499-4508. (Lang Y, Zhang G C, Zhang Z K, et al. 2011. Light response of photosynthesis and its simulation in leaves of Prunus sibirica L. under different soil water conditions. Acta Ecologica Sinica, 31(16):4499-4508.[in Chinese])(  1) 1)
|
| [9] |
李建国, 濮励杰, 朱明, 等. 2012. 土壤盐渍化研究现状及未来研究热点. 地理学报, 67(9):1233-1245. (Li J G, Pu L J, Zhu M, et al. 2012. The present situation and hot issues in the salt-affected soil research. Acta Geographica Sinica, 67(9):1233-1245.[in Chinese])(  1) 1)
|
| [10] |
李鹏民, 高辉远, Rato J S. 2005. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用. 植物生理与分子生物学学报, 31(6):559-566. (Li P M, Gao H Y, Rato J S. 2005. Application of the chlorophyll fluorescence induction dynamics in photosynthesis study. Journal of Plant Physiology and Molecular Biology, 31(6):559-566.[in Chinese])(  2) 2)
|
| [11] |
李秀芬. 2012. 黄河三角洲盐碱地造林技术研究. 北京:北京林业大学硕士学位论文. (Li X F. 2012. Afforestation in saline-alkali soil at yellow river delta. Beijing:MS thesis of Beijing Forestry University.[in Chinese])(  1) 1)
|
| [12] |
廖铁. 2004. 植物光合机构能量耗散机理. 上海:中科院上海生命学研究院植物生理生态研究所博士学位论文. (Liao T. 2004. The mechanism of energy dissipation by the photosynthetic apparatus of plants. Shanghai:PhD thesis of Chinese Academy of Sciences Shanghai Institute of Plant Physiology Life Ecological Research Institute.[in Chinese])(  1) 1)
|
| [13] |
蔺娟, 地里拜尔.苏力坦. 2007. 土壤盐渍化的研究进展. 新疆大学学报:自然科学版, 24(3):318-323, 328. (Lin J, Dilbar S. 2007. Progress in the study on soil salinization. Journal of Xinjiang University:Natural Science Edition, 24(3):318-323, 328.[in Chinese])(  1) 1)
|
| [14] |
罗海波, 马苓, 段伟, 等. 2010. 高温胁迫对'赤霞珠'葡萄光合作用的影响,中国农业科学, 43(13):2745-2750.(Luo H B, Ma L, Duan W, et al. 2010. Influence of heat stress on photosynthesis in Vitis vinifera L. cv. Cabernet Sauvignon, 43(13):2745-2750.[in Chinese])( 1) 1)
|
| [15] |
平晓燕, 周广胜, 孙敬松. 2010. 植物光合产物分配及其影响因子研究进展. 植物生态学报, 34(1):100-111. (Ping X Y, Zhou G S, Sun J S. 2010. Advances in the study of photosynthate allocation and its controls. Chinese Journal of Plant Ecology, 34(1):100-111.[in Chinese])(  1) 1)
|
| [16] |
邱念伟, 谭廷鸿, 戴华, 等. 2011. 磁化水对小麦种子萌发、幼苗生长和生理特性的生物学效应.植物生理学报, 47(8):803-810. (Qiu N W, Tan T H, Dai H, et al. 2011. Biological effects of magnetized water on seed germination, seedling growth and physiological characteristics of wheat. Plant Physiology Journal,47(8):803-810.[in Chinese])(  1) 1)
|
| [17] |
石英. 2005. 叶绿素a超快过程动力学研究. 大连:中国科学院研究生院博士学位论文. (Shi Y. 2005. The dynamics of ultrafast process of chlorophyll a in liquids studied by femtosecond laser. Dalian:PhD thesis of Chinese Academy of Sciences.[in Chinese])(  1) 1)
|
| [18] |
王义翔, 张秀梅, 王志萍, 等. 2012.水分子团簇与水合胞嘧啶分子的量化计算. 黑龙江大学自然科学学报, 29(6):822-827. (Wang Y X, Zhang X M, Wang Z P, et al. 2012. The quantum chemistry calculations about water clusters and hydrated cytosine. Journal of Natural Science of Heilongjiang University, 29(6):822-827.[in Chinese])(  1) 1)
|
| [19] |
武维华, 张蜀秋, 袁明, 等. 2008. 植物生理学. 北京:科学出版社, 450-451.(Wu W H, Zhang S Q, Yuan M, et al. 2008. Plant physiology. Beijing:Science Press,450-451.[in Chinese])( 1) 1)
|
| [20] |
许大全. 1997. 光合作用气孔限制分析中的一些问题. 植物生理学通讯, 33(4):241-244. (Xu D Q. 1997. Some problems in stomal limitation analysis of photosynthesis. Plant Physiology Communications, 33(4):241-244.[in Chinese])(  1) 1)
|
| [21] |
叶子飘. 2010. 光合作用对光和CO2响应模型的研究进展.植物生态学报, 34(6):727-740. (Ye Z P. 2010. A review on modeling of responses of photosynthesis to light and CO2. Chinese Journal of Plant Ecology, 34(6):727-740.[in Chinese])(  1) 1)
|
| [22] |
张会慧, 张秀丽, 李鑫, 等. 2012. NaCl和Na2CO3胁迫对桑树幼苗生长和光合特性的影响. 应用生态学报, 23(3):625-631. (Zhang H H, Zhang X L, Li X, et al. 2012. Effects of NaCl and Na2CO3 stresses on the growth and photosynthesis characteristics of Morus alba seedlings. Chinese Journal of Applied Ecology, 23(3):625-631.[in Chinese])(  1) 1)
|
| [23] |
张永平, 陈幼源, 杨少军, 等. 2013. 有机无机复合肥配施对甜瓜植株生长发育和叶绿素荧光特性的影响. 植物生理学报, 49(3):722-728. (Zhang Y P, Chen Y Y, Yang S J, et al. 2013. Effects of organic and inorganic compound fertilizer application on growth and chlorophyll fluorescence characteristics in melon plants. Plant Physiology Journal, 49(3):722-728.[in Chinese])(  1) 1)
|
| [24] |
郑国琦, 许兴, 徐兆桢, 等. 2002. 盐胁迫对枸杞光合作用的气孔与非气孔限制. 西北植物学报, 22(6):1355-1359. (Zheng G Q, Xu X, Xu Z Z, et al. 2002. The effect of salt stress on the stomatal and non-stomatal limitation of photosynthesis of Lycium barbarum. Acta Bot Boreal-Occident Sin, 22(6):1355-1359.[in Chinese])(  1) 1)
|
| [25] |
Belyavskaya N A. 2001. Ultrastructure and calcium balance in meristem cells of pea roots exposed to extremely low magnetic fields. Advances in Space Research, 28(4):645-650.( 1) 1)
|
| [26] |
Belyavskaya N A. 2004. Biological effects due to weak magnetic field on plants. Advances in Space Research, 34(7):1566-1574.( 1) 1)
|
| [27] |
Coey J M D, Cass S. 2000. Magnetic water treatment. Journal of Magnetism and Magnetic Materials, 209:71-74.( 1) 1)
|
| [28] |
Esitken A, Turan M. 2004. Alternating magnetic field effects on yield and plant nutrient element composition of strawberry (Fragaria×ananassa cv.camarosa). Acta Agriculturae Scandinavica, Section B-Soil & Plant Science, 54(3):135-139.( 1) 1)
|
| [29] |
Farquhar G D, Sharkey T D.1982. Stomatal conductance and photosynthesis. Annu Rev Plant Physiol, 33:317-345.( 1) 1)
|
| [30] |
Hozayn M, Qados A M S A. 2010. Irrigation with magnetized water enhances growth, chemical constituent and yield of chickpea (Cicer arietinum L.). Agriculture and Biology Journal of North America, 1(4):671-676.( 1) 1)
|
| [31] |
Jee G. 1995. Sixty-three years since kautsky:chlorophylla fluorescence. Australian Journal of Plant Physiology, 22(2):131-160.( 1) 1)
|
| [32] |
Maheshwari B L, Grewal H S. 2009. Magnetic treatment of irrigation water:its effects on vegetable crop yield and water productivity. Agricultural Water Management, 96(8):1229-1236.( 1) 1)
|
| [33] |
Selim M M. 2008. Application of magnetic technologies in correcting under ground brackish water for irrigation in the arid and semi-arid ecosystem. The 3rd International Conference on Water Resources and Arid Environments and the 1st Arab Water Forum.( 1) 1)
|
| [34] | Yoshihara T, Shimada H, Shizuka H, et al. 2001. Internal conversion of o-aminoacetophenone in solution. Phys Chem.Chem Phys, 3:4972-4978. |
 2016, Vol. 52
2016, Vol. 52

