文章信息
- 王峰, 马玲, 陈俏丽, 王博文, 郝欣, 何芳林, 柳燕
- Wang Feng, Ma Ling, Chen Qiaoli, Wang Bowen, Hao Xin, He Fanglin, Liu Yan
- 松材线虫热激转录因子Bx-HSF-1基因的克隆及表达分析
- Cloning and Expression Analysis of the Heat Shock Transcription Factor Bx-HSF-1 Gene in Bursaphelenchus xylophilus (Aphelenchida: Aphelenchoididae)
- 林业科学, 2016, 52(12): 92-98
- Scientia Silvae Sinicae, 2016, 52(12): 92-98.
- DOI: 10.11707/j.1001-7488.20161211
-
文章历史
- 收稿日期:2015-02-03
- 修回日期:2015-09-24
-
作者相关文章
松材线虫(Bursaphelenchus xylophilus)已危害东亚松林近半个世纪,据不完全统计,仅在中国就有5000万株松树受松材线虫为害致死,年均发生面积近6万hm2(张星耀,2010),且仍有不断向其适生区域以外扩张的趋势。温度是影响松材线虫分布范围的重要环境因素(Mamiya,1983),环境温度高于28 ℃时松材线虫的胚胎发育即受影响(Mamiya,1975),温度高于35 ℃时松材线虫的胚胎发育及胚后发育将会受到干扰。高温胁迫下热激蛋白(heat shock proteins,HSPs)Bx-HSP90(Feng et al.,2012)和Bx-sHSP16A(刘立宏等,2013)等基因能够通过调控松材线虫的生理代谢使其度过不良温度环境。基于松材线虫基因组(Kikuchi et al.,2011)及秀丽线虫(Caenorhabditis elegans)相关研究(Garsin et al.,2003)发现热激蛋白调控从鸟苷酸环化酶路径(guanylyl cyclase pathway,cGMP)起始经TGFβ-like路径到Insulin/IGF路径终止的3个代谢通路(Lithgow et al.,1995; Barsyte et al.,2001; Scott et al.,2002; Garsin et al.,2003)。热激条件下cGMP路径的受体蛋白DAF-6将热激信号通过HSP90/DAF-21传递到TGFβ-like路径,TGFβ-like路径中的DAF-3与Insulin/IGF路径上游的DAF-28和下游的DAF-16交互抑制,调节线虫的新陈代谢产生热激抗逆(thermotolerance)。而Insulin/IGF路径中,热激转录因子(heat shock transcription factor,HSF)HSF-1是热激信号从DAF-28传递到DAF-16的中间节点(Kaletsky et al.,2010; Barna et al.,2012)。HSF-1是细胞抗逆和维持寿命所必须的转录因子。HSF-1通过调控一系列编码分子伴侣的基因网络对环境胁迫或与年龄相关的受损蛋白进行复原和保护。在应激和衰老等状况下,HSF-1除了调节细胞伴侣蛋白外,在维持细胞骨架完整性和细胞功能方面发挥了突出作用(Baird et al.,2014)。由此可见 HSF-1是线虫热激抗逆的一种关键基因,深入研究该基因的功能及其在Insulin/IGF-1信号路径中的调控作用可为揭示松材线虫热激抗逆分子机理提供理论依据。
1 材料与方法 1.1 线虫及处理试验所用松材线虫种群于2007年采集自广东省,寄主为马尾松(Pinus massoniana)。采用贝尔曼漏斗法分离线虫,挑取单条受孕雌虫于灰葡萄孢(Botrytis cinerea)菌苔上25 ℃避光培养,扩繁线虫,至菌苔被取食80%时随机挑取100条线虫接种于新菌苔上,25 ℃避光培养,至菌苔取食50%时分别进行热激培养(30 ℃避光培养)、低温培养(10 ℃避光培养)和正常培养(25 ℃避光培养)。
1.2 线虫cDNA合成应用TRIzol(Invitrogen,cat. No. 15596-026)提取100 μg混合虫龄(雌虫∶雄虫∶幼虫=1∶1∶2)热激培养12 h的松材线虫总RNA,参考文献提供的方法合成cDNA(刘立宏等,2015)。
1.3 Bx-HSF-1基因克隆及生物信息学分析根据松材线虫转录组中鉴定到的松材线虫HSF-1基因,Bx-HSF-1,结合松材线虫基因组数据(Kikuchi et al.,2011)设计涵盖完整蛋白编码区(coding sequence,CDS)的PCR引物:(Bx-HSF-1-F: 5′-GTCAGCGATGTCGTATCT-3′和Bx-HSF-1-R: 5′-CGTGCTAGTAAGGTTGAG-3′)。以第1链cDNA为模板进行PCR扩增(50 μL反应体系,退火温度58 ℃,30个循环),PCR产物送上海生工进行测序。依据测序获得的基因序列进行基于Gene Ontology(GO,http://geneontology.org/)的基因功能预测。通过BLASTP筛选NCBI收录的直系同源序列(orthologues),利用Clustal W进行多序列比对,并构建最大似然树(maximum likelihood tree,MLT)。应用自展检验(bootstrap test)方法估计所构建系统发育树的可靠性,重复次数设定为1 000。应用ProtScale程序(http://expasy.org/cgibin/protscale.pl)进行氨基酸疏水性(hydrophobicity)分析。通过SMART网站(http://smart.embl-heidelberg.de/),分析Bx-HSF-1保守结构域。应用PSIPRED server(http://bioinf.cs.ucl.ac.uk/psipred/)和SWISS-MODEL(http://web.expasy.org/)对Bx-HSF-1进行三维建模。应用JASPAR预测Bx-HSF-1靶位点DNA序列(Bryne et al.,2008),并根据松材线虫基因组数据筛选含有该序列的靶基因。应用Hex 8.0(Macindoe et al.,2010)进行Bx-HSF-1和预测的靶位点DNA序列分子对接(docking)试验(王步勇等,2013)。
1.4 热激处理对Bx-HSF-1及其靶基因表达影响分析根据热激松材线虫转录组测序结果,分别统计出热激培养12 h相对正常培养12 h松材线虫 Bx-HSF-1和其靶基因表达量变化的log2倍数值。分别提取热激培养和正常培养12,24,36和48 h松材线虫的RNA,用DNase I(RNase-free)消化去除基因组DNA残留后反转录成第1链cDNA,以此为模板利用荧光定量q-PCR对热激培养、低温培养和正常培养12,24,36和48 h松材线虫Bx-HSF-1和其靶基因的表达丰度进行分析。Bx-HSF-1基因定量PCR引物为BxHSF1-QF(5′-ATGGAATCGAGAATG GGGGA-3′)和BxHSF1-QR(5′-TTTTGGACGGC TGAAGCATA-3′),靶基因定量PCR引物选用BxDAF7-QF(5′-GTCCTGTGAGGTGGATAGGT-3′)和BxDAF7-QR(5′-TTTGCTCGATCAATGCCCTT-3′)。以松材线虫Actin基因作为内参基因,引物为BxACTα-F(5′-ACCTAGAACAGTCCGAAAAGG-3′)和BxACTα-R(5′-CACCACTGGGAATGAGAGG-3′)。应用GoTaq 2-Step RT-qPCR System试剂盒在Agilent MX3000P多重实时荧光定量PCR仪上进行q-PCR扩增。使用2步法PCR,反应体系为20 μL,反应程序为: 第1步预变性95 ℃ 2 min; 第2步 95 ℃ 15 s,60 ℃ 1 min,进行40个循环。60~95 ℃测定融解曲线。应用MxPro-MX3000P对PCR结果进行分析。
1.5 Bx-HSF-1原位杂交按照De Boer等(1998)的方法进行原位杂交,方法如下: 应用DIG probe synthesis mix kit试剂盒,分别以BxACE1-isF(5′-CAGATGCCCGTGGAAG TAAA-3′)和BxACE1-isR(5′-GTTGTCCCTGAGCAT TCGAT-3′)为引物,合成正、反义探针,99 ℃处理5 min后冰浴备用。收集热激热激处理12 h的线虫于离心管中,加500 μL 1 × 固定液,5 ℃固定18 h,22 ℃固定4 h,然后将线虫置于500 μL裂解液中22℃裂解20 min,离心去上清后加入500 μL甲醇,-70 ℃处理1 min离心去上清,加入500 μL丙酮冰浴1 min,离心去上清后加入500 μL 20%的丙酮,22 ℃水浴20 min。离心去上清后加入500 μL DIG Easy Hyb 55 ℃预杂交1 h。分别加入正、反义探针,55 ℃杂交18 h。杂交后的线虫4 ℃避光过夜显影,在显微镜下观察显影结果,拍照记录。
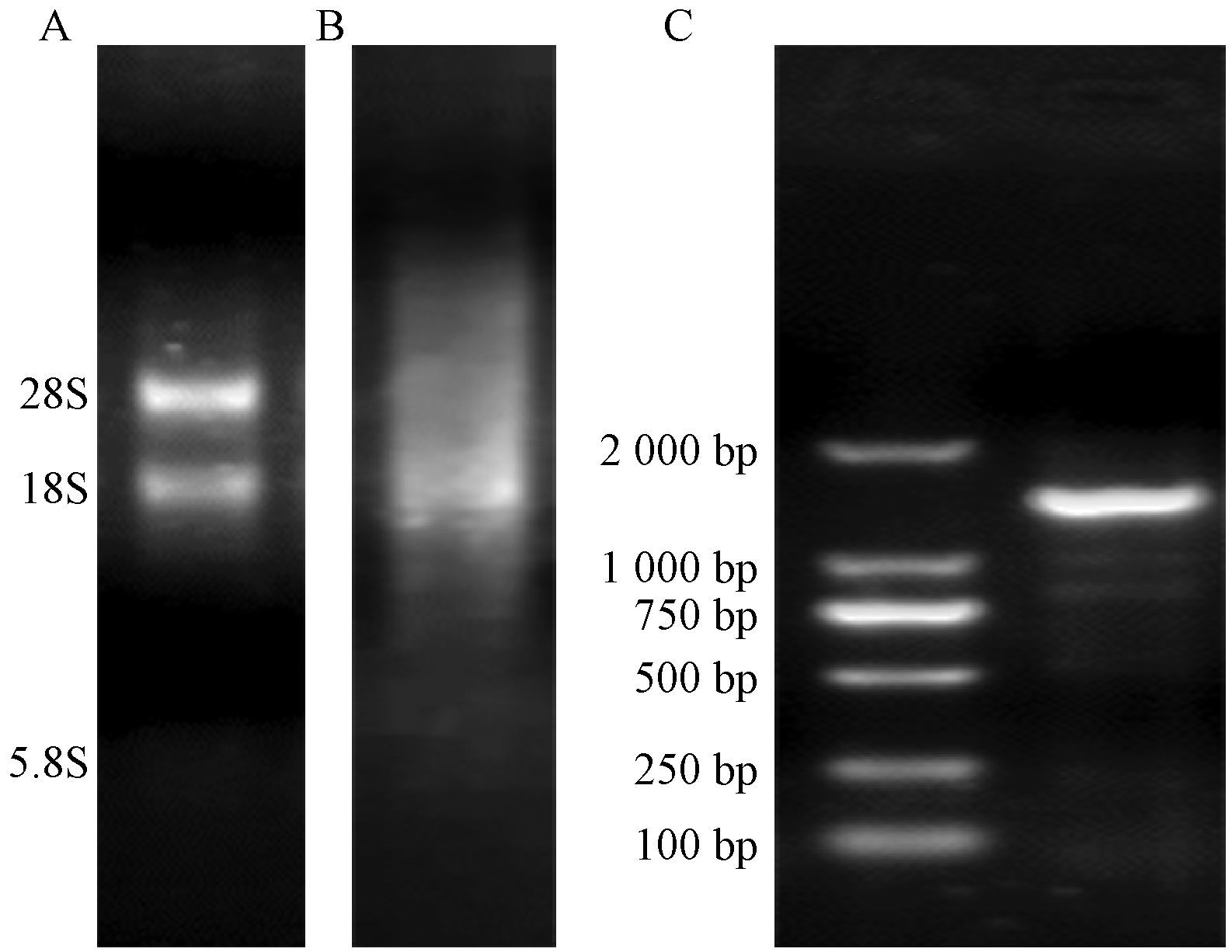
2 结果与分析 2.1 Bx-HSF-1完整蛋白编码区克隆及序列分析提取松材线虫RNA(图 1A)并合成cDNA(图 1B)。根据转录组及因组数据设计引物,PCR扩增得到Bx-HSF-1CDS区全长1 404 bp(图 1C)。
|
图 1 RNA提取及Bx-HSF-1基因CDS区克隆 Fig.1 RNA extraction and cloning of Bx-HSF-1 CDS A: 松材线虫RNA RNA of B. xylophilus; B: 松材线虫cDNA cDNA of B. xylophilus; C:Bx-HSF-1基因CDS区克隆,泳道1: Bx-HSF-1基因CDS,M: DNA Marker DL2000 Cloning of Bx-HSF-1 CDS,Line1: CDS of Bx-HSF-1,M: DNA Marker DL2000. |
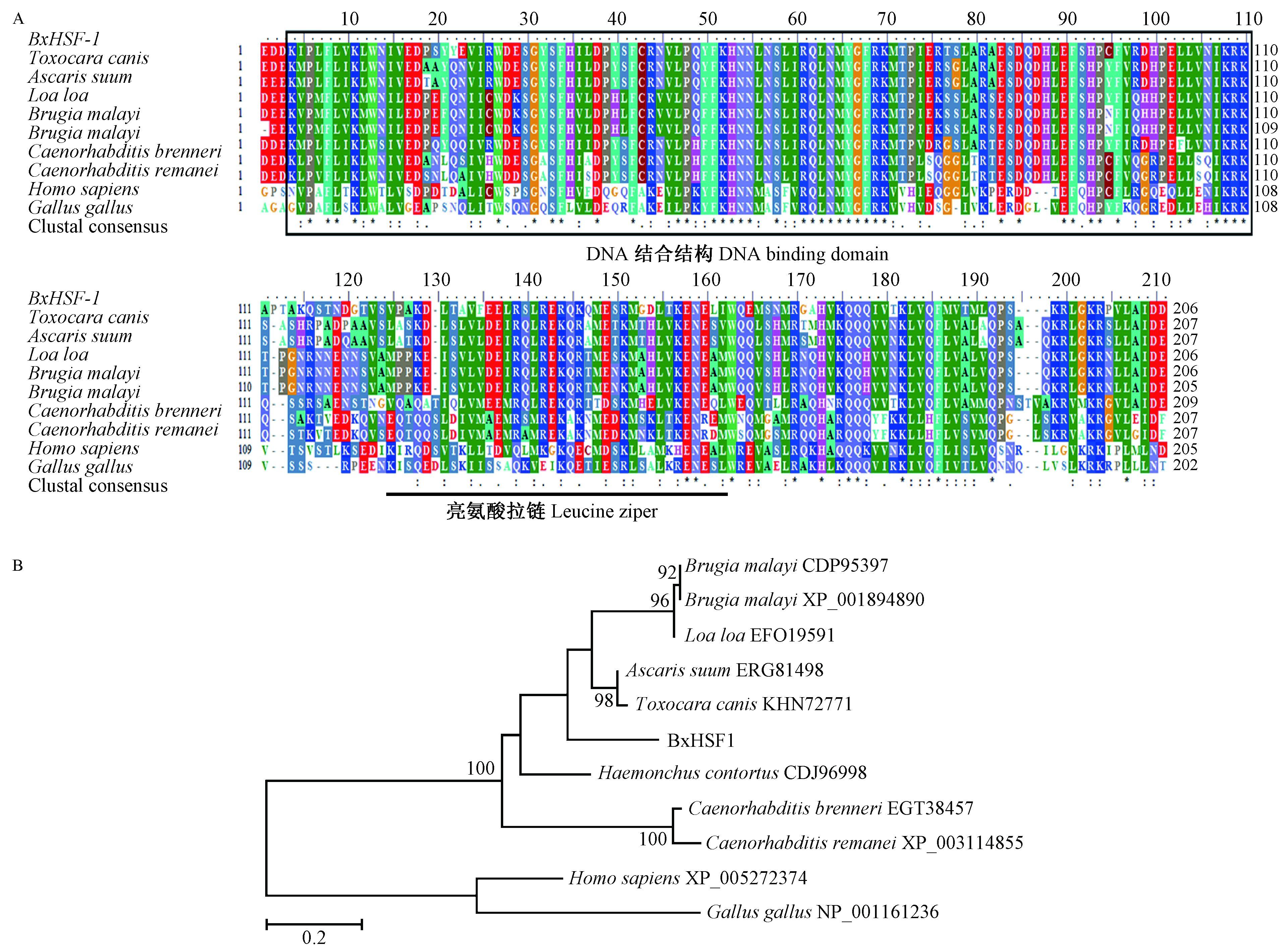
筛选NCBI中的Bx-HSF-1直系同源序列9条,结构域分析表明这9条直系同源序列均含有DNA结合结构域(DNA binding domain)和亮氨酸拉链序列(图 2 A)。多序列比对表明这9序列同源性较高(E-Value=8e-115~6e-51)。动物寄生线虫HSF-1序列相对保守,氨基酸变异最多的是捻转血矛线虫(Haemonchus contortus)HSF-1序列(E-Value=2e-97)。土壤线虫(C. brenneri和C. remanei)内部HSF-1相对保守(E-Value=0.0),和Bx-HSF-1相比较存在差异(E-Value分别为1e-76和2e-75)。用Mega 5.05选择JTT+G模型(BIC值=3811.558)构建最大似然树(图 2 B)。系统发育分析表明,唯一的植物寄生线虫HSF1蛋白Bx-HSF-1独立成枝。
|
图 2 Bx-HSF-1与其同源序列比对及最大似然树 Fig.2 The sequences alignment and maximum likelihood tree of Bx-HSF-1 and orthologues A: HSF序列比对The sequences alignment of Bx-HSF-1;B: HSF最大似然树The maximum likelihood tree of Bx-HSF-1 and orthologues. |
应用GO注释对Bx-HSF-1及其蛋白的功能进行分析,结果显示该基因参与延长线虫寿命(GO:0008340)、正向调控繁殖率(GO:0040010)、运动(GO:0040011)、热激反应(GO:0009408)、抗逆态幼虫发育(GO:0040024)和抗逆反应(GO:0006952)等生理过程(biological process),并具有特异DNA序列结合(sequence-specific DNA binding,GO:0043565)的分子功能。
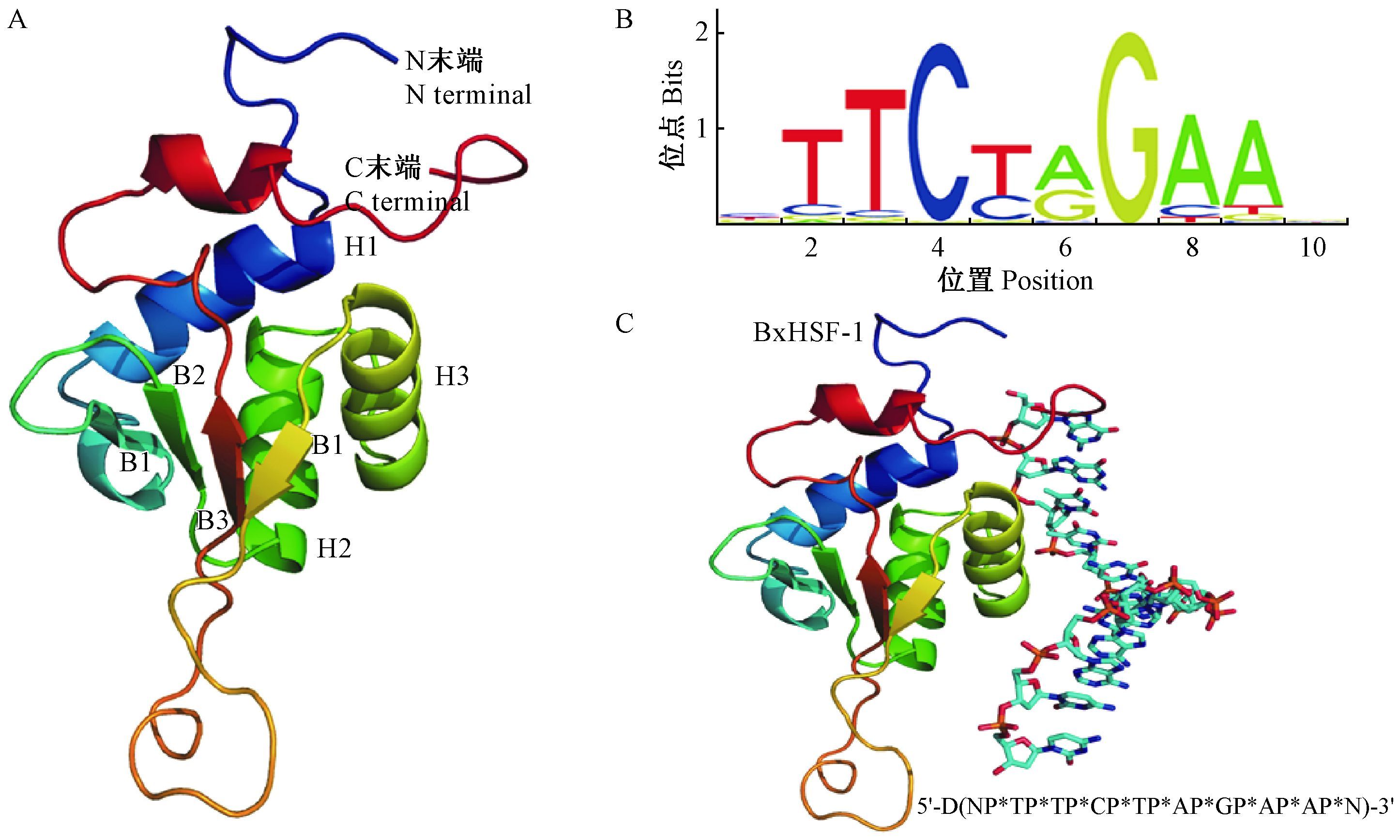
根据与PDB数据库(http://www.rcsb.org/pdb/home/home.do)收录的蛋白质序列比对结果选择相似度最高的蛋白质三维结构(PDB ID: 2LDU,E-Value=1.40e-37)作为模板构建Bx-HSF-1三维结构。结构分析表明,Bx-HSF-1的DNA结合结构域位于蛋白质N末端。氨基酸疏水性分析表明该DNA结合结构域由3个α螺旋和4个反向平行的β折叠(图 3 A)构成一个疏水核心(根据Hphob./Kyte & Doolittle计算,氨基酸平均疏水性=2.867 kacl/mol)。该疏水核心可以保障H2-T-H3与热激元件(heat shock element,HSE)靶位点互作(Sakurai,2010)。应用jaspar预测Bx-HSF-1靶位点序列为TATA 盒上游的回文(palindromic)序列: 5′-T/C/A-T/C/G-C-T/C-A/G-G-A/C/T-A/T/G-3′(图 3 B)。对松材线虫基因组进行BLAST比对,筛选出CADV01005405.1序列TATA盒“TATAAAA”上游序列含有“TTCCGGAA”,经NCBI进行BLAST分析确定该基因是抗逆态幼虫形成基因daf(dauer formation)同源基因Bx-DAF-7(E值=3.7e-33,NCBI No: CADV01005405)。应用Hex 8.0进行Bx-HSF-1和DNA(5′-NTTCCGGAAN-3′)分子对接表明二者可以结合(图 3 C)。因此,Bx-DAF-7是Bx-HSF-1的靶基因。
|
图 3 Bx-HSF-1蛋白质空间结构及与靶序列对接 Fig.3 The protein structure of Bx-HSF-1 and docking with the target DNA A: Bx-HSF-1蛋白质空间结构The protein structure of Bx-HSF-1; B: Bx-HSF-1靶序列预测Predication of Bx-HSF-1 target DNA;C: Bx-HSF-1与靶序列对接Docking of Bx-HSF-1 with target DNA sequence;H1-H3: α螺旋α helixes; B1-B4: β折叠β folds. |
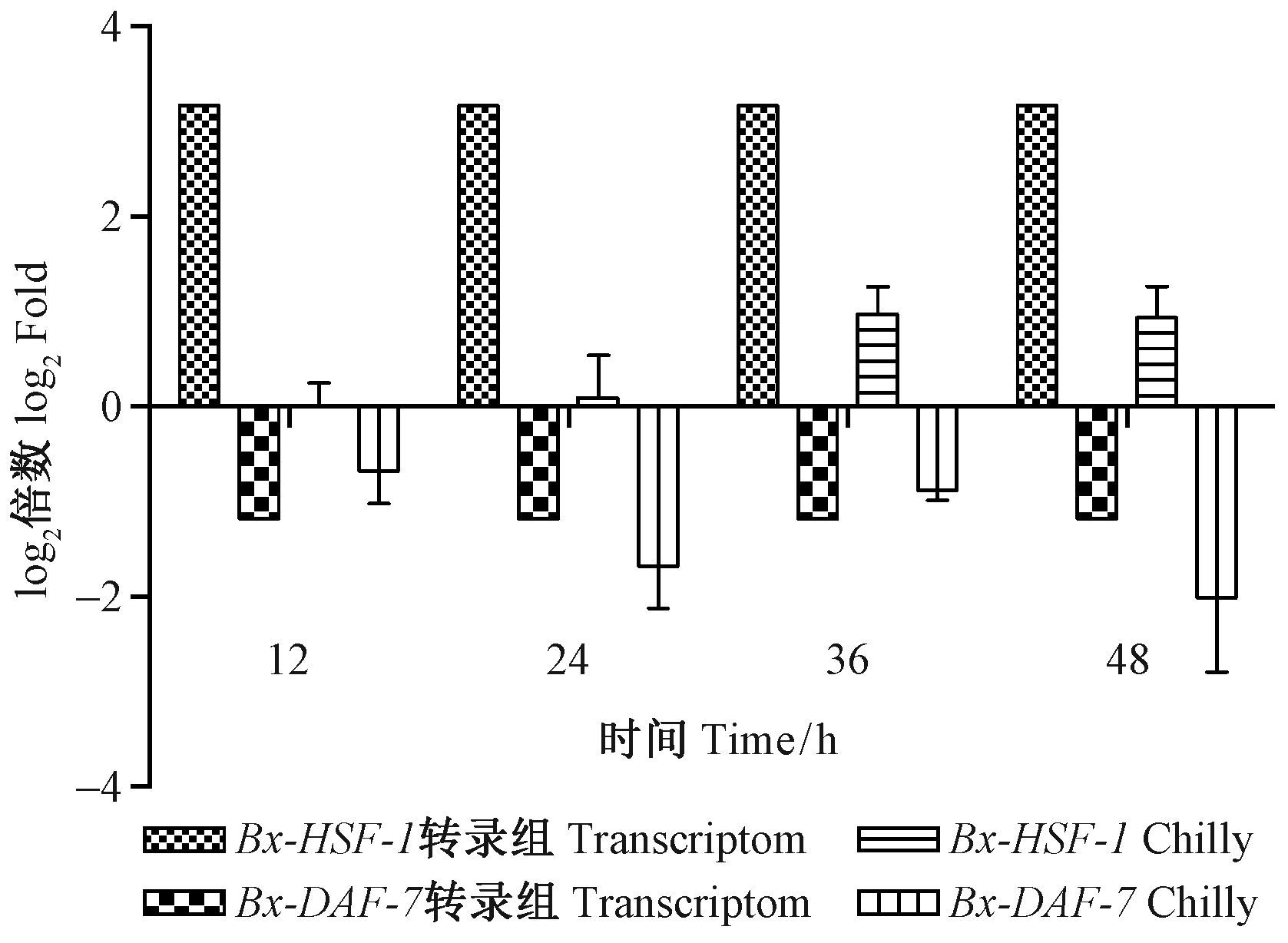
转录组测序表明线虫在热激培养12 h后 Bx-HSF-1归一化之后的表达量为6.048、正常培养12 h归一化之后的表达量为0.143,表达量变化log2倍数为3.17。Bx-DAF-7热激培养12 h归一化之后的表达量为11、正常培养12 h归一化之后的表达量为23,表达量变化log2倍数为-1.18。荧光定量 q-PCR与转录组测序结果存在偏差,但趋势一致,均为热激促进Bx-HSF-1转录,抑制Bx-DAF-7转录。在12~48 h内热激对Bx-HSF-1转录具有持续的促进作用,Bx-HSF-1与Bx-DAF-7的表达量负相关(图 4)。低温处理同样促进Bx-HSF-1转录、抑制Bx-DAF-7转录,但对Bx-HSF-1促进程度小于热激处理,低温处理条件下Bx-HSF-1与Bx-DAF-7的表达量呈负相关。
|
图 4 热激后Bx-HSF-1与Bx-DAF-7基因表达量 Fig.4 Gene expression of Bx-HSF-1 and Bx-DAF-7 after heat shock |
采用原位杂交技术进行Bx-HSF-1基因表达定位分析,地高辛标记的反义探针在正常培养松材线虫通体均检测到微弱的本底表达信号(图 5CK),表明Bx-HSF-1基因在正常培养线虫体内各细胞均有微量表达。87%的热激培养线虫(取样样本量n=112)前体部(procorpus)信号显著(图 5A),峡部(isthmus)和肠(intestine)区体壁信号较显著,表明该部位Bx-HSF-1基因表达量显著高于其他部位和对照线虫。这一结果表明,Bx-HSF-1基因受温度刺激后多数体细胞内均有较高表达,特别是神经元(neurons,图 5A1)、体壁肌肉细胞(body wall muscle cells,图 5A2)和皮下细胞(hypodermal cells,图 5A3)中表达显著。

|
图 5 Bx-HSF-1基因原位杂交 Fig.5 In-situ hybridization of Bx-HSF-1 A: Bx-HSF-1基因原位杂交In-situ hybridization of Bx-HSF-1; CK: 对照Control check.S: 口针Stylet; M: 中食道球Metacorpus; G: 食道腺Esophageal glands; 1: 神经元Neurons; 2: 体壁肌肉细胞Body wall muscle cells; 3: 皮下细胞Hypodermal cells. |
秀丽线虫几乎所有细胞都有hsf-1基因表达(Chiang et al.,2012),但在体壁肌肉细胞、皮下细胞、头部神经元和肠表达量显著。本研究Bx-HSF-1原位杂交结果与秀丽线虫hsf-1基因表达部位符合。就热激后表达量变化而言,Bx-HSF-1也与秀丽线虫相关研究一致。在15 ℃培养7天秀丽线虫hsf-1基因仅有微量表达,35 ℃热激15 min后表达量即显著上调(Sugi et al.,2011)。说明hsf-1基因在不同种类线虫中的功能是相对保守的。
有研究(Akerfelt et al.,2010)表明,秀丽线虫HSF-1单体可以与HSP90结合,HSF-1对HSP90有反向激活作用。非热激条件下,HSF-1单体与HSP90结合,HSF-1功能被抑制。热激条件下,HSP90释放HSF-1单体、结合错误折叠蛋白,HSF-1形成三聚体与HSE基序“AGAAN”特异结合反向激活HSPs转录(Akerfelt et al.,2010)。就松材线虫而言,Bx-HSP90(Feng et al.,2012)在35 ℃热激条件下同样是肠及头部神经元处表达上调,这从另一个侧面印证了热激条件下Bx-HSF-1对Bx-HSP90的反向激活。鉴于秀丽线虫hsf-1直接或间接的与HSP90/DAF-21、多个DAF基因、DDL-1/2、AAP-1及PDK-1等多个基因发生调控/互作关系,因此除了本文预测的Bx-DAF-7外,Bx-HSF-1应该还有多个潜在靶基因,因此有必要通过酵母单杂交技术进一步筛选验证靶基因。
松材线虫除繁殖周期形成幼虫(L1-L4)和成虫外,在抗逆周期(分散周期)先形成抗逆态幼虫(specialized third-stage dauer larva,DL3 或 dispersal third-stage larva,LIII)度过不良环境,继而发育为扩散期幼虫(fourth-stage dispersal larva,DL4 或 LIV)随松墨天牛(Monochamus alternatus)迁飞,形成松树萎蔫病新的侵染源。若以DL3 形成调控路径为防治靶标,利用现代分子生物学技术干扰松材线虫抗逆周期DL3 的形成,激活或抑制这些基因则可减少DL4 的数量以达到防治松树萎蔫病的目的(王峰等,2016)。由于cGMP路径、TGFβ-like路径和Insulin/IGF路径均与线虫抗逆态幼虫形成相关,预示 Bx-HSF-1与松材线虫DL3及DL4形成代谢路径调控相关。因此Bx-HSF-1是潜在的生物防治靶标基因,深入研究Bx-HSF-1的基因功能不但对揭示松材线虫抗逆态幼虫形成的分子机理具有重要的理论意义,还具有潜在的防治应用价值。
4 结论本研究表明Bx-HSF-1受温度刺激后在多数体细胞内均有较高表达,特别是神经元、体壁肌肉细胞和皮下细胞中表达显著。转录组测序及q-PCR结果均表明Bx-HSF-1与Bx-DAF-7的表达量负相关。Bx-HSF-1具有特异DNA序列结合的分子功能,是一种与温度刺激相关的转录调控因子,可负调控抗逆态幼虫形成基因Bx-DAF-7表达。
| [] |
刘立宏, 王峰, 王步勇, 等. 2013. 松材线虫Bx-sHSP16A基因克隆及蛋白质结构研究. 中国农学通报 , 22 : 40–45.
( Liu L H, Wang F, Wang B Y, et al.2013. Gene cloning and protein structure implications of a Bx-sHSP16A from Bursaphelenchus xylophilus. China Agricultural Science Bulletin , 22 : 40–45. [in Chinese] ) |
| [] |
刘立宏, 王峰, 马玲, 等. 2015. 松材线虫乙酰胆碱酯酶1基因沉默及蛋白抑制剂研究. 林业科学 , 51 (1) : 8.
( Liu L H, Wang F, Ma L, et al.2015. BxACE1 gene RNAi and protein inhibition of acetylcholinesterase in pine wood nematode Bursaphelenchus xylophilus. Scientia Silvae Sinicae , 51 (1) : 8. [in Chinese] ) |
| [] |
王步勇, 王峰, 刘立宏, 等. 2013. 松材线虫Rbx1基因克隆及蛋白质结构分析. 东北林业大学学报 , 41 (11) : 123–126.
( Wang B Y, Wang F, Liu L H, et al.2013. Gene cloning and structures implications of an Rbx1 enzyme from Bursaphelenchus xylophilus. Journal of Northeast Forestry University , 41 (11) : 123–126. [in Chinese] ) |
| [] |
王峰, 李丹蕾, 马玲, 等. 2016. 松材线虫抗逆态基因Bx-DAF6鉴定及基因沉默. 北京林业大学学报 , 38 (1) : 21–27.
( Wang F, Li D L, Ma L, et al.2016. Identification and RNAi of a Bursaphelenchus xylophilus dauer formation gene:Bx-DAF6. Journal of Beijing Forestry University , 38 (1) : 21–27. [in Chinese] ) |
| [] |
张星耀. 2010. 我国松材线虫病防控基础研究进展. 第三届全国生物入侵大会论文摘要集-"全球变化与生物入侵":1-5. ( Zhang X Y. 2010. Basic research of the pine wilt disease prevention and control progress. Third National Conference of Biological Invasion Abstract-"Global change and biological invasions":1-5. [in Chinese][in Chinese]) |
| [] | Akerfelt M, Morimoto R I, Sistonen L.2010. Heat shock factors:integrators of cell stress, development and lifespan. Nature Reviews Molecular Cell Biology , 11 : 545–555. DOI:10.1038/nrm2938 |
| [] | Baird N A, Douglas P M, Simic M S, et al.2014. HSF-1-mediated cytoskeletal integrity determines thermotolerance and life span. Science , 346 (6207) : 360–363. DOI:10.1126/science.1253168 |
| [] | Barna J, Princz A, Kosztelnik M, et al.2012. Heat shock factor-1 intertwines insulin/IGF-1, TGF-β and cGMP signaling to control development and aging. BMC Developmental Biology , 12 (1) : 32. DOI:10.1186/1471-213X-12-32 |
| [] | Barsyte D, Lovejoy D, Lithgow G.2001. Longevity and heavy metal resistance in daf-2 and age-1 long-lived mutants of Caenorhabditis elegans. The FASEB Journal , 15 (3) : 627–634. DOI:10.1096/fj.99-0966com |
| [] | Bryne J, Valen E, Tang M, et al.2008. JASPAR, the open access database of transcription factor-binding profiles:new content and tools in the 2008 update. Nucleic Acids Research , 36 (suppl 1) : D102–D106. |
| [] | Chiang W C, Ching T T, Lee H C, et al.2012. HSF-1 regulators DDL-1/2 link insulin-like signaling to heat-shock responses and modulation of longevity. Cell , 148 : 322–334. DOI:10.1016/j.cell.2011.12.019 |
| [] | De Boer J M, Yan Y, Smant G, et al.1998. In-situ hybridization to messenger RNA in Heterodera glycines. Journal of Nematology , 30 (3) : 309. |
| [] | Feng W, Zhiying W, Danlei Li, et al.2012. Identification and characterization of a Bursaphelenchus xylophilus(Aphelenchida:Aphelenchoididae)thermotolerance-related gene:Bx-HSP90. Int J Mol Sci , 13 (7) : 8819–8833. |
| [] | Garsin D, Villanueva J, Begun J, et al.2003. Long-lived C. elegans daf-2 mutants are resistant to bacterial pathogens. Science , 300 (5627) : 1921–1921. |
| [] | Kaletsky R, Murphy C.2010. The role of insulin/IGF-like signaling in C. elegans longevity and aging. Disease Models & Mechanisms , 3 (7/8) : 415–419. |
| [] | Kikuchi T, Cotton J A, Dalzell J, et al.2011. Genomic insights into the origin of parasitism in the emerging plant pathogen Bursaphelenchus xylophilus. PLoS Pathogens , 7 (9) : e1002219. DOI:10.1371/journal.ppat.1002219 |
| [] | Lithgow G, White T, Melov S, et al.1995. Thermotolerance and extended life-span conferred by single-gene mutations and induced by thermal stress. Proceedings of the National Academy of Sciences , 92 (16) : 7540544. |
| [] | Macindoe G, Mavridis L, Venkatraman V, et al.2010. HexServer:an FFT-based protein docking server powered by graphics processors. Nucleic Acids Research , 38 : W445–W449. DOI:10.1093/nar/gkq311 |
| [] | Mamiya Y.1975. The life history of the pine wood nematode, Bursaphelenchus lignicolus. Japanese Journal of Nematology , 5 : 16–25. |
| [] | Mamiya Y.1983. Pathology of the pine wilt disease caused by Bursaphelenchus xylophilus. Annual Review of Phytopathology , 21 (1) : 201–220. DOI:10.1146/annurev.py.21.090183.001221 |
| [] | Sakurai H, Enoki Y.2010. Novel aspects of heat shock factors:DNA recognition, chro-965 matin modulation and gene expression. FEBS J , 277 : 4140–4149. DOI:10.1111/j.1742-4658.2010.07829.x |
| [] | Scott B, Avidan M, Crowder C.2002. Regulation of hypoxic death in C. elegans by the insulin/IGF receptor homolog DAF-2. Science , 296 (5577) : 2388–2391. |
| [] | Sugi T, Nishida Y, Mori I.2011. Regulation of behavioral plasticity by systemic temperature signaling in Caenorhabditis elegans. Nat Neurosci , 14 : 984–992. DOI:10.1038/nn.2854 |
 2016, Vol. 52
2016, Vol. 52

