文章信息
- 杨汉波, 张蕊, 周志春
- Yang Hanbo, Zhang Rui, Zhou Zhichun
- 木荷种子园的遗传多样性和交配系统
- Genetic Diversity and Mating System in a Seed Orchard of Schima superba
- 林业科学, 2016, 52(12): 66-73
- Scientia Silvae Sinicae, 2016, 52(12): 66-73.
- DOI: 10.11707/j.1001-7488.20161208
-
文章历史
- 收稿日期:2015-12-09
- 修回日期:2016-03-02
-
作者相关文章
植物交配系统包含了群体间或群体内个体间基因交流的全部过程,它决定着植物未来世代的群体有效大小、基因型分布和种群动态(张大勇等,2001)。由优树家系或无性系组成的林木种子园是林木良种繁育的主要形式和育种系统的重要组成部分,经营良好的种子园可提供大量遗传品质优良的种子用于林业生产(沈熙环,1992)。种子园主要依靠开放式传粉,种子的产量和质量主要受交配系统影响(Woods et al.,2002),有研究指出,超过50%的种子园遗传增益的减少是受种子园内交配系统及外源花粉污染的影响(Plomion et al.,2001)。影响种子园交配系统的因素有很多,主要包括父母本个体间繁殖适合度(Dering et al.,2014)、繁殖成功率(Funda et al.,2011)及花期物候(Tani et al.,2015)等。因此,了解种子园交配系统的实际情况不仅对于种子园的遗传管理与经营有着极其重要的生产实践意义,而且对林木遗传育种方法的选择和植物保护策略的制定具有指导意义。
不同树种的交配系统受其自身遗传学特性影响(赖焕林等,1997a)。例如,针叶树多为风媒传粉,其天然群体或人工群体的异交率大多在90%上下波动(赖焕林等,1997a; 谭小梅等,2012; Dering et al.,2014; Wei et al.,2015); 而虫媒传粉植物的交配系统主要受传粉媒介的类型与效率的影响(Ivey et al.,2005),其异交率波动较大,主要在70%~100%之间(Chaix et al.,2003; Tanksley et al.,1983; Yuskianti et al.,2013)。相对于风媒传粉,虫媒传粉可控制性强,可以通过人为调控传粉者数量和效率等,达到增加种子(果实)产量的目的(Garibaldi et al.,2013; Holzschuh et al.,2012)。另外,当传粉方式由风媒转换为虫媒后,能有效减少自交,显著提高植株坐果率(Wragg et al.,2011)。有研究认为,同时具备虫媒和风媒特征的植物,虫媒传粉方式下产生的种子具有更高的产量、质量和经济价值(Garratt et al.,2014)。因此,开展对虫媒树种种子园遗传交配系统的研究不仅具有一定的理论意义,而且对遗传改良实践、获得高遗传增益的种子园配置具有重要的实际指导作用。
从已有的研究来看,林木交配系统的研究绝大多数集中在风媒针叶树种上(赖焕林等,1997b)。国内虽营建了一些虫媒树种种子园(高晗,2004; 梁丽华,2014),但对于种子园交配系统的研究未见报道。木荷(Schima superba)为虫媒传粉植物,不仅是我国东部湿润亚热带常绿阔叶林的主要建群种,更是我国南方各省区的珍贵优质阔叶用材和高效生物防火树种,在商品用材林和生态防火林建设中占有重要地位(倪健,1996)。本文采用SSR标记研究木荷种子园的交配系统,比较亲本与子代群体的遗传多样性,以揭示该木荷种子园交配机制对后代遗传多样性所产生的影响以及亲、子代遗传多样性变化规律,为木荷种子园遗传管理提供科学依据,同时也为其他虫媒传粉植物种子园营建及相关研究提供理论参考。
1 材料与方法 1.1 材料来源试验材料来源于浙江省兰溪市兰溪苗圃木荷无性系种子园(29°08′16″N,119°27′47″E)。种子园平均海拔42 m,年均温17.7 ℃,年均降水量1 438.9 mm。该种子园以马尾松无性系种子园互为隔离,面积20 hm2,共97个亲本无性系,分8个生产小区。其中1小区于2011年5月采用1年生的嫁接容器苗定植,含44个无性系,10个无性系来自浙江龙泉,其余均来自福建建瓯,每个无性系包含6~20个分株; 其余小区为2012年2月采用2年生的嫁接容器苗定植。小区内无性系随机配置定植,株行距为5 m×5 m,同一无性系分株间距离20 m以上。
1.2 样品采集及处理2014年11月在第1小区中抽取11个无性系母本单株(在种子园中位置见图 1)采种,于2015年3月培育容器苗,当苗高10 cm左右时,每个母本随机取29~30个子代苗; 种子园亲本以第1小区的44个无性系为主要研究对象。每样本取2~3片嫩叶,液氮速冻后,置于-80 ℃冰箱中备用。
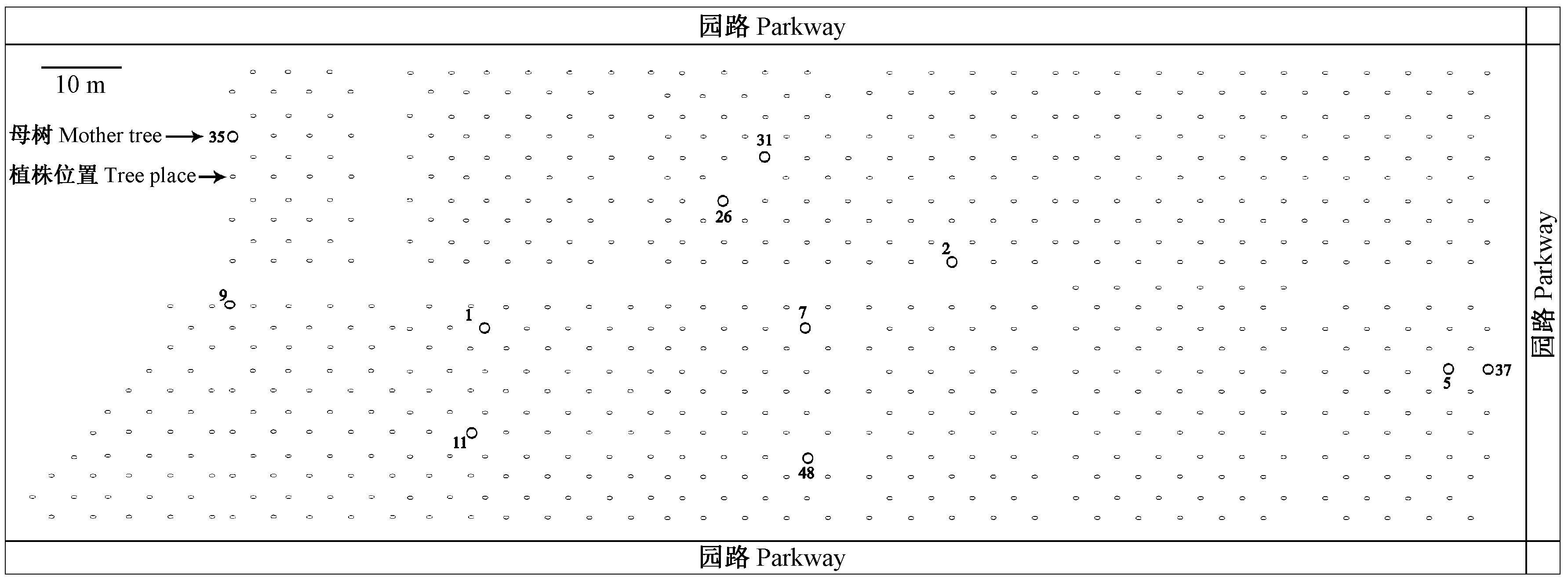
|
图 1 木荷种子园第1小区采种无性系分布 Fig.1 Illustration of the sampling clones in the first cell of Schima superba seed orchard |
采用DNA提取试剂盒提取亲本及子代的基因组DNA,利用NanoDrop-2000和1.0%琼脂糖凝胶电泳检测基因组DNA质量及浓度。本试验选用13对条带清晰、多态性强的SSR引物进行PCR扩增(Niu et al.,2012; 辛娜娜等,2015)。PCR扩增反应在TaKaRa PCR Thermal Cycler Dice Touch上进行。PCR扩增反应体系25 μL: 含12.5 μL 2×Taq Plus Master Mix,10 μmol·L-1下游引物和50 ng基因组DNA。PCR扩增程序为: 95 ℃预变性5 min; 94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸45 s(35个循环); 72 ℃延伸10 min(辛娜娜等,2015)。扩增产物在Qsep100TM全自动核酸蛋白自动分析系统上进行电泳分离检测,Qsep100TM的分辨率可高达1%,能以2~4 bp的分辨率高效区分20~20 000 bp DNA片段,在200 bp处,可清楚分辨2 bp差异的条带(http://www.sciencemag.org/content/348/6241/1383.1.full)。
1.4 数据分析对SSR检测结果进行峰图分析及等位基因的读取,然后采用GenAlEx6.5(Peakall et al.,2012)计算亲本、子代群体的遗传多样性参数。参数包括等位基因数(Na)、有效等位基因数(Ne)、Nei基因多样性指数(h)、Shannon’s信息指数(I)、观测杂合度(Ho)、期望杂合度(He)和固定指数(F=1-Ho/He)。采用MLTR 3.4软件对交配系统参数进行估计(Ritland,2002)。采用最大期望值(expectation maximization,EM)法,在95%的置信区间下经过1 000次重复取样(bootstraps)估算多位点异交率(tm)、单位点异交率(ts)、双亲近交系数(tm-ts)及父本相关性(rp)[包括单位点相关性(rp(s))和多位点相关性(rp(m))]。混合交配系统模型的一些假设对单位点估计的影响较大,而对多位点估计的影响较小(Ritland,2002),因此,本文注重多位点异交率的分析。
2 结果与分析 2.1 木荷种子园亲本与子代遗传多样性分析13对SSR引物对亲本群体(44个无性系)基因分型结果显示: 在亲本群体(表 1)中检测到5~9个等位基因(Na),平均为6.286,有效等位基因数(Ne)为3.097,其中ss32位点的Na和Ne均最大,分别为9.000和5.939,其次为ss42和ss22。亲本群体的Shannon’s信息指数(I)和Nei’s基因多样度(h)分别为1.230和0.640; 期望杂合度(He)和观测杂合度(Ho)的均值分别为0.632和0.707,He和Ho间存在一定的差异。
|
|
13对SSR引物对子代群体(328个子代个体)基因分型结果显示: 在子代群体(表 2)中检测到等位基因数(Na)为5~11个,平均为7.786,较亲本群体高出1.500个等位基因。子代群体的有效等位基因数(Ne)变化范围在2.506~5.914之间,平均为3.751,较亲本群体高出0.654个有效等位基因。Shannon’s信息指数(I)和Nei’s基因多样度(h)均与亲本群体基本保持一致,分别为1.152和0.611,说明子代能保持亲本所具有的高遗传多样性。13个SSR位点的He和Ho平均为0.600和0.715,He较亲本略有降低,Ho略高于亲本,但不存在明显差异,说明子代群体中实际观察到的杂合单株占全部单株比例较亲本有所增加,但差异不大。根据13个位点的基因分型结果计算得到的子代固定指数F为 -0.143,表明杂合子过剩现象的存在。此外,在13个位点中还检测到1~5个子代特有而亲本没有的等位基因(图 2)。
|
|
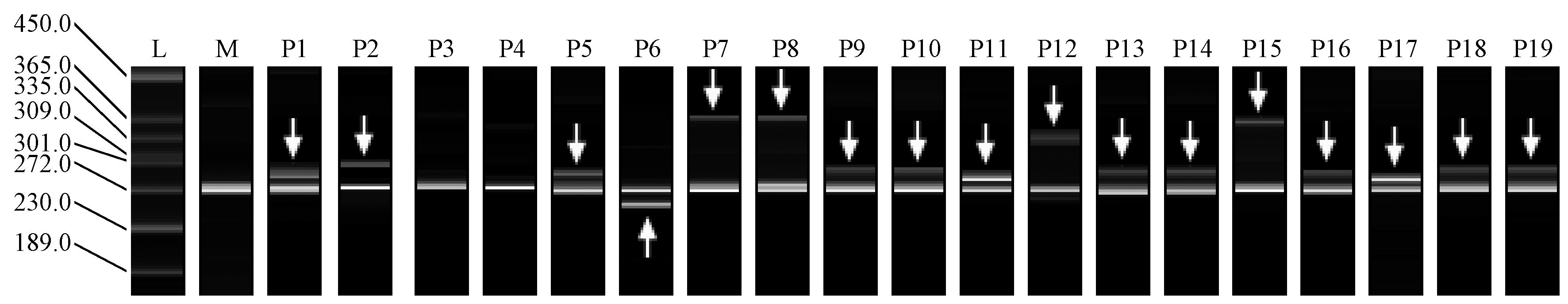
|
图 2 引物SS16在部分母本与子代中扩增结果 Fig.2 The amplification products of primer SS16 in part of female parents and progenies L: Ladder(20-1 000 bp). M: 母本; P1-P19: 子代。箭头所指为子代特有等位基因。 M: Mother tree; P1-P19: Progenies. The arrow indicates the specific alleles in progenies. |
利用MLTR程序对木荷无性系种子园1小区随机抽取的11个母本单株的328个子代进行分析(表 3),13个位点估算出多位点异交率(tm)为1.000,单位点异交率(ts)为0.939。木荷种子园的双亲近交水平较低,tm-ts为0.061。木荷种子园中有效花粉供体数目(Nep)较少,仅为2.3。单位点父本相关性和多位点父本相关性的差值(rp(s)-rp(m))反映双亲关联度与交配群体结构之间的关系,rp(s)-rp(m)为0.012,大于零,表明只有小部分花粉供体是近亲关系。
|
|
由表 4可见,供试的11个家系的多位点异交率(tm)、单位点异交率(ts)均存在一定的差异,tm变化范围为0.992(9号家系)~1.073(35号家系)。近交指数(tm-ts)变化幅度为-0.198(35号家系)~0.117(9号家系),其中11,7,48,5,1,35,26和2号家系tm-ts小于零,说明这些家系没有近亲交配存在; 相反,31,37和9号家系的双亲近交系数分别为0.107,0.062及0.117,都大于零,暗示着这些家系存在近亲交配的现象。11个家系的父本相关性(rp)差异较大,变化范围为0.210~0.762,有效花粉供体的数目为1.3~4.8,表明不同家系的父本相关性程度不一致,其中31号家系最高,最低的是48号家系。
|
|
木荷为虫媒传粉阔叶树种,已有研究表明,木荷的物种以及种群水平均具有较高的遗传多样性,是遗传多样性较高的物种(王峥峰等,2004; 张萍等,2006; 金则新等,2007; 辛娜娜等,2015)。本研究结果显示,木荷无性系种子园亲本群体具有较高的遗传多样性(Na=6.286,h=0.611,I=1.152),该结果与辛娜娜等(2015)利用14对SSR引物对木荷育种群体中部分优树无性系的分析结果(Na=6.140,h=0.599,I=1.224)基本一致,但仍存在一些差异,这可能与所使用的研究材料和电泳分离检测方法不同有关。部分SSR位点(ss13,ss18和ss22)在亲本群体分析中固定指数(F)显著低于0(表 1),表明存在杂合子过剩现象,这可能与SSR位点间等位基因的差异及无效等位基因的存在有关; 也有可能因种子园内亲本经人工选择从而造成种子园亲本杂合子过剩(Stoeckel et al.,2006)。本研究以种子园第1小区作为试验小区,母树可能接受其他小区亲本的花粉,这为基因重组提供了机会,并且种子园以马尾松无性系种子园互为隔离; 因此,子代中检测到的1~5个特异等位基因,可能来源于种子园中与第1小区相临的第2和8小区的70号和65号等无性系。该种子园亲子代各位点上最常见的等位基因的频率没有明显变化,亲子代杂合子过剩水平也没有明显的差别。这是在环境条件没有发生剧变时,上下2个连续世代间遗传结构持续稳定的一个具体表现(赖焕林等,1997b)。本研究中木荷种子园子代的遗传多样性较高(h=0.611,I=1.152),明显高于风媒传粉的针叶树种子园,如马尾松(Pinus massoniana)(h=0.441,I=0.838)(谭小梅等,2012)、油松(Pinus tabulaeformis)(h=0.382, I=0.435)(王虎等,2012)、华北落叶松(Larix principis-rupprechtii)(I=0.713,0.705,0.791)(于大德等,2014)。这可能是因为种间差异,也可能与建园时无性系配置、开花结实规律、种子园无性系亲本数量及遗传多样性水平等多方面的因素有关。而该木荷种子园遗传多样性与其他成功建园的虫媒传粉阔叶树种子园的遗传多样性水平相似,如巨桉(Eucalyptus grandis)(He=0.762)(Chaix et al.,2003)、马占相思(Acacia mangium)(He=0.606,0.610)(Yuskianti et al.,2013),说明木荷种子园营建时优树亲本无性系选择和配置相对合理。种子园亲、子代群体与木荷育种群体部分材料的遗传多样性(辛娜娜等,2015)基本一致,表明选择了子代生长表现良好的部分优树营建的种子园,种子园内亲本数量相对育种群体有所减少,但在减少数量的同时遗传多样性并未降低,种子园亲本群体遗传基础比较广泛(Wheeler et al.,1992)。
3.2 木荷种子园交配系统木荷种子园中多位点异交率(tm)为1.000,表明种子园存在高度异交机制,双亲近交水平较低,主要通过异交产生种子(表 2; 表 3)。与成功营建且投入生产的桉树(Eucalyptus)种子园如王桉(E. regnans)tm=0.911(Momn et al.,1985)、尾叶桉(E. urophylla)tm=0.930(Gaiotto et al.,1997)、巨桉 tm=0.967(Bradbury et al.,2013)等相比较,该木荷种子园异交率相对较高(tm=1.000); 这可能是物种不同造成的差异,也可能是由于分析方法的不同,SSR标记能显示同工酶、RAPD、AFLP等标记所检测不出的等位基因(高翔等,2002)。通过对比分析反映出种子园高的异交水平,没有出现建园时因亲本间亲缘关系的存在等使得异交率降低、近交率增加的现象,这从子代群体的近交指数(tm-ts=0.061)和固定指数(F=-0.143)接近或小于0均可看出。对木荷的繁育系统研究(未发表)发现,木荷具有雌蕊先熟的特征,并且花粉失活快,这可能是该种子园异交率高的原因之一。本研究结果显示,该种子园家系表现为高度异交,不同家系异交水平存在一定的差异,这可能与亲本的自交可育程度、自身花粉的充裕程度以及在园内所处的位置不同有关。11个家系间的异交率均较高且差异不显著,说明该种子园的亲本选择和配置是比较合理的。母树接受的花粉组成的多样性越高,越能使子代产生高的遗传变异(Schemske et al.,1994)。该木荷种子园有效花粉供体数目较少(表 3),可能与种子园内不同无性系间花期的不完全同步有关。11个家系的父本相关性和有效花粉供体数差别较大(表 4),这可能与各亲本在种子园中所处位置(图 1)及周围无性系花期有关: 35号母树有效花粉供体(Nep)为3.8,可能是该无性系位于种子园的边缘地区,周围可提供花粉的植株较少,提供的花粉量有限; 48号虽位于种子园中心位置,但Nep却达到4.8,其可能的原因是48号亲本周围的无性系花期重叠较少,造成花粉供体较少,需要大量外源植株提供花粉,使得其有效花粉供体数较大; 而31和7号的Nep分别为1.3和1.6,它们位于种子园中心位置,周围植株花量充足且花期同步,可以提供足够的花粉,因此它们的有效花粉供体较少,父本相关性较高。
经交配系统分析,木荷种子园具有高的异交率,但仍存有少量的近交现象发生。有研究证明近交和自交衰退可以发生在植物生活周期的不同阶段,植物生活史后期受到的影响可能更大,导致大量有害隐性基因的暴露、子代群体经济性状的下降乃至植物群体的衰亡(Charlesworth et al.,1987)。种子园中低密度的开花植株量已被证明是导致种子园高近交(自交)的重要因素(Fuchs et al.,2003)。种子园花期、花量以及选择性受精现象的存在,可能是导致种子园中非随机交配发生、造成近交(自交)的原因(张华新,2000)。本研究采用固定指数(F)和近交指数(tm-ts)对木荷种子园子代群体近交水平进行了分析,结果表明,该种子园杂合子过剩(F=-0.143),自交率极低,这与木荷的自交不亲和性有关,自花授粉难以产生有效后代。群体内发生近交或自交,是群体偏离哈迪-温伯格平衡的因素之一(王崇云,1998)。本研究采用的13个SSR位点中有8个位点在子代群体中显著偏离哈迪-温伯格平衡(表 2),反映出种子园中存在近亲繁殖的现象; 该种子园存在很低的近交水平(tm-ts=0.061); 种子园rp(s)- rp(m)值为0.012,暗示双亲关联度较低,进一步表明了其低水平的近交行为。种子园存在近交的可能原因是亲本个体间的花期不完全同步,导致开花早的个体接受到异源花粉几率降低,造成近交。
4 结论种子园中家系或无性系的合理选择和配置是保持高水平异交率的关键。本试验所得的遗传多样性参数和交配系统指标均表明,浙江省兰溪苗圃木荷种子园营建时无性系选择和配置比较成功,自交不明显,子代仍能保持丰富的遗传多样性。但本文仅对木荷无性系种子园第1小区的11个无性系亲本进行了单年份分析,因此,还需进一步对该种子园进行多年度、多样本的重复试验来验证该结论。
| [] |
高翔, 庞红喜, 裴阿卫. 2002. 分子标记技术在植物遗传多样性研究中的应用. 河南农业大学学报 , 36 (4) : 356–359.
( Gao X, Pang H X, Pei A W.2002. Application of molecular marker techniques in the plant genetic diversity study. Journal of Henan Agricultural University , 36 (4) : 356–359. [in Chinese] ) |
| [] |
高晗. 2004. 长白山珍贵阔叶树种子园建园配套技术. 哈尔滨:东北林业大学硕士学位论文. ( Gao H. 2004. The research of broadleaved tree seed garden building technique in Changbai Mountain. Harbin:MS thesis of Northeast Forestry University. [in Chinese][in Chinese]) |
| [] |
金则新, 李钧敏, 蔡琰琳. 2007. 不同海拔高度木荷种群遗传多样性的ISSR分析. 生态学杂志 , 26 (8) : 1143–1147.
( Jin Z X, Li J M, Cai Y L.2007. ISSR analysis of genetic diversity of Schima superba populations at different altitudes. Chinese Journal of Ecology , 26 (8) : 1143–1147. [in Chinese] ) |
| [] |
赖焕林, 王明庥. 1997a. 马尾松人工群体交配系统研究. 林业科学 , 33 (3) : 219–224.
( Lai H L, Wang M X.1997a. Research on mating systems in man-made populations of Masson pine. Scientia Silvae Sinicae , 33 (3) : 219–224. [in Chinese] ) |
| [] |
赖焕林, 王章荣, 陈天华. 1997b. 林木群体交配系统研究进展. 世界林业研究 , 10 (5) : 10–15.
( Lai H L, Wang Z R, Chen T H.1997b. Advances in research on mating systems of forest tree populations. World Forestry Research , 10 (5) : 10–15. [in Chinese] ) |
| [] |
梁丽华. 2014. 尾叶桉第二代种子园家系遗传特性研究. 长沙:中南林业科技大学硕士学位论文. ( Liang L H. 2014. Genetic character of families in the 2nd Eucalyptus urophylla seedlings. Changsha:MS thesis of Central South University of Forestry and Technology. [in Chinese][in Chinese]) |
| [] |
倪健. 1996. 中国木荷及木荷林的地理分布与气候的关系. 植物资源与环境学报 , 5 (3) : 28–34.
( Ni J.1996. Relationship between geographical distribution of Schima superba, its forest and climate in China. Journal of Plant Resources and Environment , 5 (3) : 28–34. [in Chinese] ) |
| [] |
沈熙环. 1992. 种子园技术. 北京: 北京科学技术出版社 .
( Shen X H. 1992. Seed orchard techniques. Beijing: Beijing Science and Technology Press . [in Chinese] ) |
| [] |
谭小梅, 周志春, 金国庆, 等. 2012. 马尾松二代无性系种子园遗传多样性和交配系统分析. 林业科学 , 48 (2) : 69–74.
( Tan X M, Zhou Z C, Jin G Q, et al.2012. Genetic diversity and mating system analysis of Pinus massoniana in a second-generation clonal seed orchard. Scientia Silvae Sinicae , 48 (2) : 69–74. [in Chinese] ) |
| [] |
王崇云. 1998. 植物的交配系统与濒危植物的保护繁育策略. 生物多样性 , 6 (4) : 298–303.
( Wang C Y.1998. Plant mating system in relation to strategies for the conservation and breeding of endangered species. Chinese Biodiversity , 6 (4) : 298–303. [in Chinese] ) |
| [] |
王虎, 樊军锋, 杨培华, 等. 2012. 油松二代种子园遗传多样性RAPD分析. 北方园艺 (4) : 117–120.
( Wang H, Fan J F, Yang P H, et al.2012. Genetic diversity analysis on second-generation seed orchard of Pinus tabulaeformis Carr. Northern Horticulture (4) : 117–120. [in Chinese] ) |
| [] |
王峥峰, 王伯荪, 张军丽, 等. 2004. 广东鼎湖山3个树种在不同群落演替过程中的遗传多样性. 林业科学 , 40 (2) : 32–37.
( Wang Z F, Wang B S, Zhang J L, et al.2004. Genetic diversity in community succession for three species in Dinghu mountain of Guangdong province. Scientia Silvae Sinicae , 40 (2) : 32–37. [in Chinese] ) |
| [] |
辛娜娜, 张蕊, 徐肇友, 等. 2015. 木荷1代育种群体遗传多样性分析. 林业科学研究 , 28 (3) : 332–338.
( Xin N N, Zhang R, Xu Z Y, et al.2015. Genetic diversity among breeding parents of Schima superba revealed by SSR. Forest Research , 28 (3) : 332–338. [in Chinese] ) |
| [] |
于大德, 袁定昌, 张登荣, 等. 2014. 华北落叶松种子园不同世代间遗传多样性变化. 植物遗传资源学报 , 15 (5) : 940–947.
( Yu D D, Yuan D C, Zhang D R, et al.2014. Genetic diversity of Larix principis-rupprechtii Mayr. seed orchard among generations. Journal of Plant Genetic Resources , 15 (5) : 940–947. [in Chinese] ) |
| [] |
张大勇, 姜新华. 2001. 植物交配系统的进化、资源分配对策与遗传多样性. 植物生态学报 , 25 (2) : 130–143.
( Zhang D Y, Jiang X H.2001. Mating system evolution, resource allocation, and genetic diversity in plants. Acta Phytoecologica Sinica , 25 (2) : 130–143. [in Chinese] ) |
| [] |
张华新. 2000. 油松种子园生殖系统研究. 北京: 中国林业出版社 .
( Zhang H X. 2000. The research on the reproductive system of Pinus tabulaeformis Carr. Beijing: China Forestry Publishing House . [in Chinese] ) |
| [] |
张萍, 周志春, 金国庆, 等. 2006. 木荷种源遗传多样性和种源区初步划分. 林业科学 , 42 (2) : 38–42.
( Zhang P, Zhou Z C, Jin G Q, et al.2006. Genetic diversity analysis and provenance zone allocation of Schima superba in China using RAPD markers. Scientia Silvae Sinicae , 42 (2) : 38–42. [in Chinese] ) |
| [] | Bradbury D, Krauss S L.2013. Limited impact of fragmentation and disturbance on the mating system of tuart (Eucalyptus gomphocephala, Myrtaceae):implications for seed-source quality in ecological restoration. Australian Journal of Botany , 61 (2) : 148–160. DOI:10.1071/BT13032 |
| [] | Chaix G, Gerber S, Razafimaharo V, et al.2003. Gene flow estimation with microsatellites in a Malagasy seed orchard of Eucalyptus grandis. Theoretical and Applied Genetics , 107 (4) : 705–712. DOI:10.1007/s00122-003-1294-0 |
| [] | Charlesworth D, Charlesworth B.1987. Inbreeding depression and its evolutionary consequences. Annual Review of Ecology and Systematics , 18 (4) : 237–268. |
| [] | Dering M, Misiorny A, Chałupka W.2014. Inter-year variation in selfing, background pollination, and paternal contribution in a Norway spruce clonal seed orchard. Canadian Journal of Forest Research , 44 (7) : 760–767. DOI:10.1139/cjfr-2014-0061 |
| [] | Fuchs E J, Lobo J A, Quesada M.2003. Effects of forest fragmentation and flowering phenology on the reproductive success and mating patterns of the tropical dry forest tree Pachira quinata. Conservation Biology , 17 (1) : 149–157. DOI:10.1046/j.1523-1739.2003.01140.x |
| [] | Funda T, Liewlaksaneeyanawin C, Fundova I, et al.2011. Congruence between parental reproductive investment and success determined by DNA-based pedigree reconstruction in conifer seed orchards. Canadian Journal of Forest Research , 41 (2) : 380–389. DOI:10.1139/X10-190 |
| [] | Gaiotto F A, Bramucci M, Grattapaglia D.1997. Estimation of outcrossing rate in a breeding population of Eucalyptus urophylla with dominant RAPD and AFLP markers. Theoretical and Applied Genetics , 95 (5/6) : 842–849. |
| [] | Garibaldi L A, Steffan-Dewenter I, Winfree R, et al.2013. Wild pollinators enhance fruit set of crops regardless of honey bee abundance. Science , 339 (6127) : 1608–1611. DOI:10.1126/science.1230200 |
| [] | Garratt M, Breeze T D, Jenner N, et al.2014. Avoiding a bad apple:Insect pollination enhances fruit quality and economic value. Agriculture, Ecosystems & Environment , 184 (2) : 34–40. |
| [] | Holzschuh A, Dudenh ffer J, Tscharntke T.2012. Landscapes with wild bee habitats enhance pollination, fruit set and yield of sweet cherry. Biological Conservation , 153 : 101–107. DOI:10.1016/j.biocon.2012.04.032 |
| [] | Ivey C T, Carr D E.2005. Effects of herbivory and inbreeding on the pollinators and mating system of Mimulus guttatus (Phrymaceae). American Journal of Botany , 92 (10) : 1641–1649. DOI:10.3732/ajb.92.10.1641 |
| [] | Momn G F, Bsu J C, Gmrrm A R.1985. Reduction in levels of inbreeding in a seed orchard of Eucalyptus regnans F. Muell. compared with natural populations. Silvae Genetica , 38 (1) : 32–36. |
| [] | Niu H, Li X, Ye W, et al.2012. Isolation and characterization of 36 polymorphic microsatellite markers in Schima superba (Theaceae). American Journal of Botany , 99 (3) : e123–e126. DOI:10.3732/ajb.1100454 |
| [] | Peakall R, Smouse P E.2012. GenAlEx 6. 5:genetic analysis in Excel. Population genetic software for teaching and research-an update. Bioinformatics , 28 (19) : 2537–2539. |
| [] | Plomion C, LeProvost G, Pot D, et al.2001. Pollen contamination in a maritime pine polycross seed orchard and certification of improved seeds using chloroplast microsatellites. Canadian Journal of Forest Research , 31 (10) : 1816–1825. DOI:10.1139/x01-115 |
| [] | Ritland K.2002. Extensions of models for the estimation of mating systems using n independent loci. Heredity , 88 (4) : 221–228. DOI:10.1038/sj.hdy.6800029 |
| [] | Schemske D W, Husband B C, Ruckelshaus M H, et al.1994. Evaluating approaches to the conservation of rare and endangered plants. Ecology , 75 (3) : 584–606. DOI:10.2307/1941718 |
| [] | Stoeckel S, Grange J, Fernández-Manjarres J F, et al.2006. Heterozygote excess in a self-incompatible and partially clonal forest tree species-Prunus avium L. Molecular Ecology , 15 (8) : 2109–2118. DOI:10.1111/j.1365-294X.2006.02926.x |
| [] | Tani N, Tsumura Y, Fukasawa K, et al.2015. Mixed mating system are regulated by fecundity in Shorea curtisii (Dipterocarpaceae) as revealed by comparison under different pollen limited conditions. PloS One , 10 (5) : e0123445. DOI:10.1371/journal.pone.0123445 |
| [] | Tanksley S D, Orton T J. 1983. Isozymes in plant genetics and breeding:Part A. Amsterdam/New York:Elsevier. |
| [] | Wei Z, Qu Z, Hou C, et al.2015. Genetic diversity and paternal analysis of open-pollinated progenies of Larix olgensis seed orchard. Journal of Nature and Science , 1 (1) : e19. |
| [] | Wheeler N C, Jech K S.1992. The use of electrophoretic markers in seed orchard research. New Forests , 6 (1/4) : 311–328. |
| [] | Woods J H, Wang T, Aitken S N.2002. Effects of inbreeding on coastal Douglas-fir:nursery performance. Silvae Genetica , 51 (4) : 163–170. |
| [] | Wragg P D, Johnson S D.2011. Transition from wind pollination to insect pollination in sedges:experimental evidence and functional traits. New Phytologist , 191 (4) : 1128–1140. DOI:10.1111/nph.2011.191.issue-4 |
| [] | Yuskianti V, Isoda K.2013. Detection of pollen flow in the seedling seed orchard of Acacia mangium using DNA marker. Indonesian Journal of Forestry Research , 10 (1) : 31–41. DOI:10.20886/ijfr |
 2016, Vol. 52
2016, Vol. 52

