文章信息
- 马志波, 黄清麟, 庄崇洋, 黄金城, 王宏
- Ma Zhibo, Huang Qinglin, Zhuang Chongyang, Huang Jincheng, Wang Hong
- 吊罗山国家森林公园山地雨林2种巢状附生蕨特征
- Characteristics of Two Nest Epiphytic Ferns in Mountain Rainforests of Diaoluoshan National Forest Park
- 林业科学, 2016, 52(12): 22-28
- Scientia Silvae Sinicae, 2016, 52(12): 22-28.
- DOI: 10.11707/j.1001-7488.20161203
-
文章历史
- 收稿日期:2016-01-05
- 修回日期:2016-09-02
-
作者相关文章
2. 中国林业科学研究院森林生态环境与保护研究所 北京 100091;
3. 海南省林业厅 海口 570000
2. Research Institute of Forest Ecology Environment and Protection, CAF Beijing 100091 ;
3. Forest Department of Hainan Province Haikou 570000
附生蕨类植物是热带林冠层维管附生植物中的一个优势类群(Cardelús et al.,2006),常与兰科(Orchidaceae)、凤梨科(Bromeliaceae)等物种共生,它们一起形成的“空中花园”是热带雨林的最典型特征,也是重要旅游吸引物。附生蕨类植物能截留森林枯落物,且自身叶片脱落后腐烂分解缓慢,利于冠层土壤的形成(Cardelús et al.,2010)。附生蕨类植物不仅自身对群落多样性有贡献,它们还是昆虫、无脊椎动物的栖居地,鸟类的栖息、觅食场所,对动植物群落的多样性起支持作用(Fayle et al.,2008; Watkins et al.,2008; Ellwood et al.,2009)。近年来附生蕨类植物受到了越来越多的重视,对它们的研究涉及分布、多样性与保护、生物量、营养物质循环等方面(Hietz et al.,2001; Soria-Auza et al.,2008; Fayle et al.,2009; Minardi et al.,2014; Hsu et al.,2014; Wagner et al.,2015)。国内学者开展了热带雨林中的蕨类植物区系、多样性及其保护研究(董仕勇等,2003; 廖文波等,2003; 秦新生等,2007; 张永夏等,2007; 罗文等,2010),以及药用蕨类植物资源研究(杨逢春等,2010; 陈能等,2014),也有对生态位、与寄主及环境因子关系的探讨(徐诗涛,2013),但缺乏量化特征方面的研究。
巢蕨(Neottopteris nidus)和崖姜(Pseudodrynaria coronans)是海南热带雨林中常见的2种大型附生蕨类植物,两者形态极相近、均呈巢状,生境相似(中国植物志编委会,1999; 2000)。本研究探讨山地雨林中巢蕨和崖姜这2种大型巢状蕨的个体大小、高度分布、密度和寄主的分布格局等量化特征,以期为二者的特征评价和冠层生物多样性监测提供基础。
1 研究区概况研究区位于海南岛东南部陵水、保亭、琼中和万宁4县交界处的吊罗山国家森林公园 (109°41′38″—110°4′46″E,18°38′42″—18°50′22″N)。1998年成立省级森林公园,1999年升级为国家森林公园,总面积3.8万hm2。该区域是我国极为珍贵的热带原始林区之一,分布有热带低地雨林(海拔700 m以下)、热带山地雨林(海拔800~1 250 m)和山地常绿阔叶矮林(海拔1 000 m以上的孤立峰岭),间有热带季雨林、热带山地常绿阔叶林。属热带海洋性季风气候,年降雨量1 870~2 760 mm,年均气温24.4 ℃,最冷月平均气温15.4 ℃,月均相对湿度80%~85%。海拔700 m以下母岩为黑云母花岗岩,土壤类型以山地赤红壤为主; 海拔800 m以上母岩为花岗岩,土壤类型主要为山地黄壤。
2 研究方法 2.1 样地设置与调查2014年5月,在吊罗山国家森林公园沿步道(步道沿沟谷、溪流而建)设置退化原始林样地11块,海拔954~1 042 m,其中1~7号样地面积均为2 500 m2,8号样地1 800 m2,9号样地1 000 m2,10号样地1 600 m2,11号样地900 m2。设置原始林样地5块,其中12~15号样地面积均为2 500 m2,16号样地面积为700 m2; 14号样地海拔755 m,其余4块样地海拔955~1 055 m。 记录样地内DBH≥5 cm树种名称并测量胸径和树高。对树干或枝条有附生蕨类的,记录蕨类的名称、数量、高度、直径。
2.2 数据分析物种多样性指数即Shannon-Wiener指数(SW)(王伯荪等,1996)计算公式如下:
| $SW = - \sum\limits_{i = 1}^S {({p_i}{{\log }_2}{p_i})} {\text{。}}$ | (1) |
式中: S为物种丰富度; pi为第i个种所占的比例。
生态优势度指数即Simpson指数(D)(王伯荪等,1996)计算公式如下:
| $D = \sum\limits_{i = 1}^S {\frac{{{n_i}({n_i} - 1)}}{{N\left( {N - 1} \right)}}} {\text{。}}$ | (2) |
式中: ni为第i个种的个体数; N为总个体数。
均匀度指数(E)(王伯荪等,1996)计算公式如下:
| $E = SW/{\log _2}S{\text{。}}$ | (3) |
根据巢状蕨的高度和直径测量结果,用SPSS20.0软件(IBM Corp.)中的Shapiro-Wilk检验方法进行正态性检验,显著性(即Sig.)>0.05时符合正态分布,否则不符合正态分布,此时尝试拟合其他分布模型。在把样地分割成600或700 m2小样地(共52块)情况下分析子样地内巢状蕨和寄主的数量(即密度)。
用扩散系数(C)判定寄主在样地中的分布类型。该方法较为简便,不必建立具体的分布函数,公式(马钦彦,2009)如下:
| $C = {S^2}/\bar x{\text{。}}$ | (4) |
式中: x为10 m×10 m样方内个体数的平均值,S2为方差。当C<1时趋于均匀分布,C=1时趋于随机分布,C>1时趋于集群分布。用t检验确定样本观测值是否偏离泊松分布(随机分布)。对于n个样本,t值计算公式如下:
| $t = \left( {C - 1} \right)/\sqrt {2/\left( {n - 1} \right)} {\text{。}}$ | (5) |
查t分布检验表即可检验t值的显著水平,本研究取α=0.05,检验面积达到2 500 m2的样地。
用glmmADMB软件包(0.8.2版)和前述分割样地数据,建立带零膨胀的广义线性混合效应模型,令连接函数为logit,对应分布函数为二项式分布,其他参数的设置参考文献(Bolker,2008; Roulin et al.,2007; Zuur et al.,2009),以附生蕨类出现的概率或数量为因变量,以样地类型(原始林和退化原始林)、树种与寄主丰富度和寄主大小(胸径) 为自变量,进行相关性分析。
3 结果与分析 3.1 样地基本情况退化原始林样地中,5~9号样地平均胸径、平均树高和密度相对较大,蓄积量也较大(表 1); 1~4号样地密度较低,因此蓄积量较低(表 1)。原始林样地中,14号样地林分密度最大,但平均胸径、平均树高较小,因此单位面积蓄积量低于12,13和15号样地。15号样地的平均胸径、平均树高接近12和13号样地,但密度较低,因此其单位面积蓄积与14号样地同处较低水平(表 1)。所有样地中,10号样地的平均胸径最大、平均树高最高,但是其密度较低,因此单位面积蓄积量不是最大,单位面积蓄积量最大的是平均胸径、平均树高和林分密度都较大的16号样地(表 1)。
|
|
各样地的均匀度指数普遍较大(表 1)。11号样地丰富度最小,Shannon-Wiener多样性指数最低,这与取样面积较小有关。3号样地Simpson指数最低,为8.06,与其均匀度较低有关(E为0.77)。原始林样地中,16号样地取样面积较小,因此丰富度较低,但是均匀度较高,因此Shannon-Wiener多样性指数并不低,甚至高于样地面积为2 500 m2退化原始林的1~4号样地; 其他原始林样地(12~15)的丰富度明显高于退化原始林样地,其中12号样地最高(118种),Shannon-Wiener指数也最大(6.16)。
总体而言,退化原始林物种丰富度、生物多样性和生态优势度明显低于原始林,虽然平均胸径、平均树高较大,但林分密度大幅低于原始林,因此单位面积蓄积量低于原始林。但是,退化原始林内有更多的寄主和更多的巢蕨和崖姜(表 1)。
3.2 寄主的种属分布所有样地中的巢蕨和崖姜寄主植物共有79种,属于31个科的53个属,除葡萄科(Vitaceae)的扁担藤(Tetrastigma planicaule)外,其余均为乔木树种。其中,可同时出现巢蕨和崖姜的占全部寄主种数的46.8%(37个种),如鸡毛松(Podocarpus imbricatus)、红鳞蒲桃(Syzygium hancei)、海南榕(Ficus hainanensis)和白椎(Castanopsis carlesii var. hainanica)等; 只出现巢蕨的占31.6%(25个种),如天料木(Homalium cochinchinense)、杏叶柯(Lithocarpus amygdalifolius)、亮叶青冈(Cyclobalanopsis phanera)、乌心楠(Phoebe tavoyana)和扁担藤; 只出现崖姜的占21.5%(17个种),如海南栲(Castanopsis hainanensis)、乌檀(Nauclea officinalis)、密脉蒲桃(S. chunianum)和油丹(Alseodaphne hainanensis)等。
所有样地中,只在原始林中出现的寄主植物种有24种(占总种数的30%),只在退化原始林中出现的有48种(占61%),原始林和退化原始林的共有寄主有7种(占9%),分别是白椎、鸡毛松、白花含笑(Michelia mediocris)、肉实树(Sarcosperma laurinum)、山香圆(Turpinia montana)、红鳞蒲桃和两广梭罗(Reevesia thyrsoidea),前6种可以同时附生巢蕨和崖姜,两广梭罗只出现巢蕨。在2种林分中只出现巢蕨的寄主种数相同,均有12种; 只出现崖姜的寄主在原始林中有9种,略微高于退化原始林(8种); 在原始林中可同时出现巢蕨和崖姜的寄主只有3种,即海南蕈树(Altingia obovata)、琼楠柿(Diospyros howii)和华南毛柃(Eurya ciliata),在退化原始林可同时出现巢蕨和崖姜的寄主较多,有28种。
3.3 巢状蕨高度分布共调查到597个巢状蕨,高度为0.5~25.0 m,变动较大,平均8.4 m,标准差5.3 m。主要分布在相对较矮的位置,分布在10 m以下的占总数的69.5%, 分布在5.0~9.0 m的占39.7%。按2.0 m间距、上限排外法把所有2种附生蕨分成13个高度组(第1组为1.0 m以下不完整的高度组)。各组数量分布不均衡(图 1),表现出正偏(偏度为0.683)和低峰态(峰度为-0.314)的特征。不能通过正态检验(Sig.=0.000<0.05,df=597),应拒绝原假设,即附生蕨的高度分布不服从正态分布。拟合其他分布效果也不理想。
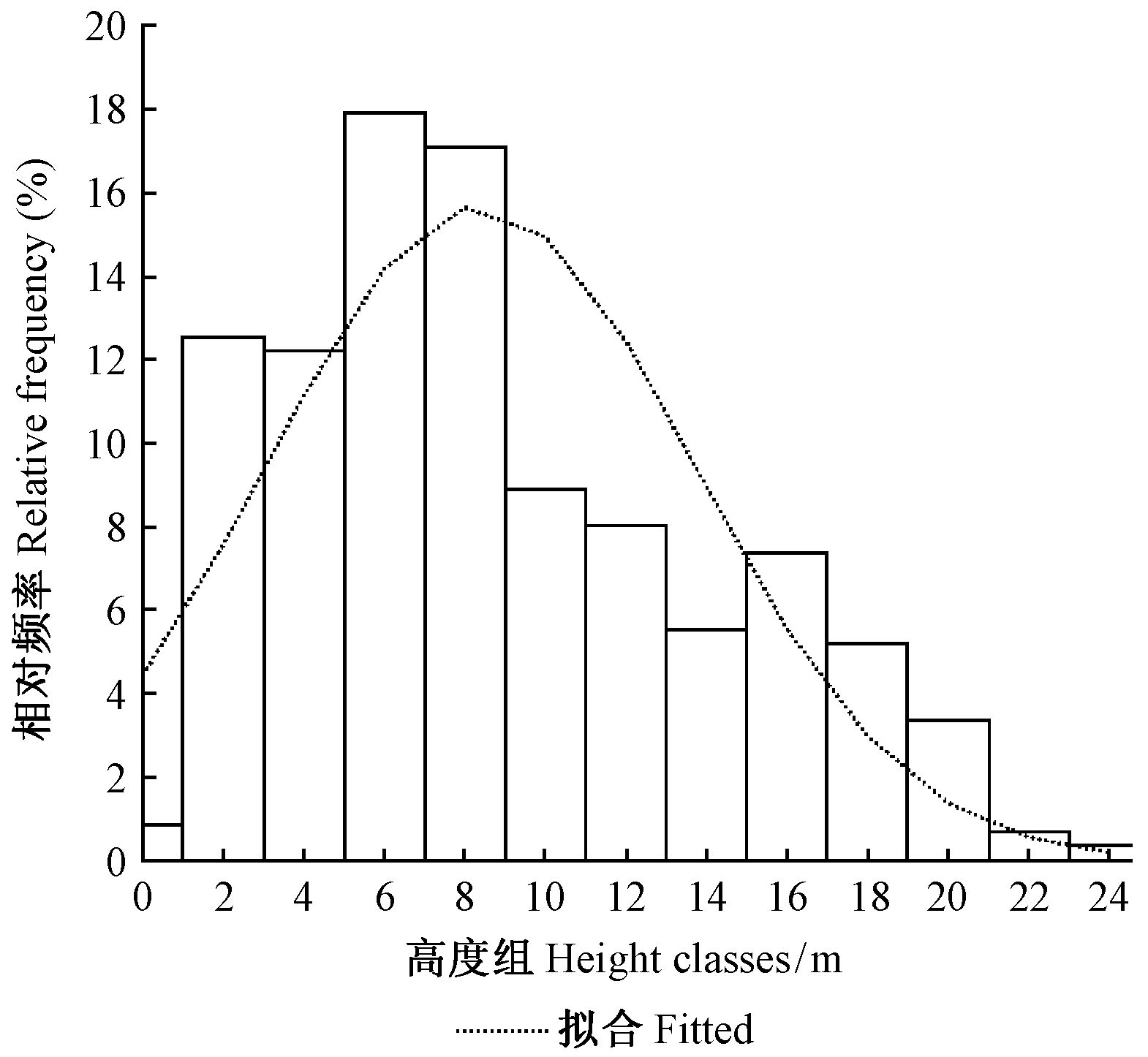
|
图 1 不同高度组的附生蕨数量分布 Fig.1 Number of ferns on hosts at different height |
巢状蕨的直径分布幅度较大,为0.2~5.0 m,平均1.0 m,标准差0.7 m,有正偏(偏度为1.734)和高峰态(峰度为3.802)特征。该特征与正态性检验结果一致(Sig.=0.000<0.05,df=597),即直径不符合正态分布。按0.5 m间距、上限排外法把所有附生蕨直径分成10组(第1组为0.5 m以下不完整的分组),各组数量分布情况如图 2所示。
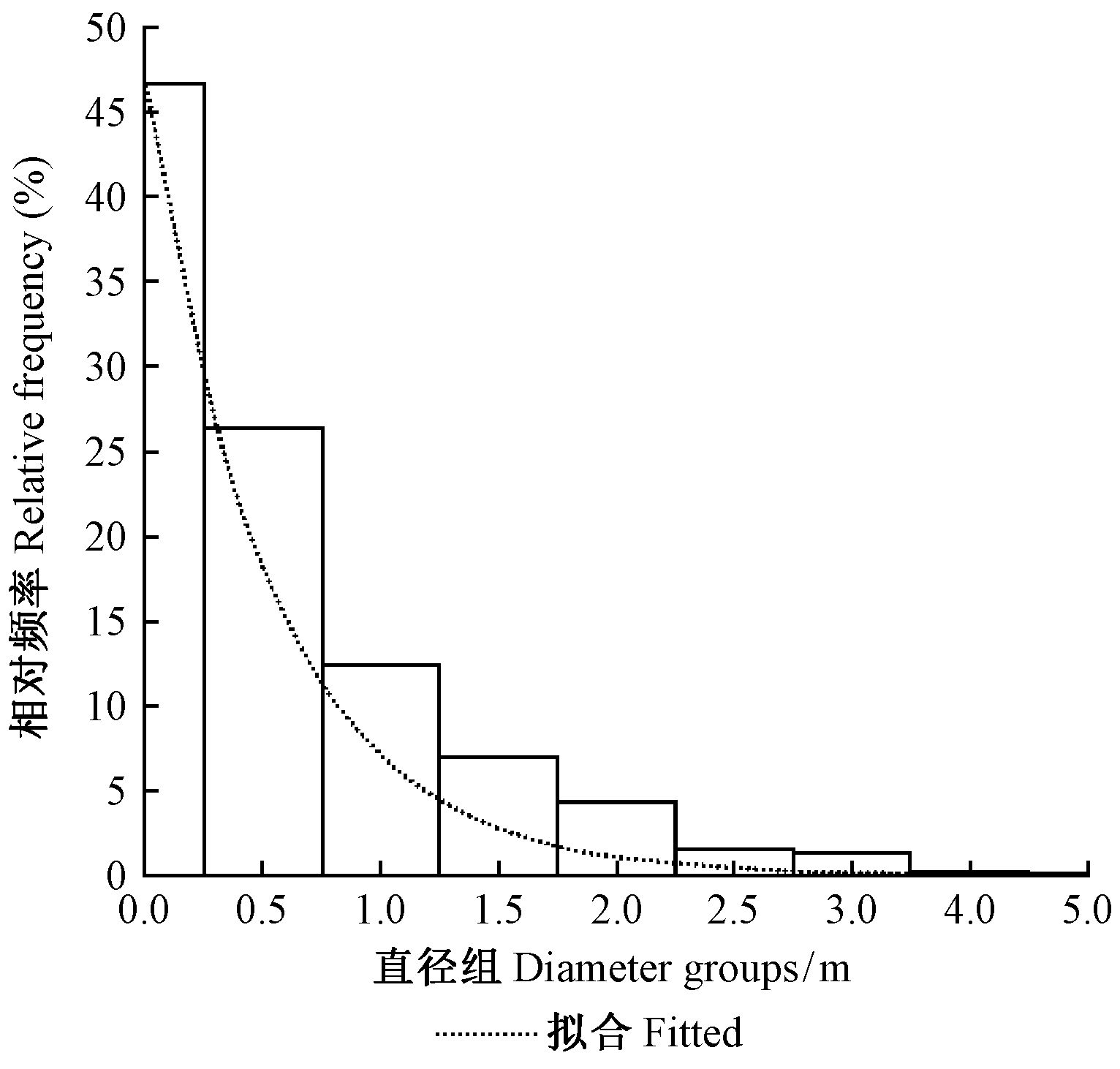
|
图 2 不同直径组的巢状蕨数量分布 Fig.2 Number of nest ferns in different diameter classes |
可用负指数方程描述图 2中附生蕨数量Nf随直径di增大而递减的趋势,拟合模型如下:
| ${N_f} = 510.125{e^{ - 1.255}}^{{d_i}}({R^2} = 0.944){\text{。}}$ | (6) |
所有52个小样地的巢状蕨密度为0.0~616.7 株·hm-2,变幅较大,平均为179.9 株·hm-2,标准差为155.2 株·hm-2。巢状蕨密度分布有正偏(偏度为0.893)和低峰态(峰度-0.072)特征,未通过正态性检验(Sig.=0.000<0.05,df=52)。按50.0 株·hm-2间隔、上限排外法把密度分成13个组(第1组为25 株·hm-2以下不完整的分组),呈现密度 de低的小样地数量Ns多、密度高的小样地数量少的趋势(图 3),可用负指数方程拟合该趋势,结果如下:
| ${N_s} = 13.462{e^{ - 0.005{d_e}}}({R^2} = 0.933){\text{。}}$ | (7) |
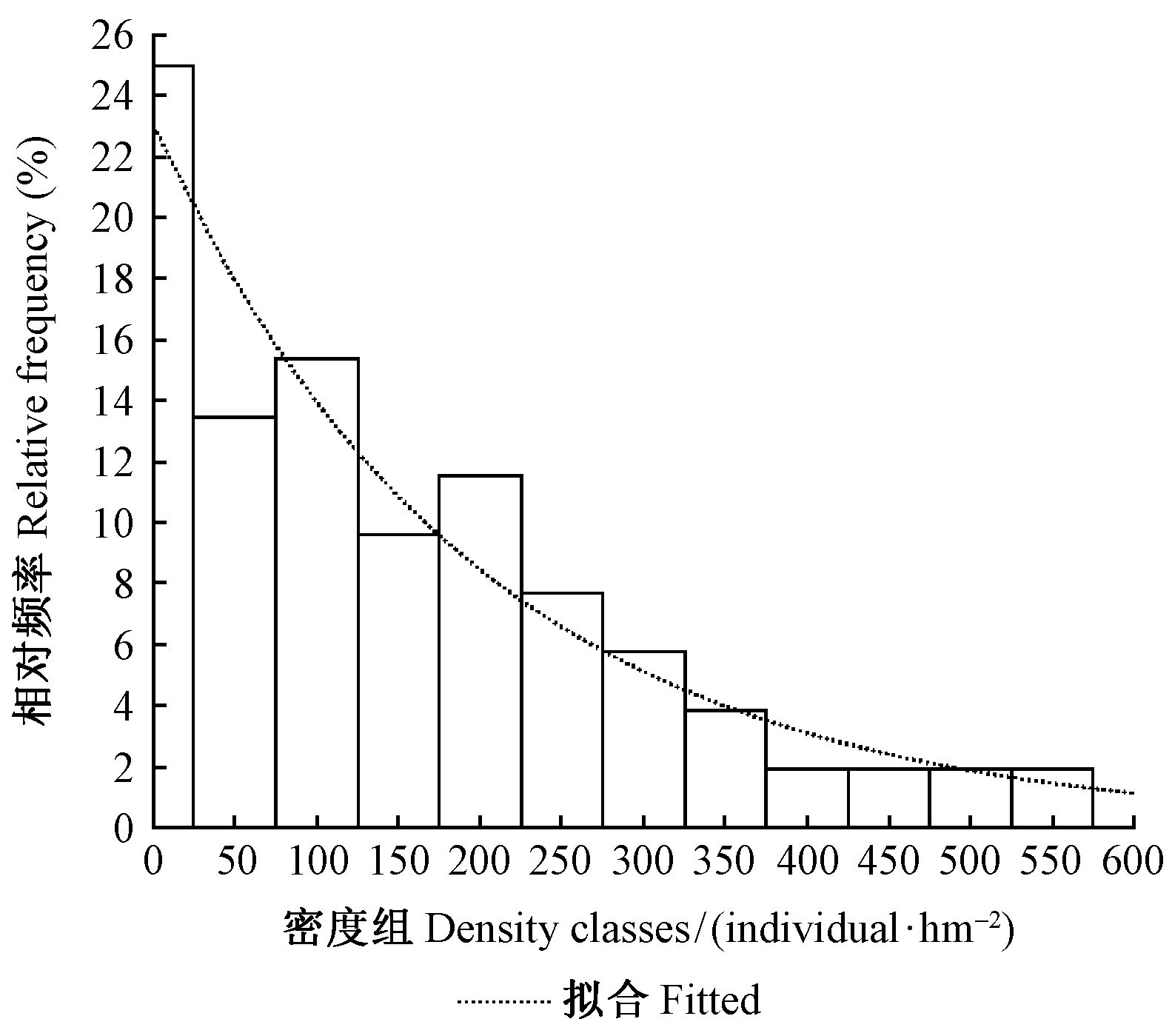
|
图 3 不同密度组的巢状蕨数量分布 Fig.3 Number of subplots in different ferns density class |
所有52个小样地2种蕨的寄主密度为0.0~333.3 株·hm-2,平均100.0 株·hm-2,标准差76.0 株·hm-2。具有一定的正偏(偏度0.786)和高峰态(峰度0.265)特征,正态性检验不通过(Sig.=0.004<0.05,df=52)。按30.0 株·hm-2间距、上限排外法将寄主密度分成11组(第1组为15 株·hm-2以下不完整的分组),各组数量分布情况较为接近指数分布的形态(图 4),此时可以用负指数方程拟合不同密度组的小样地数量(Ns)与寄主密度(dh)之间的关系:
| ${N_s} = 13.761{e^{ - 0.009}}^{{d_h}}({R^2} = 0.739){\text{。}}$ | (8) |
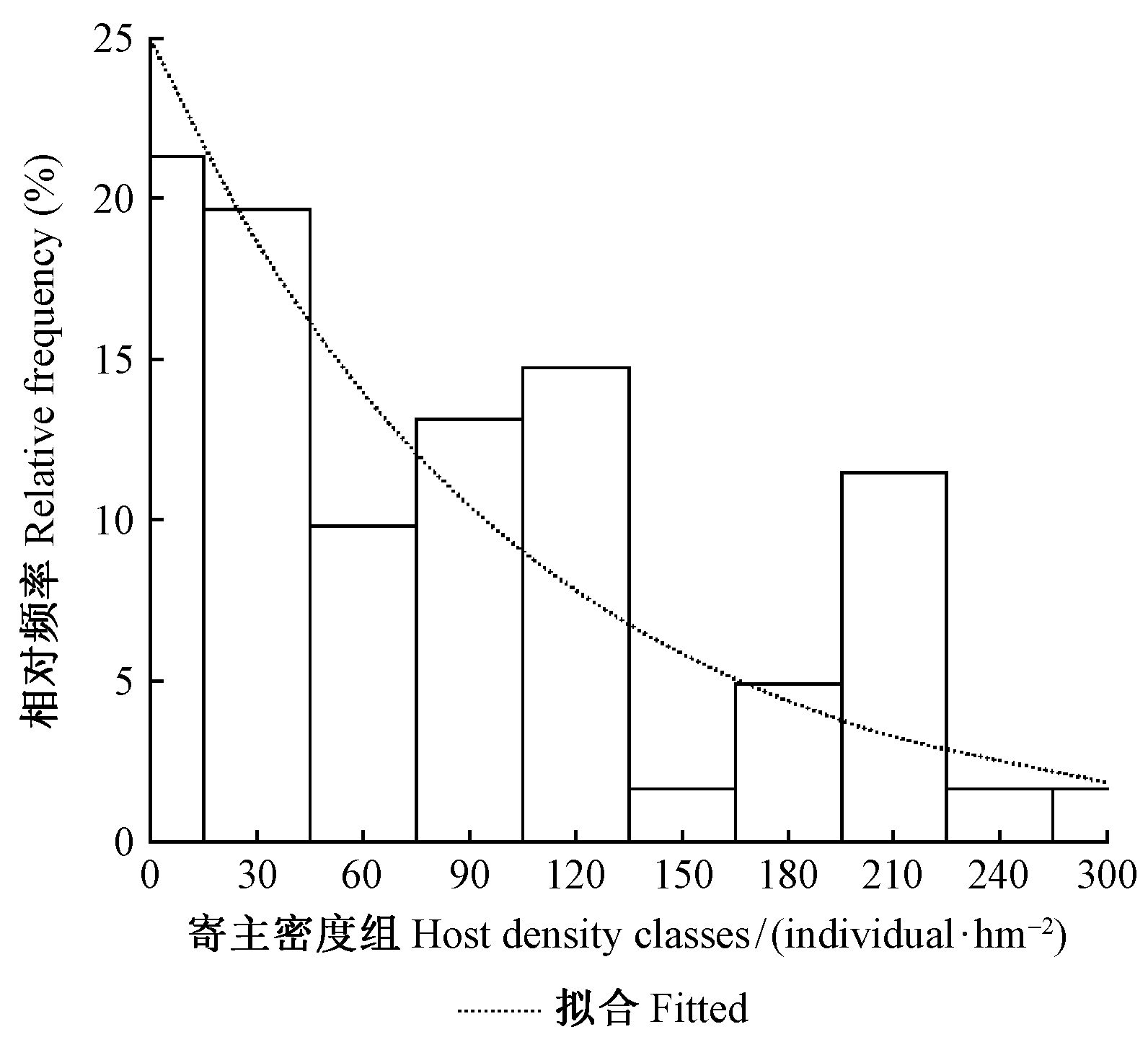
|
图 4 不同寄主密度组的子样地数量分布 Fig.4 The number of subplots in different host density classes |
巢状蕨与寄主的数量比直接反映巢状蕨在单个寄主上附生数量。该比值为1.0~10.0,平均值为1.8,标准差1.3。按1.0间距、上限排外法将比值分成10组(第1组为0.5以下不完整的分组),各组中巢状蕨的数量(N)分布明显呈负指数分布的形态(图 5),拟合各组中巢状蕨的数量和巢状蕨与寄主的数量比(r)的负指数方程结果如下:
| $N = 203.662{e^{ - 0.997}}^r({R^2} = 0.997){\text{。}}$ | (8) |
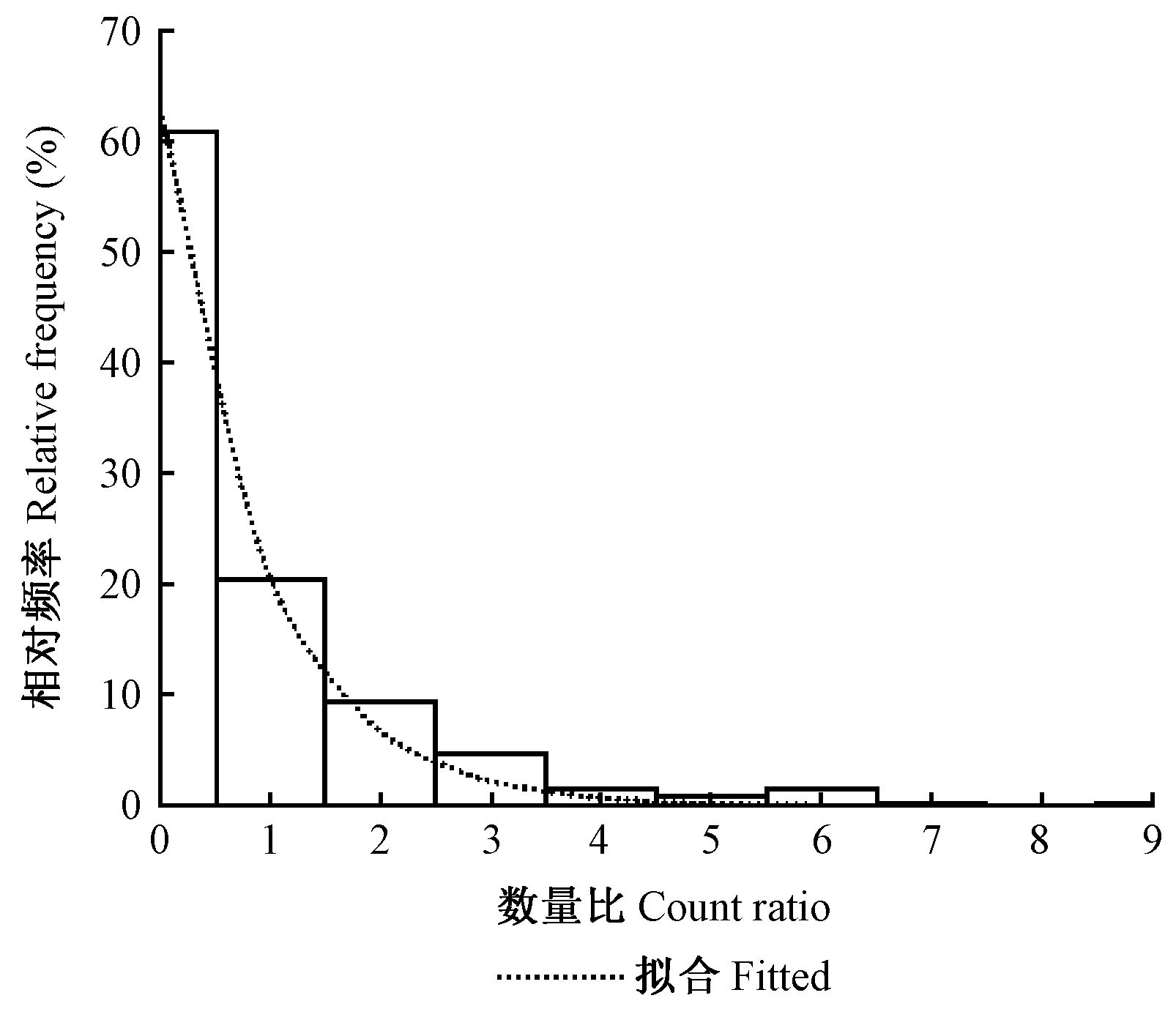
|
图 5 单株寄主植物上的巢状蕨数量分布 Fig.5 Numbers distribution in class of nest ferns number per host |
对所调查的2 500 m2样地,计算了扩散系数(C)和t-统计量(表 2)。根据扩散系数结果可以判定在原始林样地(12~15号样地)和退化原始林样地(1~7号样地)附生蕨的寄主均有集群分布的趋势。由于t-统计量均大于对应查表值t(α=0.05,df=24)=2.063 9,说明“扩散系数大于1”具有统计意义上的显著性(α=0.05),因此最终判定在2种样地中寄主树种均呈集群分布。
|
|
对小样地数据建立了带零膨胀的广义线性混合效应模型(表 3),结果表明: 巢蕨与崖姜在退化原始林的出现概率显著大于原始林样地; 寄主物种越丰富、直径越大,出现概率也越大; 树种丰富、但密度较低的林内出现的概率高; 除样地物种丰富度外,其余变量均对寄主上附生蕨的数量有显著影响; 单位面积退化原始林中的附生蕨多度显著大于原始林; 寄主直径越大、丰富度越高,附生蕨数量越多; 林分密度小的附生蕨数量多。由模型分析得到启示: 附生蕨类,至少本研究的2种附生蕨,对热带天然林的生物多样性有一定指示作用。不过本研究尺度较小,大尺度上生物、非生物因子与这2种附生蕨分布的关系还有待进一步研究。
|
|
所有样地的上林冠层高不低于15 m。2种附生蕨有70%分布在10 m以下,有40%分布在5~9 m高的空间范围内,说明2种蕨类都喜荫、耐潮湿(李德志等,2004),今后需进一步研究它们的分布与光源温度等环境因子间的关联性。
原始林树种更丰富,原始林中大树也多——大的树体可以拦截更多的繁殖体、支撑更多的大型附生植物,也有更长的时间积攒附生植物,因此,预计原始林中有更多的附生蕨。但是,本研究中原始林内巢状蕨的数量显著低于退化原始林,这可能与退化原始林更靠近溪流沟谷、更为潮湿有关。这与Cardelús等(2006)的研究结果相近,他们沿不同海拔梯度分析了环境因子(降水、温度、冠层光照)与附生蕨丰富度的关系,结果表明丰富度只与降水显著相关。个体水平的研究也支持该观点,铁角蕨属(Asplenium)的广布种Asplenium antiquum的生长率和存活率都随海拔的升高即干旱胁迫的增大而降低(Hsu et al.,2014)。
5 结论巢蕨与崖姜是吊罗山国家森林公园山地雨林中可以形成“空中花园”的2种大型附生蕨类植物。2者寄主合计31科、53属、79种,除了扁担藤1种藤本外,其余均为乔木树种。巢蕨和崖姜有不明显的寄主专一性,有37个种可以同时出现这2种附生蕨,25个种只出现巢蕨,17个种只出现崖姜。在垂直方向,巢蕨与崖姜在0.5~25.0 m的林层中均有分布,但多数低于10.0 m,且集中于5.0~9.0 m; 在水平方向,2者的寄主在原始林和退化原始林中都呈集群分布。
巢蕨和崖姜的直径分布、密度分布以及寄主的密度分布、单株寄主上的数量多寡均可用负指数函数表达。2者的出现概率和多度与林分物种丰富度、密度和寄主物种丰富度大小等特征有非线性相关关系,对山地雨林的物种多样性有一定指示作用。退化原始林内巢蕨与崖姜的出现概率和多度均大于原始林,这种格局主要取决于森林的组成与结构,还是受小气候、地形等因素限制,可能需要大尺度与小尺度的综合研究予以解答。
| [] |
陈能, 钟琼芯. 2014. 尖峰岭药用蕨类植物资源调查与开发利用. 热带生物学报 , 5 (4) : 381–387.
( Chen N, Zhong Q X.2014. Inventory and development of medicinal ferns at the Jianfengling Nature Reserve in Hainan, China. Journal of Tropical Biology , 5 (4) : 381–387. [in Chinese] ) |
| [] |
董仕勇, 陈珍传, 张宪春. 2003. 海南岛吊罗山蕨类植物的多样性及其保育. 生物多样性 , 11 (5) : 422–443.
( Dong S Y, Chen Z C, Zhang X C.2003. Biodiversity and conservation of pteridophytes from Diaoluo Mountain, Hainan Island. Biodiversity Science , 11 (5) : 422–443. [in Chinese] ) |
| [] |
李德志, 臧润国. 2004. 森林冠层结构与功能及其时空变化研究进展. 世界林业研究 , 17 (3) : 12–16.
( Li D Z, Zang R G.2004. The research advances on the structure and function of forest canopy, as well as their temporal and spatial changes. World Forestry Research , 17 (3) : 12–16. [in Chinese] ) |
| [] |
廖文波, 金建华, 王伯荪, 等. 2003. 海南和台湾蕨类植物多样性及其大陆性特征. 西北植物学报 , 23 (7) : 1237–1245.
( Liao W B, Jin J H, Wang B S, et al.2003. Biodiversities and their continental features of the fern floras in Hainan and Taiwan island, China. Acta Botanica Boreali-occidentalia Sinica , 23 (7) : 1237–1245. [in Chinese] ) |
| [] |
罗文, 宋希强, 许涵, 等. 2010. 海南尖峰岭自然保护区蕨类植物区系分析. 武汉植物学研究 , 28 (3) : 294–302.
( Luo W, Song X Q, Xu H, et al.2010. Floristic analysis of pteridophytes in Jianfengling Nature Reserve, Hainan Island. Journal of Wuhan Botanical Research , 28 (3) : 294–302. [in Chinese] ) |
| [] |
马钦彦. 2009. 负二项分布及种群格局检验分析. 北京林业大学学报 , 31 (3) : 1–5.
( Ma Q Y.2009. Analysis of the negative binomial distribution and test of population pattern. Journal of Beijing Forestry University , 31 (3) : 1–5. [in Chinese] ) |
| [] |
秦新生, 严岳鸿, 张荣京, 等. 2007. 海南岛石灰岩地区蕨类植物资源. 华南农业大学学报 , 28 (4) : 122–124.
( Qin X S, Yan Y H, Zhang R J, et al.2007. Resources of pteridophytes in limestone regions in Hainan Island. Journal of South China Agricultural University , 28 (4) : 122–124. [in Chinese] ) |
| [] |
王伯荪, 余世孝, 彭少麟. 1996. 植物群落学实验手册. 广州: 广东高等教育出版 .
( Wang B S, Yu S X, Peng S L. 1996. Experiment handbook of plant community. Guangzhou: Guangdong Higher Education Press . [in Chinese] ) |
| [] |
徐诗涛. 2013. 海南热带山地沟谷雨林鸟巢蕨附生特性研究. 海口:海南大学博士学位论文. ( Xu S T. 2013. Epiphytic characteristics of Asplenium nidus L. (Aspleniaceae) complex in tropical montane rain forest, Hainan Island. Haikou:PhD thesis of Hainan University. [in Chinese][in Chinese]) |
| [] |
杨逢春, 黄华平, 牛黎明, 等. 2010. 海南岛药用蕨类植物多样性及生境分布类型. 海南师范大学学报:自然科学版 , 23 (3) : 314–319.
( Yang F C, Huang H P, Niu L M, et al.2010. Diversity and habitat of pteridophyte herbs in Hainan Island. Journal of Hainan Normal University:Natural Science , 23 (3) : 314–319. [in Chinese] ) |
| [] |
张永夏, 陈红锋, 胡学强, 等. 2007. 海南铜铁岭低地雨林蕨类植物区系及其特点. 西北植物学报 , 27 (4) : 805–812.
( Zhang Y X, Chen H F, Hu X Q, et al.2007. Fern flora and its characteristics of the lowland rainforest in Tongtieling, Hainan Island. Acta Botanica Boreali-occidentalia Sinica , 27 (4) : 805–812. [in Chinese] ) |
| [] |
中国植物志编委会. 1999. 中国植物志:第4(2)卷. 北京: 科学出版社 .
( Flora of China Editorial Committee. 1999. Flora of China:volume 4(2). Beijing: Science Press . [in Chinese] ) |
| [] |
中国植物志编委会. 2000. 中国植物志:第6(2)卷. 北京: 科学出版社 .
( Flora of China Editorial Committee. 2000. Flora of China:volume 6(2). Beijing: Science Press . [in Chinese] ) |
| [] | Bolker B M. 2008. Ecological models and data in R. Princeton:Princeton University Press. |
| [] | Cardelús C L, Colwell R K, Watkins J E.2006. Vascular epiphyte distribution patterns:explaining the mid-elevation richness peak. Journal of Ecology , 94 (1) : 144–156. DOI:10.1111/jec.2006.94.issue-1 |
| [] | Cardelús C L, Mack M C.2010. The nutrient status of epiphytes and their host trees along an elevational gradient in Costa Rica. Plant Ecology , 207 (1) : 25–37. DOI:10.1007/s11258-009-9651-y |
| [] | Ellwood F, Manica A, Foster W A.2009. Stochastic and deterministic processes jointly structure tropical arthropod communities. Ecology Letters , 12 (4) : 277–284. DOI:10.1111/ele.2009.12.issue-4 |
| [] | Fayle T M, Ellwood M D F, Turner E C, et al.2008. Bird's nest ferns:islands of biodiversity in the rainforest canopy. Antenna , 32 (1) : 34–37. |
| [] | Fayle T M, Chung A Y C, Dumbrell A J, et al.2009. The effect of rain forest canopy architecture on the distribution of epiphytic ferns (Asplenium spp. ) in Sabah, Malaysia. Biotropica , 41 (6) : 676–681. |
| [] | Hietz P, Briones O.2001. Photosynthesis, chlorophyll fluorescence and within-canopy distribution of epiphytic ferns in a mexican cloud Forest. Plant Biology , 3 (3) : 279–287. DOI:10.1055/s-2001-15198 |
| [] | Hsu R C C, Oostermeijer J G B, Wolf J H D.2014. Adaptation of a widespread epiphytic fern to simulated climate change conditions. Plant Ecology , 215 (8) : 889–897. DOI:10.1007/s11258-014-0340-0 |
| [] | Minardi B D, Voytena A P L, Santos M, et al.2014. Water stress and abscisic acid treatments induce the CAM pathway in the epiphytic fern Vittaria lineata (L. ) Smith. Photosynthetica , 52 (3) : 404–412. DOI:10.1007/s11099-014-0047-4 |
| [] | Roulin A, Bersier L F.2007. Nestling barn owls beg more intensely in the presence of their mother than in the presence of their father. Animal Behaviour , 74 (4) : 1099–1106. DOI:10.1016/j.anbehav.2007.01.027 |
| [] | Soria-Auza R W, Kessler M.2008. The influence of sampling intensity on the perception of the spatial distribution of tropical diversity and endemism:a case study of ferns from Bolivia. Diversity and Distributions , 14 (1) : 123–130. DOI:10.1111/j.1472-4642.2007.00433.x |
| [] | Watkins J E, Cardelús C L, Mack M C.2008. Ants mediate nitrogen relations of an epiphytic fern. New Phytologist , 180 (1) : 5–8. DOI:10.1111/nph.2008.180.issue-1 |
| [] | Zuur A F, Ieno E N, Walker N, et al. 2009. Mixed effects models and extensions in ecology with R. New York:Springer Science & Business Media. |
 2016, Vol. 52
2016, Vol. 52

