文章信息
- 石亚攀, 池玉杰, 于存
- Shi Yapan, Chi Yujie, Yu Cun
- 偏肿革裥菌产漆酶活性的诱导
- Induction on Laccase Activity Produced by Lenzites gibbosa
- 林业科学, 2016, 52(12): 150-155
- Scientia Silvae Sinicae, 2016, 52(12): 150-155.
- DOI: 10.11707/j.1001-7488.20161218
-
文章历史
- 收稿日期:2015-08-21
- 修回日期:2015-10-27
-
作者相关文章
漆酶(laccasc)是一种含铜的多酚氧化酶,广泛存在于植物、昆虫、细菌和高等真菌中,其中丝状真菌是最主要的漆酶生产者。漆酶的作用底物广泛,能催化降解多种酚类、芳香胺及其衍生物等木质素类化合物,可应用于纸浆中木质素的脱除、漂白废水等有毒酚类物质的去除等,且无二次污染,是理想的生物处理方法,具有广泛的应用前景。目前,国内外对漆酶已有多方面研究,既包括漆酶基因异源表达(郑邦晓等,2015; You et al.,2014)和表达调控机制(卓睿等,2015)等基因分子研究,也包括菌种筛选、培养条件优化、诱导剂对漆酶的诱导、酶的固定化和对污染物的处理等基础和应用研究(Devi et al.,2012)。
白腐菌漆酶属于诱导酶类,其合成水平不仅与菌株本身的产酶能力密切相关,同时还受不同培养条件特别是诱导剂的影响(刘剑等,2014; Jaszek et al.,2006; Mahmoud et al.,2013)。研究表明,添加合适的诱导剂(与木质素相关的芳烃类或酚类化合物)可显著提高白腐菌的漆酶活性(李鑫等,2013; 侯红漫等,2003; 吴香波等,2009)。偏肿革裥菌(Lenzites gibbosa)能够产生漆酶和锰过氧化物酶(MnP),是一种对木材和木质素降解能力较强的白腐菌,本试验在前人研究的基础上挑选了12种诱导剂,在液体培养条件优化的基础上检测这些诱导剂对偏肿革裥菌产漆酶活性的诱导,从而在漆酶活性优化培养的基础上进一步提高偏肿革裥菌的漆酶活性。
1 材料与方法 1.1 菌种、培养基与培养方式偏肿革裥菌由东北林业大学林学院森林保护学科森林病虫病理实验室提供,试验前挑取冷藏于4 ℃冰箱试管内的菌种,接种于PDA平板培养基上,于28 ℃下活化培养7天。
PDA培养基(L-1): 马铃薯200 g煮汁,葡萄糖 20 g,琼脂20 g。
液体种子培养基(L-1)(李鑫等,2013): 马铃薯200 g,葡萄糖20 g,蛋白胨1 g,MgSO4 0.05 g,KH2PO4 0.2 g,pH自然。在制作培养基时,向培养瓶中加适量碎玻璃渣,摇动培养,形成浑浊均一的菌丝液体。培养10天后用移液枪吸取定量的菌丝液作为接种体。
根据陈军(2008)、张玉龙等(2011)对偏肿革裥菌漆酶、MnP活性优化的研究结果,选择如下培养基作为初始产酶培养基(L-1): 玉米粉10 g,氯化铵0.44 g,CaCl2·2H2O 0.01 g,MgSO4·7H2O 0.05 g,KH2PO4 0.2 g,吐温80 250 μL,矿物元素溶液10 mL,维生素溶液1 mL,pH=7。菌丝培养4天后加入灭菌的CuSO4溶液,终浓度为0.2 mmol·L-1。
培养方式: 在100 mL三角瓶中,产酶培养基装液量30 mL,接种在上述液体种子培养基内生长10天的菌丝液3 mL,在28 ℃下静止培养。
1.2 漆酶活性测定方法漆酶活性采用紫外分光光度计在420 nm处检测ABTS [2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐]的氧化速度进行测定。反应体系1 mL,其中50 mmol·L-1丙二酸钠缓冲液850 μL、20 mmol·L-1 ABTS溶液50 μL、适当稀释后的酶液100 μL,测定反应3 min内420 nm处吸光值的增加量,定义每分钟使1 μmol ABTS转化所需要的酶量为1个漆酶活性单位(U)(林俊芳等,2009)。
漆酶活性计算公式:
| $\begin{array}{l} M\left( {{\rm{U \times }}{{\rm{L}}^{ - 1}}} \right) = \frac{{\Delta {\rm{OD}}}}{{\Delta t}} \times n \times \frac{{{V_T}}}{{{V_E}}} \times \frac{{{{10}^6}}}{\varepsilon }\\ = 92.593 \times \Delta {\rm{OD}} \times n \end{array}$ |
式中: ΔOD为420 nm处吸光值增加量; Δt为反应时间,3 min; VT为反应体系总体积,1 mL; VE为加入酶液体积,0.1 mL; n为酶液稀释倍数; ε为摩尔吸光系数,ε420=36 000 L·mol-1。
1.3 诱导剂对漆酶的诱导1) 诱导剂的筛选试验 参考相关文献(李鑫等,2013; 侯红漫等,2003; 王岁楼等,2005; 王佳玲等,1997; Feng et al.,2013),在前人研究的基础上选择12种底物作为漆酶诱导剂,其中生物诱导剂2种: 麦麸、木屑; 化学诱导剂10种: 愈创木酚、苯酚、香兰素、藜芦醇、苯甲酸、没食子酸、酪氨酸、二甲苯、苯胺蓝和ABTS。木屑和麦麸添加量均为1.5%,在配制初始产酶培养基时加入; 其他化学诱导剂配置成高浓度母液,经过滤除菌后,偏肿革裥菌在初始产酶培养基中培养第4天时与CuSO4溶液同时加入(下同)。添加终浓度均为0.2 mmol·L-1,以不加诱导剂的初始产酶培养基培养的菌液为对照,每组重复3次(下同),隔天测定漆酶活性,获得各单项诱导剂的漆酶活性曲线,进而初步筛选出诱导效果较好的生物和化学诱导剂。
2)诱导剂浓度单因素试验 根据上述各单项诱导剂的诱导结果,筛选漆酶活性较高的诱导剂,进行最佳诱导剂不同浓度的单因素试验,确定该诱导剂的最适添加量。
3) 诱导剂组合、Cu2+浓度对漆酶活性的影响 在不加Cu2+和添加0.2 mmol·L-1 Cu2+2种情况下,测定2种最佳诱导剂在最适浓度下单独添加和同时添加时的漆酶活性,确定诱导剂组合的诱导效果是否优于单项诱导剂。
在添加最佳诱导剂组合的基础上改变Cu2+浓度,检测漆酶活性,确定Cu2+最适添加量。
4) 接种量、培养方式对漆酶活性的影响 在上述试验获得最佳诱导剂组合和最适Cu2+添加量的基础上,改变接种量,检测漆酶活性,从而确定最适接种量。
在最佳诱导剂组合、最适Cu2+添加量和最适接种量的基础上,分别在静止和摇瓶(150 r·min-1)2种培养方式下进行培养,温度均为28 ℃,检测漆酶活性,确定最佳培养方式。
2 结果与分析 2.1 诱导剂的筛选试验12种诱导剂对漆酶活性的诱导有高有低,通过隔天测定各单项诱导剂的酶活性,确定第13 天为诱导剂培养的产酶高峰,12种诱导剂在13天时对漆酶活性的诱导结果见图 1。由图 1可以看出,麦麸和木屑2种生物诱导剂对漆酶都有显著的诱导作用,在13天时酶活性分别为1873.16和1 448.16 U·L-1,分别是在初始产酶培养基中对照培养酶活性(144.45 U·L-1)的13和10倍,麦麸效果略好于木屑。化学诱导剂中愈创木酚诱导效果最好,酶活性为1 210.19 U·L-1,是对照酶活性的8.4倍; 其次为苯酚、香兰素,分别是对照酶活性的3.5和2.3倍。其他诱导剂诱导效果一般,添加苯胺蓝和ABTS漆酶活性反而降低。根据以上结果,选择麦麸、木屑、愈创木酚为较好的诱导剂。
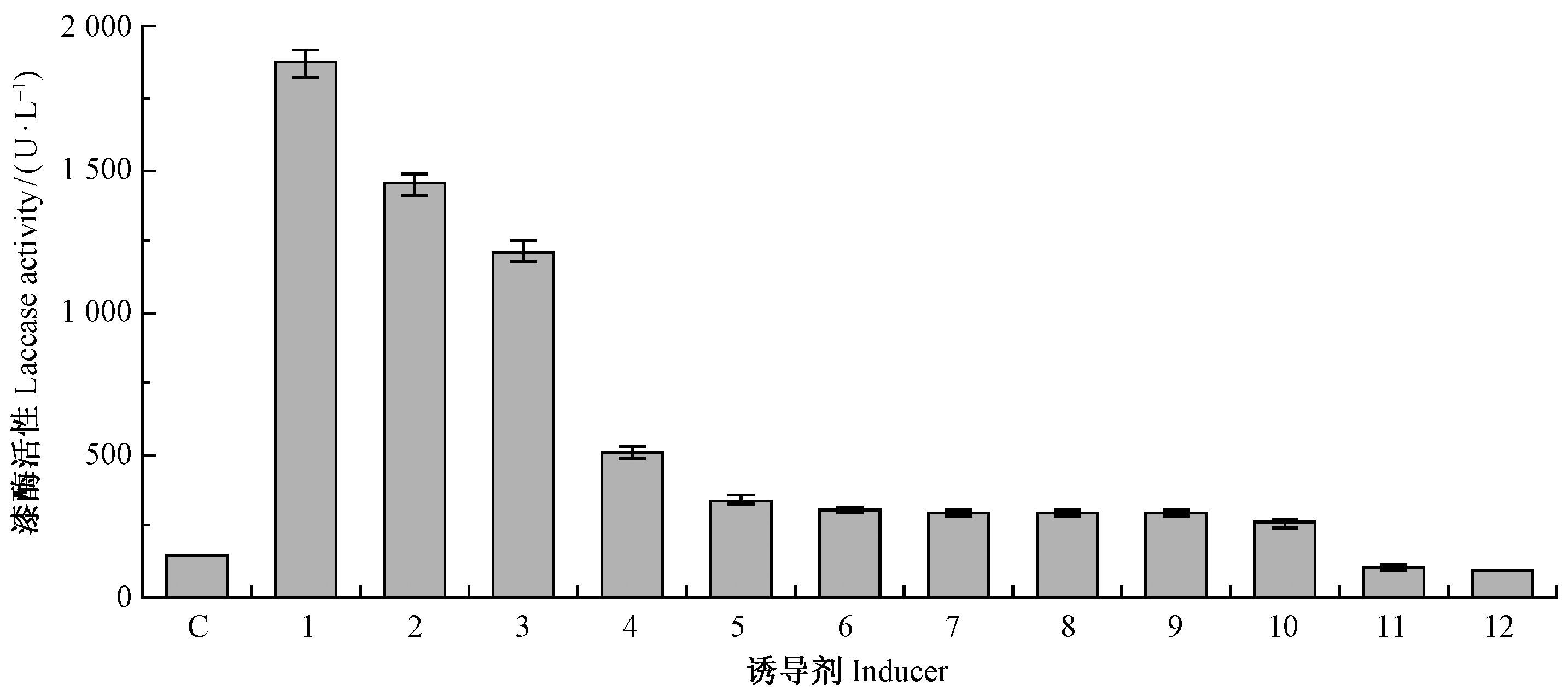
|
图 1 不同诱导剂对漆酶活性的影响 Fig.1 Effect of different inducers on laccase activity C.对照Control;1.麦麸Wheat bran; 2.木屑Bits of wood; 3.愈创木酚Guaiacol; 4.苯酚Phenol; 5.香兰素Vanillin; 6.藜芦醇Veratryl alcohol; 7.苯甲酸Benzoic acid; 8.没食子酸Gallic acid; 9.酪氨酸Tyrosine; 10.二甲苯o-Xylene; 11.苯胺蓝Aniline blue; 12.ABTS. |
通过单项诱导剂的筛选,选择生物诱导剂的麦麸和化学诱导剂的愈创木酚进行最佳诱导剂不同浓度的单因素试验,确定该诱导剂的最适添加量。图 2、图 3分别显示了不同浓度的麦麸和愈创木酚在13天时对漆酶的诱导结果。由图 2可以看出,不加麦麸,漆酶的活性很低; 加入1.0%的麦麸,漆酶的活性显著提高,表明麦麸对漆酶的显著诱导能力,当麦麸含量为1.5%时,漆酶活性最高;但麦麸含量升高到2.0%时,漆酶的活性又下降,可能是麦麸含量过高影响了培养基中的含氧量,菌体生长欠佳,也不利于漆酶合成。
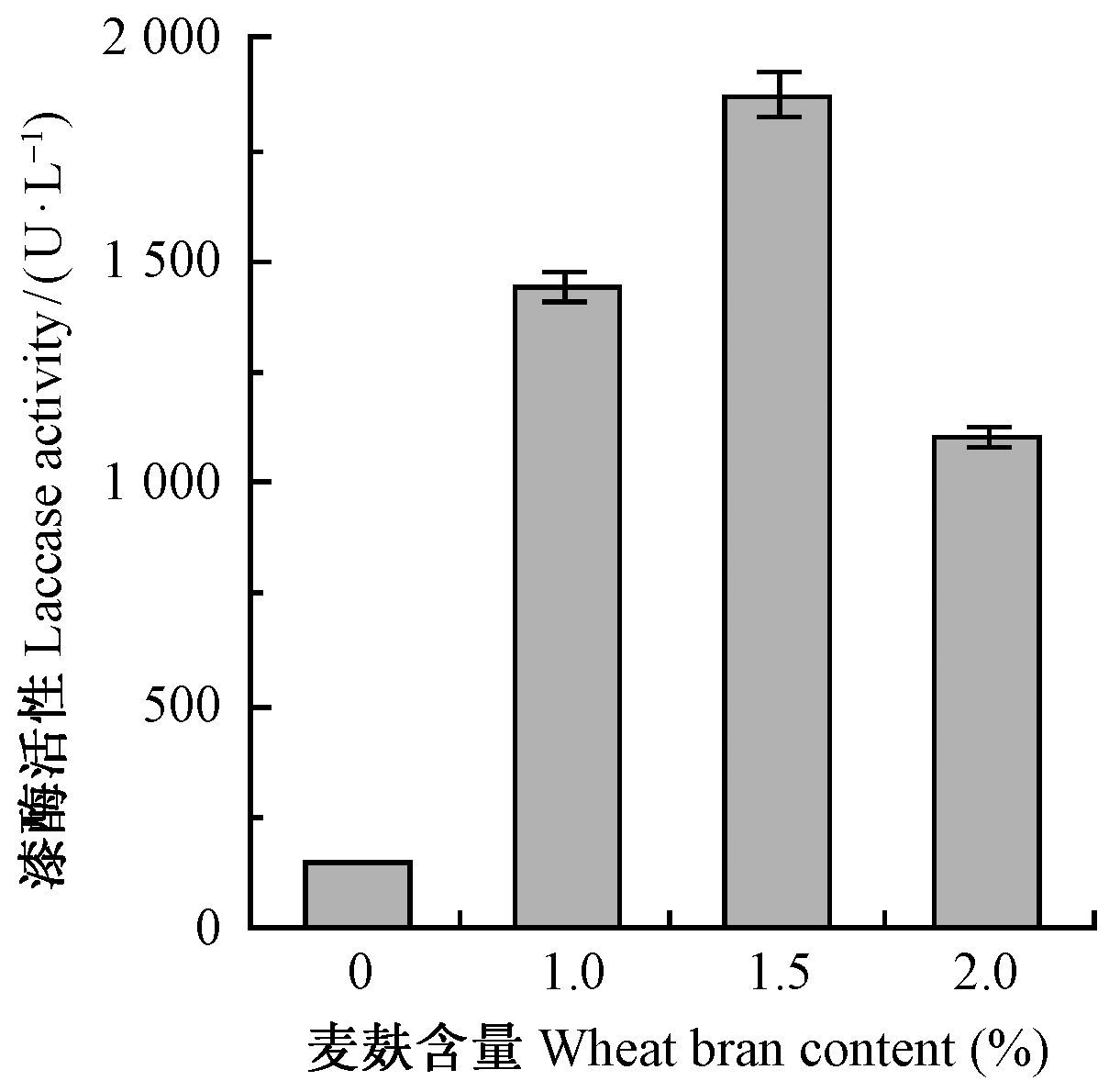
|
图 2 麦麸含量对漆酶活性的影响 Fig.2 Effect of wheat bran content on laccase activity |
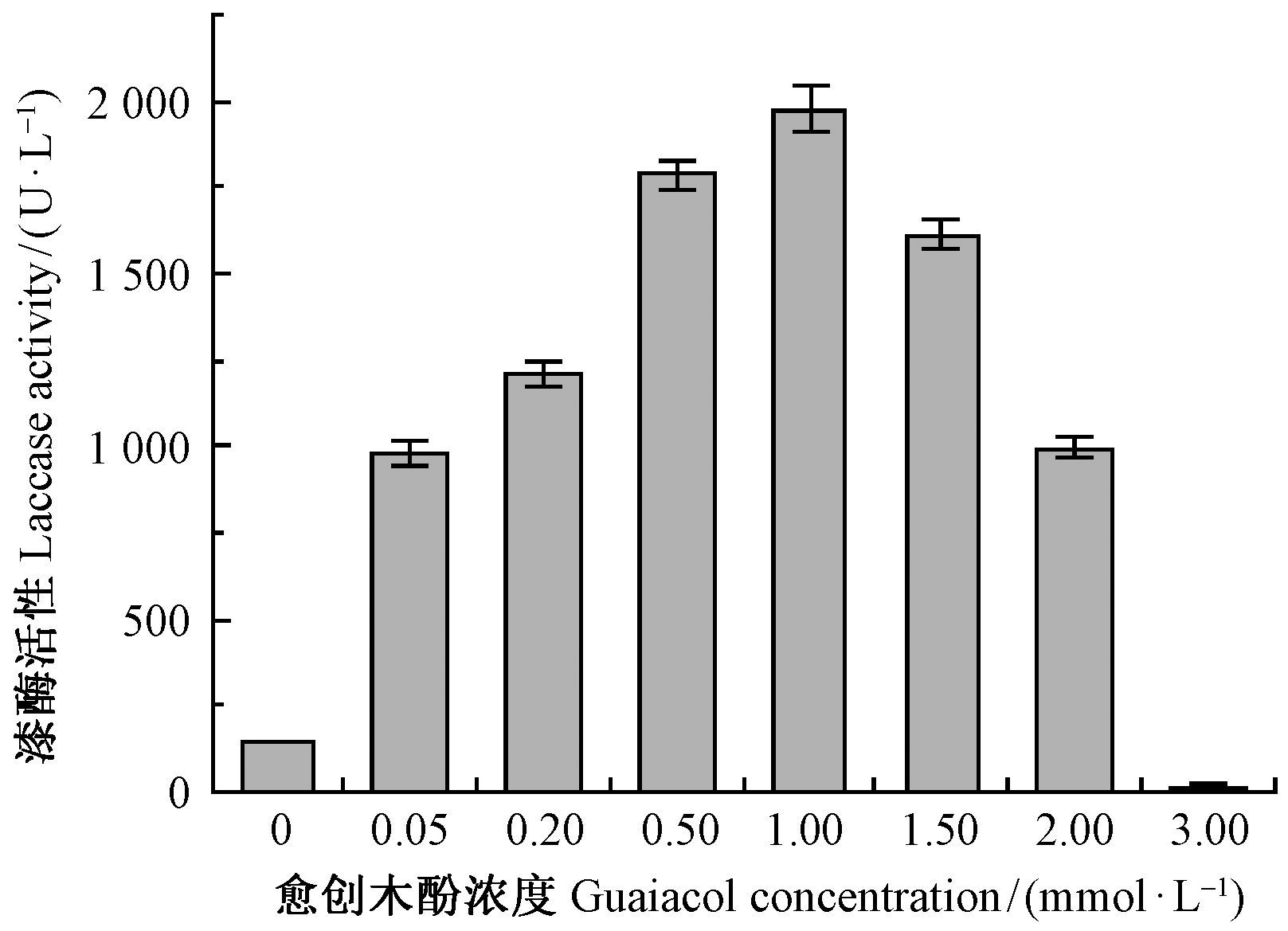
|
图 3 愈创木酚浓度对漆酶活性的影响 Fig.3 Effect of guaiacol concentration on laccase activity |
由图 3可以看出,不加愈创木酚,漆酶的活性很低; 加入少量的愈创木酚(0.05 mmol·L-1),漆酶的活性显著提高,也表明了愈创木酚对漆酶的显著诱导能力,当愈创木酚浓度为1.00 mmol·L-1时,诱导的漆酶活性达到最高,为1 975.72 U·L-1,是对照酶活性的13.7倍,高于1.5%的麦麸对漆酶的诱导效果,但愈创木酚浓度增加到1.50 mmol·L-1时,漆酶活性就开始下降,说明过高浓度的愈创木酚不利于菌体产生漆酶,对菌丝体也有毒害作用。
2.3 诱导剂组合、Cu2+浓度对漆酶活性的影响在不加Cu2+和添加0.2 mmol·L-1 Cu2+2种情况下,分别检测麦麸和愈创木酚2种最佳诱导剂在最适浓度下单独添加和同时添加时的漆酶活性,13天时的结果如图 4所示。一是无论是否添加Cu2+,同时添加麦麸和愈创木酚2种诱导剂,比单独添加其中1种诱导剂的漆酶活性高,即麦麸和愈创木酚2种诱导剂组合的诱导效果优于任何1种单项诱导剂; 二是在含有0.2 mmol·L-1 Cu2+情况下,无论是单项诱导剂还是2种诱导剂组合,都比不含有Cu2+的诱导效果更好。最高的漆酶活性出现在含有0.2 mmol·L-1 Cu2+同时添加1.5%麦麸和1.00 mmol·L-1愈创木酚情况下,此时漆酶活性为3 575.94 U·L-1,是对照酶活性的24.8倍,因此确定同时添加1.5%麦麸和1.00 mmol·L-1愈创木酚为最佳诱导剂组合。
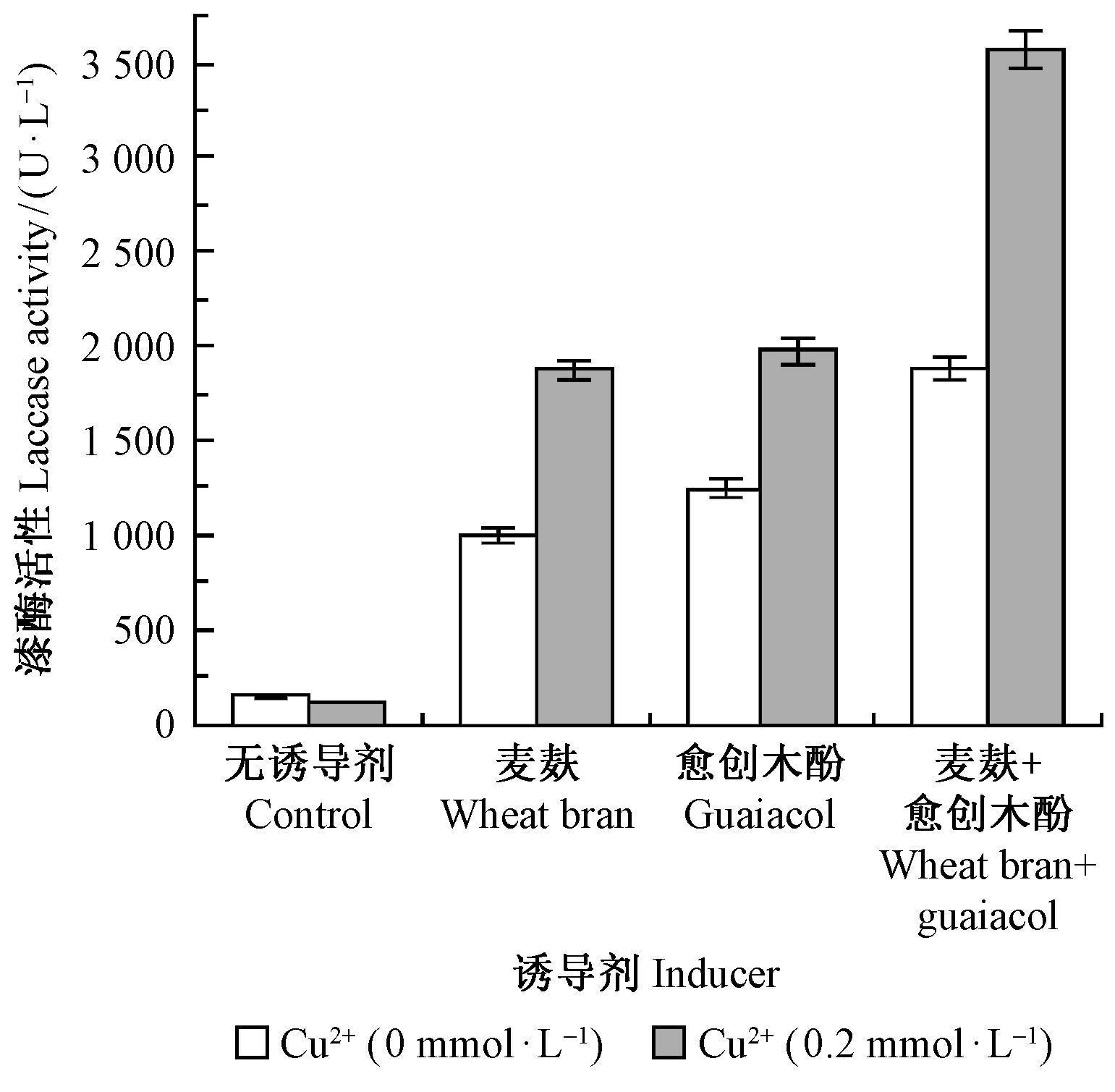
|
图 4 诱导剂组合对漆酶活性的影响 Fig.4 Effect of inducers combination on laccase activity |
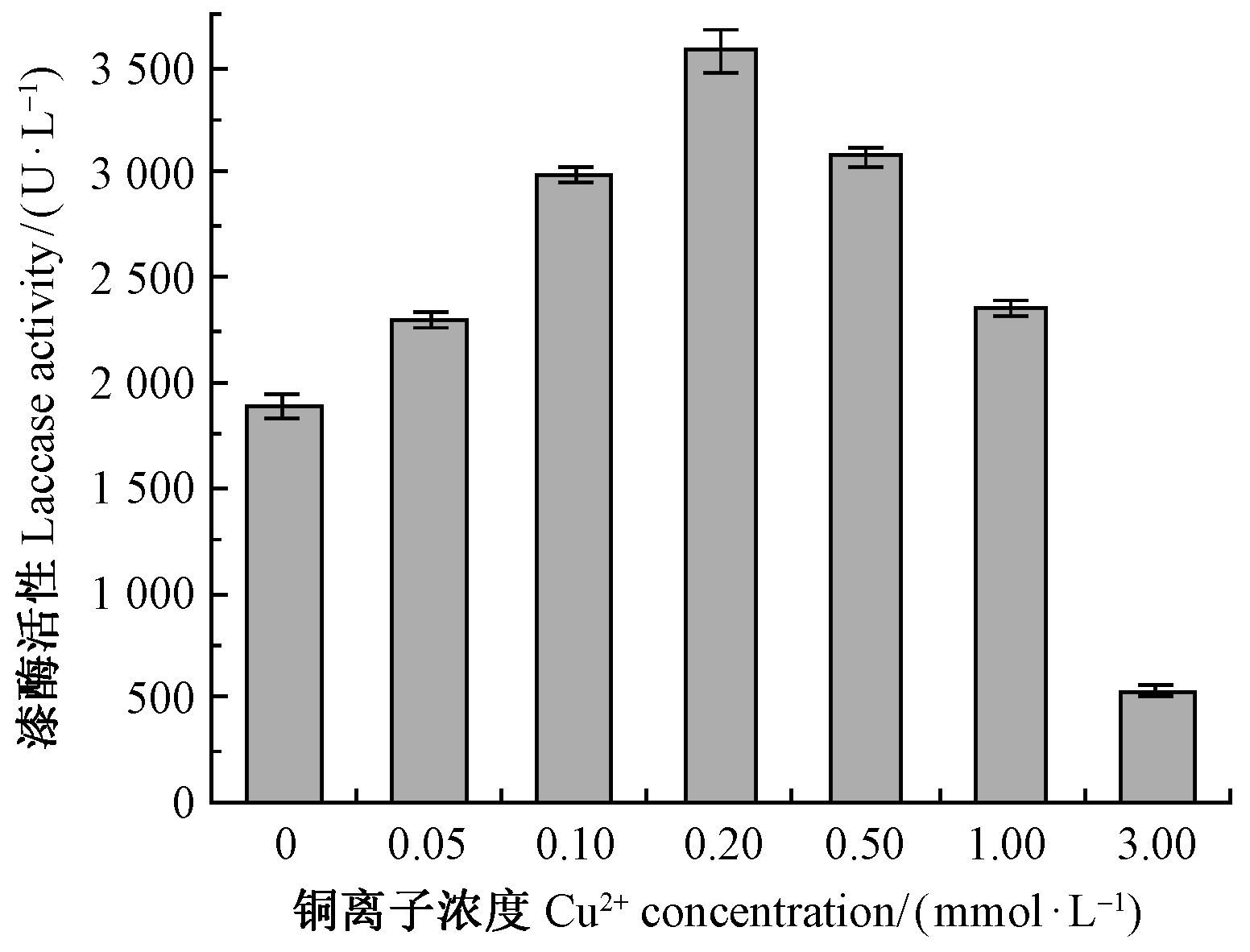
图 5显示了在培养液内添加最佳诱导剂组合的条件下,添加不同浓度Cu2+时的漆酶活性在13天时的变化情况,从而进一步明确Cu2+的最适添加量。Cu2+浓度不同漆酶活性不同,基本是较低浓度促进,较高浓度抑制。当Cu2+浓度在0~0.2 mmol·L-1之间时漆酶活性随Cu2+浓度增加而增加,在0.2 mmol·L-1时酶活性达到最高, 超过0.2 mmol·L-1后酶活性随Cu2+浓度增加而逐渐下降,当Cu2+浓度达到3 mmol·L-1时对漆酶活性有显著的抑制作用。分析原因是过高浓度的Cu2+对菌体有毒性,抑制菌体生长,也抑制了菌体对漆酶的分泌。
|
图 5 Cu2+浓度对漆酶活性的影响 Fig.5 Effect of Cu2+ concentration on laccase activity |
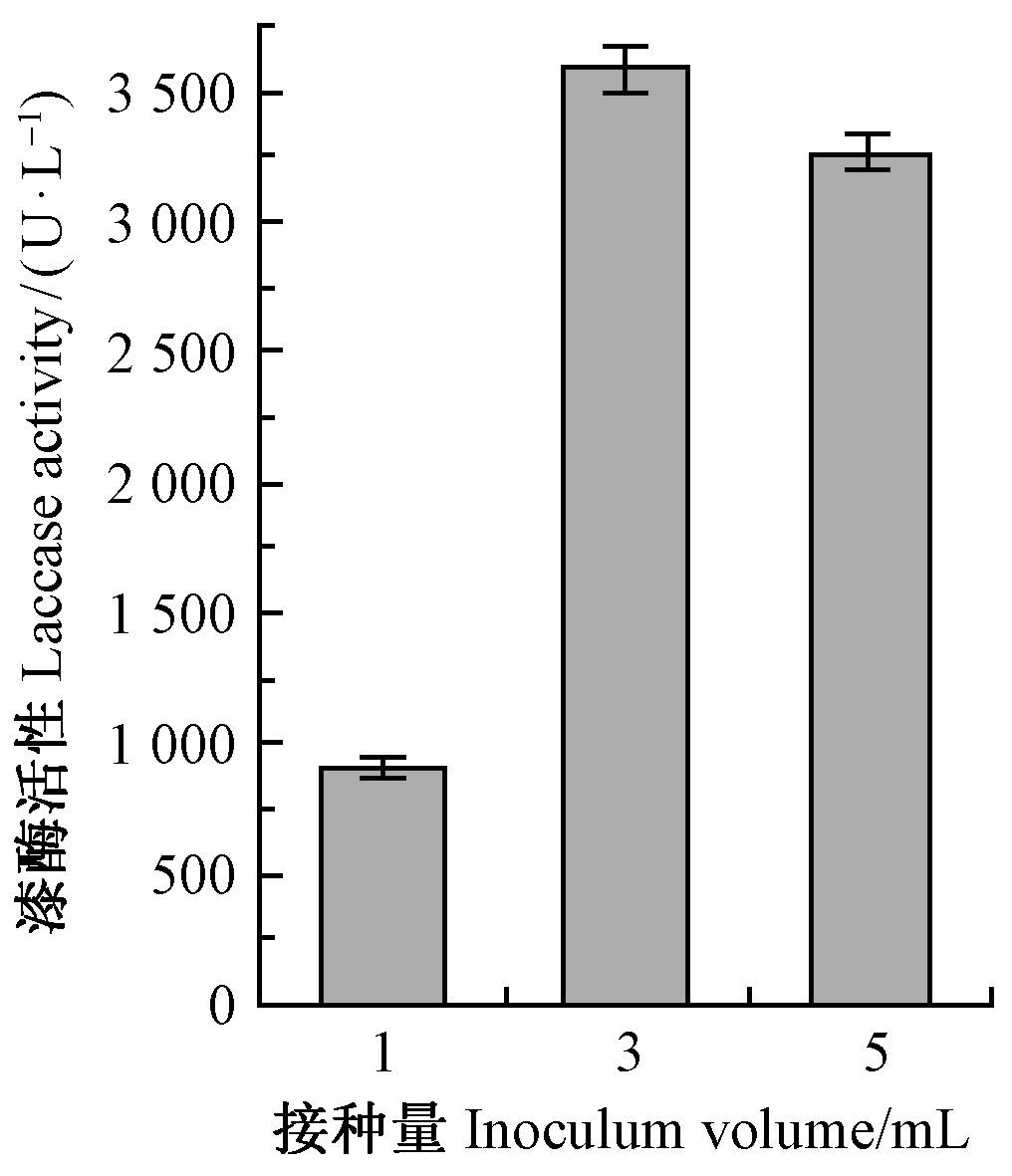
在获得最佳诱导剂组合和最适Cu2+添加量的基础上, 13天时的漆酶活性随不同接种量的变化情况如图 6所示。在100 mL三角瓶中,装液量30 mL 情况下接种3 mL种子母液时的酶活性最高,接种1 mL时菌丝量不足,导致酶活性显著下降; 而增加接种量到5 mL时酶活性并没有增加,而是有所降低,说明过高的接种量也不利于菌丝产酶,从而确定最适接种量为3 mL。
|
图 6 接种量对偏肿革裥菌产漆酶活性的影响 Fig.6 Effect of Inoculum volume on laccase activity |
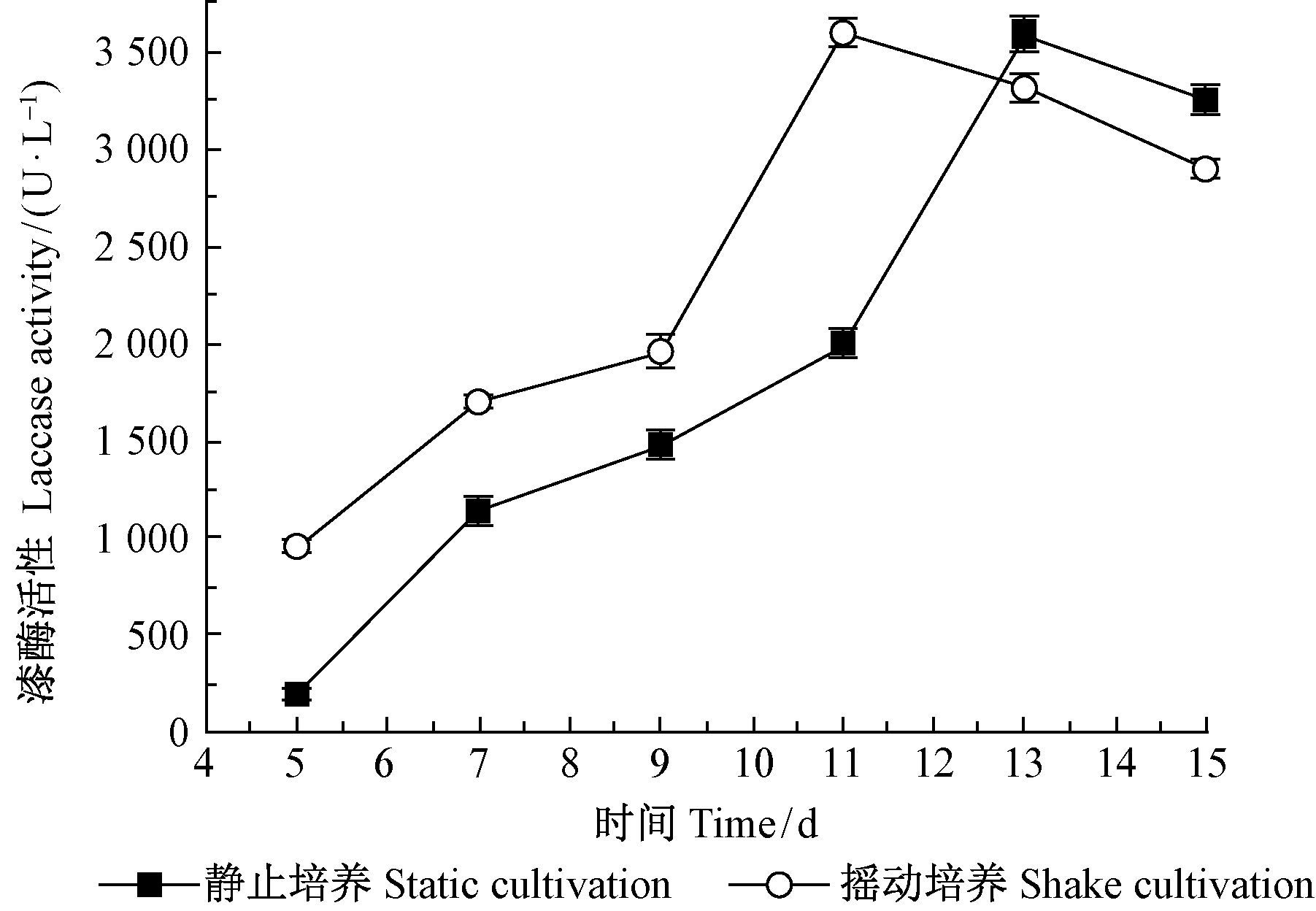
根据以上试验结果,在初始培养基中加入最适浓度的Cu2+(0.2 mmol·L-1)、麦麸(1.5%)、愈创木酚(1.00 mmol·L-1)和3 mL接种量,在28℃下静止和摇动(150 r·min-1)2种条件下培养偏肿革裥菌,检测漆酶活性随时间变化情况,结果如图 7所示。静止培养时漆酶仍为第13天达到酶活性高峰,酶活性为3588.91 U·L-1,仍为初始对照培养基酶活性的24.8倍,进一步验证说明2种诱导剂组合对漆酶诱导效果稳定。与静止培养相比,摇动培养溶氧量充足,菌丝生长良好,所以漆酶产酶高峰有所提前,从13天提前到11天,酶活性为3 594.46 U·L-1,酶活性提高并不显著,但整体上摇动培养好于静止培养,使分泌漆酶高峰提前了2天。因此确定最佳培养方式为摇动培养。
|
图 7 不同培养方式对漆酶活性的影响 Fig.7 Effect of culture methods on laccase activity |
以往研究表明,添加适量Cu2+均能起到提高漆酶活性的效果(李鑫等,2013; 侯红漫等,2003; 郑苗苗,2012)。漆酶蛋白中含有Cu2+,参与酶催化反应中的电子传递过程(Daljit et al.,2010),因此可视Cu2+为漆酶作用的必要金属离子或作为诱导剂。本试验参考郑苗苗(2012)研究结果将添加0.2 mmol·L-1Cu2+作为初始条件,结果表明该浓度恰好适宜,在同时含有麦麸和愈创木酚时,比无Cu2+时的酶活性提高1.90倍,Cu2+浓度较高和较低漆酶活性都下降。在含有0.2 mmol·L-1 Cu2+ 的情况下,麦麸和愈创木酚诱导的酶活性高,在初始产酶培养基中加入1.5%的麦麸和1.00mmol·L-1的愈创木酚时酶活性分别达到1873.16和1 975.72 U·L-1,是对照酶活性的13和13.7倍; 而同时含有2种诱导剂时酶活性高达3 594.46 U·L-1,是对照酶活性的24.9倍。李鑫等(2013)研究表明,贝壳状革耳菌(Panus conchatus)培养4天后加入Cu2+,其最适浓度可提高到3.00 mmol·L-1,此时Cu2+诱导漆酶产量提高3倍左右。但本试验中第4天加入Cu2+,其浓度达3.00mmol·L-1时,Cu2+对漆酶活性表现出明显的抑制作用,说明偏肿革裥菌不适应高浓度Cu2+环境;单独添加Cu2+时,Cu2+对漆酶并没有诱导效果,反而在一定程度上抑制了漆酶活性,推测原因是Cu2+对菌体生长有毒性和抑制作用,影响了对漆酶的分泌。侯红漫等(2003)研究表明,0.1 mmol·L-1Cu2+可提高Pleurotus ostreatus漆酶活性约5.5倍。以上研究表明Cu2+对不同菌种漆酶的诱导效果不一致,各菌种其最适Cu2+浓度不同,但Cu2+均表现为诱导作用。
同一化学诱导剂对不同的菌种诱导效果有很大差别,已有研究表明ABTS对多种白腐菌漆酶活性有显著的诱导效果(吴香波等,2009; 方华等,2008),可提高酶活性2.5~7倍,但本试验ABTS对于偏肿革裥菌产漆酶不但没有诱导效果,反而有所抑制。苯酚和香兰素对偏肿革裥菌产漆酶也有一定诱导效果。Feng等(2013)研究0.09 mmol·L-1苯酚作为诱导剂诱导Pestalotiopsis sp. J63产漆酶效果最好,可提高酶活性1.7倍,好于愈创木酚,而对于偏肿革裥菌愈创木酚的效果远远好于苯酚; 王佳玲等(1997)研究表明香兰素对漆酶和MnP都有一定的诱导效果,本试验中香兰素在最佳浓度1.00 mmol·L-1时诱导偏肿革裥菌产漆酶活性可达615.19 U·L-1,酶活性提高4.3倍,效果也非常显著,但其效果仍没有愈创木酚好。
生物诱导剂(木屑、麦麸、稻草)的诱导效果普遍较好,本课题组之前研究均使用木屑作为白腐菌产漆酶底物,一般能提高漆酶酶活性6.3~7.5倍(张玉龙等,2011; 闫洪波,2009),李鑫(2013)将麦麸作为生物诱导剂,能使漆酶活性提高约3.5倍,本试验中木屑和麦麸分别使偏肿革裥菌漆酶活性提高9,12倍,麦麸的效果好于木屑。一些研究将麦麸作为单一碳源观察漆酶产量,其效果并不好(Feng et al.,2013),由此可见,麦麸虽然也可以被菌丝利用,但只能起到辅助诱导作用,在碳氮源适宜的情况下才能较大幅度提高漆酶产量。
诱导剂组合试验研究不多,李鑫等(2013)将3.00 mmol·L-1Cu2+和1.5%麦麸进行组合,二者共同提高P. conchatus漆酶活性约8.5倍。本试验中将0.2 mmol·L-1Cu2+、1.5%麦麸及1.00 mmol·L-1愈创木酚三者结合,可诱导偏肿革裥菌漆酶产量提高将近24倍,其效果非常显著,好于以往任何漆酶优化试验效果(陈军,2008),表明偏肿革裥菌所产漆酶是一种诱导型漆酶,其合成不仅易受培养条件的影响,更受到诱导剂的影响,这对漆酶的研究及应用具有非常重要的意义,对不同的菌种均可探索其生物诱导剂和化学诱导剂的最佳组合,以便最大限度地提高漆酶产量。诱导剂及用量的选择也是漆酶优化工艺中非常关键的步骤而不可或缺。
4 结论在白腐菌偏肿革裥菌产漆酶的过程中,加入一些含有木质素结构的底物作为诱导剂可大大提高漆酶产量,诱导剂的种类和添加量对漆酶活性都有显著影响。生物诱导剂麦麸和化学诱导剂愈创木酚2种诱导剂组合能大幅度提高偏肿革裥菌的漆酶活性,比培养条件的优化对酶活性的提高更显著。偏肿革裥菌产漆酶的最适条件为: 在100 mL三角瓶中加入初始产酶培养基30 mL,其中添加1.5%麦麸,接入3 mL菌丝母液,在28 ℃、150 r·min-1下摇动培养4天后,再添加0.2 mmol·L-1 Cu2+和1.00 mmol·L-1愈创木酚,培养至11天可达到产酶高峰。
| [] |
陈军, 高大文, 池玉杰, 等. 2008. 偏肿拟栓菌Pseudotrametes gibbosa产漆酶的条件优化. 菌物学报 , 27 (6) : 940–946.
( Chen J, Gao D W, Chi Y J, et al.2008. Optimization of condition for producing laccase by Pseudotrametes gibbosa. Mycosystema , 27 (6) : 940–946. [in Chinese] ) |
| [] |
方华, 黄俊, 陈瞾, 等. 2008. 白腐菌分泌漆酶的培养条件研究. 化学与生物工程 , 25 (8) : 30–33.
( Fang H, Huang J, Chen Z, et al.2008. Research of culture condition for producing laccase by white rot fungus Pleurotus ostreatus. Chemistry and Bioengineering , 25 (8) : 30–33. [in Chinese] ) |
| [] |
侯红漫, 蒋娇娇. 2003. 白腐菌漆酶的生产及其最佳诱导条件. 大连轻工业学院学报 , 22 (1) : 28–31.
( Hou H M, Jiang J J.2003. Laccase production by white rot fungi Pleurotus ostreatus and its optimal inducing condition. Journal of Dalian Institute of Light Industry , 22 (1) : 28–31. [in Chinese] ) |
| [] |
李鑫, 李建科, 董攀, 等. 2013. 白腐菌发酵培养及诱导剂对漆酶合成的影响. 食品工业科学 , 3 (5) : 160–168.
( Li X, Li J K, Dong P, et al.2013. White-rot fungus fermentation cultivation and effect of inducer on laccase production. Science and Technology of Food Industry , 3 (5) : 160–168. [in Chinese] ) |
| [] |
林俊芳, 刘志明, 陈晓阳, 等. 2009. 真菌漆酶的酶活测定方法评价. 生物加工过程 , 7 (4) : 1–8.
( Lin J F, Liu Z M, Chen X Y, et al.2009. Evaluation of assay methods for determining fungal laccase activity. Chinese Journal of Bioprocess Engineering , 7 (4) : 1–8. [in Chinese] ) |
| [] |
刘剑, 刘君昂, 周国英, 等. 2014. 响应面法优化革耳Panus rudis FG-35菌株产漆酶培养基. 生物技术通报 (4) : 57–63.
( Liu J, Liu J A, Zhou G Y, et al.2014. Optimization of components for laccase production by Panus rudis FG-35 using response surface methodology. Biotechnology Bulletin (4) : 57–63. [in Chinese] ) |
| [] |
王佳玲, 付时雨, 余惠生, 等. 1997. 氮源浓度和芳香化合物对白腐菌产木素降解酶的影响. 纤维素科学与技术 , 5 (4) : 25–32.
( Wang J L, Fu S Y, Yu H S, et al.1997. Effect of nitrogen concentration and aromatic compounds on ligninolytic enzymes production by white rot fungi. Journal of Cellulose Science and Technology , 5 (4) : 25–32. [in Chinese] ) |
| [] |
王岁楼, 王琼波. 2005. 漆酶在食品工业中的应用及其产生菌的研究. 食品科学 , 26 (2) : 260–263.
( Wang S L, Wang Q B.2005. Application of laccase in the food industry and its producer. Food Science , 26 (2) : 260–263. [in Chinese] ) |
| [] |
吴香波, 谢益民, 冯晓静. 2009. 白腐菌Coriolus versicolor培养及产漆酶条件的研究. 纤维素科学与技术 , 17 (2) : 12–19.
( Wu X B, Xie Y M, Feng X J.2009. Research about cultivation and condition for producing laccase by Coriolus versicolor. Journal of Cellulose Science and Technology , 17 (2) : 12–19. [in Chinese] ) |
| [] |
闫洪波. 2009. 偏肿拟栓菌锰过氧化物酶cDNA基因克隆及在毕赤酵母中的表达. 哈尔滨:东北林业大学博士学位论文. ( Yan H B. 2009. Molecular cloning of cDNA gene encoding a manganese peroxidase from Pseudotrametes gibbosa and heterologous expression of this gene in Pichia pastoris. Harbin:PhD thesis of Northeast Forestry University. [in Chinese][in Chinese]) |
| [] |
张玉龙, 池玉杰, 闫洪波. 2011. 偏肿栓菌产锰过氧化物酶条件优化. 林业科学 , 48 (8) : 88–94.
( Zhang Y L, Chi Y J, Yan H B.2011. Optimization of ferment conditions of manganese peroxidase produced by Trametes gibbosa. Scientia Silvae Sinicae , 48 (8) : 88–94. [in Chinese] ) |
| [] |
郑邦晓, 余湘萍, 叶秀云, 等. 2015. 齿毛菌漆酶的基因克隆、异源表达及脱色研究. 福州大学学报:自然科学版 , 43 (2) : 285–292.
( Zheng B X, Yu X P, Ye X Y, et al.2015. Gene cloning, heterologous expression and decolorization study of a novel laccase gene from Cerrena sp. Journal of Fuzhou University:Natural Science Edition , 43 (2) : 285–292. [in Chinese] ) |
| [] |
郑苗苗. 2012.偏肿革裥菌漆酶基因克隆及在毕赤酵母中的表达. 哈尔滨:东北林业大学博士学位论文. ( Zheng M M. 2012. Molecular cloning of gene encoding a laccase from Lenzites gibbosa and heterologous expression of this gene in Pichia pastoris. Harbin:PhD thesis of Northeast Forestry University. [in Chinese][in Chinese]) http://cn.bing.com/academic/profile?id=1362003182acfd685b1262ae9982cb20&encoded=0&v=paper_preview&mkt=zh-cn |
| [] |
卓睿, 马富英, 周帅, 等. 2015. 糙皮侧耳生长发育过程中漆酶基因家族的表达研究. 菌物学 , 34 (4) : 712–716.
( Zhuo R, Ma F Y, Zhou S, et al.2015. Expression of laccase gene family in different development stages of Pleurotus ostreatus. Mycosystema , 34 (4) : 712–716. [in Chinese] ) |
| [] | Daljit S A, Rakesh K S.2010. Ligninolytic fungal laccases and their biotechnological applications. Appl Biochem Biotechnol , 160 (6) : 1760–1788. DOI:10.1007/s12010-009-8676-y |
| [] | Devi V M, Inbathamizh L, Ponnu T M, et al.2012. Dye decolorization using fungal laccase. bulletin of environment, Pharmacology & Life Sciences , 1 (3) : 67–71. |
| [] | Feng X Y, Chen H Y, Xue D S, et al.2013. Enhancement of laccase activity by marine-derived deuteromycete Pestalotiopsis sp. J63 with agricultural residues and inducers. Chinese Journal of Chemical Engineering , 21 (10) : 1182–1189. |
| [] | Jaszek M, Grzywnowicz K, Malarczyk E, et al.2006. Enhanced. extracellular laccase activity as a part of the response system of white rot fungi:Trametes versicolor and Abortiporus beinnis to paraquat-caused oxidative stress conditions. Pesticide Biochemistry and Physiology , 85 (3) : 147–154. DOI:10.1016/j.pestbp.2006.01.002 |
| [] | Mahmoud M G, Rifaat H M, EI Sayed O H, et al.2013. Effect of inducers and process parameters on laccase production by locally isolated marine Streptomyces lydicus from Red Sea, Egypt. International Journal of Chem Tech Research , 5 (1) : 15–23. |
| [] | You L F, Liu Z M, Lin J F, et al.2014. Molecular cloning of a laccase gene from Ganoderma lucidum and heterologous expression in Pichia pastoris. Journal of Basic Microbiology Supplement:Fungi , 54 (1) : 134–141. |
 2016, Vol. 52
2016, Vol. 52

