文章信息
- 王安可, 毕毓芳, 王玉魁, 蔡函江, 翟志忠, 钟浩, 杜旭华, 丁兴萃, 田新立
- Wang Anke, Bi Yufang, Wang Yukui, Cai Hanjiang, Zhai Zhizhong, Zhong Hao, Du Xuhua, Ding Xingcui, Tian Xinli
- 金属纳米颗粒CCCSNs在植物体内的积累和分布
- Accumulation and Allocation of Copper-Carbon Core-Shell Nanoparticles in Three Species
- 林业科学, 2016, 52(11): 47-54
- Scientia Silvae Sinicae, 2016, 52(11): 47-54.
- DOI: 10.11707/j.1001-7488.20161106
-
文章历史
- 收稿日期:2016-05-05
- 修回日期:2016-09-23
-
作者相关文章
随着纳米科技的不断发展,纳米材料在林业中的应用也逐渐受到关注。铜/碳-核/壳纳米颗粒(CCCSNs)是一种新型复合材料,它以棉花纤维为生物模板,铜原子均匀地嵌在炭黑中,形成了一种碳包铜结构的纳米复合材料,这样的结构使得铜核在碳的保护下数年之内不会被轻易氧化,并根据需求可以加工成不同粒级的材料,且具有良好的热稳定性和化学稳定性,可被加工成从纳米到米的不同规格(Wu et al., 2012;Lian et al., 2013)。Qi等(2011)将CCCSNs应用于防治蓝链菌(Ophiostoma minus),并发现CCCSNs可以在落羽杉(Taxodium distichum)各器官中积累。王安可等(2015)也证实该材料对白腐菌(Trametes versicolor)具有良好的抗性。
许多纳米材料可以进入植物体内。Khodakovskay等(2012)发现CNTs (carbon nanotubes)可以渗透进入番茄(Lycopersicon esculentum)种皮影响种子萌发和幼苗生长。Pokhrel等(2013)发现玉米(Zea mays)苗对Citrate-nAg (纳米级柠檬酸银)有微量的吸收。Edward等(2009)发现MWCNTs (multiwalled carbon nanotubes)可以通过吸附在小麦(Triticum aestivum)根系表层而进入根毛和根冠。Kurepa等(2010)证实纳米Ti-ARS可以从拟南芥(Arabidopsis thaliana)的根系传输到茎和叶片。刘丽娇(2014)发现CuO ENPs不仅可以从根系进入植物体,凤眼莲(Eichhornia crassipes)的沉水叶片可以吸收CuO ENPs。吕琨淼(2013)也证实浮萍(Lemna minor)叶片可以吸收CuO ENPs。目前大多数的研究专注于纳米材料对植物生理生化的影响和对植物的毒性,关于植物积累的程度,尤其是地上部分对纳米材料的吸收研究较少。根据纳米材料可以进入活体植物细胞这一特点,本文旨在经过初步研究毛竹(Phyllostachys edulis)、富贵竹(Dracaena sanderiana)和陆地棉(Gossypium hirsutum)3种植物材料对CCCSNs的积累分散效果,以期为植物利用CCCSNs提高其制品的防腐能力提供依据。
1 材料与方法 1.1 试验材料引进材料CCCSNs由美国南方大学提供,铜含量为13%,铜核约85 nm,颗粒测试约4 000 nm (含团聚因素)。试验毛竹为3年生盆栽实生苗,苗高约1 m,由太湖源竹种园在温室中繁殖培育。于2014年6月选取长势一致的植株运输至本实验室(浙江杭州),清除冲洗干净土壤后,改为水培培养(杭州自来水pH6~7),24 h不间断通气,自然光照。试验陆地棉‘中棉所47’,由本实验室于2014年5月穴盘种植,自来水浇灌,自然光常规培养10天后进行移栽,株高约10 cm,移栽至直径30 cm、高40 cm的黑色塑料花盆中,填土约17 L,仍然常规光照,自来水浇灌。试验富贵竹于2015年6月购自杭州市花卉市场,水培培养,不通气,自然光照。培养地点均为本研究中心楼顶平台。
1.2 试验处理试验共设3个处理(含对照),水培处理为0,0.1和0.5 g·L-1CCCSNs,土培处理为每盆0,0.1和0.5 g。毛竹盆栽苗从土培改为水培时,不缓苗,直接进行CCCSNs施用;共9盆,每盆6株,随机分为3组,每组3盆(每组为1个处理)。陆地棉苗从穴盘移栽至花盆时进行CCCSNs施用,施用时CCCSNs全部洒于根系处,不与培养土混合;共计9盆,每盆3株,随机分为3组,每组3盆。富贵竹从市场购回后,以自来水培养15天后施用CCCSNs;共计6盆,每盆6株,随机分为3组,每组2盆。
1.3 试验方法 1.3.1 铜含量测定待CCCSNs施用50天后,一次性破坏性取样。将施用材料用水冲干净后120 ℃ 2 h,80 ℃12 h至样品完全烘干。不分植物器官(茎和叶),根据地上部高度分段切割(水培植物以培养液水面作为0),磨粉备用。取0.5 g粉末于50 mL四氟乙烯烧杯,加10 mL色谱纯级硝酸和200 μL过氧化氢石墨盘加热,200 ℃ 30 min,150 ℃至样品完全消解且排酸至0.5 mL,定容至50 mL。使用PerkinElmer AAnalyst 800测定样品铜含量。铜标准液购自北京有色金属研究总院。1盆植株视为1个样品,每样消解重复2次,每个消解样重复测定3次。数据统计均值比较采用Tuekey法。
1.3.2 根细胞透射电镜及能谱扫描待CCCSNs施用1个月后,切取部分根系,用水冲净表面的材料后,将毛细根切成约6 mm长度的段(尽量使各处理之间切取部位与根尖距离相同)浸泡于2.5%的戊二醛真空过夜后送至浙江大学农生环测试中心电镜室进行样品处理、透射电镜和能谱扫描。
2 结果与分析 2.1 CCCSNs在植株内的积累由于CCCSNs的核心元素是铜元素,因此能否在植物体内检测到铜含量的提升是判断CCCSNs是否分散到植物体内的标准。
2.1.1 CCCSNs在毛竹体内的积累为了探明CCCSNs是否能在毛竹体内分散贮存,对水培毛竹实生苗进行破坏性取样,测定植株铜含量。结果表明,0.1和0.5 g·L-1CCCSNs处理的毛竹体内铜含量均有提高,地上部平均铜含量分别为13.19和11.79 μg·g-1,比对照提高了263%和225%,与对照差异极显著。检测到的最高铜含量为21.65 μg·g-1,较对照提高了487%。由图 1可知,地上部铜含量分段比较,0.1和0.5 g·L-1的处理均高于对照,0.1 g·L-1的处理在离地0~10,10~20和50~60 cm这3个部分铜含量高于0.5 g·L-1的处理,这说明在CCCSNs质量浓度为0.1~0.5 g·L-1之间,水培毛竹铜含量与施用样品的质量浓度没有梯度关系。这说明即使0.1 g·L-1的CCCSNs对于毛竹的极限吸收量来说,也是过量的。

|
图 1 毛竹植株铜含量 Fig.1 Cu content of Phyllostachys edulis in main stem and leaves 小写字母表示在α=0.05水平上的差异显著性。下同。The small letters mean significant difference in same column at 0.05 level.The same below. |
为了排除CCCSNs在植物中的分散具有同源性(CCCSNs由棉花纤维制成),试验选用陆地棉作为观测对象。对土培陆地棉破坏性取样,地下部为一段、地上部每10 cm一段,测试植株铜含量。
由图 2可知,每盆0.1和0.5 g CCCSNs处理后,陆地棉体内铜含量均有提高,地上部平均铜含量分别为5.22和6.53 μg·g-1,比对照分别提高24%和52%,均与对照有显著差异,其中每盆0.5 g的处理与对照有极显著差异。最高铜含量为9.19 μg·g-1,较对照提高了96%。地下部分(即根系)铜含量各处理之间差异显著,比对照分别提高192%和629%,这可能是由于根细胞和细胞间隙中储存较多的CCCSNs,还没有及时输送到地上部。地上部铜含量分段比较,在0~30 cm,植株铜含量为每盆0.5 g>0.1 g>对照,说明CCCSNs质量浓度每盆为0.1~0.5 g之间,陆地棉体内铜含量随CCCSNs施用量的增加而增加。离地30 cm以上的部分,每盆0.1和0.5 g的处理与对照差异不显著,这可能是CCCSNs从根系进入,由下向上传输,距离越远越困难。

|
图 2 陆地棉植株铜含量 Fig.2 Cu content of Gossypium hirsutum in main stem and leaves |
为了排除由于毛竹自身结构的特殊性(茎中空和具竹隔等特点)而对CCCSNs的吸收积累产生特异性表现,试验选用常见水培植物富贵竹作为观测对象。对水培富贵竹破坏性取样,每15 cm一段,测试植株铜含量。由图 3可知,施加CCCSNs的富贵竹,铜含量均高于对照。测试结果表明,0.1和0.5 g·L-1CCCSNs处理的富贵竹地上部铜含量分别为29.31和27.95 μg·g-1,比对照增加104%和90%。最高铜含量是44.88 μg·g-1,比对照提高了63%。地下部0.1和0.5 g·L-1的处理与对照相比铜含量提高了1 344%和2 040%,与地上部铜含量提高百分率差异悬殊有可能是由于CCCSNs残留在根系表面造成的。地上部0.1和0.5 g·L-1CCCSNs处理的植株铜含量均高于对照,但是0.1和0.5 g·L-1的处理之间没有因施用浓度而表现出梯度差异。说明CCCSNs的质量浓度在0.1~0.5 g·L-1之间,富贵竹的铜含量与CCCSNs的施用量没有关系。
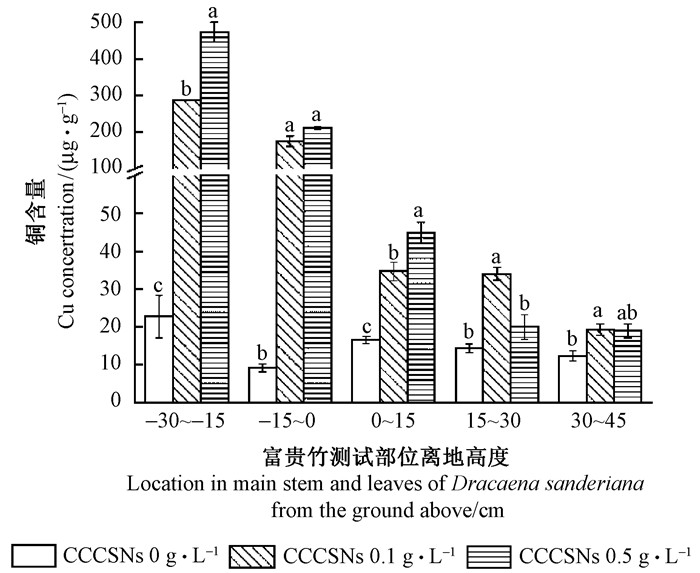
|
图 3 富贵竹植株铜含量 Fig.3 Cu concentration of Dracaena sanderiana in main stem and leaves |
综上所述,CCCSNs可以通过根系进入植物体内,但是进入植物体内的量与植物的种类有关。陆地棉较其他2种植物没有明显的同源性优势;从铜含量提高的百分率来看,毛竹对CCCSNs的吸收优于富贵竹,但富贵竹体内最高铜含量高于毛竹。这与许多研究者发现的结果类似,不同植物对同种纳米材料的吸收效果不同。Doshi等(2008)发现相同条件对菜豆(Phaseolus vulgaris)和黑麦草(Lolium perenne)施用纳米级的铝氧化物Alex和L-Alex,但只有黑麦草体内可以积累Alex和L-Alex,菜豆则不能。Schwabe等(2013)也证实用CeO2 NPs同时处理小麦和南瓜(Cucurbita moschata)8天,只有在南瓜的茎中检测到Ce。
CCCSNs在植株体内的积累与施用量也有关系。在低浓度时,植物积累CCCSNs的量与施用量有关;但是超过一定浓度,进入植物体内CCCSNs的量会达到一定的极限,与施用量没有关系。这一结果与此前多位研究者对纳米材料在植物中积累的描述基本相符。Lee等(2008)证实绿豆(Phaseolus radiatus)和小麦对Cu NPs的积累与施用浓度呈正相关。Lopez-Moreno等(2016)发现番茄吸收Fe和Co的量与CoFe2O4 NPs的施用量正相关。
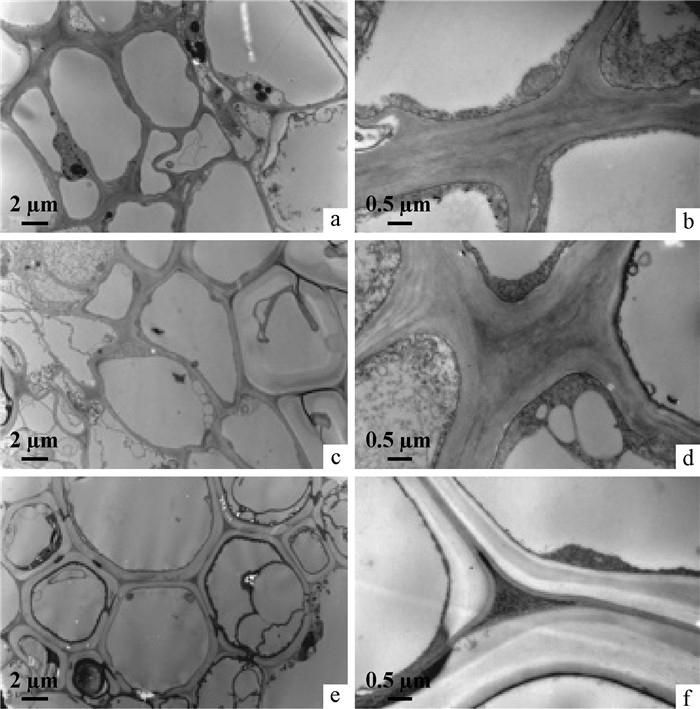
2.2 根细胞透射电镜结果通过电镜观察发现(图 4、图 5和图 6),3种植物的根细胞电镜图之间没有明显的区别。经过CCCSNs处理的根细胞与对照细胞相比,其细胞间隙比细胞壁颜色深;大多数细胞膜内壁上有深黑色物质沉积,尤其在0.5 g·L-1和每盆0.5 g CCCSNs处理的细胞;并且在毛竹根细胞0.1 g·L-1的处理中发现,细胞质内也沉积了大量深黑色物质。此外,通过电镜发现0.5 g·L-1处理的毛竹根细胞被真菌侵染,在真菌细胞膜内壁和胞内也附着和沉积了许多黑色物质。

|
图 4 毛竹根细胞透射电镜 Fig.4 The TEM of Phyllostachys edulisroot cell a, b, c:CK的根细胞; d, e, f:经过0.1 g·L-1CCCSNs处理的根细胞;g, h, i:经过0.5 g·L-1 CCCSNs处理的根细胞。大写字母表示能谱测试位点。 a, b, c:Root cell of CK; d, e, f:Root cell treated with 0.1 g·L-1 CCCSNs; g, h, i:Root cell treated with 0.5g·L-1 CCCSNs. Capital letters are the EDS sites. |
|
图 5 陆地棉根细胞透射电镜 Fig.5 The TEM of Gossypium hirsutum root cell a, b:CK的根细胞; c, d:经过0.1 g·pot-1 CCCSNs处理的根细胞; e, f:经过0.5 g·盆-1 CCCSNs处理的根细胞。a, b:Root cell of CK; c, d:Root cell treated with 0.1 g·pot-1 CCCSNs; e, f:Root cell treated with 0.5 g·pot-1 CCCSNs. |

|
图 6 富贵竹细胞透射电镜 Fig.6 The TEM of Dracaena sanderiana root cell a, b: CK的根细胞; c, d: 0.1 g·L-1 CCCSNs处理的根细胞; e, f: 0.5 g·L-1 CCCSNs处理的根细胞。a, b: Root cell of CK;c, d: Root cell treated with 0.1 g·L-1 CCCSNs; e, f: Root cell treated with 0.5 g·L-1 CCCSNs. |
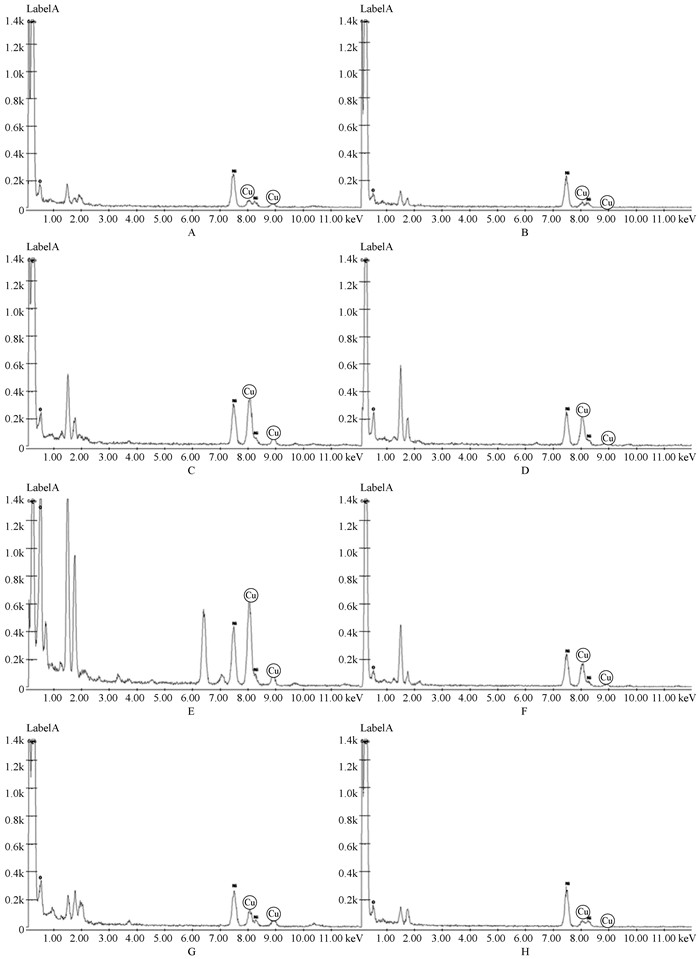
为了确定所观察到的物质是否是试验所添加的CCCSNs,对毛竹根细胞的这些位点进行了能谱扫描。在未添加CCCSNs的根细胞中,没有监测到明显的铜峰(图 7A和B)。细胞间隙(图 7C)和细胞壁(图 7D)均有明显铜峰,且相差不大;说明在细胞壁和细胞间隙均积聚了较多的CCCSNs。细胞质内的黑色沉积物(图 7E)的铜峰明显高于细胞质内没有沉积物位点的铜峰(图 7F),说明黑色的沉积物是施用的CCCSNs;并且由于对照细胞质中没有出现铜峰,由此推断CCCSNs处理过的细胞,细胞质内没有明显沉积物的地方可能含有CCCSNs析出的离子态铜,这些铜离子游离在细胞质或其他部位中。在侵染毛竹根系的真菌细胞内积聚的黑色物质(图 7G)经过能谱确认,是试验施加的CCCSNs;没有积聚物的位点(图 7H)没有铜峰。综上所述,CCCSNs可以进入植物细胞,大多积累在细胞间隙和细胞壁,也可以穿过细胞壁(包括真菌细胞壁),积聚在细胞质内或细胞膜内侧。Liu等(2009)曾证实纳米材料SWNTs (single-walled carbon nanotubes)可以穿过植物细胞膜和细胞壁。杨远强(2012)发现CuO NPs大多沉积在海州香薷(Elsholtzia splendens)细胞的细胞壁和细胞膜附近。 Da Costa等(2016)通过电镜发现CuO NPs大多积累在水稻(Oryza sativa)叶片细胞的叶绿体上。综合以上结果推测,纳米材料在细胞中沉积的位置具有随机性,某种特定的材料也可能对某些位置具有倾向性。
|
图 7 毛竹根细胞能谱 Fig.7 The DES of Phyllostachy edulis root cell 大写字母对应图 4中标注的能谱位点。Capital letters match the sites in Fig.4. |
虽然该试验证明CCCSNs可以进入植物细胞,但是CCCSNs如何从根系运送至茎和叶、茎和叶中的Cu是以游离态还是CCCSNs形态存在均未明确。有学者提出,植物根吸收纳米材料的途径可能是纳米材料首先穿过根表皮层进入根内部,然后进入根系的纳米材料需要进一步横向渗透穿过内皮层进入木质部的导管,进而被输送到植物各器官(吕继涛等,2013;Ma et al., 2010)。解晓燕(2012)在玉米的根、叶片细胞和木质部汁液中均检测到CuO ENPs,由此推测CuO ENPs首先吸附在玉米根系表面,然后进入根细胞中,从未完全形成凯氏带的幼嫩根细胞中进入木质部中,随水分及营养物质运输到地上部。Shen等(2010)发现经过SWCNTs处理的拟南芥细胞,出现有氧化铈沉积的内吞状结构。结合前人的结果,笔者推测更倾向于若是大量的铜以游离态的形式大量存在于植物体,必将影响植物的生长发育,因此认为运送到地上部的铜大部分仍然以CCCSNs的型态存在。但是在试验过程中并没有发现植物生长异常。毕毓芳等(2015)也证实CCCSNs对植物光合作用影响很小。
3 结论本文研究了毛竹、富贵竹和陆地棉3种植物材料对CCCSNs的积累分散效果。结果表明,CCCSNs可以从根系进入植物体向地上部传输,但植物积累的量与物种有关。3种植物中地上部平均绝对、相对铜含量和最高铜含量均为富贵竹最高;但与对照相比提高的百分率,毛竹最高。植物地上部铜含量可能与CCCSNs的施用浓度有关。试验中陆地棉土培施用的浓度较为适宜,铜含量随施用量的增加而增加;水培施用的0.1 g·L-1CCCSNs比土培浓度高,可能过量,未表现出积累量与施用量的相关性。透射电镜和能谱扫描发现,经过CCCSNs处理的植株,CCCSNs可以积聚在其根细胞的细胞质内、细胞膜内侧、细胞壁和细胞间隙中。3种植物之间根细胞积累CCCSNs的方式没有明显差别。虽然该试验已经证明CCCSNs可以从根系进入植物体内,但是CCCSNs如何从细胞间隙进入细胞和以何种方式运送至地上部等问题仍然需要进一步研究。
| [] |
毕毓芳, 王安可, 翟志忠, 等. 2015. CCCSNs施入对毛竹叶片光合及生理特性的影响. 安徽农业大学学报 , 42 (5) : 743–748.
( Bi Y F, Wang A K, Zhai Z Z, et al.2015. Effects of carbon-copper core-shell nanoparticles on physiological characteristics, photosynthetic parameters and chlorophyll fluorescence characteristics of Phyllostachys pubescens. Journal of Anhui Agricultural University , 42 (5) : 743–748. [in Chinese] ) |
| [] |
刘丽娇.2014.CuO ENPs对凤眼莲的影响:生长抑制、吸收分布和存在形态.青岛:中国海洋大学博士学位论文. ( Liu L J. 2014. Impact of copper oxide engineered nanoparticles on Eichhornia crassipes: toxicity, uptake and distribution, existing speciation. Qingdao: PhD thesis of Ocean University of China. [in Chinese][in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10423-1014368376.htm |
| [] |
吕琨淼.2013.人工合成氧化铜纳米颗粒对浮萍的影响:毒性效应、吸收方式和分布规律.青岛:中国海洋大学硕士学位论文. ( Lü K M. 2013. Impact of copper oxide engineered nanoparticles on Lemna minor: toxicity, uptake and distribution. Qingdao: MS thesis of Ocean University of China. [in Chinese][in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10423-1013367845.htm |
| [] |
吕继涛, 张淑贞. 2013. 人工纳米材料与植物的相互作用:植物毒性、吸收和传输. 化学进展 , 25 (1) : 156–163.
( Lü J T, Zhang S Z.2013. Interactions between manufactured nanomaterials and plants: phytotoxicity, uptake and translocation. Progress in Chemistry , 25 (1) : 156–163. [in Chinese] ) |
| [] |
王安可, 毕毓芳, 杨慧敏, 等. 2015. CCCSNs对几种木腐菌的抑菌性评价. 浙江农业学报 , 27 (9) : 1606–1611.
( Wang A K, Bi Y F, Yang H M, et al.2015. Evaluation of antimicrobial activity of CCCSNs on several kinds of wood rotting fungi. Acta Agricultural Zhejiangensis , 27 (9) : 1606–1611. [in Chinese] ) |
| [] |
解晓燕.2012.CuO纳米颗粒的植物毒性及在玉米体内的长距离运输.青岛:中国海洋大学硕士学位论文. ( Xie X Y. 2012. Phytotoxicity and long-distance transport of CuO nanoparticles in maize (Zea mays L.). Qingdao: MS thesis of Ocean University of China. [in Chinese][in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10423-1012504253.htm |
| [] |
杨远强.2012.纳米氧化铜的植物吸收累积与毒性效应初探.杭州:浙江大学博士学位论文. ( Yang Y Q. 2012. Accumulation and phytotoxicity of CuONPs to plant. Hangzhou: PhD thesis of Zhejiang University. [in Chinese][in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10335-1012318108.htm |
| [] | Da Costa M V J, Sharma P K.2016. Effect of copper oxide nanoparticles on growth, morphology, photosynthesis, and antioxidant response in Oryza sativa. Photosynthetica , 54 (1) : 110–119. DOI:10.1007/s11099-015-0167-5 |
| [] | Doshi R, Braida W, Christodoulatos C, et al.2008. Nano-aluminum: transport through sand columns and environmental effects on plants and soil communities. Environmental Research , 106 : 296–303. DOI:10.1016/j.envres.2007.04.006 |
| [] | Edward W, Jones K C.2009. Novel method for the direct visualization of in vivo nanomaterials and chemical interactions in plants. Environmental Science & Technology , 43 (14) : 5290–5294. |
| [] | Khodakovskaya M, Dervishi E, Mahmood M, et al.2012. Carbon nanotubes are able to penetrate plant seed coat and dramatically affect seed germination and plant growth. AcsNano , 3 (10) : 3221–3227. |
| [] | Kurepa J, Paunesku T, Vogt S, et al.2010. Uptake and distribution of ultrasmall anatase TiO2 alizarin red S nanoconjugates in Arabidopsis thaliana. Nano Letters , 10 (7) : 2296–2302. DOI:10.1021/nl903518f |
| [] | Lee W M, An Y J, Yoon H, et al.2008. Toxicity and bioavailability of copper nanoparticles to the terrestrial plants mung bean (Phaseolus radiatus) and wheat (Triticum aestivum): plant agar test for water-insoluble nanoparticles. Environmental Toxicology and Chemistry , 27 (9) : 1915–1921. DOI:10.1897/07-481.1 |
| [] | Lian K, Qi Y, Wu Q, et al. 2013. Special properties of new type carbon-copper core-shell nanoparticles composite material fabricated using biomass as template. 8th IEEE International Conference on Nano/Micro Engineered and Molecular Systems (NEMS), Baton Rouge, LA. |
| [] | Liu Q L, Chen B, Wang Q L, et al.2009. Carbon nanotubes as molecular transporters for walled plant cells. Nano Letters , 9 (3) : 1007–1010. DOI:10.1021/nl803083u |
| [] | López-Moreno M L, Avilés L L, Pérez N G, et al.2016. Effect of cobalt ferrite (CoFe2O4) nanoparticles on the growth and development of Lycopersicon lycopersicum (tomato plants). Science of the Total Environment , 550 : 45–52. DOI:10.1016/j.scitotenv.2016.01.063 |
| [] | Ma X M, Geiser-Lee J, Deng Y, et al.2010. Interactions between engineered nanoparticles (ENPs) and plants: phytotoxicity, uptake and accumulation. Science of the Total Environment , 408 (16) : 3053–3061. DOI:10.1016/j.scitotenv.2010.03.031 |
| [] | Pokhrel L R, Dubey D.2013. Evaluation of developmental responses of two crop plants exposed to silver and zinc oxide nanoparticles. Science of the Total Environment , 452-453 (3) : 321–332. |
| [] | Qi Y, Lian K, Wu Q, et al. 2011. Potentials of nanotechnology application in forest protection. The TAPPI International Conference on Nanotechnology for Renewable Materials, Washington, DC. |
| [] | Schwabe F, Schulin R, Limbach L K, et al.2013. Influence of two types of organic matter on interaction of CeO2 nanoparticles with plants in hydroponic culture. Chemosphere , 91 (4) : 512–520. DOI:10.1016/j.chemosphere.2012.12.025 |
| [] | Shen C X, Zhang Q F, Li J, et al.2010. Induction of programmed cell death in Arabidopsis and rice by single-wall carbon nanotubes. American Journal of Botany , 97 (10) : 1602–1609. DOI:10.3732/ajb.1000073 |
| [] | Wu Q L, Lei Y Q, Kun L, et al.2012. Copper/carbon core shell nanoparticles as additive for natural fiber/wood plastic blends. Bioresources , 7 (3) : 3213–3222. |
 2016, Vol. 52
2016, Vol. 52

