文章信息
- 李河, 李杨, 徐建平, 周国英
- Li He, Li Yang, Xu Jianping, Zhou Guoying
- 海南省油茶及其他寄主植物果生刺盘孢菌群体遗传结构分析
- Population Genetic Structure of Colletotrichum fructicola from Oil-Tea and Other Host Plants in Hainan province
- 林业科学, 2016, 52(10): 80-88
- Scientia Silvae Sinicae, 2016, 52(10): 80-88.
- DOI: 10.11707/j.1001-7488.20161010
-
文章历史
- 收稿日期:2015-10-22
- 修回日期:2016-08-26
-
作者相关文章
2. 经济林培育与保护教育部重点实验室, 中南林业科技大学 长沙 410004
2. Key Laboratory for Non-wood Forest Cultivation and Conservation of Ministry of Education, Central South University of Forestry and Technology Changsha 410004
油茶(Camellia oleifera)又名茶子树、油茶树,主要是山茶科(Theaceae)山茶属植物中油脂含量较高且具有栽培经济价值的一类植物的总称,与橄榄(Canarium album)、油棕(Elaeis guineensis)、椰子(Cocos nucifera)并称为世界四大木本油料植物。茶籽油具有合理的脂肪酸构成、丰富的营养成分和良好的保健功能,素有“东方橄榄油”等美誉,已被国际粮农组织列为重点推广的健康型食用油(龙正海等,2008;柏云爱等,2008;汤富彬等,2013;黄翠莉等,2011)。炭疽属(Colletotrichum)真菌可引起多种植物病害,在农业、林业生产上造成重大危害,其危害的寄主植物范围广泛,如杉木(Cunninghamia lanceolata)、小叶杨(Populus simonii)、南方泡桐(Paulownia australis)、山茶(Camellia japonica)、库拉索芦荟(Aloe vera)、菜豆(Phaseolus vulgaris)、辣椒(Capsicum annuum)等(陈守常等,1965;1964;梁子超等,1964;袁嗣令等,1963;杨友联等,2010)。油茶在海南有野生种和栽培种分布,是当地传统油料植物资源,由于气候环境条件不同所产茶籽油的口感与品质优于内地,其价格较为昂贵(郑道君等,2015)。笔者研究发现,油茶炭疽病是由多种炭疽属真菌引起的,而不仅仅是以前报导的胶孢炭疽菌(Colletotrichum gloeosporioides),其中果生刺盘孢菌(C.fructicola)是引起油茶炭疽病优势致病菌,分布范围非常广,在海南省以及在全国油茶产区均危害严重(李河等,2014;2016;Li et al., 2016)。本文对海南省油茶及其他寄主植物炭疽病菌果生刺盘孢菌的群体遗传结构、基因流以及遗传变异规律进行研究,阐明油茶炭疽病的潜在侵染源,为制定可持续控制该病害策略提供重要的理论依据。
1 材料与方法 1.1 试验材料 1.1.1 采样地油茶及其他植物炭疽病叶采自海南省南、中及北部南圣镇、通什镇、枫木林场和澄迈林场,4个地区均属于热带气候,油茶资源和林下植被丰富,是海南省的主要油茶产区,但炭疽病发生严重。南圣镇与通什镇两地处于海南省中部偏南,相距35 km左右,采样地通什镇海拔约为725 m,南圣镇海拔约为330 m,年平均温度为20~23 ℃,全年降雨量为1 687~2 324 mm,土壤为山地红壤为主,pH值在4~6,土壤肥沃,特别适宜种植油茶。枫木实验林场位于海南屯昌县枫木镇,采样地海拔150 m,地处海南省中部山区的东北部,年平均气温23.4 ℃,年平均降雨量2 125 mm,年平均相对湿度85%,土壤为砖红壤。澄迈林场位于海南岛北部,林场地貌属于低丘陵和缓坡区、红壤,年平均温度23.7 ℃,年降雨量1 749 mm,采样地海拔76 m,适宜种植油茶。
1.1.2 油茶炭疽病菌形态特征炭疽病果初生黑褐色的斑点,以后扩大成圆形、中央灰黑色、边缘黑褐色的病斑,严重时全果变黑,上生黑色小点。病果易脱落,少数不脱落的病果常沿病斑中部开裂,种仁散落;炭疽病叶病斑常沿叶缘发生,多呈半圆形,黑褐色,边缘紫红色,后期病斑中心灰白色,内轮生小黑点;病果和病叶上的小黑点即病菌的分生孢子盘,分生孢子萌发后可形成附着孢产生侵染钉或侵染菌丝穿透角质和表皮细胞壁(图 1)。

|
图 1 油茶炭疽病及果生刺盘孢菌 Fig.1 Oil tea anthracnose and C. fructicola A.病果;B.病叶;C.菌落正面;D.菌落背面;E.分生孢子萌发形成附着胞;F.附着胞萌发出侵染钉。 A. Diseased fruits; B. Diseased leaves; C. Colony above; D. Colony below; E. The germination of the conidia and formation of appresoria; F. Penetration pegs produced from appressoria. |
包括澄迈黄花梨(Dalbergia odorifer)(CMHHL)、澄迈檀香(Santalum album)(CMTX)、澄迈油茶(Camellia oleifera)(CMYC)、枫木鲫鱼胆(Maesa perlarius)(FMJYD)、枫木油茶(C. oleifera)(FMYC)、南圣葛根(Pueraria lobata)(NSGG)、南圣山麻杆(Alchornea davidii)(NSSMG)、南圣油茶(C. oleifera)(NSYC)、南圣蒲葵(Livistona chinensis)(NSPK)、通什山矾(Symplocos sumuntia)(TZSF)、通什油茶(C. oleifera)(TZYC)和通什银柴树(Aporosa chinensis)(TZYCS)共12个种群炭疽病叶样品。
1.2 试验方法 1.2.1 病原菌分离、鉴定病原菌分离方法参考方中达(1998)的组织分离法,从病健交界处组织进行分离,于马铃薯葡萄糖琼脂培养基(potato dextrose agar medium PDA)纯化培养后4 ℃冰箱保存备用。经回接试验、形态和多基因分子鉴定,确定为不同寄主植物果生刺盘孢菌共108个菌株。样品采集地、寄主分布、菌株分离数量等信息见表 2。
|
|
基因选择及目的片段扩增与测序参照Weir等(2012)的方法、反应体系及条件。对所有分离筛选获得的菌株,选择核糖体转录间隔区(internal transcribed spacers,ITS)、3-磷酸甘油醛脱氢酶基因(glyceralde-hyde-3-phosphate dehydrogenase,GAPDH)和钙调蛋白基因(calmodulin,CAL)进行扩增。PCR扩增引物和退火温度见表 1。
|
|
PCR产物分别用正反向引物进行双向测序,以保证测序的准确率。测序委托上海铂尚生物科技有限公司完成。
1.3 数据分析采用MEGA6.0 (Tamura et al., 2013)对DNA序列进行比对和编辑,同时辅以手工矫正。用MEGA6.0 (Tamura et al., 2013)软件统计ITS-CAL-GAPDH 3个基因序列按顺序拼接后的碱基组成、变异位点数等序列特征。使用GenALEx6(Peakall et al., 2006)分析各不同寄主种群果生刺盘孢菌种群的3个基因拼接序列的单倍型及多样性以及分子变异分析(analysis of molecular variance,AMOVA)(Excoffier et al., 1992)。用DnaSP 5.0软件(Librado et al., 2009)统计3个基因拼接序列的核苷酸多样性(nucleotide diversity,Pi)、种群间遗传分化指数(fixation index,FST)、最小重组事件以及对所有病菌种群序列的单倍型错配进行分析,并根据FST值计算基因流Nm值。根据3个基因拼接序列的单倍型频率和核苷酸差异,用TCS1.21软件(Clement et al., 2000)构建单倍型的网状亲缘关系图。菌株多基因系统发育树构建:将根据ITS-CAL-GAPDH 3个基因序列推导出来的18种单倍型序列与GenBank中炭疽属其他真菌菌株的ITS-CAL-GAPDH 3个基因序列,采用MEGA6.0 (Tamura et al., 2013)构建近邻归群(neighbor-joining,NJ)系统发育树,朱顶红炭疽菌(C.hippeastri)作为外群,在系统发育分析中,研究病菌与相近种进行比较时,来源于同一种群的单倍型是否会紧密地聚为一支。
2 结果与分析 2.1 果生刺盘孢菌单倍型分布及其多样性108个果生刺盘孢菌样品的采集地、ITS-CAL-GAPDH 3个基因拼接序列单倍型分布及其遗传多样性信息见表 2。3个基因拼接序列共1 367个碱基,变异位点17个,其中简约信息位点11个,单碱基突变位点6个;A+T的含量(45.5%)略低于C+G的含量(54.5%)。从病菌ITS-CAL-GAPDH 3个基因序列17个变异位点,共推导出18种单倍型(haplotype)。主要单倍型Haplotype11包含了绝大部分样品,共有70个样品,占总样品的64.8%, 4个采样地9种不同寄主植物的全部12个病菌种群中均含有该单倍型,这表明果生刺盘孢菌可以在同一个采样地内或不同采样地间的油茶与其他寄主植物之间无性扩散。
南圣油茶上的病菌样品含有的单倍型最多,共6种;枫木油茶上的病菌样品8株、澄迈檀香的病菌样品15株,均有5种单倍型。南圣山麻杆病菌样品5株,有2种单倍型;通什银柴树病菌样品8株,却只有1种单倍型。
澄迈林场、枫木林场、南圣镇和通什镇4个不同采样地的油茶果生刺盘孢菌种群,都有相同的单倍型Haplotype11,样品数量分别为5,4,7和3株;另外,南圣镇和通什镇油茶果生刺盘孢菌种群还同时含有单倍型Haplotype7,这说明海南岛不同地区的油茶果生刺盘孢菌种群之间存在有效的基因流。由表 2可知,这4个不同采样地的油茶果生刺盘孢菌种群同时也有各自的单倍型,分别有3,4,5和2种独特单倍型。
澄迈油茶果生刺盘孢菌10个菌株,共有4种单倍型,除了单倍型Haplotype11能在其他的所有种群中找到外,Haplotype13在同一样地的檀香以及另一块样地通什镇的山矾上均有发现;Haplotype5,Haplotype17是澄迈油茶果生刺盘孢菌特有单倍型。枫木油茶果生刺盘孢菌8个菌株,共有5种单倍型,除了单倍型Haplotype11在其他的所有种群中发现外,还有Haplotype6,Haplotype12均在澄迈檀香上出现,而Haplotype4,Haplotype15是枫木油茶果生刺盘孢菌特有单倍型。南圣油茶果生刺盘孢菌14个菌株,共有6种单倍型,除单倍型Haplotype11能在其他的所有种群中发现外,Haplotype14在同一样地的山麻杆和蒲葵上也有发现;Haplotype7在同一样地的葛根以及澄迈檀香、油茶和通什山矾、油茶上均有发现;Haplotype8在同一样地的葛根、蒲葵中也有发现;Haplotype9在同一样地的葛根以及澄迈的黄花梨上均有发现;Haplotype16是南圣油茶果生刺盘孢菌特有单倍型。通什油茶果生刺盘孢菌共分离到5个菌株,Haplotype11, Haplotype7在同一样地内以及不同样地、不同寄主植物间均有发现,而单倍型Haplotype10是通什油茶果生刺盘孢菌特有单倍型。此外,澄迈果生刺盘孢菌具有Haplotype3, Haplotype5, Haplotype18, Haplotype17 4种地理特有单倍型,枫木林场则有Haplotype1, Haplotype2, Haplotype15 3种地理特有单倍型,南圣镇含有Haplotype14,Haplotype8,Haplotype16 3种地理特有单倍型,通什镇则只有1种地理特有单倍型Haplotype10。
综合上述分析可知,4个采样地9种不同寄主植物12个果生刺盘孢菌种群之间不仅存在有效的基因流,造成不同种群含有相同的单倍型,又因各自自然地理异质性及不同寄主植物的选择压力,每个种群内存在独立进化,种群间呈现出一定程度的寄主专化性,形成独特的单倍型菌株。
果生刺盘孢菌每个种群,除通什银柴树病菌样品单倍型多样性为0外,其他种群的单倍型多样性在0.40~0.80之间,其中枫木鲫鱼胆和南圣葛根病菌样品的单倍型多样性最高,为0.80;南圣山麻杆病菌样品的单倍型多样性最小,也达到0.40;果生刺盘孢菌的ITS-CAL-GAPDH 3个基因拼接后核苷酸多态性(Pi)也处于较高的水平。结果表明,果生刺盘孢菌在海南地区具有丰富的遗传多样性。
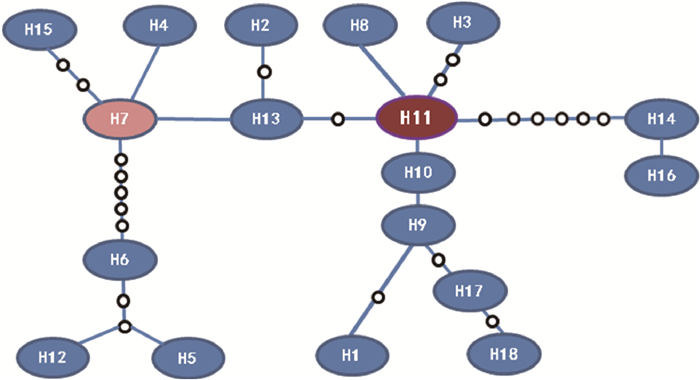
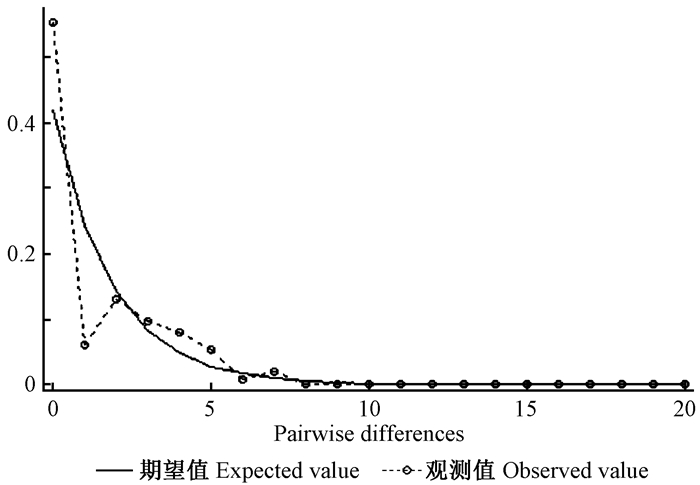
2.2 单倍型网络及种群扩张分析利用单倍型分析软件TCS绘制病菌ITS-CAL-GAPDH 3个基因拼接序列单倍型网络结构见图 2。病原菌各单倍体型并没有依采样地点和寄主植物的不同形成各自的分支,而是以单倍型Haplotype11为辐射中心,呈现比较典型星状发散图,Haplotype11可能是原始单倍型。另外,笔者还发现大部分单倍型以多步突变与原始单倍型Haplotype11相连,单倍型Haplotype7, Haplotype13和Haplotype9也逐步通过突变形成辐射亚中心,导致整个单倍型网络结构复杂,这表明样品采集地的果生刺盘孢菌种群未发生过种群扩张。另外,笔者对所有果生刺盘孢菌不同种群3基因连接序列的核苷酸不配对进行分析,分布呈双峰型曲线(图 3),也证明采样地油茶及其他寄主植物的果生刺盘孢菌种群未经历过种群扩张或“瓶颈效应”。
|
图 2 果生刺盘孢菌单倍型网络图 Fig.2 Parsimony network of the haplotypes of C.fructicola 各单倍型之间的连线表示一步变异,小空心圆代表未检测到的单倍型。 Each mutation is shown as a line between each two haplotypes. Small dots represent unsampled haplotypes. |
|
图 3 果生刺盘孢菌种群核苷酸不配对分布 Fig.3 Mismatch distribution of C. fructicola population |
108株果生刺盘孢菌ITS-CAL-GAPDH 3个基因拼接序列的分子变异(AMOVA)分析结果见表 3。果生刺盘孢菌种群变异主要发生在种群内,占总变异的97%,而种群间遗传差异非常小,只占总变异的3%;而且基因分化程度(PhiPT)仅为0.032(P=0.19),显示种群间遗传分化不明显。以上结果表明,采样同一地点内和不同地点间,相同或不同寄主植物来源的病菌种群间均存在较强的基因流。
|
|
种群遗传学研究认为,引起种群分化的主要原因是遗传漂变和自然选择的作用(曲若竹等,2004)。Wright(1931)认为种群间基因流大于1,则能发挥均值化作用,即能有效抑制由遗传漂变引起的遗传分化,当基因流Nm大于4时,种群间的基因交流就更为充分。本研究基于ITS-CAL-GAPDH 3个基因拼接序列计算出的12个病菌种群间的基因流及遗传分化值见表 4(对角线下方三角为Fst值,对角线上方三角为Nm值;Nm≈(1-Fst)/2 Fst,病菌种群间的Fst值为负,在Nm值中用∞代替,这说明这些种群间的基因流极强)。
|
|
同一地理群体内,澄迈病菌样品中,黄花梨与檀香和油茶以及檀香与油茶3种寄主植物病菌之间的基因流值为6.25, 8.591和∞,远大于1,说明澄迈不同的寄主植物间病菌存在很强的基因流;枫木林场病菌样品中,寄主植物油茶与鲫鱼胆病菌之间的基因流值为1.904,也大于1,说明在枫木林场不同寄主植物间病菌也存在较强的基因流;南圣镇样地中,葛根、山麻杆、蒲葵和油茶等4种寄主植物病菌种群之间的基因流值最小的是葛根和油茶病菌种群,为4.763,其他的均为∞,说明病菌在南圣镇样地不同的寄主植物间存在极强的基因流;通什样地中,山矾、银柴树和油茶3种寄主植物的病菌种群之间,Nm值最小为2.789,也大于1,说明通什样地内寄主植物的病菌也存在较强的基因流。
不同地理群体间,基因流最小的是通什银柴树和枫木鲫鱼胆病菌种群,Nm值为0.75(<1),基因流虽然不能有效抑制这2个病菌种群间的遗传分化,但也说明这2个病菌群体间也存在一定程度的基因流。除了这2个群体外,其他的4个不同采样地中的油茶病菌种群之间、油茶与其他寄主植物病菌种群之间以及其他寄主植物病菌种群之间,虽然地理距离相隔35 km以上,但病菌间的基因流Nm值均大于1,且大部分病菌种群间的Nm值远远大于1,说明病菌种群间都存在较大程度的基因流,而且大部分种群间的基因流极强。说明果生刺盘孢菌可以在不同地理区域以及不同的寄主植物之间扩散、传播。4个样地虽然存在一定的自然地理异质性,但并未对病菌的基因流造成障碍,基因流有效发挥了均值化作用,抑制不同地理区域、不同寄主植物间病菌因遗传漂变而发生遗传分化。
2.5 果生刺盘孢菌遗传重组基于ITS-CAL-GAPDH 3个基因拼接序列,采用基因多态性分析软件DnaSP v.5.10.01估算12个果生刺盘孢菌种群内以及油茶果生刺盘孢菌种群与其他寄主植物果生刺盘孢菌种群间的最小重组事件。12个种群中,只有澄迈檀香CMTX和枫木油茶FMYC 2个果生刺盘孢菌种群内有重组事件,Rm值均为1,其他10个种群内Rm值均为0,未检测到重组信号。为了解油茶与其他寄主植物上的果生刺盘孢菌种群间是否有重组事件,对种群内未检测到重组信号的种群两两组合作为一个种群进行遗传重组检测,结果见表 5。澄迈油茶病菌种群与南圣油茶、通什油茶、枫木鲫鱼胆、南圣葛根和通什山矾上的5个病菌种群间都检测到了重组事件,Rm值均为1;南圣油茶与枫木鲫鱼胆病菌种群间、通什油茶与枫木鲫鱼胆病菌种群间检测到了重组事件,Rm值均为1。此外,南圣葛根、通什山矾与枫木鲫鱼胆种群间也检测到了重组事件。油茶种群之间以及油茶与鲫鱼胆、葛根和山矾等植物种群之间的果生刺盘孢菌存在一定程度的遗传重组,这可能是海南省油茶及其他植物果生刺盘孢菌遗传多样性丰富的重要原因之一。
|
|
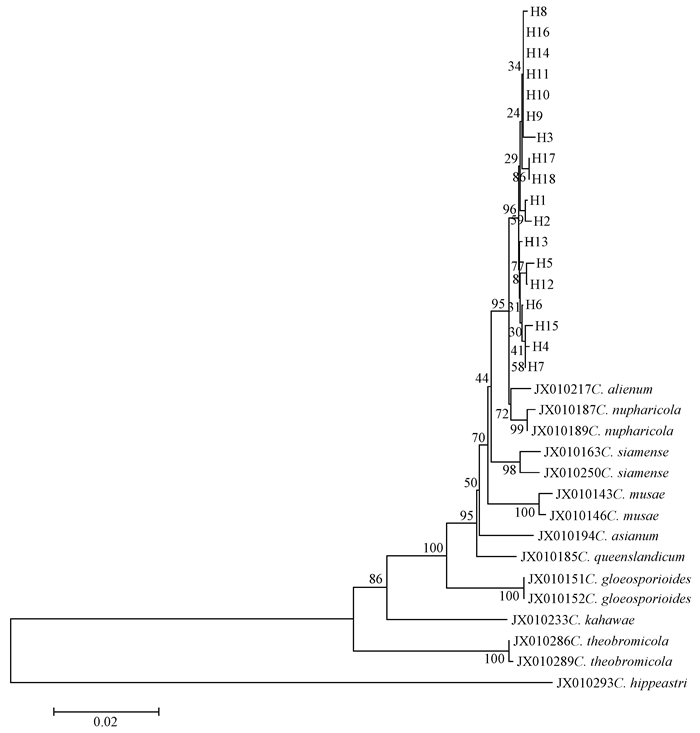
从GenBank数据库中下载刺盘孢属10个种15条ITS-CAL-GAPDH 3个基因拼接序列与从108个菌株的ITS-CAL-GAPDH 3个基因拼接序列推导出的果生刺盘孢菌18种不同单倍型序列(H1~H18)构建系统发育树(图 4)。结果表明,在系统树中没有发现同一个种群的单倍型聚在一起,而是散乱地分布在系统树中;部分地理种群虽然各自具有独特的单倍型,但各单倍型的差异不大。
|
图 4 基于ITS-CAL-GAPDH序列的N-J系统树 Fig.4 Neighbour-joining tree of ITS-CAL-GAPDH sequences |
油茶炭疽病菌的主要越冬场所为病芽(痕)和病枝。病芽痕和枯花苞起源于病花芽,导致病顶枝的形成,这是主要侵染来源。病叶芽是枝、叶发病的主因。因此,炭疽病菌初次侵染源主要是植株上部组织,地面残落病部和土壤带菌量少,侵染能力有限(陈守常等,1965)。王义勋等(2013)认为油茶炭疽病菌主要是以菌丝的形态在花托和幼果内潜伏越冬,成为初侵染源。目前尚无其他寄主植物炭疽病菌侵染油茶或油茶与其他植物炭疽病菌之间存在基因流的研究报道。前期通过分离、鉴定海南省4个油茶林中不同寄主植物的炭疽病菌种类,从油茶、葛根、黄花梨等海南当地13种植物上,共分离获得135株炭疽病菌,其中C.fructicola85株、C.siamense45株,C.gloeosporioides3株,C.cliviae和C.camelliae各1株;4个采样地的油茶树与当地其他寄主植物具有相同的炭疽病菌C.fructicola和C.siamense,这两种菌占总分离炭疽菌的96%;通过致病性测定,不同寄主来源的5种炭疽菌均能引起油茶炭疽病(李河等,2016)。这说明海南省油茶炭疽病原组成复杂以及病菌潜在寄主植物种类多样。
为从分子水平证明不同寄主植物间的炭疽病菌存在基因流,本研究对不同地点、不同寄主植物的炭疽病最主要的病菌果生刺盘孢菌C.fructicola的ITS-CAL-GAPDH 3个基因拼接序列进行群体遗传结构分析。结果发现,12个病菌种群内均有单倍型Haplotype11,为优势单倍型。另外,12个种群间基因流最小的是通什银柴树和枫木鲫鱼胆病菌种群(Nm=0.75),而其他病菌种群间的基因流Nm值均大于1,甚至大于4,表明12个病菌种群间都存在较大程度的基因流,而且大部分种群间的基因流极大。综合上述结果可知,果生刺盘孢菌各种群间的基因流并未受到地理距离或不同寄主的影响,表明该病菌具有在不同寄主植物间以及长距离传递基因流的能力,病菌在不同地区、不同植物间的无性扩散方式导致每个种群中存在相同的基因型,且克隆生长有利于毒性更强的优势基因型在种群内维持,导致更严重的病害发生。
病原菌基因重组不但可以通过现存基因随机结合产生新的基因型,而且还可以通过基因内部的DNA序列重排产生新的等位基因。此外,基因重组还可以通过降低背景选择和搭便车(hitchhiking)对连锁基因的影响而增加病原物群体内的遗传多样性和减少群体遗传分化的水平(祝雯等,2012)。Souza等(2010)采用RAPD分子标记研究发现重组在C.lindemuthianum的遗传变异中起着重要作用。Souza等(2003)研究发现炭疽属真菌C.sublineolum具有准性生殖,从而导致自然界中该菌丰富的遗传变异及众多生理小种的出现。Maisa等(2014)发现在巴西圣保罗地区6个脐橙(Citrus sinensis)的炭疽菌C.acutatum种群中发现基因重组,推测可能是准性生殖或一种其他的有性生殖方式。国内关于植物病原菌的重组报道较少。杨涛等(2000)发现灰霉菌(Botrytis cinrea)准性生殖过程的存在。在本研究中,澄迈油茶病菌种群与南圣油茶、通什油茶、枫木鲫鱼胆、南圣葛根和通什山矾上的病菌种群存在重组现象;南圣油茶与枫木鲫鱼胆病菌种群间、通什油茶与枫木鲫鱼胆病菌种群存在重组现象;南圣葛根、通什山矾与枫木鲫鱼胆种群存在重组现象,这些寄主植物病菌形成了自己独特的单倍型,表现出丰富的单倍型多样性和核苷酸多样性,说明该病菌对环境变化的适应能力强,容易扩展其地理分布和寄主范围,这可能是造成海南省油茶炭疽病害发生严重的重要原因之一。病原菌丰富的遗传多样性容易导致病害的发生,造成严重的经济损失。病原物种遗传多样性的高低与其进化潜力、环境的适应能力及选择压力紧密相关,而较高的遗传多样性对于物种在环境胁迫的情况下生存繁衍有着重要的意义。基因流在植物病原物的群体遗传和进化生物学上发挥诸多作用,类似突变、基因流是种群遗传多样性的重要来源(祝雯等,2012)。通过基因流,病原群体可从相邻的种群中引入新的等位基因或基因重组,增加当地群体的遗传多样性。
果生刺盘孢菌最早在泰国的咖啡浆果(Coffea arabica)上发现(Prihastutiet al.,2009),随后在日本的砂梨(Pyrus serotina)、以色列的补血草(Limonium sinense)、美国的葡萄(Vitis vinifera)和草莓(Fragaria ananassa)以及德国的榕属(Ficus)植物上相继发现,而在中美洲发现该菌是作为内生菌存在植物体内(Weir et al., 2012);在我国的贵州省和云南省也发现该菌,其寄主包括辣椒(Capsicum annuum)、花生(Arachis hypogaea)、番茄(Solanum lycopersicum)、灰莉(Fagraea ceilanica)、冬青(Ilex chinensis)、葡萄(Vitis vinifera)和茶树(Camellia sinensis)(Peng et al., 2013;刘威等,2014)。笔者首次发现果生刺盘孢菌能侵染油茶树,并且该菌地理分布广,在我国主要油茶产区均有分布(李河等,2014)。
本研究结果表明,海南省油茶及当地其他植物的果生刺盘孢菌种群间存在广泛的基因交流,这为制定海南省油茶炭疽病防治方案,如清除油茶林内共享相同病原的杂草、灌木等寄主植物,避免病原间存在基因交流的树种与油茶混栽等具体处理方法提供依据。另外,本研究只从病原菌的群体遗传结构层面分析了海南岛不同地区油茶和其他寄主植物果生刺盘孢菌的遗传多样性及不同种群之间存在高频率的基因流、种群内存在独特的单倍型菌株,该病菌对环境变化的适应能力和生活力强,可能是造成炭疽病害发生严重的重要原因。海南岛是相对小而封闭的生态系统,系统内不同群体的果生刺盘孢菌相互融合较容易,需要进一步在全国范围内研究油茶炭疽病菌及潜在寄主植物种类,从分子水平阐明不同地理区域的油茶及其他寄主植物炭疽病菌是否存在基因流、是否普遍存在基因重组或杂交以及是否存在遗传分化和寄主专化性现象。研究结果将为整体考虑我国油茶及其他寄主植物制定可持续控制油茶炭疽病策略提供重要的理论依据。
4 结论海南地区果生刺盘孢菌单倍型Haplotype11在每个种群中均有分布,为优势单倍型,说明该病菌主要以无性扩散为主。在不同地区间和不同寄主间扩散的无性繁殖方式导致每个群体中存在相同的基因型,且无性繁殖有利于优势基因型在种群内维持。揭示该病菌具有在油茶树及其他寄主植物之间以及不同地区之间传递基因流的能力,说明油茶炭疽病的侵染源丰富。
海南省油茶树与当地其他寄主植物炭疽病菌果生刺盘孢菌之间存在基因重组,并且遗传分化现象明显,具有丰富的遗传多样性,表明该病菌对环境变化的适应能力和生活力强,是造成油茶炭疽病害发生面积广、为害严重的重要因素之一。
| [] |
柏云爱, 宋大海, 张富强, 等. 2008. 油茶籽油与橄榄油营养价值的比较. 中国油脂 , 33 (3) : 39–41.
( Bo Y A, Song D H, Zhang F Q, et al.2008. The comparison of nutritional value between tea seed oil and palm oil. China Oils and Fats , 33 (3) : 39–41. [in Chinese] ) |
| [] |
陈守常, 田泽君, 郭隆錫. 1965. 油茶炭疽病的发生与蔓延. 植物保护学报 , 4 (3) : 207–218.
( Chen S C, Tian Z J, Guo L X.1965. Development and spread of the anthracnose of Camellia oleifera (Lour. ) rehd.Acta Phytophylacica Sinica , 4 (3) : 207–218. [in Chinese] ) |
| [] |
陈守常, 田泽君, 陈大昌. 1964. 油茶炭疽病菌有性世代的形态特征、出现频率、致病力及其产生条件. 植物病理学报 , 3 (1) : 45–52.
( Chen S C, Tian Z J, Chen D C.1964. Studies on the perithecial stage of the anthracnose fungus on Camellia oleifera (Lour. ) rehd. Acta Phytopathologica Sinica , 3 (1) : 45–52. [in Chinese] ) |
| [] |
方中达. 1998. 植病研究法 : 122–145.
( Fang Z D.1998. Methods in plant pathology : 122–145. [in Chinese] ) |
| [] |
黄翠莉, 吴苏喜, 刘瑞兴, 等. 2011. 油茶籽油对大鼠降血脂和预防脂肪肝的影响. 食品科学 , 32 (13) : 332–335.
( Huang C L, Wu S X, Liu R X, et al.2011. Blood lipid-lowering and fatty liver-preventing effects of tea seed (Camellia oleifera Abel. ) oil in rats. Food Science , 32 (13) : 332–335. [in Chinese] ) |
| [] |
梁子超, 岑炳沾, 戴品初. 1964. 油茶炭疽病菌的有性世代、越冬方式和侵入途径. 植物保护学报 , 3 (3) : 316–317.
( Liang Z C, Chen B Z, Dai P C.1964. Studies on anthracnose of Camellia oleifera (Lour. ) rehd.I. The perfect stage, mode of over wintering and ingress of the pathogen. Acta Phytophylacica Sinica , 3 (3) : 316–317. [in Chinese] ) |
| [] |
刘威, 叶乃兴, 陈玉森, 等. 2014. 茶树炭疽菌Colletotrichum fructicola的鉴定及系统发育分析. 茶叶科学 , 34 (1) : 95–104.
( Liu W, Ye N X, Chen Y S, et al.2014. Identification and phylogenetic analysis of anthracnose pathogen Colletotrichum fructicola Isolated from Camellia sinensis. Journal of Tea Science , 34 (1) : 95–104. [in Chinese] ) |
| [] |
李河, 周国英, 徐建平, 等. 2014. 一种油茶新炭疽病原的多基因系统发育分析鉴定. 植物保护学报 , 41 (5) : 602–607.
( Li H, Zhou G Y, Xu J P, et al.2014. Pathogen identification of a new anthracnose of Camellia oleifera in China based on multiple-gene phylogeny. Acta Phytophylacica Sinica , 41 (5) : 602–607. [in Chinese] ) |
| [] |
李河, 李杨, 蒋仕强, 等. 2016. 海南省不同寄主植物炭疽病菌侵染油茶研究. 植物保护 , 42 (4) : 64–70.
( Li H, Li Y, Jiang S Q, et al.2016. The initial inoculums source of oil tea anthracnose in Hainan Province. Plant Protection , 42 (4) : 64–70. [in Chinese] ) |
| [] |
龙正海, 王道平. 2008. 油茶籽油与橄榄油化学成分研究. 中国粮油学报 , 23 (2) : 121–123.
( Long Z H, Wang D P.2008. Chemical constituents of olive oil and from Camellia oleifera seed oil. Journal of the Chinese Cereals and Oils Association , 23 (2) : 121–123. [in Chinese] ) |
| [] |
曲若竹, 侯林, 吕红丽, 等. 2004. 群体遗传结构中的基因流. 遗传 , 26 (3) : 377–382.
( Qu R Z, Hou L, Lü H L, et al.2004. The gene flow of population genetic structure. Hereditas , 26 (3) : 377–382. [in Chinese] ) |
| [] |
汤富彬, 沈丹玉, 刘毅华, 等. 2013. 油茶籽油和橄榄油中主要化学成分分析. 中国粮油学报 , 28 (7) : 108–113.
( Tang F B, Shen D Y, Liu Y H, et al.2013. Analysis of main chemical components in Camellia oil and Olive oil. Journal of the Chinese Cereals and Oils Association , 28 (7) : 108–113. [in Chinese] ) |
| [] |
王义勋, 刘伟, 陈京元, 等. 2013. 油茶炭疽病菌潜伏越冬场所、菌态及菌量研究. 湖北林业科技 , 1 : 32–33.
( Wang Y X, Liu W, Chen J Y, et al.2013. Overwintering sites, various stages and amount of Colletotrichum gloeosporioides on Camellia oleifera. Hubei Forestry Science and Technology , 1 : 32–33. [in Chinese] ) |
| [] |
杨涛, 关天舒, 白金铠. 2000. 灰霉菌准性生殖现象及其生物学意义. 辽宁农业科学 , 6 : 24–26.
( Yang T, Guan T S, Bai J K, et al.2000. The parasexuality of Botrytis cinerea and its biological significance. Liaoning Agricultural Sciences , 6 : 24–26. [in Chinese] ) |
| [] | 杨友联.2010.中国贵州、云南、广西炭疽菌属真菌多基因分子系统学研究.武汉:华中农业大学博士学位论文. |
| [] |
袁嗣令, 张能唐, 翁月霞, 等. 1963. 油茶炭疽病的研究. 植物保护学报 , 2 (3) : 253–262.
( Yuan S L, Zhang N T, Weng Y X, et al.1963. The anthracnose disease of Camellia oleosa (Lour. ) rehd. Acta Phytophylacica Sinica , 2 (3) : 253–262. [in Chinese] ) |
| [] |
郑道君, 潘孝忠, 谢良商, 等. 2015. 海南省油茶产业发展现状调查与分析. 经济林研究 , 33 (1) : 131–135.
( Zheng DJ, Pan XZ, Xie LS, et al.2015. Investigation and analysis of Camellia oleifera industry development status in Hainan Province. Nonwood Forest Research , 33 (1) : 131–135. [in Chinese] ) |
| [] |
祝雯, 詹家绥. 2012. 植物病原物的群体遗传学. 遗传 , 34 (2) : 157–166.
( Zhu W, Zhan J S.2012. Population genetics of plant pathogens. Hereditas , 34 (2) : 157–166. [in Chinese] ) |
| [] | Clement M, Posada D, Crandall K A.2000. TCS:a computer program to estimate gene genealogies. Molecular Ecology , 9 (10) : 1657–1659. DOI:10.1046/j.1365-294x.2000.01020.x |
| [] | Excoffier L, Smouse P E, Quattro J M.1992. Analysis of molecular variance inferred from metric distances among DNA haplotypes:application to human mitochondrial DNA restriction data. Genetics , 131 (2) : 479–491. |
| [] | Librado P, Rozas J.2009. DnaSP v5:A software for comprehensive analysis of DNA polymorphism data. Bioinformatics , 25 (11) : 1451–1452. DOI:10.1093/bioinformatics/btp187 |
| [] | Li H, Zhou G Y, Liu J A, et al.2016. Population genetic analyses of the fungal pathogen Colletotrichum fructicola on tea-oil trees in China. PLoS ONE , 11 (6) : 1–24. |
| [] | Maisa C G, Cristina B A, Pereira S.2014. Recent Introduction and Recombination in Colletotrichum acutatum populations associated with Citrus postbloom fruit drop epidemics in São Paulo, Brazil. Population Biology , 104 (7) : 769–778. |
| [] | Peakall R, Smouse P E.2006. GENALEX 6:genetic analysis in excel. Population genetic software for teaching and research. Molecular Ecology Notes , 6 (1) : 288–295. |
| [] | Prihastuti H, Cai L, Chen H, Hyde K D.2009. Characterization of Colletotrichum species associated with coffee berries in northern Thailand. Fungal Diversity , 39 : 89–109. |
| [] | Peng L J, Sun T, Yang Y L, et al.2013. Colletotrichum species on grape in Guizhou and Yunnan provinces, China. Mycoscience , 54 (1) : 29–41. DOI:10.1016/j.myc.2012.07.006 |
| [] | Souza E A, Jr C, Pinto J M A.2010. Sexual recombination in Colletotrichum lindemuthianum occurs on a fine scale. Genet Mol Res , 9 (3) : 1759–1769. DOI:10.4238/vol9-3gmr863 |
| [] | Souza E A, Fávaro L C, Casela C R.2003. Genetic tecombination in Colletotrichum sublineolum. Phytopathology , 151 (6) : 329–334. DOI:10.1046/j.1439-0434.2003.00727.x |
| [] | Tamura K, Stecher G, Peterson D, et al.2013. MEGA6:molecular evolutionary genetics analysis version 6. 0. Molecular Biology and Evolution , 30 (12) : 2725–2729. DOI:10.1093/molbev/mst197 |
| [] | Wright S.1931. Evolution in mendelian populations. Genetics , 16 (2) : 97–159. |
| [] | Weir B S, Johnston P R, Damm U.2012. The Colletotrichum gloeosporioides species complex. Studies in mycology , 73 (1) : 115–180. |
 2016, Vol. 52
2016, Vol. 52

