文章信息
- 宋跃, 甄成, 张含国, 李淑娟
- Song Yue, Zhen Cheng, Zhang Hanguo, Li Shujuan
- 长白落叶松胚性愈伤组织诱导及体细胞胚胎发生
- Embryogenic Callus Induction and Somatic Embryogenesis from Immature Zygotic Embryos of Larix olgensis
- 林业科学, 2016, 52(10): 45-54
- Scientia Silvae Sinicae, 2016, 52(10): 45-54.
- DOI: 10.11707/j.1001-7488.20161006
-
文章历史
- 收稿日期:2015-11-13
- 修回日期:2016-01-10
-
作者相关文章
落叶松属(Larix)包括18个种,是广布于北极圈两侧、温带和寒温带山区的重要针叶用材树种,其早期速生、容易成林、适应性强、轮伐期短,材质符合多种用途并且在某些方面超过松类(Pinus),尤其在高寒地区是营造短周期工业用材林不可替代的树种(杨书文等,1994)。随着世界性林木资源的紧缺,落叶松的遗传改良也倍受重视,其人工林面积日益扩大。据统计,落叶松林木的蓄积量在东北地区占针叶林总蓄积量的39.4%,占黑龙江省用材林蓄积量的23.6%,其中大兴安岭林区占用材林总蓄积量的67%(王伟达,2008)。但落叶松生长周期长、有性生殖产生的子代变异较大,致使其许多优良性状都难以维持(王伟达等,2009),传统的育种方法无法完全满足落叶松快速遗传改良的迫切需求,致使落叶松良种使用的比率和发展速度受到限制。
体细胞胚胎发生具有数量多、繁殖快、结构完整、植株再生率高以及不受季节影响等特点,被认为是一种可实现落叶松良种大规模繁殖利用的方法。自Klimaszewska(1989)以杂种落叶松(Larix×eurolepis;L.×leptoeuropaea)的子叶前期合子胚为外植体,在含2, 4-D 2.0 mg·L-1及6-BA 0.5 mg·L-1的培养基上诱导出胚性愈伤组织,并进一步在添加ABA 0.1 mg·L-1及KT 0.2 mg·L-1的MSG培养基上获得成熟体细胞胚以来,落叶松属植物的体细胞胚胎发生相关研究迅猛发展。欧洲落叶松(Larix decidua)(Von Aderkas et al., 1990)、北美落叶松(L. laricina)(Klimaszewska et al., 1997)、美国西部落叶松(L. occidentalis)(Thompson et al., 1992)、日本落叶松(L. kaempferi)(Von Aderkas et al., 1990;吕守芳等,2005;汪小雄等,2010)、华北落叶松(L. principis-rupprechtii)(齐力旺,2000)及杂种落叶松(Klimaszewska,1989;Lelu et al., 1994a;王伟达等,2009)等多种落叶松均已建立起体胚发生体系并获得再生植株。几个体胚发生技术较为成熟的种,如欧洲落叶松、日本落叶松及华北落叶松等,在此基础上已经开展了原生质体(Klimaszewska,1989;Korlach et al., 1995;Fukumoto et al., 2005)、超低温保存(Klimaszewska et al., 1992)及基因转化(Huang et al., 1991;Klimaszewska et al., 1997;Levée et al., 1997;朱彩虹等,2013)等多方面的研究,并从细胞水平(Von Aderkas et al., 2015)到分子水平进行了全面的探索(Zhang et al., 2012;2013;Zhao et al., 2014;Teyssier et al., 2014)。
然而,广泛分布于我国东北地区的长白落叶松(L. olgensis)的体细胞胚胎发生国内外尚无详细报道。长白落叶松的繁育存在种子质量差,结实大小年现象明显,扦插繁殖生根较难、生根率受家系(基因型)等因素的影响(杨书文等,1991;刘足根等,2007)等困难,限制了其良种的大规模使用。为此,本研究以长白落叶松的未成熟合子胚为外植体,进行胚性愈伤组织的诱导、增殖培养及体细胞胚胎发生的相关研究。试图揭示影响长白落叶松胚性愈伤组织诱导的关键因素,并探讨继代培养过程中添加不同种类、浓度的生长调节剂对胚性愈伤组织增殖及体胚发生的影响,为长白落叶松的良种繁育及进一步进行遗传转化奠定基础。
1 材料与方法 1.1 试验材料采种母树为选自黑龙江省林口县境内的青山种子园3个长白落叶松家系的优良单株(即3个基因型),分别是:长73-22、长73-37及长73-50。供试材料分别于2014年6月27日(约散粉后63天)、7月3日(约散粉后70天)、7月13日(约散粉后80天)及7月15日(约散粉后82天)采集。采下的大孢子叶球立即用塑料密封袋密封,随后放入冷冻冰盒内保存,材料运输至实验室后储藏于4 ℃冰箱内备用。
1.2 试验方法 1.2.1 未成熟胚的形态学观察剥离大孢子叶球的种鳞,选择饱满的未成熟种子剥除外皮,用镊子将胚从胚乳中挑出,显微镜下观察幼胚的发育状态。
1.2.2 外植体的消毒与接种选择饱满、发育良好的种子剥去种皮。超净工作台内,去皮种子先经无菌的去离子水漂洗3次,转入75%的乙醇浸泡1 min;再经无菌水漂洗3次,3%的NaClO溶液浸泡10 min;最后再经3次无菌水漂洗,接种备用。
接种前,外植体表面水分用无菌滤纸吸干。接种的方法有2种:1)纵向划破胚乳至胚,不将种胚单独挑出而直接接种于培养基中;2)纵向划破胚乳至胚,挑其种胚,但不使胚与胚乳完全分离,将胚与胚乳一同接入培养基中(宋跃等,2016)。2种方法处理的胚乳切口均向下朝向培养基。前2次(即6月27日及7月3日)采集的材料,其合子胚多处于原胚期或子叶前期,透明而幼嫩,因不易挑出而采用第1种方法进行接种;第3及第4次(即7月13日及15日)采集的材料多为子叶期胚,相对易于与胚乳分离,故选用第2种方法接种。
1.2.3 胚性愈伤组织的诱导处理好的未成熟胚分别接种于含有2, 4-D 0.5~2.0 mg·L-1、6-BA 0.5 mg·L-1、KT 0.5 mg·L-1、谷氨酰胺1.0 g·L-1、酸水解酪蛋白0.5 g·L-1、琼脂(凝胶强度 > 1 060 g·cm-2)5.8 g·L-1、蔗糖25 g·L-1,pH值为6.0±0.02的BM、MS及S培养基(表 1)上,(25±1) ℃暗培养,每个培养皿接种10个外植体,设3次重复,并分别进行标记。接种后定期观察培养物的变化,4~8周后进行胚性愈伤组织诱导率的统计。
|
|
诱导出的胚性愈伤组织先在原诱导培养基中继代1次(培养21天),第2~4次则分别继代于生长调节剂浓度降低为原诱导培养基1/2,1/5,1/10的培养基中(培养14天左右),此后则长期连续继代于表 2所列的4种增殖培养基中,(25±1) ℃下进行暗培养,继代周期为15天。
|
|
挑取3团约0.15 g (称量)生长旺盛的愈伤组织接种于增殖培养基中进行培养,每3天称1次鲜质量并观察愈伤组织的生长状态,直至愈伤组织生长进入衰退期(培养81天),各处理均重复3次。称质量时,先小心将愈伤组织与培养基分离,然后转入无菌培养皿(称量前去皮)进行鲜质量的称量,记录数据后再将胚性愈伤组织接回原处继续培养。上述操作均在超净台内进行,确保培养物不被污染。绘制生长曲线,确定最佳继代周期。
1.2.5 体细胞胚胎的发生与植株再生挑取不同增殖培养基中长势较好的胚性愈伤组织,转接于不含植物生长调节剂的1/4BM培养基上培养14天,再转接到含有ABA 20 mg·L-1、PEG400080 g·L-1、AgNO35.0 mg·L-1、谷氨酰胺0.5 g·L-1、酸水解酪蛋白0.25 g·L-1、琼脂(凝胶强度 > 1 060 g·cm-2)5.8 g·L-1、蔗糖60 g·L-1,pH值为6.0±0.02的BM培养基上,(25±1) ℃下暗培养,各处理均设3次重复,每次重复接种3团约0.2 g(称量)的愈伤组织。
在含有ABA的培养基中培养7周后,各处理均选取3~5个发育正常的子叶胚,放置在含有蔗糖20 g·L-1、琼脂4.0 g·L-1、VB1 3.0 mg·L-1、AC 2.0 g·L-1的WPM培养基中进行萌发,重复3次。光照时间为每天16 h,光照强度约为50 μmol·m-2s-1。7天后统计体胚萌发率,8周后统计植株再生率。
1.2.6 再生植株的移栽在WPM培养基中培养8周后,将体细胞胚胎萌发形成的带根幼苗从培养瓶中取出,小心去除根上附着的培养基,移栽至含有蛭石及草炭土(质量比1:2)的花土中。保持较高的相对湿度,培养室温度维持在(23±1) ℃,光照时间为每天16 h,光照强度约为35 μmol·m-2s-1。移栽后的第5周进行成活率的统计。
1.3 数据的统计分析胚性愈伤组织诱导率(%)=诱导出胚性愈伤组织的未成熟合子胚数/接种的未成熟合子胚数×100%;胚性愈伤组织的增殖率(%)=(增殖后胚性愈伤组织的鲜质量-接种前愈伤组织的鲜质量)/接种前愈伤组织的鲜质量×100%;每克胚性愈伤组织的体细胞胚胎发生数=体细胞胚胎的发生数/体胚诱导前胚性愈伤组织的鲜质量;体细胞胚胎的萌发率(%)=萌发的体胚数/接种的体胚数×100%;植株再生率(%)=生根的体胚数/接种的体胚数×100%;移栽成活率(%)=移栽成活的植株数/移栽的植株数×100%。文中数据均采用PASW Statistics 18软件进行方差分析,Duncan法进行多重比较。
2 结果与分析 2.1 长白落叶松胚性愈伤组织的诱导散粉后63~70天采集的幼胚大多处于子叶前期,接种时胚与胚乳未完全分离。接种4周内多数外植体无明显变化,仅有少数胚乳形成一端凸起、质地较硬的白色愈伤组织或膨大而松软的黄色愈伤组织,这2种愈伤组织均不能稳定地增殖且均为非胚性愈伤组织。接种6周左右,部分外植体胚乳的切口处有无色透明、似晶体且表面有丝状凸起物的愈伤组织伸出,这种愈伤组织通过镜检可以观察到ESM结构(图 1B),表明该种愈伤组织有继续分化形成体胚的潜能,可认为是胚性愈伤组织(图 1A)。

|
图 1 长白落叶松胚性愈伤组织诱导及体细胞胚胎发生 Fig.1 Embryogenic callus induction and somatic embryogenesis of L. olgensis A.胚性愈伤组织;B.胚性胚柄细胞团(ESM)结构;C.胚性愈伤组织褐化;D.胚性愈伤组织的不定芽发生;E.体胚发生;F.体胚萌发;G.植株再生;H.植株移栽。 A. Embryogenic callus; B. Embryonal suspensor masses; C. Embryogenic callus browning; D. Embryogenic callus organogenesis; E. Somatic embryogenesis; F. Somatic embryo germination; G. Plant regeneration; H. Plant transplanting. |
散粉后80~82天采集的胚发育相对成熟,接种时胚乳与胚是相对分离的。接种后7天左右,部分合子胚的顶端即有愈伤组织形成,这些愈伤组织多为白色、黄色或黄绿色,表面松软而内部质地较硬,镜检未见胚性细胞或胚性胚柄细胞团结构,且细胞排列松散呈典型的非胚性愈伤组织特征。伴随着顶部的变化,绝大部分胚胎的下胚轴也会形成一种透明或白色半透明的愈伤组织,这种愈伤组织经数次连续继代会逐渐转变成不透明、表面带有粉状凸起的愈伤组织或褐化死亡,且镜检时也未发现胚性细胞,也不能产生体细胞胚,是一种极易与胚性愈伤组织混淆的非胚性愈伤组织(宋跃等,2016)。
2.1.1 外植体采集时间对胚性愈伤组织诱导的影响不同时间采集的未成熟合子胚的胚性愈伤组织诱导率存在差别(表 3)。在授粉后63~82天内,合子胚的胚性愈伤组织诱导率表现出先升高后降低的趋势。其中,授粉后70天采集的合子胚诱导率最高,可达22.35%;其次为授粉后63天采集的合子胚,诱导率为5.61%;而授粉80天后采集的合子胚则未能诱导出胚性愈伤组织。
|
|
方差分析表明,未成熟合子胚的采集时间对长白落叶松胚性愈伤组织诱导率的影响显著(P=0.000)。这一研究结果暗示,长白落叶松未成熟合子胚的胚性愈伤组织诱导存在一个窗口期,而散粉后70天左右的胚可能最适合于进行胚性愈伤组织的诱导。
2.1.2 家系对胚性愈伤组织诱导的影响由表 4可知,本试验中的3个家系合子胚的胚性愈伤组织诱导能力由高到低为:长77-37 > 长77-22 > 长73-50。其中,长77-37与长73-50的诱导率相差近4倍,说明不同家系(基因型)的外植体诱导胚性愈伤组织的能力存在一定的差异。
|
|
培养基中添加不同浓度的2, 4-D对长白落叶松胚性愈伤组织的诱导存在一定的影响(表 5)。在一定范围内胚性愈伤组织的诱导率会随培养基中添加的2, 4-D浓度升高而升高,当其浓度为1.5 mg·L-1时诱导率最高,为11.11%;而当2, 4-D的浓度超过1.5 mg·L-1时,胚性愈伤组织的诱导率则开始下降。这表明,培养基中添加过低或过高浓度的2, 4-D均不利于长白落叶松胚性愈伤组织的诱导。
|
|
本试验应用的3种基本培养基上均有胚性愈伤组织产生,但诱导率却存在一定的差异(表 6)。其中,BM培养基的诱导率最高,获得的胚性愈伤组织最多;S培养基的诱导率次之;MS培养基的诱导率最低,仅有2.79%。这说明,BM及S培养基相对更适合于长白落叶松未成熟合子胚的胚性愈伤组织诱导。
|
|
刚诱导出的胚性愈伤组织的状态极不稳定,在最初的几次继代培养过程中会向不同的状态发展。其中,绝大部分的愈伤组织会丧失胚性,进而转变成非胚性愈伤组织;还有部分胚性愈伤组织由于内部细胞凋亡而逐渐褐化并变得粘稠(图 1C);仅有极少的胚性愈伤组织能够保持胚性并不断增殖,最终形成能够稳定继代的胚性系;此外,还有2个增殖缓慢的细胞系在继代过程中通过器官发生形成了不定芽(图 1D),但并未获得生根植株。
根据4种增殖培养基中愈伤组织鲜质量变化的测量结果,绘制生长曲线(图 2)。统计并观察发现,同一胚性系在4种添加不同种类、浓度生长调节剂的增殖培养基上继代的最佳周期较为接近,均在15~18天的范围内(表 7);胚性愈伤组织长期在高浓度生长调节剂的刺激下易丧失胚性,且添加过高或过低浓度的生长调节剂均不利于愈伤组织的增殖;而在增殖培养基中用NAA代替2, 4-D在一定程度上能增加愈伤组织的增殖速率。
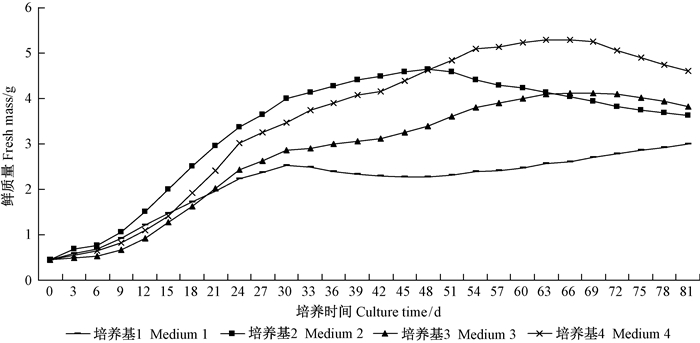
|
图 2 4种增殖培养基中长白落叶松胚性愈伤组织的生长曲线 Fig.2 Proliferative curve of embryogenic callus of L. olgensis in four proliferation media |
|
|
体胚发生前将增殖15天产生的胚性愈伤组织转入不含生长调节剂的1/4BM培养基进行过渡培养,使其组织表面变得干燥,丝状凸起增粗,可以明显改善体胚发生的同步性。过渡培养后的胚性愈伤组织转入含有ABA的体胚成熟培养基,约7~10天即可以观察到原胚发育,愈伤组织的表面形成米色、质地较硬的短棒状凸起;此后的数天内原胚不断地生长分化,芽端子叶开始形成,但体胚根端的柄状结构仍未消失;接种后25天左右,体细胞胚胎的形态基本发育成熟(图 1E)。
将体胚与胚性愈伤组织分离,转接到萌发培养基上,约3天后可观察到体胚萌发,子叶伸展并转变为翠绿色;随后体胚的下胚轴伸长,根端呈现出红色并伸出粉红色的根尖(图 1F);约20天后伴随苗端的生长,根部扎入基质内部并分化形成侧根,完成植株再生(图 1G)过程。
对体胚发生的结果(表 8)进行分析发现,胚性愈伤组织增殖培养基中添加不同种类、浓度的植物生长调节剂会对愈伤组织的体胚发生量(P=0.005)产生极显著影响,而对体胚萌发(P=0.104)及植株再生(P=0.178)的影响不显著。在胚性愈伤组织的继代增殖阶段,添加高浓度的生长调节剂有利于体细胞胚的发生和体胚萌发,而在增殖培养基中用NAA替代2, 4-D也能提高体胚的萌发率。
|
|
由于体胚苗的光合作用及根系吸收水分及矿质元素的能力都较差,所以在移栽后的一段时间内需要对其进行特殊管理,保证相对湿度维持在较高的水平,并注意适当通风,必要时还需用稀释的MS母液(无机盐)配合一定浓度的GA3喷施体胚苗。约4周后,幼苗顶芽重新生长(图 1H),即可认为移栽成活。本试验共移栽48株幼苗,其中13株成活,成活率为27.08%。
3 讨论 3.1 外植体与胚性愈伤组织诱导选择适合的外植体对胚性愈伤组织的诱导至关重要。本试验选取的3个家系均能诱导出胚性愈伤组织。虽然方差分析显示,家系(基因型)的选择对长白落叶松胚性愈伤组织诱导的影响并不显著(P=0.210),但各家系胚性愈伤组织的诱导率在一定水平上仍存在差异。有研究表明:胚性愈伤组织的诱导受到材料基因型的影响。齐力旺(2000)在研究华北落叶松体胚发生时发现,相同时间采集的2株母树的未成熟胚胚性愈伤组织诱导率并不相同。Klimaszewska等(2001)以北美乔松(Pinus strobus)多个基因型的未成熟胚为外植体进行诱导时也发现,不同基因型间胚性愈伤组织的诱导率存在极显著的差异,且外植体的基因型与采集时间及培养基的交互效应均对胚性愈伤组织的诱导具有显著的影响。此外,包括火炬松(Pinus taeda)(Becwar et al., 1990)、云杉(Picea asperata)(张建伟等,2014)、海岸松(Pinus pinaster)(Lelu et al., 1999)以及杂种落叶松(L.×eurolepis;L.×leptoeuropaea)(Lelu et al., 1994b)在内的多种针叶树也均有其胚性愈伤组织诱导受亲本基因型影响的报导。因此,基于这一现象,可以通过筛选并利用易诱导胚性愈伤组织的家系(基因型)的外植体进行诱导,以获得更多的胚性系。此外,对不同类型或同一类型处于不同发育阶段的外植体的选择也会直接影响诱导的结果。吕守芳等(2005)以日本落叶松为研究对象,发现在未成熟胚、成熟胚、胚根及胚轴等外植体中,仅有未成熟胚能够诱导出胚性愈伤组织。赵晓敏等(2007)对兴安落叶松(L. gmelinii)不同发育时期的合子胚进行诱导,得出子叶初期的合子胚诱导胚性愈伤组织的能力最强的结论。本试验4次采集的材料中,仅有处于子叶前期的合子胚(即授粉后63~70天采集的材料)能够诱导出胚性愈伤组织,与前人的研究结果(Kilmaszewska,1989;Thompson et al., 1992;Lelu et al., 1994b)相一致。
3.2 培养条件与胚性愈伤组织诱导胚性愈伤组织的诱导还与培养基含有的成分有关(崔凯荣等,2000)。用于落叶松胚性愈伤组织诱导的基本培养基主要有LM、LP、MS、DCR以及S等(Klimaszewska,1989;Yong et al., 1998;齐力旺,2000;吕守芳等,2005),这些培养基的不同主要在于供外植体生长代谢所需的无机盐含量不同。汪小雄等(2010)在研究中发现,DCR培养基诱导日本落叶松胚性愈伤组织的频率比MS高,并认为这可能与二者间大量元素中氮元素(包括NH4+和NO3-)的含量有关。Yong等(1998)也发现不同培养基中,日本落叶松胚性物的诱导频率存在差别。本试验所用的3种基本培养基均能诱导出胚性愈伤组织,诱导率分别为BM(8.99%) > S(7.39%) > MS(2.79%),刚好与3种培养基中氮含量的排序相反[MS(61.04 mmol·L-1) > S(32.51 mmol·L-1) > BM(12.76 mmol·L-1)],印证了前人的结果。除无机盐外,生长调节剂也会影响胚性愈伤组织的诱导。许多研究结果表明,内源IAA在胚性愈伤组织诱导过程中起着关键的作用,其含量升高或维持较高水平是胚性细胞出现的一个重要标志。而在培养基中添加2, 4-D可以改变细胞内源IAA的代谢,促使体细胞向胚性细胞的转变(崔凯荣等,2000)。有研究认为,2,4-D是落叶松胚性感受态表达的重要条件,胚性状态的表达是以2, 4-D的存在为前提的(齐力旺,2000);通过采用311-A最优回归设计对华北落叶松胚性愈伤组织诱导培养基中生长调节剂的种类、浓度优化筛选,结果表明2, 4-D对华北落叶松胚性愈伤组织的诱导作用明显,当2, 4-D的浓度高于或低于1.29 mg·L-1时均不利于胚性愈伤组织的诱导(齐力旺等,2001)。对本试验的结果进行方差分析表明,2, 4-D浓度对长白落叶松胚性愈伤组织诱导的影响不显著(P=0.623)。但观察试验结果仍可发现,胚性愈伤组织的诱导率随2, 4-D浓度的增加呈现先升高后降低的趋势。说明长白落叶松对2, 4-D的响应存在个体差异,但优化诱导培养基中2, 4-D的浓度可以在一定水平上提高胚性愈伤组织的诱导率。
3.3 胚性愈伤组织的继代增殖与体胚成熟、萌发胚性愈伤组织的继代增殖与更新是落叶松体细胞胚胎发生的一个重要环节。在培养介质中添加不同浓度或种类的生长调节剂诱导形态发生已受到广泛的重视(崔凯荣等,2000)。由于植物组织或细胞在离体条件下往往缺乏合成生长素与细胞分裂素的能力,所以为了促进细胞生长、分裂和分化,在针叶树体细胞胚胎发生的早期通常同时添加生长素(主要是2, 4-D)和细胞分裂素(如6-BA,KT)。但处于不同发育阶段的植物细胞对激素的敏感性不同,所以有必要在胚性愈伤组织增殖的过程中对生长调节剂的浓度进行调节(郭奕鸣等,2003)。有研究表明,长期继代在含有高浓度2, 4-D的培养基中的胚性愈伤组织虽然能够形成大量的早期原胚,但原胚的发育会受到抑制,导致体细胞胚成熟能力的丧失,引起体胚的质量下降(齐力旺,2000)。通常认为高浓度的2, 4-D可促使DNA甲基化增加,从而引起基因表达活性的降低(崔凯荣等,2000),影响发育相关蛋白及细胞内贮藏蛋白的含量(Tautorus et al., 1991),最终导致原胚发育失败。同时,高浓度的2, 4-D还会引起杂种落叶松胚性愈伤组织的增殖速度降低,继代过程中用低浓度的NAA代替2, 4-D更利于华北落叶松早期原胚的发育,并可以明显降低多重胚与畸形胚的比例,改善成熟胚的质量,提高体胚的生根比率及植株转化率,而不添加生长素则会引起胚性愈伤组织的死亡(齐力旺等,2004;王伟达等,2008)。本试验的结果表明:长白落叶松胚性愈伤组织在含2, 4-D 0.3 mg·L-1、6-BA 0.1 mg·L-1及KT 0.1 mg·L-1的BM培养基上增殖15天可获得相对较多的胚性愈伤组织,增殖率为345.93%;在含2, 4-D 1.5 mg·L-1、6-BA 0.5 mg·L-1及KT 0.5 mg·L-1的BM培养基上培养14天,再经诱导可获得较多的体细胞胚胎,平均为每克179.87个。分析认为,继代时高浓度的2, 4-D可以刺激愈伤组织产生大量的原胚,而经过渡培养时去除2, 4-D,DNA去甲基化,蛋白质大量合成,供体胚成熟所需,所以经2, 4-D 1.5 mg·L-1增殖的愈伤组织最终形成较多的子叶胚。
4 结论对于长白落叶松而言,散粉后70天的合子胚适合诱导胚性愈伤组织,基本培养基为BM,添加2, 4-D 1.5 mg·L-1,且不同家系间的诱导率存在一定水平的差异。此外,长白落叶松胚性愈伤组织在含高浓度生长调节剂(2, 4-D 1.5 mg·L-1,BA 0.5 mg·L-1,KT 0.5 mg·L-1)的培养基中不易保持胚性,且增殖速度慢,但体胚的发生量及体胚的萌发率最优;适当的降低浓度(2, 4-D 0.3 mg·L-1,BA 0.1 mg·L-1,KT 0.1 mg·L-1),愈伤组织的胚性可长期保持,增殖速率提高,但体胚的发生量及体胚的萌发率有所下降;当浓度极低时(2, 4-D 0.15 mg·L-1,BA 0.05 mg·L-1,KT 0.05 mg·L-1)愈伤组织的增长速度降低,但愈伤组织的胚性仍能长期保持;而用0.5 mg·L-1的NAA代替0.15 mg·L-1的2, 4-D则利于胚性愈伤组织的增殖,并能在一定水平上提高体胚的萌发率。因此,根据不同阶段的培养目的,可选择添加不同种类和浓度生长调节剂的增殖培养基进行继代培养。
本研究以长白落叶松未成熟合子胚为外植体成功地诱导出胚性愈伤组织,并通过愈伤组织的增殖、体细胞胚胎成熟及萌发等步骤获得再生植株,且移栽成活,为研究落叶松胚胎发育提供了试验材料及体系,也为长白落叶松的良种繁育提供了一种可行的方法,为进一步开展长白落叶松的遗传改良研究及转基因育种奠定了基础。
| [] |
崔凯荣, 戴若兰. 2000. 植物体细胞胚胎发生的分子生物学. 北京: 科学出版社 .
( Cui K R, Dai R L. 2000. Molecular biology of plant somatic embryogenesis. Beijing: Science Press . [in Chinese] ) |
| [] |
郭奕明, 杨映根, 郭毅, 等. 2003. 落叶松体细胞的胚胎发生. 植物生理学报 , 39 (5) : 531–535.
( Guo Y M, Yang Y G, Guo Y, et al.2003. Somatic embryogenesis of larch. Plant Physiology Communications , 39 (5) : 531–535. [in Chinese] ) |
| [] |
刘足根, 朱教君, 袁小兰, 等. 2007. 辽东地区长白落叶松(Larix olgensis)种子雨和种子库. 生态学报 , 27 (2) : 579–587.
( Liu Z G, Zhu J J, Yuan X L, et al.2007. On seed rain and soil seed bank of Larix olgensis in montane regions of eastern Liaoning Province, China. Acta Ecologica Sinica , 27 (2) : 579–587. [in Chinese] ) |
| [] |
吕守芳, 张守攻, 齐力旺, 等. 2005. 日本落叶松体细胞胚胎发生的研究. 林业科学 , 41 (2) : 48–52.
( Lü S F, Zhang S G, Qi L W, et al.2005. Somatic embryogenesis from immature embryos of Larix kaempferi. Scientia Silvae Sinicae , 41 (2) : 48–52. [in Chinese] ) |
| [] |
齐力旺.2000.华北落叶松体细胞胚胎发生与遗传转化系统建立的研究.北京:中国林业科学研究院博士学位论文. ( Qi L W.2000.Studies on the somatic embryogenesis and establishment of experimental system in Larix principis-rupprechtii.Beijing:PhD thesis of Chinese Academy of Forestry.[in Chinese][in Chinese]) |
| [] |
齐力旺, 李玲, 韩一凡, 等. 2001. 落叶松胚性愈伤组织诱导培养基中激素的311-A最优回归设计筛选. 林业科学研究 , 14 (3) : 251–257.
( Qi L W, Li L, Han Y F, et al.2001. Study on induction embryogenic callus of Larix principis-rupprechtii by 311-A regression design. Forest Research , 14 (3) : 251–257. [in Chinese] ) |
| [] |
齐力旺, 韩一凡, 韩素英, 等. 2004. 麦芽糖、NAA及ABA对华北落叶松体细胞胚成熟及生根的影响. 林业科学 , 40 (1) : 52–57.
( Qi L W, Han Y F, Han S Y, et al.2004. Effects of maltose, NAA and ABA on somatic maturation and radicle rooting of Larix principis-rupprechtii. Scientia Silvae Sinicae , 40 (1) : 52–57. [in Chinese] ) |
| [] |
宋跃, 张含国, 李淑娟, 等. 2016. 落叶松胚性愈伤组织诱导与未成熟胚形态的关系. 东北林业大学学报 , 44 (4) : 25–30.
( Song Y, Zhang H G, Li S J, et al.2016. Relationship between the induction of embryogenic callus of larch and the morphology of immature embryos. Journal of Northeast Forestry University , 44 (4) : 25–30. [in Chinese] ) |
| [] |
王伟达.2008.落叶松体细胞胚形成与不定芽诱导的研究.哈尔滨:东北林业大学硕士学位论文. ( Wang W D.2008.Study of embryogenesis and induction of adventitious buds in larch.Harbin:MS thesis of Northeast Forestry University.[in Chinese][in Chinese]) http://www.cnki.com.cn/article/cjfdtotal-lyke200908009.htm |
| [] |
王伟达, 李成浩, 杨静莉, 等. 2008. 不同植物生长调节物质对杂种落叶松胚性愈伤组织增殖的影响. 东北林业大学学报 , 36 (9) : 5–7.
( Wang W D, Li C H, Yang J L, et al.2008. Effect of different plant growth regulators on embryogenic callus proliferation of hybrid Larix. Journal of Northeast Forestry University , 36 (9) : 5–7. [in Chinese] ) |
| [] |
王伟达, 李成浩, 杨静莉, 等. 2009. 杂种落叶松未成熟胚的体细胞胚胎发生和植株再生. 林业科学 , 45 (8) : 34–38.
( Wang W D, Li C H, Yang J L, et al.2009. Somatic embryogenesis and plantlet regeneration from immature zygotic embryos of hybrid larch. Scientia Silvae Sinicae , 45 (8) : 34–38. [in Chinese] ) |
| [] |
汪小雄, 杨映根. 2010. 日本落叶松体细胞胚胎发生的研究. 安徽农业科学 , 38 (4) : 2118–2121.
( Wang X X, Yang Y G.2010. Study on the somatic embryogenesis of Larix leptolepis. Journal of Anhui Agricultural Sciences , 38 (4) : 2118–2121. [in Chinese] ) |
| [] |
杨书文, 邵顺流, 张培杲, 等. 1991. 长白落叶松扦插繁殖技术的研究. 东北林业大学学报 , 19 (S2) : 1–8.
( Yang S W, Shao S L, Zhang P G, et al.1991. Study on the cutting propagation technique of Larix olgensis. Journal of Northeast Forestry University , 19 (S2) : 1–8. [in Chinese] ) |
| [] |
杨书文, 王秋玉, 夏德安. 1994. 落叶松的遗传改良. 哈尔滨: 东北林业大学出版社 .
( Yang S W, Wang Q Y, Xia D A. 1994. Genetic improvement of larch. Harbin: Northeast Forestry University Press . [in Chinese] ) |
| [] |
张建伟, 王军辉, 李青粉, 等. 2014. 云杉未成熟合子胚诱导体细胞胚发生. 林业科学 , 50 (4) : 39–46.
( Zhang J W, Wang J H, Li Q F, et al.2014. Somatic embryogenesis of Picea asperata induced from immature embryos. Scientia Silvae Sinicae , 50 (4) : 39–46. [in Chinese] ) |
| [] |
赵晓敏, 沈海龙, 杨玲, 等. 2007. 兴安落叶松胚性愈伤组织诱导影响因子的研究. 植物研究 , 27 (5) : 538–543.
( Zhao X M, Shen H L, Yang L, et al.2007. Factors affecting induction of embryogenic callus of Larix gmelinii. Bulletin of Botanical Research , 27 (5) : 538–543. [in Chinese] ) |
| [] |
朱彩虹, 李水根, 齐力旺, 等. 2013. 农杆菌介导的日本落叶松胚性细胞遗传转化研究. 中国生物工程杂志 , 33 (5) : 75–80.
( Zhu C H, Li S G, Qi L W, et al.2013. Agrobacterium tumefaciens-mediated transformation of Larix leptolepis embryogenic tissue. China Biotechnology , 33 (5) : 75–80. [in Chinese] ) |
| [] | Becwar M R, Nagmani R, Wann S R.1990. Initiation of embryogenic cultures and somatic embryo development in Loblolly pine (Pinus taeda). Canadian Journal of Forest Research , 20 (6) : 810–817. DOI:10.1139/x90-107 |
| [] | Fukumoto T, Hayashi N, Sasamoto H.2005. Atomic force microscopy and laser confocal scanning microscopy analysis of callose fibers developed from protoplasts of embryogenic cells of a conifer. Planta , 223 (1) : 40–45. DOI:10.1007/s00425-005-0065-3 |
| [] | Huang Y, Diner A M, Karnosky D F.1991. Agrobacterium rhizogenes-mediated genetic transformation and regeneration of a conifer:Larix decidua. In Vitro Cellular and Developmental Biology-Plant , 27 (4) : 201–207. DOI:10.1007/BF02632217 |
| [] | Klimaszewska K.1989. Plantlet development from immature zygotic embryos of hybrid larch through somatic embryogenesis. Plant Science , 63 (89) : 95–103. |
| [] | Klimaszewska K, Ward C, Heliak W M.1992. Cryopreservation and plant regeneration from embryogenic cultures of larch (Larix×eurolepis) and black spruce (Picea mariana). Journal of Experimental Botany , 43 (246) : 73–79. |
| [] | Klimaszewska K, Devantier Y, Lachance D, et al.1997. Larix laricina(Tamarack)somatic embryogenesis and genetic transformation. Canadian Journal of Forest Research , 27 (4) : 538–550. |
| [] | Klimaszewska K, Park Y S, Overton C, et al.2001. Optimized somatic embryogenesis in Pinus strobus L. In Vitro Cellular & Developmental Biology-Plant , 37 (3) : 392–399. |
| [] | Korlach J, Zoglauer K.1995. Developmental patterns during direct somatic embryogenesis in protoplast cultures of European larch (Larix decidua Mill. ).Plant Cell Reports , 15 (3) : 242–247. |
| [] | Lelu M A, Bastien C, Klimaszewska K, et al.1994a. An improved method for somatic plantlet production in hybrid larch (Larix×leptoeuropaea):Part 1. Somatic embryo maturation.Plant Cell Tissue and Organ Culture , 36 (1) : 107–115. DOI:10.1007/BF00048321 |
| [] | Lelu M A, Klimaszewska K, Charest P J.1994b. Somatic embryogenesis from immature and mature zygotic embryos and from cotyledons and needles of somatic plantlets of Larix. Canadian Journal of Forest Research , 24 (1) : 100–106. DOI:10.1139/x94-015 |
| [] | Lelu M A, Bastien C, Drugeault A, et al.1999. Somatic embryogenesis and plantlet development in Pinus sylvestris and Pinus pinaster on medium with and without growth regulators. Physiologia Plantarum , 105 (4) : 719–728. DOI:10.1034/j.1399-3054.1999.105417.x |
| [] | Levée V, Lelu M A, Jouanin L, et al.1997. Agrobacterium tumefaciens-mediated transformation of hybrid larch (Larix kaempferi×L. decidua) and transgenic plant regeneration.Plant Cell Reports , 16 (10) : 680–685. |
| [] | Tautorus T E, Fowke L C, Dunstan D I.1991. Somatic embryogenesis in conifers. Canadian Journal of Botany , 69 (9) : 1873–1899. DOI:10.1139/b91-237 |
| [] | Teyssier C, Maury S, Beaufour M, et al.2014. In search of markers for somatic embryo maturation in hybrid larch (Larix×eurolepis):global DNA methylation and proteomic analyses. Physiologia Plantarum , 150 (2) : 271–291. DOI:10.1111/ppl.2014.150.issue-2 |
| [] | Thompson R G, Von Aderkas P.1992. Somatic embryogenesis and plant regeneration from immature embryos of western larch. Plant Cell Reports , 11 (8) : 379–385. DOI:10.1007/BF00234365 |
| [] | Von Aderkas P, Klimaszewska K, Bonga J M.1990. Haploid and diplod embryogenesis in Larix leptolepis, L. decidua and their reciprocal hybrids.Canadian Journal of Forest Research , 20 (1) : 9–14. |
| [] | Von Aderkas P, Teyssier C, Charpentier J P, et al.2015. Effect of light conditions on anatomical and biochemical aspects of somatic and zygotic embryos of hybrid larch (Larix×marschlinsii). Annals of Botany , 115 (4) : 605–615. DOI:10.1093/aob/mcu254 |
| [] | Yong W K, Yang Y, Noh E R, et al.1998. Somatic embryogenesis and plant regeneration from immature zygotic embryos of Japanese larch(Larix leptolepis). Plant Cell Tissue and Organ Culture , 55 (2) : 95–101. DOI:10.1023/A:1006120302512 |
| [] | Zhang Y, Zhang S G, Han S Y, et al.2012. Transcriptome profiling and in silico analysis of somatic embryos in Japanese larch (Larix leptolepis). Plant Cell Reports , 31 (9) : 1637–1657. DOI:10.1007/s00299-012-1277-1 |
| [] | Zhang L F, Li W F, Han S Y, et al.2013. cDNA cloning, genomic organization and expression analysis during somatic embryogenesis of the translationally controlled tumor protein (TCTP) gene from Japanese larch (Larix leptolepis). Gene , 529 (1) : 150–158. DOI:10.1016/j.gene.2013.07.076 |
| [] | Zhao J, Wang B, Wang X, et al.2014. iTRAQ-based comparative proteomic analysis of embryogenic and non-embryogenic tissues of Prince Rupprecht's larch (Larix principis-rupprechtii Mayr). Plant Cell Tissue and Organ Culture , 120 (2) : 655–669. |
 2016, Vol. 52
2016, Vol. 52

