文章信息
- 何辉, 楼雄珍, 林二培, 俞友明, 童再康, 黄华宏
- He hui, Lou Xiongzhen, Lin Erpei, Yu Youming, Tong Zaikang, Huang Huahong
- 光皮桦应拉木的显微特征及其形成早期内源激素分布
- Xylem Characteristics of Tension Wood and Endogenous Hormones Distributions during Its Early Formation Period in Betula luminifera
- 林业科学, 2016, 52(10): 38-44
- Scientia Silvae Sinicae, 2016, 52(10): 38-44.
- DOI: 10.11707/j.1001-7488.20161005
-
文章历史
- 收稿日期:2015-09-18
- 修回日期:2015-12-25
-
作者相关文章
应力木(react wood)包括针叶材上的应压木(compression wood, CW)和阔叶材上的应拉木(tension wood, TW),是指在外力作用下形成的弯曲树干或树枝试图恢复到原来位置,而形成的解剖和物理性质明显不同的木材。应力木大量出现在人工林中,尤其是速生树种,制约了优质人工林的培育和木材的高效利用。目前对杨树(Populus)、桉树(Eucalyptus)等树种应拉木的显微特征和物理化学特性已有详细研究,并提出内源激素重新分布、生长应力变化等解释应拉木形成的学说(Jourez et al., 2001; Toghraie et al., 2006; 刘亚梅等,2012)。其中“激素分布学说”最具影响力,认为倾斜树干由于受到重力的作用,使得其内源激素在上下2个部位的分布不均衡,进而引起树干上方细胞分裂速度加快,生长轮变宽,细胞结构特化,即形成应拉木。同时,由于具备特殊的材质,应拉木已是研究阔叶树木材形成机制的模式系统之一。有研究利用杂交杨(P. tremula × P. tremuloides)、蓝桉(E. globulus)的应拉木系统,结合基因芯片技术,鉴定系列木材形成相关的基因(Andersson-Gunnerås et al., 2006; Paux et al., 2005)。
光皮桦(Betula luminifera)为桦木科(Corylaceae)桦木属落叶乔木,主要分布在秦岭、淮河流域以南的河南、四川、湖南、浙江、福建等14个省区,其不仅相对速生,且材质优良,出材率高,加工性能好,已被多省列为优先推广的珍贵树种之一。光皮桦的一部分种质具有早开花的特性,自然条件1.5年生幼苗就能开花结实,这在高大乔木树种中极为少见,可作林木遗传研究的理想材料。近年来,光皮桦人工林发展十分迅速,也存在多种形式的应拉木表型,但尚未有其特征及成因的研究报道。本文以光皮桦无性系为材料,通过人为拉弯诱导形成应拉木,进行解剖结构观测以及微纤丝角、纤维素和木质素含量的测定;并对其形成早期主要内源激素的分布特征进行分析,以期为揭示应拉木形成机制提供理论依据。
1 材料与方法 1.1 试验材料试验材料为光皮桦1年生嫁接无性系1Ⅴ25-2,栽植在浙江农林大学试验苗圃。2010年6月15日选择生长相对一致的植株(1 m高处直径为1.0 cm左右)进行人工拉弯处理,使1.0~1.5 m高度的树干成45°(与竖直方向的夹角),且皆向西弯曲。在处理6 h,48 h,7天和12个月时,分别取应拉区和对应区的木质部,并根据相应横截面切片的苯胺番红、苯胺固绿FCF双重染色结果(图 1)取应拉木(tension wood, TW)和对应木(opposite wood, OW)作为后续分析材料,同时取直立植株相同高度的木质部为对照。每次取样5株。

|
图 1 光皮桦应拉木诱导处理及取样 Fig.1 Inducible treatment and sampling of tension wood in B. luminifera A.拉弯试验,方框内示意取样部位,上部为应拉区,下部为对应区。B.拉弯处理12个月主干的横截面切片,经苯胺番红、苯胺固绿FCF双重染色,TW,OW分别为应拉木、对应木。标尺:0.5 cm。 A. Tension experiment of B. luminifera. Bent tree with harvesting zone (open box). Tension region on upper side; opposite region on lower side. B. Transverse section of B. luminifera stem after 12 months of bent treatment, and were double-stained with Safranin O-Fast green FCF. Tension wood (TW) and opposite wood (OW) were labeled. Scale bars: 0.5 cm. |
细胞壁结构观测:将对照和处理12个月的木质部样品切成1 cm长的木段,在沸水煮至木材充分软化,趁热用Leica RM2235转轮式切片机制作成10 μm和1000 μm的薄片。其中,1 000 μm的薄片经系列酒精脱水后,临界点干燥,并镀金,最后在扫描电镜下观测和拍照。而10 μm的薄片采用苯胺番红、苯胺固绿双重染色(李和平,2009),用加拿大树胶封片后,在Leica正置生物显微镜(DM LB2)下观测和拍照。根据木质素在紫外光激发下产生蓝色自发荧光的特点,参照Selig等(2012)的报道,应用Leica荧光显微镜(DM4000)对未染色的10 μm的切片直接观测和拍照。
纤维特征观测:木材纤维形态的观测采用富兰克林离析法(Donaldson, 1992;Donaldson et al., 2012)。在Leica正置生物显微镜(DM LB2)下直接观测纤维的长度、宽度和腔径,并计算双壁厚。
1.2.2 微纤丝角测定测定样品为对照和处理12个月的TW和OW样品。将样品制成2.0 cm×0.6 cm×0.1 cm的小样片,用X-射线衍射仪XRD-6000(岛津,日本)进行连续扫描,扫描范围为5.0~40.0°,步宽为0.2°,扫描速度为2.0°·min-1,管电压为40 kV,管电流为30 mA,样品台旋转速度为30 r·min-1。获得样品的衍射数据用0.6T法从衍射强度曲线上求微纤丝角(阮锡根等,1993)。
1.2.3 纤维素和木质素含量测定纤维素含量测定采用硫酸蒽酮法(Wang et al., 2007)。木质素按Klason木质素法测定(Kirk et al., 1988)。
1.2.4 内源激素含量的酶联免疫分析主要测定吲哚乙酸(IAA)、赤霉素(GAs; GA1+GA3)、玉米素核苷(ZR)和油菜素内脂(BR)等4种内源激素含量,样品为拉弯处理6 h、48 h和7天的应拉木、对应木和直立木(对照)木质部。采用中国农业大学作物化学控制实验室制备的试剂盒,(Yang et al., 2001),每样本重复测定8次。
1.3 数据分析所有样品测定数据的平均值、标准差和多重比较等由SAS8.0分析软件分析。
2 结果与分析 2.1 应拉木和对应木的显微特征图 2为光皮桦主干被拉弯处理12个月时的木质部解剖结构图。对应木、直立木(对照)纤维细胞腔(L)的大小相似,而应拉木则明显缩小(图 2A)。3种木质部表现出类似的荧光强度变化,即导管相比纤维细胞壁要强;而在纤维细胞壁上荧光最强的是细胞角隅区,其次是胞间层(ML)和次生壁(SW)。应拉木纤维细胞增厚次生壁的自动荧光相对黯淡,表明其木质化程度低。相比对应木和对照,应拉木的细胞壁已明显增厚(图 2B)。经番红-固绿的双重染色,对应木、对照纤维次生壁呈现紫红色,应拉木纤维次生壁则为蓝绿色,与Ruelle等(2007)和Jiang等(2009)对利蒂风子(Laetia procera)、水曲柳(Fraxinus mandshurica)应拉木的观测结果相似,表明应拉木次生壁此时已出现胶质纤维层(gelatinous layer)。由表 1可知,不同木质部样品的纤维特征也存在一定差异。应拉木平均纤维长度大于对应木、对照样品的相应数值,其中应拉木与对应木间的差异达极显著水平,说明拉弯处理会导致对应区木质部短纤维增多。对于平均纤维宽度值,对照样品显著大于应拉木,而在应拉木与对应木间无显著差异。应拉木的平均双壁厚度表现最大,分别是对应木的1.8倍,和对照样品的1.5倍,这也进一步说明应拉木细胞壁发生了增厚现象。

|
图 2 光皮桦应拉木的解剖特征 Fig.2 Anatomy characteristics of tension wood in B. luminifera A.木质部横切面的自发荧光图。标尺:50.0 μm。a:应拉木;b:对应木;c:对照。B.木质部横切面的扫描电镜图,标尺:5.0 μm。a:应拉木,b:对应木;c:对照。C.苯胺番红、苯胺固绿FCF双重染色的木质部横切面,木质化壁能被番红染成红色,高纤维素含量的G层则被固绿染成蓝绿色,a:应拉木;b:对应木;c:对照。V:导管;F:纤维;RP:射线薄壁细胞;ML:胞间层;CC:细胞角隅;L:纤维细胞腔;SW:次生细胞壁标尺:100.0 μm。G为胶质层;S1,S2为次生壁层。 A. Autofluorescence image of xylem cross-section. Scale bars: 50.0 μm. a: Tension wood (TW); b: Opposite wood (OW); c: Control. B.The scanning electron microscopy images of xylem cross-section. Scale bars: 5.0 μm. a: TW; b: OW; c: Control. C. Sections were double-stained with Safranin-Fast green FCF, lignified walls stain red with Safranin O, whereas Fast-green colors the pure cellulosic. a: TW; b: OW; c: control. V: Vessel; F: Fibre; RP: Ray parenchyma; ML: Middle lamella; CC: Cell corner; L: Lumen; SW: Secondary cell wall. G-layer in bluey green. G: Gelatinous layer; S1, S2: Layers of the secondary cell wall.Scale bars: 100.0 μm. |
微纤丝角是细胞壁中纤维素链的螺旋卷索与纤维轴之间的夹角(Walke et al., 1996),是木材机械性能的主要决定因子。试验中X-射线衍射分析发现,应拉木微纤丝角最小,且与对应木和对照样品的差异均达到极显著水平(P < 0.01);而对应木与对照样品间的差异相对较小,未达极显著水平,说明经拉弯处理形成的应拉木抗张强度要比对应木大。另外,拉弯处理对木质部中纤维素和酸不溶木质素含量也有一定影响。应拉木纤维素含量表现最高,为54.4%,显著大于对应木和对照样品中的含量,这也间接表明次生壁的增厚部分主要由纤维素组成。3种不同木质部样品中酸不溶木质素的变化趋势与纤维素相反,应拉木表现最低,且与对应木和对照样品的差异均达到极显著水平(P < 0.01)(表 1)。
|
|
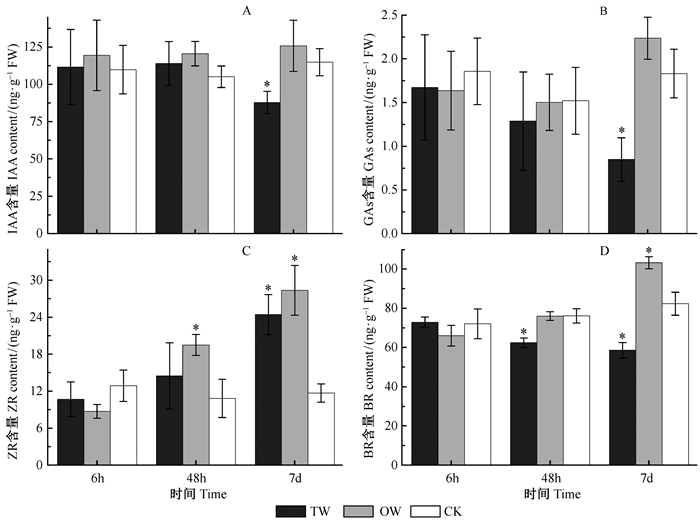
图 3为不同拉弯时间应拉区、对应区木质部和对照主要内源激素分布的差异。IAA是应拉木形成中研究最早和最多的激素,被认为对阔叶材树种应拉木的形成有抑制作用(Kennedy et al., 1965; Leach et al., 1967; Robnett et al., 1973)。由图 3A可知,拉弯处理7天时应拉区木质部IAA含量显著小于对应区木质部(P=0.037)和对照样品(P=0.035),而拉弯处理6和48 h相应的应拉区、对应区木质部及对照间的差异均不明显。单从数值大小看,3个处理时间应拉区木质部IAA含量皆小于对应区木质部。GA对木材的形成和发育也具重要作用。试验中应拉木、对应木及对照GAs(GA1+GA3)的分布规律与IAA基本相同,仅拉弯处理7天时应拉木GAs(GA1+GA3)含量显著小于对应木(P=0.006 9)和对照(P=0.018)。另外,随着处理时间延长应拉区木质部GAs(GA1+GA3)含量呈现下降趋势(图 3B)。细胞分裂素被认为只有与生长素或赤霉素共同作用才能对木材形成起作用(崔克明,1991)。试验中测得3个处理时间应拉区和对应区木质部ZR的含量均无明显差异,但2区块木质部ZR含量均表现出随处理时间延长而增加的趋势(图 3C),拉弯处理7天时相应含量均显著大于对照样品(P=0.032和0.019)。BR是植物中发现较晚的一种激素,早期的研究认为它能促进木质部细胞的分化(宋东亮等,2010)。经测定除拉弯处理6 h的样品外,应拉区木质部BR含量均显著小于对应区(P 48h=0.028,P 7d=0.003 9)和对照(P 48h=0.032,P 7d=0.020)的相应数值,尤其是拉弯处理7天的应拉区与对应区木质部间相差近1倍。同时,随着处理时间延长,对应区木质部BR含量呈现递增趋势,而应拉区木质部则表现相反(图 3D)。
|
图 3 不同处理时间应拉木、对应木和直立木主要内源激素的含量 Fig.3 The content of main endogenous hormones from TW, OW and the control at different treatment times *表示与对照比差异达5%显著水平。* indicate significant difference at 5%, compared with the control. |
次生壁中出现胶质纤维层是阔叶材种应拉木的一个重要解剖特征。然而,并不是所有阔叶材种的应拉木都具有明显的胶质纤维层,据调查日本的346种阔叶树种中有137种未发现胶质纤维层(Yamaguchi et al., 1983;Pilate et al., 2004)。本试验中光皮桦经12个月的拉弯处理(与竖直方向成45°),应拉区木质部的细胞壁明显增厚,纤维平均双壁厚是对应木的1.8倍,且该层结构主要被固绿染色,证实了胶质纤维层的形成,这与欧美杨(P. euramericana)、蓝桉(E. globulus)、冈尼桉(E. gunnii)等树种类似处理得到的结果一致(Jourez et al., 2001; Paux et al., 2005; Toghraie et al., 2006)。纤维长度是决定木材纤维品质的重要指标,然而过去有关应拉木与对应木纤维长度差异的研究结果并不一致,有研究得出应拉木大于对应木(Jourez et al., 2001);有研究认为应拉木与对应木相当(Scurfield et al., 1962);也有研究得出应拉木比对应木要小(刘亚梅等,2010)。光皮桦应拉木的平均纤维长度与对照无明显差异,但显著大于对应木,说明经拉弯处理后可能会导致对应区较短纤维的增多。从主要化学成分看,高纤维素和低木质素含量是应拉木的另一个重要特征(Wada et al., 1995; Pilate et al., 2004)。相比对应木和对照样品,光皮桦应拉木纤维素含量表现最高,而木质素含量则表现最低,但具体差异数值均较小。有研究认为木质素的缺少主要是针对次生壁中新产生的胶质纤维层(Timell et al., 1969; Yoshida et al., 2002; Bowling et al., 2008)。因此,分析材料包含非胶质层,可能就是引起本试验纤维素和木质素在不同木质部区块间差异小的主要原因。
IAA变化及其作用是解释应拉木形成的“激素分布学说”的主要内容。从20世纪50年代--80年代,许多学者通过应用生物测定法分析IAA含量、同位素示踪IAA的流向,以及外施生长素类调节剂和运输抑制剂后观测表型等策略进行研究,提出IAA的减少诱导应拉木的形成(Kennedy et al., 1965; Leach et al., 1967; Robnett et al., 1973; Du et al., 2007)。从具体试验方案看,这些结果大多是对处理数十天或是特殊显微结构出现后的样品进行分析得到的。本试验针对光皮桦应拉木形成早期阶段的主要内源激素变化进行了分析,虽然3个处理时间应拉区木质部IAA含量均小于对应区,但仅处理7天的木质部样品两区块间差异达到显著水平。Hellgren等采用GC-MS测定了拉弯欧洲颤杨(P. tremula)中IAA的分布,发现应拉区形成层部位中IAA含量与直立木无明显差异,且对应木中IAA含量呈现显著下降,推测应拉木形成与IAA平衡的变化间没有相关性(Hellgren et al., 2004)。Moyle等(2002)对经拉弯处理杂交杨(P. tremula × P. tremuloides)进行研究,也发现处理24 h内应拉区与对应区IAA含量没有明显差别,而且同阶段PttIAA已呈现特异性表达,提出处理使得细胞对IAA的敏感性发生了改变。最近,Gerttula等(2015)利用免疫定位和RNA-Seq技术研究了杂交杨(P. alba × P. tremula)茎干向地性的发生机制,发现在响应重力刺激的早期阶段,生长素输出载体PIN3蛋白在应拉区指向形成层,而在对应区指向皮层,推测导致应拉木形成的主要原因是次生维管组织中呈径向排列的生长素含量梯度,而不是其绝对含量。因此,拉弯早期阶段在茎干次生维管组织中形成的IAA含量径向梯度可能也是光皮桦应拉木形成的关键。赤霉素是木本植物形成层发育所必需的另一种激素,与木材径长生长有密切联系,但在应拉木形成中的作用仍未有一致结论。Blum等(1971)和Cronshaw等(1968)分别通过对杨树和枫树(Acer rubrum)进行试验后,提出GA3与应拉木形成没有直接关系。近年的Du等(2004)和Nugroho等(2012)分别以七叶树(Aesculus turbinate)和相思木(Acacia mangium)为材料,通过施加外源GA3,以及合成抑制剂多效唑和烯效唑-P的研究,提出GA3能促进这2个树种应拉木的形成(Du et al., 2004; Nugroho et al., 2012)。然而,在光皮桦应拉木诱导处理6和48 h的应拉木、对应木和对照样品中GAs(GA1+GA3)含量均无显著差异,而处理7天时应拉区木质部GAs(GA1+GA3)含量则明显低于对应区、对照。可见,赤霉素在应拉木形成中的作用可能与物种、发育阶段,以及赤霉素种类等因素有关。Hossain等(2012)研究认为,BR能调控细胞壁成分的生物合成,应用RNAi使得拟南芥(Arabidopsis)的BR生物合成受阻,导致转化植株花序茎中的木质素含量比野生型下降了38%,且S/G木质素单体比例更低。从本试验结果看,除处理6 h两木质部区块间BR的差异不明显外,其余时间均是应拉区显著小于对应区,且随处理时间延长对应区BR含量呈现递增。BR的这种变化趋势可能与对应木中高木质素含量有一定联系。尽管通过测定得出了应拉木形成早期阶段主要内源激素在不同木质部区域的分布规律,但是这些内源激素调控应拉木形成的分子机制仍不清楚,因此,解析光皮桦应拉木的形成原因,还需对参与这些激素信号传导的基因作深入的分析。
4 结论光皮桦经12个月的人为拉弯处理,应拉区木质部的细胞壁明显增厚,出现明显的胶质纤维层;平均纤维长度、纤维素含量增加,表现出特有的理化特征。在拉弯处理的早期阶段,木质部中IAA,GAs,BR和ZR含量呈现不同的变化,表明这些激素的重新分布可能是导致光皮桦应拉木形成的重要原因。
| [] |
崔克明. 1991. 植物生长调节剂在控制形成层活动中的作用. 植物学通报 , 8 (1) : 22–29.
( Cui K M.1991. The role of plant growth regulations in the control of cambial activity. Chinese Bulletin of botany , 8 (1) : 22–29. [in Chinese] ) |
| [] |
李和平, 龙鸿. 2009. 植物显微技术. 2版. 北京: 科学出版社 : 54 -55.
( Li H P, Long H. 2009. Plant microscopy technique. 2nd edition. Beijing: Science Press : 54 -55. [in Chinese] ) |
| [] |
刘亚梅, 刘盛全. 2012. 人工倾斜火炬松3年生苗木应压木的解剖性质. 林业科学 , 48 (1) : 131–137.
( Liu Y M, Liu S Q.2012. Anatomical properties of compression wood of three-year-old loblolly pine induced by artificial inclination. Scientia Silvae Sinicae , 48 (1) : 131–137. [in Chinese] ) |
| [] |
刘亚梅, 刘盛全. 2010. 欧美杨107杨苗人工倾斜树干应拉木形成特征及其解剖特性. 林业科学 , 46 (5) : 133–140.
( Liu Y M, Liu S Q.2010. Formation anatomical characteristics of tension wood in stem of Poplar I-107 seedlings (Populus×euramericana cv. '74/76') induced by artificial inclination. Scientia Silvae Sinicae , 46 (5) : 133–140. [in Chinese] ) |
| [] |
阮锡根, 王婉华, 潘彪. 1993. 应力木纤丝角的研究. 林业科学 , 29 (6) : 534–536.
( Ruan X G, Wang W H, Pang P.1993. Study of microfibril angles in tension wood. Scientia Silvae Sinicae , 29 (6) : 534–536. [in Chinese] ) |
| [] |
宋东亮, 沈君辉, 李来庚. 2010. 植物维管系统形成的调节机制. 植物生理学通讯 , 46 (5) : 411–421.
( Song D L, Sheng J X, Li L G.2010. Regulation of plant vascular system formation. Plant Physiology Communications , 46 (5) : 411–421. [in Chinese] ) |
| [] | Andersson-Gunnerås S, Mellerowicz E J, Love J, et al.2006. Biosynthesis of cellulose-enriched tension wood in Populus:global analysis of transcripts and metabolites identifies biochemical and developmental regulators in secondary wall biosynthesis. The Plant Journal , 45 (2) : 144–165. DOI:10.1111/tpj.2006.45.issue-2 |
| [] | Blum W.1971. Uber die experimentelle Beeinflussung der Reaktionsholzbildung bei Fichten und Pappeln. Ber. Schweiz. Bot. Ges , 80 : 225–251. |
| [] | Bowling A J, Vaughn K C.2008. Immunocytochemical characterization of tension wood:Gelatinous fibers contain more than just cellulose. American Journal of Botany , 95 (6) : 655–663. DOI:10.3732/ajb.2007368 |
| [] | Cronshaw J, Morey P R.1968. The effect of plant growth substances on the development of tension wood in horizontally inclined stems of Acer rubrum seedlings. Protoplasma , 65 (4) : 379–391. DOI:10.1007/BF01666298 |
| [] | Donaldson L A.1992. Within-and between-tree variation in microfibril angle in Pinus radiata. New Zealand Journal of Forestry Science , 22 (1) : 77–86. |
| [] | Donaldson L A, Knox J P.2012. Localization of cell wall polysaccharides in normal and compression wood of radiata pine:relationships with lignification and microfibril orientation. Plant Physiology , 158 (2) : 642–653. DOI:10.1104/pp.111.184036 |
| [] | Du S, Uno H, Yamamoto F.2004. Roles of auxin and gibberellin in gravity-induced tension wood formation in Aesculus turbinate seedlings. IAWA Journal , 25 (3) : 337–347. DOI:10.1163/22941932-90000370 |
| [] | Du S, Yamamoto F.2007. An Overview of the biology of reaction wood formation. Journal of Integrative Plant Biology , 49 (2) : 131–143. DOI:10.1111/jipb.2007.49.issue-2 |
| [] | Gerttula S, Zinkgraf M, Muday G K, et al.2015. Transcriptional and hormonal regulation of gravitropism of woody stems in Populus. The Plant Cell , 27 (10) : 2800–2813. |
| [] | Hellgren J M, Olofsson K, Sundberg B.2004. Patterns of auxin distribution during gravitational induction of reaction wood in popular and pine. Plant Physiology , 135 (1) : 212–220. DOI:10.1104/pp.104.038927 |
| [] | Hossain Z, McGarvey B, Amyot L, et al.2012. DIMINUTO1 affects the lignin profile and secondary cell wall formation in Arabidopsis. Planta , 235 (3) : 485–498. DOI:10.1007/s00425-011-1519-4 |
| [] | Jiang S, Xu K, Zhao N, et al.2009. Ethylene evolution changes in tilted Fraxinus mandshurica Rupr. var. japonica Maxim. seedlings in relation to tension wood formation. Journal of Integrative Plant Biology , 51 (7) : 707–713. |
| [] | Jourez B, Riboux A, Leclercq A.2001. Anatomical characteristics of tension wood and opposite wood in young inclined stems of poplar (Populus euramericana cv'Ghoy'). Iawa Journal , 22 (2) : 133–157. DOI:10.1163/22941932-90000274 |
| [] | Kennedy R W, Farrar J L.1965. Induction of tension wood with the anti-auxin 2, 3, 5-tri-iodobenzoic acid. Nature , 208 (5008) : 406–407. DOI:10.1038/208406a0 |
| [] | Kirk T K, Obst J R.1988. Lignin determination. Methods Enzymology , 161 (1) : 87–161. |
| [] | Leach R W A, Wareing P F.1967. Distribution of auxin in horizontal woody stems in relation to gravimorphism. Nature , 214 (5092) : 1025–1027. DOI:10.1038/2141025a0 |
| [] | Moyle R, Schrader J, Stenberg A, et al.2002. Environmental and auxin regulation of wood formation involves members of the Aux/IAA gene family in hybrid aspen. The Plant Journal , 31 (6) : 675–685. DOI:10.1046/j.1365-313X.2002.01386.x |
| [] | Nugroho W D, Yamagishi Y, Nakaba S, et al.2012. Gibberellin is required for the formation of tension wood and stem gravitropism in Acacia mangium seedlings. Annals of Botany , 110 (4) : 887–895. DOI:10.1093/aob/mcs148 |
| [] | Paux E, Carocha V, Marques C, et al.2005. Transcript profiling of eucalyptus xylem genes during tension wood formation. New Phytologist , 16 (1) : 89–99. |
| [] | Pilate G, Chabbert B, Cathala B, et al.2004. Lignification and tension wood. Comptes Rendus Biologies , 327 (9) : 889–901. |
| [] | Robnett W E, Morey P R.1973. Wood formation in Prosopis:Effect of 2, 4-D, 2, 4, 5-T, and TIBA. American Journal of Botany : 745–754. |
| [] | Ruelle J, Yoshida M, Clair B, et al.2007. Peculiar tension wood structure in Laetia procera (Poepp. ) Eichl (Flacourtiaceae). Trees , 21 (3) : 345–355. |
| [] | Scurfield G, Wardrop A B.1962. The nature of reaction wood. VI. The reaction anatomy of seedlings of woody perennials. Australian Journal of Botany , 10 (2) : 93–105. |
| [] | Selig B, Luengo Hendriks C L, Bardage S, et al.2012. Automatic measurement of compression wood cell attributes in fluorescence microscopy images. Journal of Microscopy , 246 (3) : 298–308. DOI:10.1111/j.1365-2818.2012.03621.x |
| [] | Timell T E.1969. The chemical composition of tension wood. Svensk Papperstidn , 72 : 173–181. |
| [] | Toghraie N, Parsapajouh D, Ebrahimzadeh H, et al.2006. Tension wood in eucalypt trees. Journal of Science (University of Tehran) , 32 (1) : 13–22. |
| [] | Wada M, Okano T, Sugiyama J, et al.1995. Characterization of tension and normally lignified wood cellulose in Populus maximowivzii. Cellulose , 2 (4) : 223–233. DOI:10.1007/BF00811814 |
| [] | Walke J C F, Butterfield B G.1996. The importance of microfibril angle for the processing industries. New Zealand Forestry , 40 (4) : 34–40. |
| [] | Wang G F, Gao Y, Yang L W, et al.2007. Identification and analysis of differentially expressed genes in differentiating xylem of Chinese fir (Cunninghamia lanceolata) by suppression subtractive hybridization. Genome , 50 (12) : 1141–1155. DOI:10.1139/G07-091 |
| [] | Yamaguchi K, Shimaji K, Itoh T.1983. Simultaneous inhibition and induction of compression wood formation by morphactin in artificially inclined stems of Japanese larch (Larix leptolepis Gordon). Wood Science and Technology , 17 (2) : 81–89. DOI:10.1007/BF00369125 |
| [] | Yang J, Zhang J, Wang Z, et al.2001. Hormonal changes in the grains of rice subjected to water stress during grain filling. Plant Physiol , 127 (1) : 315–323. DOI:10.1104/pp.127.1.315 |
| [] | Yoshida M, Ohta H, Okuyama T.2002. Tensile growth stress, lignin distribution in the cell walls of black locust (Robinia pseudoacacia). Journal of Wood Science , 48 (2) : 99–105. DOI:10.1007/BF00767285 |
 2016, Vol. 52
2016, Vol. 52

