文章信息
- 戴婷婷, 吴小芹
- Dai Tingting, Wu Xiaoqin
- 等温扩增技术快速检测棕榈疫霉
- A Method for Rapidly Identifying Phytophthora palmivora Using the LAMP Technique
- 林业科学, 2016, 52(10): 161-166
- Scientia Silvae Sinicae, 2016, 52(10): 161-166.
- DOI: 10.11707/j.1001-7488.20161020
-
文章历史
- 收稿日期:2014-11-06
- 修回日期:2015-03-04
-
作者相关文章
棕榈疫霉(Phytophthora palmivora )是农林业生产上的一种危害非常严重的病原菌,能够侵染根、茎、叶、花以及果实等各个部位,在气候潮湿的条件下发病更为严重。比如大田的番木瓜(Carica papaya) 疫病目前检测出是由棕榈疫霉引起,一旦番木瓜大田疫病暴发,会导致大量植株死亡,造成严重的经济损失(成家壮等,1995);木薯(Manihot esculenta )已在华南地区广泛种植,是中国种植面积较大的经济作物,由棕榈疫霉引起的木薯根腐病是中国木薯种植中的新发病害(Guo et al ., 2012)。棕榈疫霉菌属于卵菌门(Oomycota)、卵菌纲(Oomycetes)、霜霉目(Peronosporales)、腐霉科(Pythiaceae)、疫霉属(Phytophthora )。棕榈疫霉引起的植物病害分布广泛,因此建立棕榈疫霉的快速分子检测技术对于其引起疫病的早期控制具有重要意义。目前对该病害还没有快速有效的防治措施,控制该病的最有效途径就是加强检疫,防止病原菌的传播和阻碍其扩散方式,从而有利于降低疫病引起的损失。传统棕榈疫霉菌的分类检测主要是基于形态学特征、生理生化特征以及致病性测定等。这种方法不但耗时较长、检出率不高,且鉴定时还受到其他因子的干扰,采用常规检疫方法需要耗时20天左右才能确定是否有棕榈疫霉存在,而且易出现漏检等现象。核酸扩增技术是分子生物学领域的一项重要的研究手段,核酸扩增技术主要包括常规PCR为基础的变温扩增技术以及等温扩增技术2大类。目前,基于常规PCR为基础的变温扩增技术主要包括普通PCR、巢式PCR、多重PCR、实时荧光定量PCR等,这些技术在棕榈疫霉菌的检测中广泛应用(Bowman et al ., 2007)。由于核酸的变温扩增技术需要精密变温设备和高级复杂的分析仪器,对操作人员的熟练度和专业水平要求比较高,且反应时间长,大概需要4~5 h,不利于在基层推广;而病原菌的防控关键在于对病原微生物的快速、准确、及早的检测并确诊。因此,建立一种快速、准确的新型的等温扩增技术对于棕榈疫霉菌的检测显得尤为重要。等温扩增成为核酸扩增技术的研究热点,Notomi等(2000)开发了一种新型核酸扩增技术即环介导等温核酸扩增技术(loop-mediated isothermal amplification, LAMP)。LAMP检测体系的基因的扩增和产物的检测可一步完成,扩增效率高,可在30~60 min扩增109~1010倍,其特异性较高,同时在LAMP反应过程中,从dNTP析出的焦磷酸根离子与反应溶液中的Mg2+结合,产生副产物焦磷酸镁乳白色沉淀,对靶基因序列的检测只需通过添加金属离子指示剂HNB来实现(Goto et al ., 2009),通过颜色变化判断扩增与否。LAMP反应简单、快速、高效、经济等特征,因而具有极为广泛的应用前景。自LAMP检测技术建立14年以来,该技术已经广泛应用于细菌、病毒、寄生虫、真菌等病原菌的检测研究中(Pan et al ., 2011; Parida et al ., 2005; Niessen et al ., 2010),但在植物病原卵菌的检测报道较少(戴婷婷等, 2013; Dai et al ., 2012; 戴婷婷等, 2015),棕榈疫霉的等温快速检测国内外未见报道。本研究设计了基于IGS 靶标的LAMP引物,优化反应体系,建立了快速、灵敏、可视化的环介导等温扩增技术检测棕榈疫霉,对该疫病预测发生,及时采取有效的防治方法控制其传播和流行、减少经济损失具有重要意义。
1 材料与方法 1.1 菌株与材料供试的棕榈疫霉菌株分离自海南儋州的田间木薯根茎中。棕榈疫霉及其他真菌菌株、卵菌菌株均为单孢菌株。供试菌株的种名、寄主、来源及数量见表 1。Bst DNA聚合酶购自NewEngland Biolabs公司;甜菜碱(Sigma公司)、MgSO4、羟基萘酚蓝(HNB)(Sigma公司);dNTP(10 mmol·L-1)购自宝生物工程(大连)有限公司;枪头购自美国Axygen公司;DNAsecure Plant Kit购自QIAGEN公司;供试疫霉菌和腐霉菌菌株转至利马豆培养基(LBA)(郑小波,1997)平板,其他菌株转至马铃薯葡萄糖固体培养基(PDA)(Erwin et al ., 1996)平板上,26 ℃黑暗培养4天后从菌落边缘切取10块2 mm×2 mm菌丝块,疫霉和腐霉菌株转至V8液体培养基(郑小波,1997),其他菌株转至马铃薯葡萄糖液体培养基(PDB)(Erwin et al ., 1996),26 ℃振荡培养4~5天,过滤收集菌丝,经冷冻抽干研磨成菌丝粉,-20 ℃保存备用。
|
|
取少量菌丝粉,加900 μL 2% CTAB提取液和90 μL 10% SDS,漩涡混匀,于60 ℃水浴50~60 min,中间每10 min上下颠倒几次;12 000 r·min-1离心15 min,取上清700 μL加等体积酚/氯仿/异戊醇(25:24:1),颠倒混匀,12 000 r·min-1离心15 min;将上清液550 μL转移至新管,加等体积氯仿,轻轻颠倒混匀,12 000 r·min-1离心15 min。上清液400 μL转移至新管中,加2倍体积的无水乙醇和1/10体积的3 mol·L-1 NaAc(pH5.2),-20 ℃沉淀30 min。12 000 r·min-1离心5 min,倾去上清,沉淀用70%乙醇洗涤2次,室温晾干。加适量TE(pH 8.0)或灭菌超纯水溶解沉淀(含20 μg·mL-1 RNase),37 ℃处理60 min后,电泳后-20 ℃保存备用。所有的土壤样品采用FastDNA© SPIN试剂盒(Q-Biogene Ltd, USA)进行DNA的提取。土壤DNA提取步骤参见试剂盒说明书;发病田块中从0~10 cm的深度分别采集土样,将土样晾干碾碎,分别称取0.5 g土样作为检测样品,没有发病的健康田块作为对照土样。
1.3 人工接种木薯的发病组织检测用直径5 mm打孔器在木薯根表面打1个深5 mm的孔,将V8培养4天后的菌丝块放入孔中,同时进行保湿培养。取3株接种棕榈疫霉菌6天后的木薯发病组织,每份样本取2 g病健交接处的组织,碾碎后每毫克组织加入10 μL 0.5 mol·L-1 NaOH,在研钵中充分研磨后转移至1.5 mL的EP管中,12 000 r·min-1离心10 min,取5 μL上清液加入495 μL 0.1 mmol·L-1 Tris (pH 8.0),混匀后取1 μL直接用于LAMP扩增。将棕榈疫霉菌株DNA作为阳性对照,以灭菌水作为阴性对照。同时提取健康植株DNA作为参照。试验重复3次。
1.4 LAMP引物的设计与合成核糖体基因转录单元间隔区(intergenic spacer,IGS)是介于16S-23S rDNA间区,该区域是设计引物的高度保守区,是进化变化的敏感标记物,较ITS相比可以更迅速地跟踪标记。已有的研究表明,可以通过IGS对许多植物病原菌的遗传多样性和分子系统学进行研究。该基因是一个多拷贝基因,有助于提高PCR扩增的灵敏度。因此,本研究采用IGS 基因作为棕榈疫霉菌的分子检测靶标,分析棕榈疫霉菌与其他疫霉菌在IGS 基因序列上的差异,设计并筛选了特异性LAMP引物,并在此基础上建立棕榈疫霉菌的LAMP分子检测体系。引物根据IGS 基因序列(DQ 163014.1),应用PrimerExplore V4软件,并结合Bioedit软件进行序列分析,设计多套LAMP引物,从中筛选出特异性好、灵敏度高的一套LAMP引物(表 2),其中F3/B3为外引物,FIP/BIP为内引物,LF为正向环引物,LB为反向环引物。引物由上海生工有限公司合成,用ddH2O溶解后分装,-20 ℃冰箱保存备用。
|
|
为了筛选最特异性的LAMP引物,摸索最优的LAMP反应体系,本研究对LAMP反应中的内外引物的浓度(0.2~1.8 μmol·L-1)、MgSO4浓度(2~10 mmol·L-1)、dNTPs浓度(0.2~2 mmol·L-1)、甜菜碱浓度(0.8~1.6 mol·L-1)、HNB浓度(100~200 mmol·L-1)、反应时间(30~100 min)、Bst DNA聚合酶添加量(0.32~0.64 U·μL-1)进行优化,确定最终LAMP反应体系。反应各组分终浓度为:2.5 μL 10×ThermoPol buffer,5 mmol·L-1 MgSO4,1.4 mmol·L-1 dNTPs,内引物FIP and BIP各1.6 μmol·L-1,外引物F3 and B3各0.2 μmol·L-1,正向环引物LF 0.8 mmol·L-1, 反向环引物LB 0.8 mmol·L-1,0.8 mol·L-1甜菜碱,180 mmol·L-1 HNB,8 U·μL-1 Bst DNA polymerase,2 μL病菌DNA,灭菌水补至25 μL。64 ℃在水浴锅中等温反应80 min,反应结束后根据HNB颜色变化观察LAMP反应结果。每个试验重复3次。
2 结果与分析 2.1 LAMP反应体系的特异性验证对于引物的特异性的验证可以通过GenBank中的BLAST进行序列比对(http://blast.ncbi.nlm.nih.gov/Blast.cgi),将设计好的引物分别在GenBank中的BLAST进行比对确认,同时设计的引物针对同种不同地域、不同寄主来源菌株、同属不同种的疫霉菌和其他真菌菌株进行特异性试验,从而保证LAMP引物的特异性。分别提取棕榈疫霉菌、苎麻疫霉菌、樟疫霉菌、辣椒疫霉菌、掘氏疫霉菌、致病疫霉菌、草莓疫霉菌、平头炭疽菌、茄镰刀菌、稻瘟病菌、立枯丝核菌、大丽轮枝菌、终极腐霉菌等病原菌的基因组DNA,进行LAMP特异性验证。本研究筛选出棕榈疫霉菌的特异性引物进行LAMP扩增,当发生LAMP扩增反应时, 产生大量的焦磷酸镁白色沉淀,通过自配反应体系HNB显色反应所示,棕榈疫霉菌的反应管均呈天蓝色,为阳性结果,其他疫霉种、腐霉、真菌和阴性对照菌反应管均呈紫色,为阴性结果(图 1,图 2)。
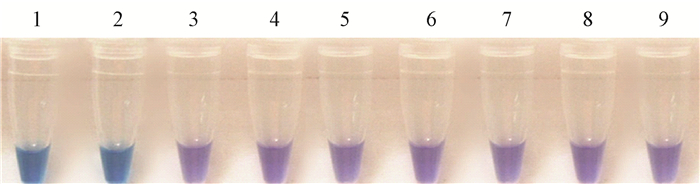
|
图 1 HNB检测LAMP反应棕榈疫霉菌种间的特异性试验 Fig.1 The specificity of LAMP for P. palmivora detection by HNB 棕榈疫霉反应管呈天蓝色而阴性对照菌反应管呈紫色,下同。A sky blue colour was observed using the naked eye in the tube which contained P. palmivora while the negative controls remained violet after the reaction 1, 2.棕榈疫霉P. palmivora DNA;3.苎麻疫霉P.boehmeriae ; 4.樟疫霉P. cinnamomi ;5.辣椒疫霉P. capsici ;6.掘氏疫霉P. drechsleri ;7.致病疫霉P. infestans ;8.草莓疫霉P. fragariae ;9.阴性对照水Negative control. |
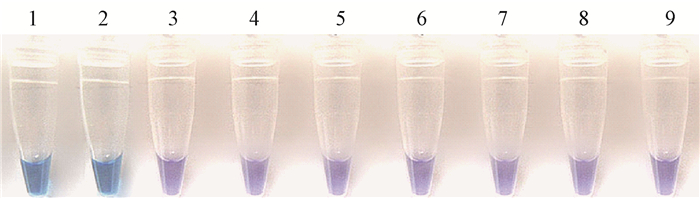
|
图 2 HNB检测LAMP反应棕榈疫霉菌的特异性试验 Fig.2 The specificity of LAMP for P. palmivora detection by HNB 1, 2.棕榈疫霉P. palmivora DNA;3.平头炭疽Colletotrichum truncatum ;4.茄镰刀Fusarium solani ;5.稻瘟病菌Magnaporthe grisea ;6.立枯丝核菌Rhizoctonia solani ;7.大丽轮枝菌Verticilium dahliae ;8.终极腐霉Pythium ultimum ;9.阴性对照水Negative control. |
棕榈疫霉菌的基因组DNA模板经浓度测定后,进行10倍梯度的稀释,使得浓度梯度依次为10 ng·μL-1,1 ng·μL-1,100 pg·μL-1,10 pg·μL-1,1 pg·μL-1,100 fg·μL-1,10 fg·μL-1,1 fg·μL-1,100 ag·μL-1,10 ag·μL-1。分别取2.0 μL作为LAMP反应模板,于64 ℃等温下反应80 min。反应结束后,通过HNB颜色变化鉴别是否发生了LAMP扩增。图 3为灵敏度检测结果的HNB显色图,HNB显色结果显示,当发生LAMP扩增反应时,阳性反应变为天蓝色,未发生LAMP扩增的仍为紫色。3种检测结果最低检测灵敏度都为10 fg·μL-1。

|
图 3 LAMP反应的灵敏度试验 Fig.3 Sensitivity of PtYpt1 -LAMP method (以10倍递度稀释的橡树疫霉的基因组DNA作为反应模板。从左到右浓度依次为100 ng·μL-1~10 fg·μl-1。 Using serially diluted genomic DNA (100 ng·μL-1-10 fg·μL-1) from P. palmivora as template. The detection limit for the assay was 10 fg·μL-1. Sensitivity of LAMP method by HNB.A positive reaction was indicated by a color change from violet to sky blue. |
采用LAMP检测采自田间的木薯根部土壤中病原物和接种发病木薯组织样品,3份采自病田土样和3份感病组织样品均产生了阳性的天蓝色反应,而作为阴性对照的土样和健康组织中则没有发生颜色变化(图 4),同时采用传统分离方法即土壤诱捕法(郑小波, 1997)均分别能从3份LAMP阳性样品中分离到棕榈疫霉,而健康样品未分离到,说明采自这些病田的土样和感病组织样品中含有棕榈疫霉。
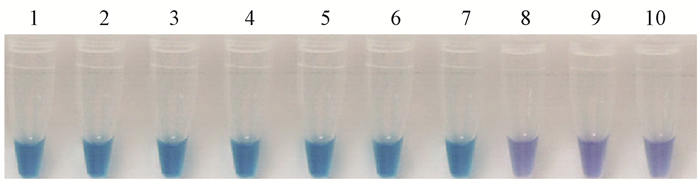
|
图 4 病田土壤中病原物和发病组织中病原物的LAMP检测 Fig.4 LAMP of DNA extracted from some cassava root samples 1.棕榈疫霉阳性对照1Positive control;2-4.土壤中病原物的LAMP显色结果 Amplified products using DNA from soil samples collected from diseased cassava root tubes; 5-7.发病组织中病原物的LAMP显色结果 Amplified products using DNA from diseased cassava root tissues; 8.未侵染的土样的扩增结果 Uninfested soil sample; 9.提取健康组织DNA的扩增结果 Healthy plant tissues;10.阴性对照 Negative controls. |
本研究建立了PpIGS- LAMP的可视化检测技术体系,可特异性检测引起棕榈根腐病的棕榈疫霉。LAMP检测技术可直接检测田间采集的病土和发病组织中的病原菌。整个过程在64 ℃仅需80 min,即可通过肉眼直接观测到试验结果,降低了检测成本,适合基层等大批量植物的快速检测,为生产实践中的推广使用提供了可行性。
4 讨论棕榈疫霉是农业生产上的一种危害严重的病原菌,目前该病还缺少有效的防控措施,因此建立棕榈疫霉的快速分子检测技术对于疫病的早期控制具有重要意义。目前LAMP检测技术已经成功用于病毒、细菌、真菌、寄生虫的检测中。相对于传统PCR,LAMP扩增方法具有以下几个特点:在等温条件下能进行扩增反应,反应时间短;没有变性的过程不需要热循环仪器,普通水浴锅或等温保温瓶即可进行LAMP反应;特异性较高,4条内外引物针对靶序列的6个结合区;鉴定简便,产生的副产物--焦磷酸镁沉淀,只要用指示剂HNB进行可视化显色方法就能够判断扩增与否,从而实现了扩增结果快速鉴定。但LAMP检测技术也存在一些缺点:扩增片段过小,靶序列长度要控制在300 bp以下,扩增产物不容易分离;LAMP体系靶标选择和引物筛选较为繁琐;LAMP反应体系容易产生非特异性条带的扩增,因而在操作时要防止气溶胶的污染;利用LAMP技术对于单碱基核苷酸位点的鉴定适用性较差;相对于Real-time PCR技术,LAMP反应体系不能对反应结果进行定量分析。
LAMP技术的关键点是用于设计引物靶标基因的选择与引物的筛选。靶标基因的选择要确保种内的不同菌株间高度的保守,而在种间变异性较高。核糖体转录间隔区域基因(ITS)是最常用的靶标,但对于疫霉种ITS区域非常相似,同源性相对较高;同时其余保守靶标包括beta微管蛋白、肌动蛋白、转录延长因子、细胞色素氧化酶基因、elicitin基因等也可作为疫霉菌的检测靶标,通过使用Bioedit软件对这些靶标序列进行分析,使用PrimerExplore V4软件设计了LAMP特异性引物,但均未能筛选出特异性好和灵敏度较高的LAMP引物组。最终针对棕榈疫霉菌的LAMP检测技术中,所选择的靶标是rDNA-IGS,该靶标已经成功应用于腥黑粉菌属3种检疫性真菌(梁宏等,2006)、原料乳与乳制品中致病菌(董鑫悦等,2012)等多种病原菌的检测。本研究基于IGS 靶标检测棕榈疫霉,共设计了10组符合条件的引物,最终筛选出1组最为特异并灵敏度极高的引物。它能从疫霉属其他菌株和其他真菌中将棕榈疫霉检测出来,并且在进行PpIGS -LAMP引物的灵敏度验证中,结果在25 μL的反应体系中最低检测灵敏度可以达到10 fg·μL-1。
本研究建立的棕榈疫霉的PpIGS -LAMP检测技术,在25 μL的反应体系中,最低检测灵敏度达到10 fg· μL-1级别,比基于ITS靶标的普通PCR扩增技术提高10~100倍(李超萍等,2013)。为了提高棕榈疫霉检测准确性和检测效率,本研究首次报道了应用IGS 基因为靶序列建立的PpIGS-LAMP 技术该技术检测棕榈疫霉,操作简便易行,适用于基层单位开展田间诊断,对于病害的早期诊断与防治有着重要意义。
| [] |
成家壮, 韦小燕. 1995. 广州地区番木瓜疫病的初步研究. 植物病理学报 , 25 (4) : 350.
( Cheng J Z, Wei X Y.1995. A preliminary investigation on the papaya Phytophthora disease in Guangzhou. Acta Phytopathological Sinica , 25 (4) : 350. [in Chinese] ) |
| [] |
戴婷婷, 陆晨辰, 沈浩, 等. 2013. 基于环介导等温扩增技术检测橡树疫霉. 南京农业大学学报 , 36 (3) : 23–28.
( Dai T T, Lu C C, Shen H, et al.2013. Rapid diagnostic methods for Phytophthora ramorum using LAMP. Journal of Nanjing Agricultural University , 36 (3) : 23–28. [in Chinese] ) |
| [] |
戴婷婷, 康振烨, 吴小芹. 2015. 可视化环介导等温扩增技术检测Phytophthora tentaculata. 南京林业大学学报:自然科学版 , 39 (6) : 1–6.
( Dai T T, Kang Z Y, Wu X Q.2015. Rapid diagnostic methods for Phytophthora tentaculata using LAMP. Journal of Nanjing Forestry University:Natural Science Edition , 39 (6) : 1–6. [in Chinese] ) |
| [] |
董鑫悦, 满朝新, 李洋, 等. 2012. 新技术在原料乳与乳制品中致病菌检测方面的应用. 中国乳品工业 , 40 (10) : 33–35.
( Dong X Y, Man C X, Li Y, et al.2012. Application of new technologies on the detection of pathogenic bacteria in raw milk and dairy products. China Dairy Industry , 40 (10) : 33–35. [in Chinese] ) |
| [] |
李超萍, 刘先宝, 时涛, 等. 2013. 木薯根腐病棕榈疫霉病菌的分子检测. 热带作物学报 , 34 (7) : 1314–1318.
( Li C P, Liu X Bhi, S T, et al.2013. Molecular detection of Phytophthora palmivora from the cassava root rot. Acta Phytopathological Sinica , 34 (7) : 1314–1318. [in Chinese] ) |
| [] |
梁宏, 彭友良, 张国珍, 等. 2006. 腥黑粉菌属3种检疫性真菌rDNA-IGS区的扩增及其序列分析. 植物病理学报 , 36 (5) : 407–412.
( Liang H, Peng Y L, Zhang G Z, et al.2006. Amplification and sequence analysis of the rDNA intergenic spacer (rDNA-IGS) from three Tilletia species. Acta Phytopathological Sinica , 36 (5) : 407–412. [in Chinese] ) |
| [] |
郑小波. 1997. 疫霉菌及其研究技术. 北京: 中国农业出版社 .
( Zheng X B. 1997. Methods in Phytophthora. Beijing: Chinese Agriculture Press . [in Chinese] ) |
| [] | Bowman K, Albrecht U, Graham J, et al.2007. Detection of Phytophthora nicotianae and P. palmivora in citrus roots using PCR-RFLP in comparison with other methods. European Journal of Plant Pathology , 119 (2) : 143–158. |
| [] | Dai T T, Lu C C, Lu J, et al.2012. Development of a loop-mediated isothermal amplification assay for detection of Phytophthora sojae. FEMS Microbiology Letters , 334 (1) : 27–34. DOI:10.1111/fml.2012.334.issue-1 |
| [] | Erwin D, Ribeiro O, Shattock R. 1996. Phytophthora diseases worldwide. USA: American Phytopathological Society (APS Press) : 200 -562. |
| [] | Goto M, Honda E, Ogura A, et al.2009. Short technical reports:Colorimetric detection of loop-mediated isothermal amplifcation reaction by using hydroxynaphthol blue. Biotechniques , 46 (3) : 167–172. DOI:10.2144/000113072 |
| [] | Guo H, Li C P, Shi T, et al.2012. First report of Phytophthora palmivora causing root rot of cassava in China. Plant Disease , 96 (7) : 1072. |
| [] | Notomi T, Okayama H, Masubuchi H, et al.2000. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research , 28 (12) : 63–69. DOI:10.1093/nar/28.12.e63 |
| [] | Niessen L, Vogel R F.2010. Detection of Fusarium graminearum DNA using a loop-mediated isothermal amplification (LAMP) assay. International Journal of Food Microbiology , 140 (2) : 183–191. |
| [] | Pan W, Wang J Y, Shen H Y, et al.2011. Development and application of the novel visual loop-mediated isothermal amplification of Omp25 sequence for rapid detection of Brucella sp. Journal of Animal and Veterinary Advances , 10 (16) : 2120–2126. DOI:10.3923/javaa.2011.2120.2126 |
| [] | Parida M, Horioke K, Ishida H, et al.2005. Rapid detection and differentiation of dengue virus serotypes by a real-time reverse transcription-loop-mediated isothermal amplification assay. Journal of Clinical Microbiology , 43 (6) : 2895–2900. DOI:10.1128/JCM.43.6.2895-2903.2005 |
 2016, Vol. 52
2016, Vol. 52

