文章信息
- 林开勤, 赵德刚, 李岩, 何选泽, 王韶敏
- Lin Kaiqin, Zhao Degang, Li Yan, He Xuanze, Wang Shaomin
- 杜仲性别相关EST-SSR标记的开发
- Development of Gender-Related EST-SSR Markers in Eucommia ulmoides
- 林业科学, 2016, 52(10): 146-152
- Scientia Silvae Sinicae, 2016, 52(10): 146-152.
- DOI: 10.11707/j.1001-7488.20161018
-
文章历史
- 收稿日期:2015-10-08
- 修回日期:2015-11-25
-
作者相关文章
2. 遵义市凤凰山国家森林公园 遵义 563000
2. Fenghuangshan National Forest Park Zunyi 563000
在进化过程中,植物为了适应自然界而表现出性别的多态性(许智宏等,1998)。植物性别类型主要分为器官、个体和群体3个层次(李同华等,2004)。植物的性别往往由遗传控制,性别研究在理论上是植物成花及繁殖发育生理学的重要组成部分,也是植物发育分子生物学中研究基因调控表达的重要内容(王克霞,2004)。同时,在生产实践中,雌雄异株植物的利用价值常因雌、雄株而异,如:银杏因其雄株长势旺盛,作为行道树的多以雄株为主(程晓建等,2002);而猕猴桃(Actinidia)等以收获果实为主的植物,雌株的经济价值显然要高于雄株(康宗利等,2011)。但许多雌雄异株植物开花前难以分辨其性别,往往需要种植2~8年后才能开花,因此开展植物性别早期鉴定在生产实践中具有重要意义。
杜仲(Eucommia ulmoides)为单科单属单种,雌雄异株,是第三纪孑遗植物,列为我国第二类珍稀濒危保护树种(马希汉等,2011)。杜仲作为一种传统药用植物、天然橡胶的可能替代树种,其雌雄株的利用价值也有所不同,雄株通常用于园林或道路绿化,雌株叶的胶含量显著高于雄株叶,而雌株种子的胶含量高于雌雄植株的树皮和叶片(王丙武等,1999;杜红岩等,2006;莫俊等,2014),而且杜仲雌株的叶绿素和核酸含量显著高于雄株(赵云云等,1991)。因此,开展杜仲性别鉴定对于其利用具有重要意义。然而,杜仲需要种植7年以上才能开花,而开花前难以采用形态学或细胞学方法鉴定其性别。为了提高杜仲资源利用率,推动杜仲产业可持续发展,杜仲雌雄植株早期鉴定显得尤为重要。性别由基因决定,应用已知性别的植株筛选与性别相关的DNA分子标记,这种方法为雌雄异株植物性别早期鉴定提供了理论依据。目前,SSR分子标记在杜仲雌雄植株性别鉴定方面还未见报道,本研究旨在运用EST-SSR分子标记技术,开发杜仲性别特异的DNA标记,从而为杜仲性别的早期鉴定提供科学依据和技术支撑。
1 材料与方法 1.1 试验材料选择7个不同地区已知性别的雌、雄植株各6株(表 1),采摘无病虫害、完全展开的嫩叶,用多于叶样20倍体积的变色硅胶干燥,用于性别标记的筛选;选择贵州大学农业生物工程研究院试验基地已确定性别的13年生雌雄植株各12株,采集嫩叶,用于性别标记的验证。
|
|
1) 杜仲基因组DNA的提取采用新型植物基因组提取试剂盒(天根,型号:tgDP320-03)提取基因组DNA。取3 μL DNA样品与1 μL 6×Loading buffer混匀后上样,以30 ng·μL-1的λDNA作为marker,用1%的琼脂糖凝胶电泳检测DNA质量及浓度,置于-20 ℃保存、备用。
2) 微卫星序列查找与引物设计根据杜仲转录组文库(赵德刚等,2015)中EST-SSR的两翼序列,应用Primer 3-2.3.4与Oligo 6.0软件相结合设计引物,设计引物时设置的主要参数为:GC含量40%~70%,退火温度58~62 ℃,引物长度18~23 bp,预期扩增产物长度100~300 bp,且无二级结构和二聚体。最终随机挑选出140对引物,命名为EST-Eu加序号,如EST-Eu001,将序列送英潍捷基(上海)贸易有限公司合成引物。
3) EST-SSR PCR扩增反应条件采用20 μL PCR扩增反应体系:2×premix Taq(Takara:RR901A)10 μL,DNA 1 μL(25 ng·μL-1),正、反向引物各0.5 μL(10 μmol·L-1),用灭菌双蒸水补足20 μL。PCR反应在BIO-RAD C1000上进行,反应程序为:94 ℃预变性4 min,再进行35个循环,每个循环包括94 ℃变性40 s,tm(43~65 ℃,因引物而异)复性30 s,72 ℃延伸40 s,最后72 ℃延伸10 min,4 ℃保存。
4) 扩增产物的检测PCR扩增产物先用3%的琼脂糖凝胶(制胶时加入BIOTUM公司生产的10 000×的GelRed DNA染料)、1×TAE缓冲液、120 V电泳60 min,检测是否有与性别相关的特异条带;若有特异条带,则用8%的变性聚丙烯酰胺凝胶进行电泳分离,采用垂直电泳槽(北京六一,型号:DYCZ-30)以及BIO-RAD公司生产的电泳仪(PowerPac 3000)、1×TBE缓冲液, 在120 V电压下电泳180 min。电泳结束后,参照刘涛(2011)的银染方法进行染色,应用BIO-RAD公司的Molecular Imager ChemiDocTMXRS+凝胶成像仪及配套的凝胶成像系统Image Lap进行观察、拍照。
5) EST-SSR片段的克隆与测序以筛选性别标记所用的雌雄植株DNA各6份为模板进行PCR扩增,PCR产物包括雌株片段6条(命名:Eu-f160-1-6)、雄株片段6条(命名:Eu-m160-1-6)以及雄性特异片段6条(命名:EuMSM 1-6),经Gel Extraction Kits(OMEGA,美国)回收纯化后,用pGEM®-T Easy Vector system (Promega,美国)的方法将纯化产物连接至T载体上,连接产物导入大肠杆菌(Escherichia coli) DH5α感受态细胞中,涂布于含有X-Gal、IPTG和Amp+的LB平板筛选培养基上进行蓝白斑筛选,37 ℃倒置过夜培养。挑取阳性单菌落, 以EST-Eu059引物进行菌落PCR,检测目的片段是否转化在大肠杆菌中,同时挑取PCR验证后的阳性菌落在恒温37 ℃、转速200 r·min-1条件下过夜摇菌,用Plasmid Mini Kits(OMEGA,美国)提取质粒。质粒送北京诺赛基因组研究中心有限公司测序。使用SerialCloner 2.0进行序列查找、拼接和序列间的比对,雄性特异序列导入美国国家生物技术信息中心(National Center of Biotechnology Information)的Blastn(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列比对。
2 结果与分析 2.1 EST-SSR性别特异片段的筛选利用140对EST-SSR特异引物对杜仲雌、雄植株各6株的基因组DNA进行PCR扩增,结果显示:在140对特异引物中,有131对引物在PCR扩增中成功扩增出产物,只有引物EST-Eu059在雌、雄样品中扩增得到了不同产物(图 1);该引物在最佳退火温度为59 ℃进行PCR,在6份雄株样品中都有2条序列,而6份雌株样品中均仅1条序列(Eu-f160),且其片段大小与雄株样品的1条序列(Eu-m160)相同(约160 bp)。仅在雄株中出现的序列,其片段大小约120 bp,命名为EuMSM: E. ulmoidesmale specific marker(图 2),该引物正向序列为5′-GTG TCATTCGGTTGTCAGGTT-3′,反向序列为5′-TTG TTCTCTGCTCCTAGTTCAGC-3′。这一结果用同样的步骤,重复3次,得到同样的结果,说明该标记稳定、可靠。
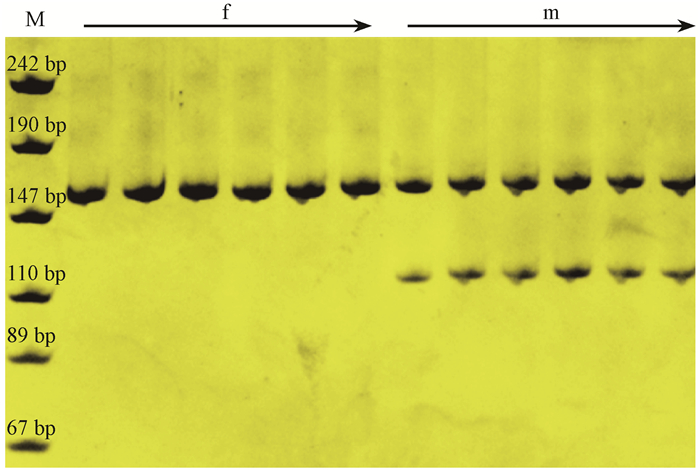
|
图 1 引物EST-Eu059在杜仲雌雄株样品的扩增结果 Fig.1 The result of PCR amplification with primer EST-Eu059 for dioecious plants of E. ulmoides M:DL500 DNA marker; f:雌株The female(Left to right: ASF14, JKF3, GSF1, QNYF8, QNCF28, XYF2); m:雄株The male (Left to right: ASM8, DFM11, FHSM3, QNCM35, JKM11, JKM14). |

|
图 2 EuMSM性别特异序列比对结果 Fig.2 Alignment result of EuMSM gender specific sequence seq-1:Eu-m160;seq-2:EuMSM. |
利用EST-Eu059为引物,以筛选性别标记所用的雌雄植株DNA各6份为模板进行PCR扩增的产物连接在T载体上,经测序发现,Eu-f160与Eu-m160均为156 bp,且有2个碱基不相同;EuMSM为112 bp,分别与Eu-f160、Eu-m160进行比对,Eu-f160和Eu-m160序列均有重复单元(GT)6,但是前者在重复单元内的第3个G碱基变为A,可能产生了突变,而EuMSM序列缺失重复单元(GT)6。经Blastn比对NCBI的核酸和EST数据库显示,在GenBank数据库中的序列与EuMSM序列没有同源性。
2.3 雄性特异性标记的验证用杜仲雌、雄植株基因组DNA各12份进行验证,引物EST-Eu059在全部雄株中均扩增得到1条雄性特异条带(图 3)。
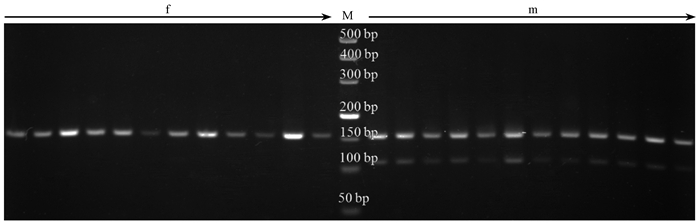
|
图 3 引物EST-Eu059应用于雌雄植株鉴别的验证 Fig.3 The verification of PCR products with primer EST-Eu059 for female and male plants f:雌株The female(Left to right: QNC1B, QNC1C, QNC1D, QNC7A, QNC12, QNC36, QNC30, QNC37, QNC42, QNY11, QNY10, QNY17); M: DL 500 DNA marker; m:雄株The male(Left to right: QNC1A, QNC7B, QNC11, QNC17B, QNC21, QNY1, QNC40, QNC43, QNY12, QNY15, QNY16, QNC19). |
在被子植物中,个体性别分离是雌雄同株经独立进化100多次而产生的(Charlesworth,2002; 丁一等,2014)。而植物的性别决定是一个复杂的过程,是基因、环境和激素协同调控的动态过程,在遗传性别决定系统(genetic sex determination, GSD)中,性别分离是通过减数分裂的等位基因发生分离所决定的,其基因表达模式不变但基因的含量发生了变化(Golenberg et al., 2013)。Sakamoto等(1998)对二倍体植物大麻(Cannabis sativa)雌雄株的核基因组大小分别测定发现,雌株为1 636 Mb,雄株为1 683 Mb,认为这种差异可能是Y染色体尺寸大所致。白麦瓶草(Silene latifolia)是性染色体进化最高级阶段的代表物种, 其雌株核基因组的大小比雄株的大2%~5%(Costich et al., 1991), 且具有形态和结构差异都明显的X和Y染色体, Y染色体大于X染色体,主要原因是Y染色体积累了大量的重复DNA序列、转座因子和串联重复序列(Charlesworth,1991;Shibata et al., 1999;高武军等,2010);而用流式细胞仪检测Melandrium album和M.rubrum的雌雄植株基因组却发现,雌株的DNA量比雄株DNA量小,这可能是由于性染色体异态型所致(Dolezel et al., 1995)。本实验室建立的杜仲转录组文库中,雌株获得159 434个Unigene片段、雄株257 288个Unigene片段(赵德刚等,2015),推测杜仲的性别可能是由特定的染色体差异导致,因此下一步可以进行染色体核型分析,分析杜仲的染色体形态及结构,观察雌雄植株染色体是否有差异。由于分子标记与基因可能产生共分离,因此可以应用分子标记技术开发与性别相关的特定标记。Peil等(2003)发现了2个与大麻雄株的Y染色体连锁的AFLP标记;Rode等(2005)通过单杂交(single cross)证明了与性别连锁的SSR标记在大麻雌雄株的X和Y染色体都有多态性。
分子标记辅助选择(molecular marker-assisted selection,MAS)是利用与目标基因紧密连锁的分子标记对是否带有目标基因的单株进行选择,该技术不受环境及植株生长发育阶段的影响,在植株苗期或低世代就可以进行筛选,且只需少量叶片样本,对植株的生长发育及后续繁殖无任何影响,具有快速、简便、低成本等优点(裴庆利等,2011;周胜军等,2013)。近年来,随着分子标记的广泛应用,RAPD(Di et al., 1998),AFLP(Wang et al., 2011),SRAP(Zhou et al., 2011),ISSR(王弦云,2013; Nanda et al., 2013),SSR(Elmeer et al., 2012)等已在植物性别鉴定中得到成功应用。RAPD,AFLP,ISSR均为显性标记,不能区分纯合体和杂合体;SRAP是Li等(2001)开发的一种新型共显性分子标记,其简便、高效、重复性好、多态性高,但应用在性别鉴定中效果并不明显;SSR是简单重复序列,分布于整个基因组中,多态性较丰富,重复性和可信度高,且属共显性标记,可鉴别纯合子和杂合子,在生物遗传多样性研究、亲缘关系分析、种质鉴定以及遗传图谱构建等方面得到广泛应用。RAPD(Xu et al., 2004),SCAR(Xu et al., 2004; Wang et al., 2011;Liao et al., 2009),AFLP(Wang et al., 2011)以及ISSR(王弦云,2013)标记在杜仲雌雄植株鉴别上也得到应用。Xu等(2004)用RAPD技术在杜仲雌株中扩增出特有的569 bp片段,并转化为1个SCAR标记;Wang等(2011)在杜仲中获得与雄株性别相关的AFLP片段,且成功转化成1个SCAR标记;王弦云(2013)应用ISSR标记扩增出1条大小为3 000 bp的雌性特异性条带。EST-SSR标记是基于表达序列标签或转录组序列数据库开发的SSR分子标记,来自基因组的编码区,直接反映表达信息,与其他分子标记(如AFLP,RAPD,GSSR)相比在物种之间具有更高通用性。随着高通量测序技术的应用,降低了SSR标记的开发成本,SSR标记在分子标记辅助选择中已得到广泛应用,如在植物的抗病(吴金红等,2002;陈峰等,2010)、抗虫(李进波等,2006)及性别(时秋香等,2009;周胜军等,2013)紧密连锁的基因挖掘。本研究以杜仲已知性别的雌、雄植株基因组DNA作为模板,选用140对EST-SSRs引物筛选合适的性别特异标记,发现引物EST-Eu059在杜仲雌、雄植株中出现了差异条带,且其重复性好,雌、雄植株样品都有1条相同的条带与预期产物大小一致,经比对2条序列具有高度同源性,而雄株还具有1条特异片段(EuMSM),该片段缺失了重复序列(GT)6,这可能是在进化过程中发生了缺失变异。以引物EST-Eu059的PCR扩增在杜仲雌、雄植株中出现了差异条带,说明杜仲的性别分离可能是减数分裂的等位基因发生分离所导致的,但杜仲的性别决定机制研究还很少,其具体机制还有待后续探索。EuMSM的序列与NCBI的现有序列均无同源性,说明该基因序列属首次发现或其功能还未知。EuMSM是基因组编码区的表达序列,对性别的表达可能具有调控作用,其机制还有待深入研究。
4 结论本研究开发了1个与杜仲雄株性别相关的EST-SSR标记EST-Eu059,应用该标记能够在杜仲开花前检测其性别,该方法具有高效、快速、可靠等优点。与以往AFLP(Wang et al., 2011)、RAPD(Xu et al., 2004)和ISSR(王弦云, 2013)标记技术开发的杜仲性别鉴定标记相比,SSR标记重复性好,操作简便快捷,不需再转化为SCAR标记,可以直接应用,而且属于共显性标记。该EST-SSR标记为杜仲雌、雄植株的合理利用提供了技术保障,从而提高杜仲资源利用率,推动杜仲产业可持续发展。
| [] |
陈峰, 张士永, 朱文银, 等. 2010. 分子标记辅助选择改良圣稻13和圣稻14的条纹叶枯病抗性. 中国农业科学 , 43 (16) : 3271–3279.
( Chen F, Zhang S Y, Zhu W Y, et al.2010. Improving resistance of Japonica varieties Shengdao13 and Shengdao14 to rice stripe virus disease by molecular marker-assisted selection. Scientia Agricultura Sinica , 43 (16) : 3271–3279. [in Chinese] ) |
| [] |
程晓建, 王白坡, 郑炳松, 等. 2002. 银杏雌雄株性别鉴别研究进展. 浙江林学院学报 , 19 (2) : 217–221.
( Cheng X J, Wang B P, Zheng B S, et al.2002. Progress on sex identification of dioecism in Ginkgo biloba. Journal of Zhejiang Forestry College , 19 (2) : 217–221. [in Chinese] ) |
| [] |
丁一, 徐启江. 2014. 被子植物成花诱导和性别决定机制的研究进展. 植物生理学报 , 50 (1) : 19–36.
( Ding Y, Xu Q J.2014. Progress on floral induction and sex determination in angiosperm. Plant Physiology Journal , 50 (1) : 19–36. [in Chinese] ) |
| [] |
杜红岩, 杜兰英, 傅建敏, 等. 2006. 杜仲不同器官含胶率的差异及其相关性分析. 中南林学院学报 , 26 (4) : 1–4.
( Du H Y, Du L Y, Fu J M, et al.2006. The difference and its pertinence analysis of the gutta-percha content in organs of Eucommia ulmoides Oliv. Journal of Central South Forestry University , 26 (4) : 1–4. [in Chinese] ) |
| [] |
高武军, 谢璐, 卢靖雯, 等. 2010. 重复序列及异染色质化在植物性染色体重组抑制中的作用. 遗传 , 32 (1) : 25–30.
( Gao W J, Xie L, Lu J W, et al.2010. Role of repetitive sequence and heterochromatize in recombination suppression of plant sex chromosomes. Hereditas (Beijing) , 32 (1) : 25–30. DOI:10.3724/SP.J.1005.2010.00025 [in Chinese] ) |
| [] |
康宗利, 王宁, 杨玉红, 等. 2011. 猕猴桃性别鉴定研究进展. 北方园艺 (20) : 184–187.
( Kang Z L, Wang N, Yang Y H, et al.2011. Research progress on the sex identification of Actinidia. Northern Horticulture (20) : 184–187. [in Chinese] ) |
| [] |
李进波, 夏明元, 戚华雄, 等. 2006. 水稻抗褐飞虱基因Bph14和Bph15的分子标记辅助选择. 中国农业科学 , 39 (10) : 2132–2137.
( Li J B, Xia M Y, Qi H X, et al.2006. Marker-assisted selection for brown planthopper (Nilaparvata lugens Stål) resistance genes Bph14 and Bph15 in rice. Scientia Agricultura Sinica , 39 (10) : 2132–2137. [in Chinese] ) |
| [] |
李同华, 姜静, 陈建名, 等. 2004. 种子植物性别的多态性. 东北林业大学学报 , 32 (5) : 48–52.
( Li T H, Jiang J, Chen J M, et al.2004. The sexual polymorphism of seed plant. Journal of Northeast Forestry University , 32 (5) : 48–52. [in Chinese] ) |
| [] |
刘涛. 2011.贵州玉米种质资源遗传多样性分析及种子纯度鉴定研究.贵阳:贵州大学硕士学位论文, 22-25. ( Liu T. 2011. Studies on genetic diversity analysis of corn germplasms and purity identification of hybrid corn in Guizhou. Guiyang:MS thesis of Guizhou University, 22-25.[in Chinese]) |
| [] |
马希汉, 张康健. 2011. 中国杜仲近代认识史上的四次飞跃. 中成药 , 33 (8) : 1393–1396.
( Ma X H, Zhang K J.2011. Four leap of knowledge of China Eucommia in modern history. Chinese Traditional Patent Medicine , 33 (8) : 1393–1396. [in Chinese] ) |
| [] |
莫俊, 赵德刚. 2014. 杜仲胶累积与异戊二烯代谢途径相关基因表达关系研究. 山地农业生物学报 , 11 (3) : 28–32.
( Mo J, Zhao D G.2014. The relationship between the expression of isoprene metabolic pathway genes and gutta-percha rubber contents in Eucommia ulmoides Oliver. Journal of Mountain Agriculture and Biology , 11 (3) : 28–32. [in Chinese] ) |
| [] |
裴庆利, 王春连, 刘丕庆, 等. 2011. 分子标记辅助选择在水稻抗病虫基因聚合上的应用. 中国水稻科学 , 25 (2) : 119–129.
( Pei Q L, Wang C L, Liu P Q, et al.2011. Marker-assisted selection for pyramiding disease and insect resistance genes in rice. Chinese Journal of Rice Science , 25 (2) : 119–129. [in Chinese] ) |
| [] |
时秋香, 刘世强, 李征, 等. 2009. 与黄瓜M基因连锁的三个共显性标记. 园艺学报 , 36 (5) : 737–742.
( Shi Q X, Liu S Q, Li Z, et al.2009. Three co-dominant markers linked to M gene in Cucumis sativus. Acta Horticulturae Sinica , 36 (5) : 737–742. [in Chinese] ) |
| [] |
王丙武, 王雅清, 莫华, 等. 1999. 杜仲雌雄株细胞学、顶芽及叶含胶量的比较. 植物学报 , 41 (1) : 11–15.
( Wang B W, Wang Y Q, Mo H, et al.1999. Comparison of cytology, apical buds and gutta content between staminate and pistillate of Eucommia ulmoides trees. Acta Botanica Sinica , 41 (1) : 11–15. [in Chinese] ) |
| [] |
王克霞. 2004.芦笋雌雄株间生理生化特性的差异研究.杭州:浙江大学硕士学位论文. ( Wang K X. 2004. Comparative studies on the differences of physiological and biochemical characteristics between male and female asparagus. Hangzhou:MS thesis of Zhejiang University.[in Chinese][in Chinese]) http://cdmd.cnki.com.cn/article/cdmd-10335-2004082233.htm |
| [] |
王弦云. 2013. ISSRs在杜仲遗传多样性研究及性别鉴定中的应用.合肥:安徽农业大学硕士学位论文. ( Wang X Y. 2013. Application of ISSRs to analysis of genetic diversity and sex identification for Eucommia ulmoides. Hefei:MS thesis of Anhui Agricultural University.[in Chinese][in Chinese]) http://cdmd.cnki.com.cn/article/cdmd-10364-1014147770.htm |
| [] |
吴金红, 蒋江松, 陈惠兰, 等. 2002. 水稻稻瘟病抗性基因Pi-2(t)的精细定位. 作物学报 , 28 (4) : 505–509.
( Wu J H, Jiang J S, Chen H L, et al.2002. Fine mapping of rice blast resistance gene Pi-2 (t). Acta Agronomica Sinica , 28 (4) : 505–509. [in Chinese] ) |
| [] |
许智宏, 刘春明. 1998. 植物发育的分子机理. 北京: 科学出版社 : 225 -238.
( Xu Z H, Liu C M. 1998. Molecular mechanism of plant development. Beijing: Science Press : 225 -238. [in Chinese] ) |
| [] |
赵德刚, 李岩, 赵懿琛, 等. 2015. 杜仲雌雄株转录组测序数据组装及基因功能注释. 山地农业生物学报 , 34 (1) : 1–12.
( Zhao D G, Li Y, Zhao Y Z, et al.2015. Transcriptome data assembly and gene function annotation of female and male plants in Eucommia ulmoides. Journal of Mountain Agriculture and Biology , 34 (1) : 1–12. [in Chinese] ) |
| [] |
赵云云, 刘捷平. 1991. 雌雄异株植物的生理生化特性及性别鉴定. 北京师范学院学报:自然科学版 , 12 (4) : 27–33.
( Zhao Y Y, Liu J P.1991. Physiological and biochemical characteristics and identification of the sexes in dioecious plants. Journal of Capital Normal University:Natural Science Edition , 12 (4) : 27–33. [in Chinese] ) |
| [] |
周胜军, 张鹏, 朱育强, 等. 2013. 与黄瓜全雌性基因连锁的SSR分子标记. 浙江大学学报:农业与生命科学版 , 39 (3) : 291–298.
( Zhou S J, Zhang P, Zhu Y Q, et al.2013. Identification of SSR marker linked to gynoecious loci in cucumber (Cucumis sativus L). Journal of Zhejiang University:Agriculture and Life Sciences , 39 (3) : 291–298. [in Chinese] ) |
| [] | Charlesworth B.1991. The evolution of sex chromosomes. Science , 251 (4997) : 1030–1033. DOI:10.1126/science.1998119 |
| [] | Charlesworth D.2002. Plant sex determination and sex chromosomes. Heredity , 88 (2) : 94–101. DOI:10.1038/sj.hdy.6800016 |
| [] | Costich D E, Meagher T R, Yurkow E J.1991. A rapid means of sex identification in Silene latifolia by use of flow cytometry. Plant Mol Biol Rep , 9 (4) : 359–370. DOI:10.1007/BF02672012 |
| [] | Dolezel J, Gohde W.1995. Sex determination in dioecious plants Melandrium album and M. rubrum using high-resolution flow cytometry. Cytometry , 19 (2) : 103–106. |
| [] | Di S V, Kesseli R V, Mulcahy D L.1998. A pseudoautosomal random amplified polymorphic DNA marker for the sex chromosomes of Silene dioica. Genetics , 149 (4) : 2057–2062. |
| [] | Elmeer L K, Mattat I.2012. Marker-assisted sex differentiation in date palm using simple sequence repeats. Biotech , 2 (2) : 241–247. |
| [] | Golenberg E M, West N W.2013. Hormonal interactions and gene regulation can link monoecy and environmental plasticity to the evolution of dioecy in plants. American Journal of Botany , 100 (6) : 1022–1037. DOI:10.3732/ajb.1200544 |
| [] | Li G, Quiros C F.2001. Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica. Theoretical & Applied Genetics , 103 (2) : 455–461. |
| [] | Liao L Q, Liu J, Dai Y X, et al.2009. Development and application of SCAR markers for sex identification in the dioecious species Ginkgo biloba L. Euphytica , 169 (1) : 49–55. DOI:10.1007/s10681-009-9913-8 |
| [] | Nanda S, Kar B, Nayak S, et al.2013. Development of an ISSR based STS marker for sex identification in pointed gourd (Trichosanthes dioica Roxb). Scientia Horticulturae , 150 : 11–15. DOI:10.1016/j.scienta.2012.11.009 |
| [] | Peil A, Flachowsky H, Schumann E, et al.2003. Sex-linked AFLP markers indicate a pseudoautosomal region in hemp (Cannabis sativa L). Theoretical & Applied Genetics , 107 (1) : 102–109. |
| [] | Rode J, Chol I K, Saal B, et al.2005. Sex-linked SSR markers in hemp. Plant Breeding , 124 : 167–170. DOI:10.1111/pbr.2005.124.issue-2 |
| [] | Sakamoto K, Akiyama Y, Fukui K, et al.1998. Characterization; genome size and morphology of sex chromosomes in hemp (Cannabis sativa L.). Cytologia. Cytologia , 63 (4) : 459–464. DOI:10.1508/cytologia.63.459 |
| [] | Shibata F, Hizume M, Kuroki Y.1999. Chromosome painting of Y chromosome and isolation of a Y chromosome-specific repetitive sequences in the dioecious plant Rumex acetosa. Chromosoma , 108 (4) : 266–270. DOI:10.1007/s004120050377 |
| [] | Wang D W, Li Y, Li Z Q.2011. Identification of a male-specific amplified fragment length polymorphism (AFLP) and a sequence characterized amplified region (SCAR) marker in Eucommia ulmoides Oliv. International Journal of Molecular Sciences , 12 (1) : 857–864. |
| [] | Xu W J, Wang B W, Cui K M.2004. RAPD and SCAR markers linked to sex determination in Eucommia ulmoides Oliv. Euphytica , 136 (3) : 233–238. DOI:10.1023/B:EUPH.0000032741.99885.c4 |
| [] | Zhou Y J, Wang X G, Zhang X Q.2011. Development and application of a SRAP marker for the identification of sex in Buchloe dactyloides. Euphytica , 181 (2) : 261–266. DOI:10.1007/s10681-011-0419-9 |
 2016, Vol. 52
2016, Vol. 52

