文章信息
- 许秀兰, 杨春琳, 田莎, 姜欣华, 刘韩, 刘应高
- Xu Xiulan, Yang Chunlin, Tian Sha, Jiang Xinhua, Liu Han, Liu Yinggao
- 华山松凋落针叶上的真菌多样性及4株真菌的纤维素分解能力
- Fungal Diversity in Pinus armandii Litter and the Cellulose Decomposing Capacity of Four Fungal Strains of Rhizosphaera and Lophodermium
- 林业科学, 2016, 52(1): 80-88
- Scientia Silvae Sinicae, 2016, 52(1): 80-88.
- DOI: 10.11707/j.1001-7488.20160110
-
文章历史
- 收稿日期:2014-07-09
- 修回日期:2015-10-12
-
作者相关文章
2. 四川省甘孜州林业科学研究所 甘孜 626000
2. Ganzi Institute of Forestry Research of Sichuan Province Ganzi 626000
目前,森林微生物资源的研究逐渐成为热点。过去的几十年里,有关内生真菌区系的研究快速发展,其中不乏对松(Pinus)属植物各组织内生真菌的研究(Botella et al., 2011; Hoff et al., 2004; Hu et al., 2007); 同时,森林凋落物以及土壤真菌的类群研究也有了较大发展。真菌在凋落物中广泛存在,不同类型腐生真菌在凋落物分解的不同时期发挥着重要作用(陈辉等,1993);但是,凋落物中许多真菌的生理生态功能仍未得到清楚的认识,科技人员仍在不断扩大对真菌的研究,以发现新的功能菌株。
根球壳孢菌属(Rhizosphaera)属于半知菌类球壳孢目(Sphaeropsidales)(Kumi et al., 1979),对该属真菌的研究起步较晚,其中对云杉叶疫病菌(Rhizosphaera kalkhoffii)的报道较多。云杉叶疫病菌在多种云杉属(Picea)、冷杉属(Abies)、松属植物的针叶中均可寄生(Kumi et al., 1979);其致病性在不同地方、不同针叶树上存在差异(Kumi et al., 1979; Livsey et al., 1992; Juzwik,1993),有的认为该菌是导致针叶落针的主要原因,有的则认为该菌属于弱寄生菌。在西班牙冷杉(Abies pinsapo)的发病针叶上还发现一种根球壳孢菌(Rhizosphaera oudemansii),该菌与非生物因子共同作用引起落针病(Martinez et al., 1983)。国内关于根球壳孢菌的报道很少,任玮(1990)首次报道由云杉叶疫病菌(Rhizosphaera kalkhoffii)在云南和四川地区的丽江云杉(Picea likiangensis)上引起的云杉病害;而近期报道在大兴安岭地区由该菌引起的樟子松(Pinus sylvestris var. mongolica)病害(You et al., 2013)。
二郎山林场位于四川甘孜泸定县与雅安市天全县交界处,场内针叶林居多,主要树种有冷杉、云杉、落叶松(Larix spp.)、华山松(Pinus arm and ii)、云南松(Pinus yunnanensis)、高山松(Pinus densata)、栎(Quercus)、桦(Betula)以及杨(Populus)树等,其中,华山松为主要建群树种之一。本研究对二郎山林场华山松初始凋落针叶中的真菌进行分离鉴定,并对丰富物种根球壳孢菌进行室内分解试验,旨在分析亚高山华山松凋落物中的真菌多样性与凋落物分解的关系,初探根球壳孢菌在针叶分解中的产酶特性,为该菌生活习性的深入研究奠定基础。
1 材料与方法 1.1 供试材料 1.1.1 菌种来源根球壳孢菌菌株Rhizosphaera sp.1,Rhizosphaera sp.2和Rhizosphaera sp.3分离自二郎山林场华山松凋落针叶;二郎山散斑壳(Lophodermium erlangshanense)分离自二郎山林场华山松,由四川农业大学森林保护重点实验室提供。
1.1.2 材料于2012年10月从二郎山林场海拔分别为2 750,2 650,2 510和2 460 m的华山松林下收集新近凋落针叶,放入无菌袋中带回实验室进行真菌分离。
1.1.3 培养基采用刚果红法(Teather et al., 1982)对不同固体培养基上生长的菌落进行染色观察并测量,以菌丝生长情况、分解圈透明程度以及透明圈/菌落比值作为筛选最优培养筛选的标准。最终用于分解的培养基组成如下:MgSO4·7H2O 1.25 g,KH2PO4 2.5 g,KNO3 5.0 g,FeCl4·6H2O 0.01 g,葡萄糖0.05 g,无菌水定容至1 L。
1.2 试验方法 1.2.1 分离培养采用松针研磨法进行真菌分离:在无菌条件下,称取1.0 g剪碎的松针(0.5 cm左右)于研钵中,加入50 mL无菌蒸馏水和少量石英砂,研磨3 min后转入三角瓶。将研磨液用无菌水稀释成10-1,10-2和10-3倍,分别取100 μL均匀涂布在PDA培养基上,每个浓度重复3个平板,同时重复3次分离。于恒温培养箱中培养,培养条件为25 ℃、自然光-黑暗交替。观察菌落生长情况,对单个菌落进行纯化保存。
1.2.2 室内分解材料处理使用海拔2 510 m样地新近凋落针叶为室内分解材料,用蒸馏水浸泡并洗净表面残渣,再将处理后的针叶于105 ℃杀青15 min,杀死针叶本身所带微生物,65 ℃烘干至恒质量,用剪刀剪成1 cm针段,混匀保存于干燥器中备用。
1.2.3 分子生物学鉴定分离纯化的真菌采用通用引物ITS 1和ITS 4对rDNA ITS区进行扩增。ITS 1: 5'-TCCGTAGGTGAACCTGCGG-3'(19 bp); ITS 4: 5'-TCCTCCGCTTATTGATATGC-3'(20 bp)。1)
DNA的提取 将菌株在PDA平板上活化3 ~ 7天,接种直径5 mm的菌饼于50 mL的PDA液体培养基上,25 ℃、100 r·min-1培养5 ~ 7天。用灭菌的纱布过滤菌丝,再用灭菌后的滤纸尽量将水分吸干,得到菌丝用于DNA提取。DNA提取采用植物基因组DNA提取试剂盒法(天根生化科技(北京)有限公司),具体步骤参见试剂盒说明。
2)PCR反应体系(50 μL)引物各 2.0 μL,ddH2O 19.0 μL,DNA模板2.0 μL,2×TaqPCR Master mix 25.0 μL。PCR扩增程序(35个循环):95 ℃预变性DNA 5 min; 95 ℃变性1 min,50 ℃退火1 min,72 ℃延伸1 min; 72 ℃延伸5 min。
3)PCR产物检测及测序 PCR反应终止后,对产物进行琼脂糖凝胶电泳检测(1%的1×TBE)。电泳结束后通过凝胶成像系统观察结果,若条带清晰无杂条带,则将PCR产物送至上海生工生物技术公司测序。
1.2.4 分解培养基筛选3种分解培养基配方如下:①KH2PO4(0.50 g)、MgSO4·7H2O(0.50 g)、NaCl(0.50 g)、CMC-Na(2.00 g)、蛋白胨(1.00 g)、葡糖糖(0.05 g)、琼脂条(20.00 g)、蒸馏水(1 000 mL);②KH2PO4(2.50 g)、MgSO4·7H2O(1.25 g)、KNO3(5.00 g)、CMC-Na(2.00 g)、FeCl3·6H2O(0.01 g)、葡糖糖(0.05 g)、琼脂条(20.00 g)、蒸馏水(1 000 mL);③KH2PO4(1.00 g)、MgSO4·7H2O(0.20 g)、NaNO3(2.00 g)、KCl(0.20 g)、酵母浸出膏(0.20 g)、CMC-Na(2.00 g)、葡糖糖(0.05 g)、琼脂条(20.00 g)、蒸馏水(1 000 mL)。分别配制以上3种固体培养基,在无菌条件下用打孔器取直径为5 mm的菌饼,每菌重复3个平板,置于恒温培养箱中25 ℃静止培养7天。采用刚果红法(Teather et al., 1982)对其进行染色观察并测量,以菌丝生长情况、分解圈透明程度以及透明圈/菌落比值作为筛选最优培养筛选的标准。最终培养基②为选定分解培养基。
1.2.5 针叶分解试验发酵试验参照郝杰杰等(2006)方法:称取0.500 g针叶倒入中号试管(18 mm×180 mm作为唯一碳源,再加最优培养基10.0 mL。塞上棉塞并放入高压蒸汽灭菌锅121 ℃灭菌30 min,冷却备用。在无菌条件下,用打孔器打取直径为5 mm的菌饼,每管接4块菌饼,同时以不接菌作为空白对照管,每个处理接18管。自接种后第5天起,每4天取样1次,每次取4管(3根接菌管+1根无菌管),连续取样6次。
1.2.6 针叶质量损失率及酶活测定用烘干至恒质量的滤纸过滤试管中混合溶液,同时用柠檬酸缓冲液(0.05 mol·L-1,pH4.8)多次冲洗分解残渣,最终所得滤液用缓冲液定容至8 mL,即得到待测酶液。残渣连同滤纸一起放入烘箱中,烘干至恒质量(105 ℃处理15 min,65 ℃烘至恒质量),并称量。
$$\eqalign{ & {\rm{针叶质量损失率}}\left( {\rm{\% }} \right){\rm{ = }}{{0.5 - {\rm{残渣质量}}} \over {0.5}} \times 100\% , \cr & {\rm{平均分解速率}}\left( {\rm{\% }} \right){\rm{ = }}{{\rm{针叶质量损失率}} \over {\rm{培养天数}}} \times 100\% \cr} $$
内切纤维素酶(endoglucanase,EG)酶活测定以羧甲基纤维素钠(CMC-Na)为酶解底物,外切纤维素酶(cellobiohydrolase,CBH)和β-葡萄糖苷酶(β-glucosidase,BGL)分别以微晶纤维素和水杨苷为酶解底物,测定参照许玉林等(2013)方法。
酶活定义:在特定条件下,1 min水解底物产生相当于1 μmol葡萄糖的还原糖量为1个酶活力单位,以U·mL-1表示:
$$\eqalign{ & {\rm{酶活力}}\left( {{\rm{U}} \cdot {\rm{m}}{{\rm{L}}^{ - 1}}} \right){\rm{ = }} \cr & {{{\rm{比色所得葡萄糖含量}} \times {\rm{待测酶液总体积}} \times {\rm{0}}{\rm{.093}}} \over {{\rm{比色所取酶液体积}} \times {\rm{保温时间}}}} \cr} $$ 式中:指标单位为含量(mg)、体积(mL)、时间(h)。
1.3 数据处理使用SPSS 20.0和Excel 2007软件对试验数据进行统计和分析,MEGA5.0软件进行基因序列分析,同时用Origin 8.5软件作图。
2 结果与分析 2.1 华山松针叶中的真菌多样性查阅中国真菌志,试验最终从华山松凋落针叶中分离得到15属的真菌(图 1),分类于半知菌亚门(Deuteromycotina)、子囊菌亚门(Ascomycotion)、担子菌亚门(Basidiomycotina)和接合菌亚门(Zygomycotina)。15株属于半知菌类,丝孢纲(Hyphomycetes)丝孢目(Hyphomycetales)真菌11株,其中青霉属(Penicillium)真菌居多且种类最丰富; 1株属于丝孢纲瘤座孢目(Tuberculariales)镰刀菌(Fusarium tricinctum); 3株属于腔孢纲(Coelamycetes)球壳孢目(Sphaeropsidales),分别为茎点霉属(Phoma sp.)、根球壳孢菌属(Rhizosphaera sp.)和拟腊肠茎点霉属(Allantophomopsis sp.)。5株分类于子囊菌亚门,包括散囊菌目(Eurotiales)的蓝状菌属(Talaromyces amestolkiae)、缨霉属(Thysanophora penicillioides),炭角菌目(Xylariales)的拟盘多毛孢属(Pestalotiopsis vismiae)、球壳目(Sphaeriales)的肉座菌属(Hypocrea pachybasioides)以及柔膜菌目(Helotiales)的Ceuthospora sp.。2株真菌属于接合菌亚门,分别为毛霉目(Mucorales)的毛霉属(Mucor abundans)和伞状霉属(Umbelopsis isabellina)。1株为担子菌亚门伞菌目(Agaricales)的鬼伞属(Coprinellus sp.)。

|
图1 采用NJ法对23个分类单元建立系统发育树 Fig.1 Phylogenic tree based on NJ analysis of ITS data for evolutionary relationships of 23 taxa 数字表示不同分类单元的距离; 符号表示不同目:●丝孢目;○球壳孢目;△炭角菌目;▲散囊菌目;◆瘤座孢目;■毛霉目;★伞菌目;◇柔膜菌目;☆球壳目。 Numbers on branches indicate distances among different taxa. Symbols represent the different orders appeared in the analysis: ●Hyphomycetales; ○Sphaeropsidales; △Xylariales; ▲Eurotiales; ◆Tuberculariales; ■Mucorales; ★Agaricales; ◇Helotiales; ☆Sphaeriales. |
此外,不同海拔凋落物真菌分离频率存有差异(表 1)。Mucor sp.,Trichoderma sp.,Rhizosphaera sp.,Penicillium sp.,Talaromyces sp. 5属真菌在4个海拔均可分离得到,其中Penicillium sp.和Talaromyces sp.的分离频率相对最高,Penicillium sp.在海拔2 460 m和2 750 m凋落物中分离频率大于50%,Talaromyces sp. 则在海拔2 510 m和2 650 m样地针叶中分离频率较高,分别为45.413%和53.139%。Rhizosphaera sp. 的分离频率随着海拔的升高而降低,从分离频率来看,该菌在数量上不占优势,但在各样地均存在,说明其在该地区华山松凋落针叶中具有普遍性。
|
|
以真菌通用引物ITS1和ITS4对分离菌株的DNA进行PCR扩增并测序,测序结果在NCBI的数据库进行Blast同源性比对。比对结果显示,12株分离菌株与已注册的根球壳孢菌属真菌同源性高。选取同源性较高(同源性大于97%)的菌株序列进行系统发育树构建,该12株菌株与Rhizosphaera sp.(EU700373.1)聚为一支,亲缘关系近; 从分支长度分析,几株根球壳孢菌株与大多该属真菌的进化程度相当。
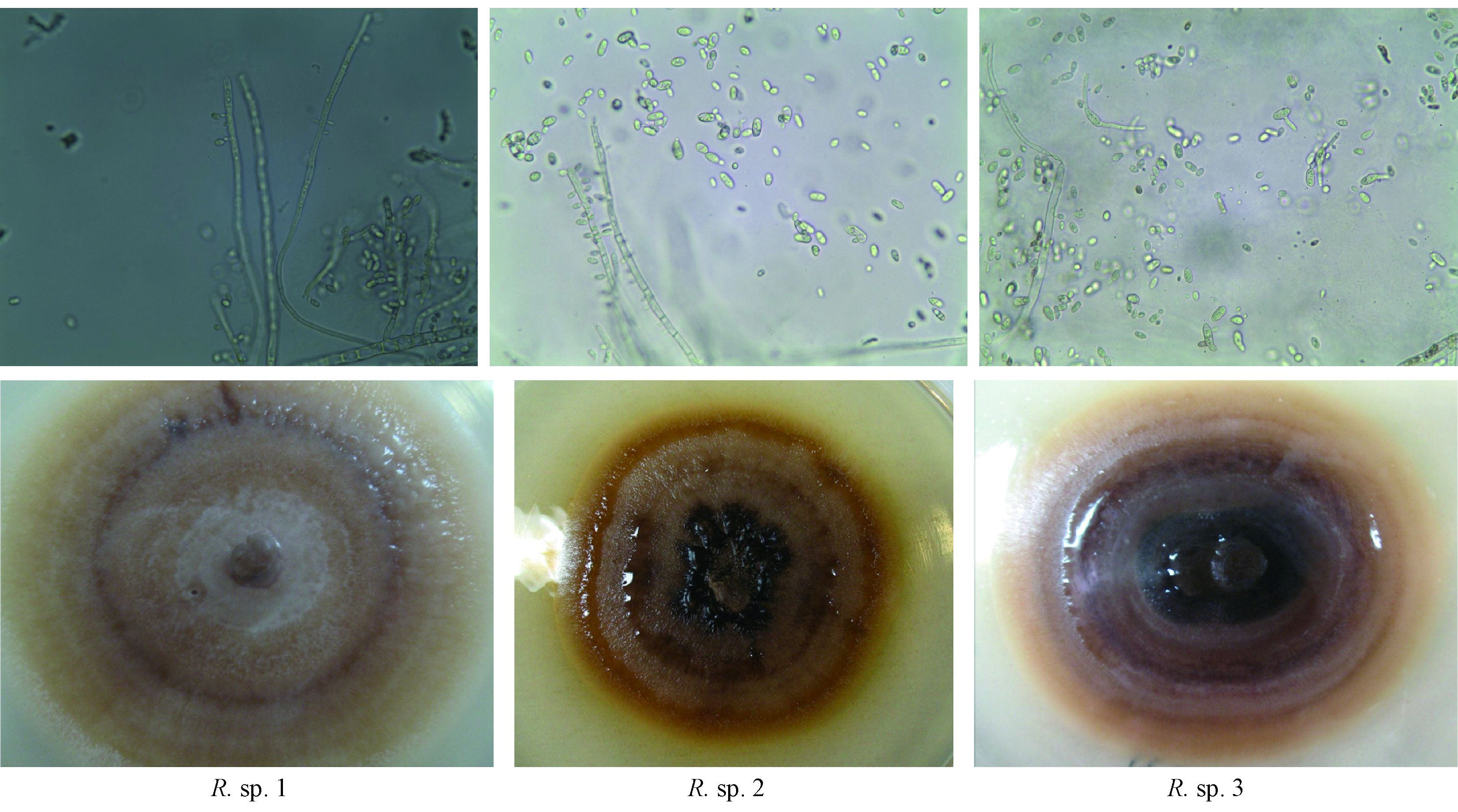
2.3 根球壳孢菌的形态特征根球壳孢菌在PDA平板上培养12天后,通过菌落形态和显微观察发现,根球壳孢菌气生菌丝均不发达或无,菌丝有隔且具分枝,菌丝宽3 ~ 9 μm; 分生孢子椭圆形至长椭圆形,大小为(6 ~ 14)μm×(4 ~ 7)μm。根据菌落颜色等特征,可将其归为3种不同的形态类型,代表菌株为R. sp.1,R.sp.2和 R. sp.2,用于后期的分解试验。3株菌株在PDA平板上生长速度不同,R. sp.1(6.3 cm)> R. sp.3(5.5 cm)> R.sp.2(5.3 cm),其菌落形态如图 2所示。
|
图2 PDA平板上3株供试菌株的菌落形态 Fig.2 The colony morphology of three strains of Rhizosphaera on PDA medium |
在室内发酵培养的前期,菌丝处于生长初期,通过利用松针破碎时所释放的可利用糖类满足生长需要;后期随着易分解成分消耗至尽,菌丝为了生存需求便开始生成酶类对难溶物质进行降解。试验结果显示,第9天时,各纤维素酶类活性均开始出现上升趋势;第13天时,3株根球壳孢菌株以及二郎山散斑壳的内切纤维素酶和β-葡聚糖酶活性均达到峰值,而外切纤维素酶活性则在第17天时达到峰值;随后至第21天,各酶活表现出下降趋势直至一个较平稳的状态(图 3)。

|
图3 室内分解过程中纤维素酶活性动态变化 Fig.3 Dynamic activities of EG,CBH and BGL produced by R. sp.during the degradation |
同时,比较不同菌株在峰值的各纤维素酶活性大小发现,根球壳孢菌与二郎山散斑壳之间的各酶活能力相当。内切纤维素酶活性最大值为R. sp.1(0.820 U·mL-1)>L. erlangsshanense(0.777 U·mL-1)>R. sp.3(0.713 U·mL-1)>R. sp.2(0.638 U·mL-1); 菌株R. sp.1外切纤维素酶活性最高为0.821 U·mL-1,其次是R. sp.3(0.717 U·mL-1),R. sp.2(0.676 U·mL-1),L. erlangshanense(0.568 U·mL-1); 而β-葡聚糖酶最高酶活性大小是R. sp.1(0.655 U·mL-1)>L. erlangshanense(0.531 U·mL-1)>R. sp.3(0.498 U·mL-1)>R. sp.2(0.434 U·mL-1)。
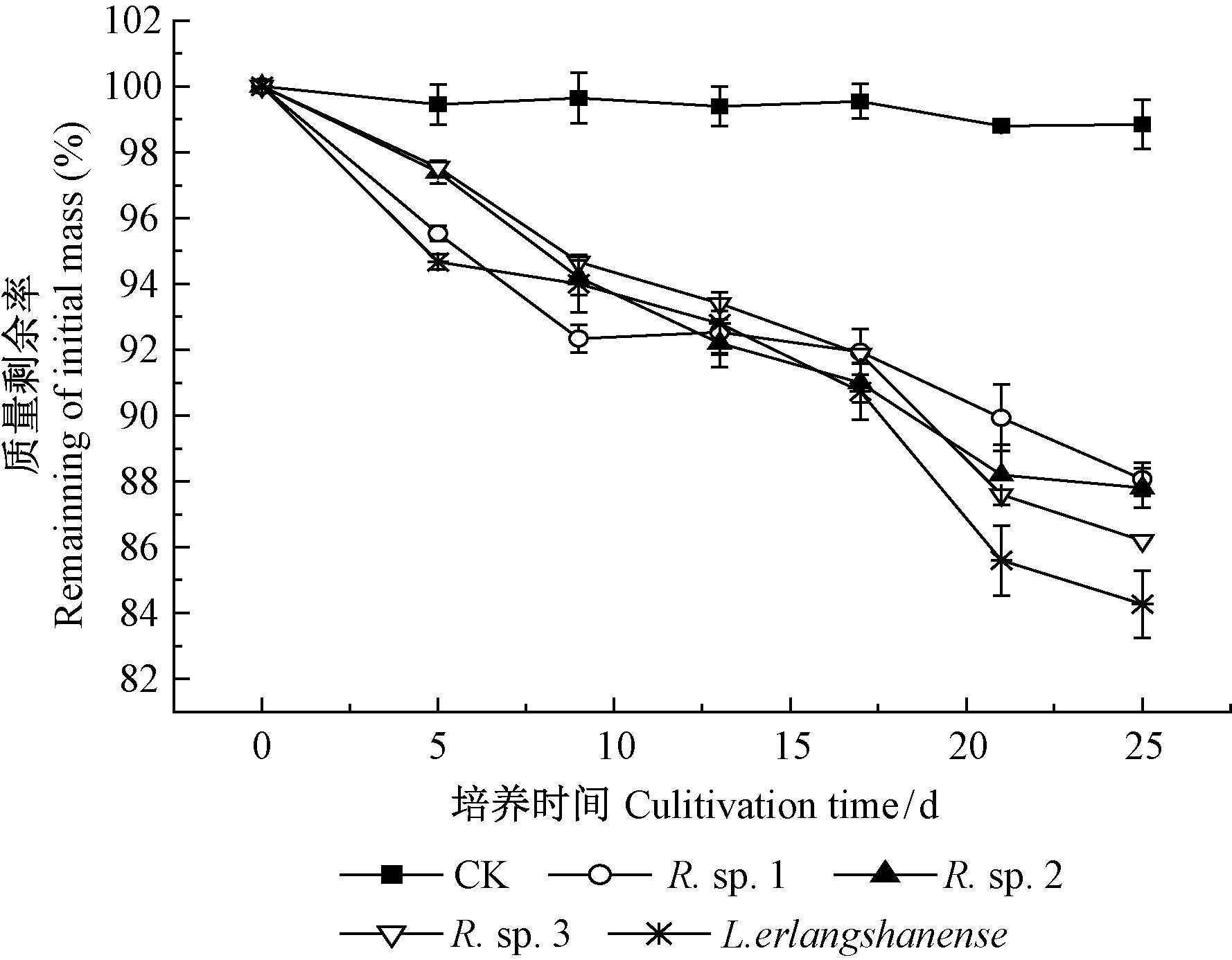
比较分析菌株分解松针的质量损失情况(图 4)发现,在整个发酵过程中,松针的质量损失率随着时间延长不断增加。L. erlangshanense的平均质量损失率为15.74%,分解速率为0.63%·d-1; R. sp.1的平均质量损失率为12.00%,分解速率为0.48%·d-1; 其次是R. sp.3(13.40%,0.54%·d-1)和R. sp.2(12.20%,0.49%·d-1)。根球壳孢菌和二郎山散斑壳在针叶降解过程中均存在一定的降解能力,但质量损失率在菌株之间均无显著差异。
|
图4 华山松针叶分解的质量变化 Fig.4 Mass change of Pinus arm and ii needles in decomposition |
真菌作为微生物的一大类群,其应用受到广泛关注,如内生真菌对病原菌的拮抗作用(顾沛雯等,2012; 蒋萍等,2007; 王静等,2013)、腐生真菌对森林凋落物的分解作用(田朝光等,2010)等。森林凋落物是森林生态系统中物质与能量的重要载体,凋落物分解在森林生态系统养分循环中极其重要。影响凋落物分解的因素主要有气候因子(Chen et al., 2000; 李雪峰等,2007)、凋落物自身性质(Xu et al., 2005)和生物因子(Findlay et al., 2002; Wright et al., 2005)。微生物是生物因子的重要组成部分,其中又以真菌为主(Korkama et al., 2008; Song et al., 2004; 郝杰杰等,2006),而腐生真菌是重要的参与者(Boberg et al., 2011)。目前,木霉属、青霉属和曲霉属等丝状真菌是纤维素分解研究较多的真菌类群(郝杰杰等,2006; 李纪顺等,2013; 宋福强等,2009)。O’Brien等(2005)借助分子手段研究发现,子囊菌在凋落物分解中占据优势。早期,Osono等(2002)认为担子菌对凋落物分解也发挥着重要作用,但因担子菌具有较高的木质素分解能力(严海元,2010; Boberg et al., 2011),故该类真菌主要在分解中后期发挥作用。
本研究从华山松凋落物针叶中分离到的真菌有半知菌、子囊菌、接合菌以及担子菌。受环境等因子的影响,真菌群落组成会有差异,但5个优势种在4个海拔凋落物中均有分布,说明它们具有普遍存在性。其中,华山松凋落针叶中占优势的青霉属以及木霉属等半知菌类真菌,无疑为凋落物的纤维素分解提供了充分保障。在华山松凋落物分解前期,仅分离得到1株担子菌Umbelopsis isabellina,说明后期参与凋落物分解的担子菌主要来源于土壤等环境。隶属于5属的子囊真菌为华山松凋落物早期的第2大类真菌,这些真菌的菌丝及其产生的胞外酶共同作用于凋落物的前期分解,同时为后期分解提供基础。综上可知,半知菌和子囊菌在凋落针叶分解初期发挥主要作用,随着降解的发生,环境中微生物不断进入并参与分解,真菌类群发生变化以有利于凋落物中难分解成分的降解。
目前,国外关于R.sp.的研究颇有争议,国内更是报道甚少。近期发现,R. kalkhoffii在四川二郎山林场活体云杉针叶中寄生(许秀兰等,2014)。本研究首次在二郎山林场4个海拔的华山松凋落物中分离得到该属真菌,可见,该属真菌的寄主及分布广,在针叶树上扮演的角色有待进一步研究。
在华山松针叶的分解试验中,R.sp. 与L. erlangshanense均具有分泌纤维素酶的能力但差异不显著。在病原菌与寄主植物关系中,致病因子常分为毒素、酶和激素3大类。目前,林木病原真菌的致病机制研究较多的是毒素的作用(李姝江等,2012; 骆军等,2010)。但李宝聚等(2000)通过对黄瓜黑星病菌(Cladosporium cucumerinum)的研究发现,细胞壁分解酶为该病害的主要致病因子; 且病原菌产生的纤维素酶可分解细胞壁使植物细胞的超微结构发生病变(李宝聚等,2001)。杨媚等(2012)研究水稻纹枯病菌(Rhizoctonia solani)发现,纤维素酶和果胶酶对水稻叶片都具有显著的细胞膜损伤和组织浸渍作用。Lophodermium sp.主要寄生于松属植物,常被作为病原菌予以报道。Boberg等(2011)的分解试验发现,兼性内生松针散斑壳(L. pinastri)可对樟子松针叶中的纤维素产生分解作用。L. erlangshanense多寄生于华山松凋落的针叶上,偶尔也在活体针叶顶端可见(刘应高等,2009),但最终导致针叶枯死而发生落针病害。本研究中,R.sp. 与L. erlangshanense产生的纤维素酶作用机制是否与其致病力相关有待深入研究,但根球壳孢菌在二郎山林场华山松凋落针叶中广泛存在,且具有分泌纤维素酶能力,在华山松凋落物分解中具有腐生能力。
| [1] |
陈辉, 唐明, 刘安全, 等. 1993. 人工竹林凋落物中真菌群落的研究. 西北林学院学报, 8(4):41-45. (Chen H, Tang M, Liu A Q, et al. Mycoflora of litter in bamboo. Journal of Northwest Forestry College, 8(4):41-45.)(  1) 1)
|
| [2] |
顾沛雯, 郝丽, 徐润, 等. 2012. 宁夏白芨滩自然保护区苦豆子内生真菌的区系组成及其抑菌活性. 西北农林科技大学学报:自然科学版, 40(5):209-216. (Gu P W, Hao L, Xu R, et al. 2012. Diversity and antimicrobial activity of endophytic fungi in Sophora alopecuroides L.from Baijitan National Nature Reserve of Ningxia. Journal of Northwest A&F University:Natural Sciences Edition, 40(5):209-216.)(  1) 1)
|
| [3] |
郝杰杰, 宋福强, 田兴军, 等. 2006. 几株半知菌对马尾松落叶的分解——木质纤维素酶的活性动力学. 林业科学, 42(11):69-75. (Hao J J, Song F Q, Tian X J, et al. 2006 Decomposition of Pinus massoniana needle driven by deuteromycetes-dynamics of lignocellulolytic enzymes. Scientia Silvae Sinicae, 42(11):69-75.)(  3) 3)
|
| [4] |
蒋萍, 吴小芹, 叶建仁, 等. 2007. 松树两种病原菌拮抗微生物的筛选. 南京林业大学学报:自然科学版, 31(1):59-62. (Jiang P, Wu X Q, Ye J R, et al. 2007. Screening of antagonistic microbes to two kinds of pine trees pathogens. Journal of Nanjing Forestry University:Natural Sciences Edition, 31(1):59-62.)(  1) 1)
|
| [5] |
李雪峰, 韩士杰, 张岩. 2007. 降水量变化对蒙古栎落叶分解过程的间接影响. 应用生态学报, 18(2):261-266 (Li X F, Han S J, Zhang Y. 2007. Indirect effects of precipitation on litter decomposition of Quercus mongolica. Chinese Journal of Applied Ecology, 18(2):261-266.)(  1) 1)
|
| [6] |
李纪顺, 陈凯, 李红梅, 等. 2013. 通过染色体整合β-1,4-葡聚糖酶基因glu14提高绿色木霉对小麦纹枯病的防治效果. 植物病理学报, 43(4):393-400. (Li J S, Chen K, Li H M, et al. 2013. Enhanced bio-control activity of Trichoderma viride against wheat sheath blight (Rhizoctonia cerealis) through chromosomal integration of Bacillus megaterium β-1,4-glucanase gene glu14. Acta Phytopathologica Sinica, 43(4):393-400.)(  1) 1)
|
| [7] |
李姝江, 朱天辉. 2012. 杂交竹梢枯病菌毒素蛋白纯化及致病力. 林业科学, 48(11):144-149. (Li S J, Zhu T H. 2012. Purification of the toxic protein from Arthrinium phaeospermun and its pathogenicity. Scientia Silvae Sinicae, 48(11):144-148.)(  1) 1)
|
| [8] |
李宝聚, 周长力, 赵奎华, 等. 2000. 黄瓜黑星病菌致病机理的研究Ⅱ.细胞壁降解酶及其在致病中的作用. 植物病理学报, 30(1):13-18. (Li B J, Zhou C L, Zhao K H, et al. 2000. Pathogenic mechanism of scab of cucumber caused by Cladosporium cucumerinum Ⅱ.The cell wall-degrading enzymes and its pathogenic action. Acta Phytopathologica Sinica, 31(1):13-18.)(  1) 1)
|
| [9] |
李宝聚, 周长力, 赵奎华, 等. 2001. 黄瓜黑星病菌致病机理的研究Ⅲ.细胞壁降解酶和毒素对寄主超微结构的影响及其协同作用. 植物病理学报, 31(1):63-69. (Li B J, Zhou C L, Zhao K H, et al. Pathogenic mechanism of scab of cucumber caused by Cladosporium cucumerinum Ⅲ. Effects and synergism of cell wall-degrading enzymes and toxin produced by C. cucumerinum on ultrastructure of cucumber. Acta Phytopathologica Sinica, 31(1):63-69.)(  1) 1)
|
| [10] |
刘应高, 潘欣, 杨静, 等. 2009. 华山松上散斑壳属一新种. 菌物学报, 28(4):473-475. (Liu Y G, Pan X, Yang J, et al. 2009. A new species of the genus Lophodermium on Pinus armandii. Mycosystema, 28(4):473-475.)(  1) 1)
|
| [11] |
骆军, 刘应高, 黄晓丽, 等. 2010. 四川松针上散斑壳菌致病毒素的确定及其致病性差异研究. 林业科学研究, 23(5):685-689. (Luo J, Liu Y G, Huang X L, et al. 2010. Pathotoxin determination of Lophodermium on pines in Sichuan Province and their differences in pathogenicity. Forest Research, 23(5):685-689.)(  1) 1)
|
| [12] |
任玮. 1990. 云杉叶疫病的研究.西南林学院学报, 10(2):176-179. (Ren W. 1990. Studies on the needle blight of spruce. Journal of Southwest Forestry College, 10(2):176-179.)(  1) 1)
|
| [13] |
宋福强, 范晓旭, 张星星, 等. 2009. 三株丝状真菌分解樟子松凋落物酶活性. 微生物学通报, 36(5):635-639. (Song F Q, Fan X X, Zhang X X, et al. 2009. Activies of Enzymes during the litter of Pinus sylvestris var. mongolica degradation by three strains of mycelial fungi. Microbiology, 36(5):635-639.)(  1) 1)
|
| [14] |
田朝光, 马延和. 2010. 真菌降解木质纤维素的功能基因组学研究进展. 生物工程学报, 26(10):1333-1339 (Tian C G, Ma Y H. 2010. Progress in lignocellulose deconstruction by fungi. Chinese Journal of Biotechnology, 26(10):1333-1339.)(  1) 1)
|
| [15] |
王静, 易晓华, 魏艳, 等. 2013. 11 株侧柏内生真菌的农药活性及分子生物学鉴定. 中国农学通报, 29(15):183-187. (Wang J, Yi X H, Wei Y, et al. Pesticide Activity and Molecular Biology Identification of 11 Strains of Endophytic Fungi from Platycladus orientalis (L.) Franco. Chinese Agricultural Science Bulletin, 29(15):183-187.)(  1) 1)
|
| [16] |
许秀兰, 张翅, 黄晓丽, 等. 2014. 云杉叶栖真菌的群落结构与多样性分析. 东北林业大学学报, 42(3):122-125. (Xu X L, Zhang C, Huang X L, et al. 2014. Community diversity of dendrocola mycoflora in spruce needles. Journal of Northeast Forestry University, 42(3):122-125.)(  1) 1)
|
| [17] |
许玉林, 郑月霞, 叶冰莹, 等. 2013. 一株纤维素降解真菌的筛选及鉴定. 微生物学通报, 40(2):220-227. (Xu Y L, Zheng Y X, Ye B Y, et al. 2013. Isolation and identification of a cellulose degrading fungi. Microbiology, 40(2):220-227.)(  1) 1)
|
| [18] |
杨媚, 杨迎青, 郑丽, 等. 2012. 水稻纹枯病菌细胞壁降解酶组分分析、活性测定及其致病作用.中国水稻科学, 26(5):600-606. (Yang M, Yang Y Q, Zheng L, et al. 2012. Component analysis, activity measurement and pathogenic effect of cell wall degrading enzymes from rice sheath blight pathogen Rhizoctonia solani. Chinese Journal of Rice Science, 26(5):600-606.)(  1) 1)
|
| [19] |
严海元, 辜夕容, 申鸿. 2010. 森林凋落物的微生物分解. 生物学杂志, 29(9):1827-1835. (Yan H Y, Gu X R, Shen H. 2010. Microbial decomposition of forest litter:a review. Chinese Journal of Ecology, 19(9):1827-1835.)(  1) 1)
|
| [20] |
Botella L, Diez J J. 2011. Phylogenic diversity of fungal endophytes in Spanish stands of Pinus halepensis. Fungal Diversity, 47(1):9-18.( 1) 1)
|
| [21] |
Boberg J B, Ihrmark K, Lindahl B D. 2011. Decomposing capacity of fungi commonly detected in Pinus sylvestris needle litter. Fungal Ecology, 4(1):110-114.( 3) 3)
|
| [22] |
Chen H, Harmon M E, Griffiths R P, et al. 2000. Effects of temperature and moisture on carbon respired from decomposing woody roots. Forest Ecology and Management, 138(1):51-64.( 1) 1)
|
| [23] |
Findlay S, Tank J, Dye S, et al. 2002. A cross-system comparison of bacterial and fungal biomass in detritus pools of headwater streams. Microbial Ecology, 43(1):55-66.( 1) 1)
|
| [24] |
Hoff J A, Klopfenstein N B, McDonald G I, et al. 2004. Fungal endophytes in woody roots of Douglas-fir (Pseudotsuga menziesii) and ponderosa pine (Pinus ponderosa). Forest Pathology, 34(4):255-271.( 1) 1)
|
| [25] |
Hu H L, Jeewon R, Zhou D Q, et al. 2007. Phylogenetic diversity of endophytic Pestalotiopsis species in Pinus armandii and Ribes spp.:evidence from rDNA and tubulin gene phylogenies. Fungal Diversity, 24:1-22.( 1) 1)
|
| [26] |
Juzwik J. 1993. Morphology, cultural-characteristics, and pathogenicity of Rhizosphaera kalkhoffii on Picea spp. in northern Minnesota and Wisconsin. Plant Disease, 77(6):630-634.( 1) 1)
|
| [27] |
Kumi J, Lang K J. 1979. The susceptibility of various spruce species to Rhiosphaera kalkhoffii and some cultural characteristics of the fungus in vitro. Eurppean Journal of Forest Pathology, 9(1):35-46.( 2) 2)
|
| [28] |
Korkama R T, Muller M M, Pennanen T. 2008. Decomposition and fungi of needle litter from slow-and fast-growing Norway spruce (Pice abies) clones. Microbial Ecology, 56(1):76-89.( 1) 1)
|
| [29] |
Livsey S, Barklund P. 1992. Lophodermium piceae and Rhizosphaera kalkhoffii in fallen needles of Norway spruce(Picea abies). Eurppean Journal of Forest Pathology, 22(4):204-216.( 1) 1)
|
| [30] |
Martinez A T, Ramirez C. 1983. Rhizosphaera oudemansii (Sphaeropsidales) associated with a needle cast of Spanish Abies pinsapo. Mycopathologia, 83(3):175-182.( 1) 1)
|
| [31] |
Osono T, Takeda H, 2002. Comparison of litter decomposition ability among diverse fungi in a cool temperate deciduous forest in Japan. Mycologia, 94(2):421-427.( 1) 1)
|
| [32] |
O'Brien H E, Parrent J L, Jackson J A, et al. 2005. Fungal community analysis by large-scale sequencing of environmental samples. Applied and Environmental Microbiology, 71(9):5544-5550.( 1) 1)
|
| [33] |
Song F Q, Tian X J, Li Z Q, et al. 2004. Diversity of filamentous fungi in organic layers of two forests in Zijin Mountain. Journal of Forest Research, 15(4):273-279.( 1) 1)
|
| [34] |
Teather R M, Wood P J. 1982. Use of congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovin rumen. Applied and Environmental Microbiology, 43(4):777-780.( 2) 2)
|
| [35] |
Wright M S, Covich A P. 2005. Relative importance of bacteria and fungi in a tropical headwater stream:Leaf decomposition and invertebrate feeding preference. Microbial Ecology, 49(4):536-546.( 1) 1)
|
| [36] |
Xu X N, Hirata E. 2005. Decomposition patterns of leaf litter of seven common canopy species in a subtropical forest:N and P dynamics. Plant and Soil, 273(1/2):279-289.( 1) 1)
|
| [37] |
You C J, Tian C M, Liang Y M, et al. 2013. First report of pitch canker disease caused by Rhizosphaera kalkhoffii on Pinus sylvestris in China. Plant Disease, 97(2):283-284.( 1) 1)
|
 2016, Vol. 52
2016, Vol. 52

