文章信息
- 杭佳, 石云, 安婧婧, 贺达汉
- Hang Jia, Shi Yun, An Jingjing, He Dahan
- 宁夏黄土丘陵区不同生态恢复生境中步甲对微生境的选择
- Selection of Microhabitat of Carabid Beetles (Coleoptera:Carabidae) in Different Ecological Restored Habitats in the Hilly and Gully Area of Loess Plateau, Ningxia, China
- 林业科学, 2016, 52(1): 71-79
- Scientia Silvae Sinicae, 2016, 52(1): 71-79.
- DOI: 10.11707/j.1001-7488.20160109
-
文章历史
- 收稿日期:2014-04-11
- 修回日期:2014-06-17
-
作者相关文章
2. 宁夏大学资源与环境学院 银川 750021;
3. 宁夏大学西北退化生态系统恢复与重建国家重点实验室培育基地 银川 750021
2. College of Resources and Environment, Ningxia University Yinchuan 750021;
3. State Key Laboratory for Restoration and Reconstruction of Degraded Ecosystem in North-Western China, Ningxia University Yinchuan 750021
人类土地利用方式的变化加速了景观的多样化(Settle,1998),而新增的土地利用类型又为植物和动物创造了新生境(Mühlenberg et al., 1996)。然而,由于人类活动干扰,许多土地被过度利用或施入大量化学药剂(Mühlenberg et al., 1996),造成稀有种或受保护植物和动物物种濒临灭绝(Beaufoy et al., 1994; Poschlod et al., 1996)。因此,物种的生境需求信息是保护区选择、管理政策实施及多样化土地利用时进行动植物影响评价的关键(Fielding et al., 1995; Oppel et al., 2004)。近年来,指示生物(bioindicator)研究引起了越来越多学者的关注。步甲科(Carabidae)昆虫分布广泛,大多为捕食性,在自然界生态平衡及害虫控制方面起着重要作用,具有对局地环境明显的依赖性和对环境变化的敏感性、丰富的形态和生态多样性,并于地表采集和诱捕,因此,不仅被用来描述生境的精细特征及指示生境的细微变化,而且还被用作较大尺度生态系统的指示性生物来监测环境及群落的变化趋势(高光彩等,2009; 张红玉等,2006)。
宁夏南部山区地处我国水土剧烈流失的黄土丘陵沟壑区,生物多样性匮乏,生态环境十分脆弱。2000年以来,该区实施了一系列生态恢复工程,显著改善了区域小气候及非生物和生物条件(刘库等,2006; 杭佳等,2014)。不同生态建设的恢复时间,导致了不同生境斑块的破碎化及随时间变化生境质量的改变。在这些动态的及破碎化的景观中,对昆虫种群保护而言,了解特定物种或物种组合可接受的生境因子是非常重要的,因此就必须获得物种特有的生境需求信息(Hein et al., 2007a)。
本研究在宁夏彭阳县黄土丘陵区选择灌草混交林地、乔灌混交林地、生态薪炭林地、生态经济林地、天然封育草地和水平农田6种典型生境,调查步甲科昆虫的种群特征,应用二项Logistic回归模型构建步甲科昆虫的生境选择模型,分析不同生境内步甲的微生境选择,探讨生态恢复对维持步甲物种多样性的影响,以期直观揭示生态恢复进程,同时为山区土地资源可持续管理和生物多样性保护提供理论依据。
1 研究区概况彭阳县位于宁夏回族自治区东南部、六盘山东麓,106°32'—106°58' E,35°41'—36°17' N,土地总面积2 528.65 km2,总人口26.65万人。境内海拔1 297~2 483 m,属半干旱大陆性季风气候。年均气温7.4~8.5 ℃,无霜期140~170天,年降水量350~550 mm,年蒸发量1 330 mm,主季风为西北风。土壤以黄绵土为主,土壤肥力中下,生产力水平低。地貌以梁峁状丘陵为主,是我国水土流失最严重的县域之一。
研究地点位于彭阳县王洼乡,该地包括了目前黄土丘陵沟壑区生态环境恢复及水土保持治理措施的最基本类型及特征(李生宝等,2006)。本研究中6种典型生境的基本特征描述及样地分布见杭佳等(2014)。
2 研究方法 2.1 昆虫调查采用陷阱法进行标本采集(Yu et al., 2006)。用一次性塑料水杯(杯高9 cm,上下口径分别为7.5 cm和4 cm)作为陷阱器埋入土中,杯口与地面平齐,杯壁上方1/4处(杯口下方约2.5 cm)打一小孔(直径约0.5 cm),以免雨水过多使标本流失。引诱剂为醋、糖、医用酒精和水混合液,质量比为2∶1∶1∶20,每杯放引诱剂40~60 mL。采样时间为2012年和2013年每年6—8月,覆盖了大部分植被生长季,每月采样3次,每次放置诱杯3天,采集到的标本存放在75%酒精内带回实验室鉴定到种,并统计数量(高兆宁,1999; 王新谱等,2010)。
每种典型生境选择6个20 m×20 m研究样点,共36个,每个样点5个诱杯,共180杯,分别布置在样点的四角和中央,样点间隔25 m。为了避免边缘效应影响,尽量避免在生境边缘设置样点。每个样点诱杯的捕获结果分别收集,统计并编号。
2.2 土壤和植被数据调查统一选择试验中期(2012和2013年7月),在每个生境随机选择3个样点,以每个样点中央诱杯为中心,在直径2 m范围内通过目测法记录该范围内乔木、灌木和草本植物物种组成、物种数、林冠层盖度、灌木层盖度、草本层盖度、枯落物盖度及枯落物厚度(于晓东等,2006a; 2006b),并且记录各样点的海拔、坡度、坡向及0~30 cm土壤含水量等环境因子。同时,在该范围内取30 cm×30 cm草本植物地上部分,烘干,折算草本植物生物量; 土壤含水量由于受降雨事件影响较大,于试验中期选择5~7天连续无降雨后取样,采用烘干法测定; 海拔利用GPS测定; 坡度利用手持罗盘测定; 坡向用直接的方向表示。以上植被因子及土壤含水量的平均值作为环境因子参数。各生境概况见表 1。
|
|
以各样点中每个诱杯采集的步甲科昆虫为单位,计算每个生境中步甲的物种丰富度、个体数量和Shannon-Wiener多样性指数(马克平等,1994)。采用Chao-1指数评估每个生境类型中真实的步甲物种丰富度(Colwell,2006)。Chao-1指数是基于单物种和双物种出现的非参数丰富度估计量,显示了同其他物种丰富度估计量的良好对比,也体现了少有物种携有试验中未能捕获到的物种数量的重要信息(Colwell,2006; Hortal et al., 2006; González-Megías et al., 2011)。同时,绘制基于Chao-1指数的物种丰富度估计曲线(species richness estimation curve)(Barton et al., 2009)。Chao-1指数计算公式为: $${S_{{\rm{chao}} - 1}} = {S_{{\rm{obs}}}} + {{{n_1}\left( {{n_1} - 1} \right)} \over {2\left( {{n_2} + 1} \right)}}$$。 式中:Schao-1为估计的物种数;Sobs为观测到的物种数(物种数量观测值);n1为只有1个物种个体的物种数,n2为只有2个物种个体的物种数。
以步甲优势种在每个生境陷阱中出现次数与陷阱总数的比值定义为优势种的发生概率(occurrence probabilities)(Hein et al., 2007b)。
采用非参数检验Kruskal-Wallis方差分析(non-parametric Kruskal-Wallis analysis of variance)以及Turkey多重比较(Turkey post-hoc pairwise comparisons)分析不同生境内环境变量及步甲个体数量、物种丰富度及多样性指数的差异。
采用二项Logistic回归分析确定影响步甲生境选择的关键环境因子。由于变量之间的多重共线性会影响Logistic回归模型对预测结果的准确性(Menard,2002),因此,在构建多变量模型前,要对预测变量(环境变量)进行筛选。在已选定的环境变量中,先经过单变量逻辑斯蒂回归分析,P值小于0.30的变量被保留并进入后续分析(McGrath et al., 2003)。对保留变量再进行Spearman秩相关分析,选择不相关的参数变量用于多变量回归模型的建立。此时,若直接去除相关变量则会导致一部分环境信息丢失,因此,2个变量强烈相关时(ρs≥0.7,Fielding et al., 1995),选择在单变量分析中显示出最佳AUC值(ROC曲线和45°线之间的面积,Hosmer et al., 2000)的变量进入下一步分析(Hein et al., 2007b)。
逻辑斯蒂模型的一般表达式为:
π(x)=eg(x)/1+eg(x)。
应用Nagelkerke的RN2评估模型的拟合能力。RN2可以反映因变量中由自变量解释的变异大小,但对模型参数多少不敏感(McCullagh et al., 1989),因此,不同模型间还需要应用Akaike Information Criterion(AIC)进行比较,以便选出参数最少、拟合能力最好的模型(曹铭昌等,2010)。应用ROC曲线评估模型的预测精度,将不同阈值的正确预测存在的百分率(敏感性)和1减去正确预测不存在的百分率(特异性)表现在图上,通过比较曲线和45°线之间的面积(area under curve,AUC)确定模型的预测精度(Anderson et al., 2003)。根据Hosmer等(2000)描述的评估标准:AUC>0.7为可接受范围(acceptable),0.8<AUC<0.9为好(excellent),AUC>0.9为非常好(outst and ing)。
以上所有数据分析均在SPSS 19.0软件中进行。
3 结果与分析研究共获得步甲3 236号,隶属于9属16种。以种群的个体数量为依据,统计不同步甲物种的优势度。其中,直角通缘步甲(Amara gebleri)、麻步甲(Carabus br and ti)和赤胸长步甲(Dolichus halensis)为优势种,个体数分别占个体总数的40.64%,24.13%和20.02%; 直角婪步甲(Harpalus corporosus)、蒙古伪葬步甲(Pseudotaphoxenus mongolicus)、棒婪步甲(Harpalus bungii)、双斑猛步甲(Cymindis binotata)等9种为常见种,合计占总个体数的13.97%; 中华婪步甲(Harpalus sinicus)、谷婪步甲(Harpalus calceatus)、中华金星步甲(Calosoma chinense)和考氏肉步甲(Broscus kozlovi)为少有种,合计占总个体数的1.24%。
3.1 步甲多样性分析在物种水平上,步甲个体数量在6种不同生境间存在显著差异(U=14.93,df=5,P=0.011),其中灌草混交林地显著高于乔灌混交林地,极显著高于生态薪炭林林地、生态经济林林地、天然封育草地和水平农田,天然封育草地中最低; 物种丰富度虽在灌草混交林地中高于其他生境,但并未达显著差异(U=10.50,df=5,P=0.062); Shannon-Wiener多样性指数在不同生境中存在显著差异(U=13.31 df=5,P=0.021),其中灌草混交林地显著高于乔灌混交林地和生态薪炭林林地,生态经济林林地、天然封育草地和水平农田极显著低于灌草混交林地,天然封育草地中最低(表 2)。
|
|
每种生境中步甲Chao-1丰富度指数估计曲线明显不同。从图 1中看出,灌草混交林地和生态薪炭林林地中步甲丰富度估计曲线达到渐进水平,显示能用陷阱法诱集到几乎所有的步甲物种;相反,乔灌混交林地和生态经济林林地中步甲丰富度未达到渐进水平,还有部分物种未诱集到,所以对物种丰富度估计存在较大变异;天然封育草地和水平农田林地中步甲丰富度曲线近似达到渐进水平,显示在这2种生境中可诱集到大部分的步甲物种。
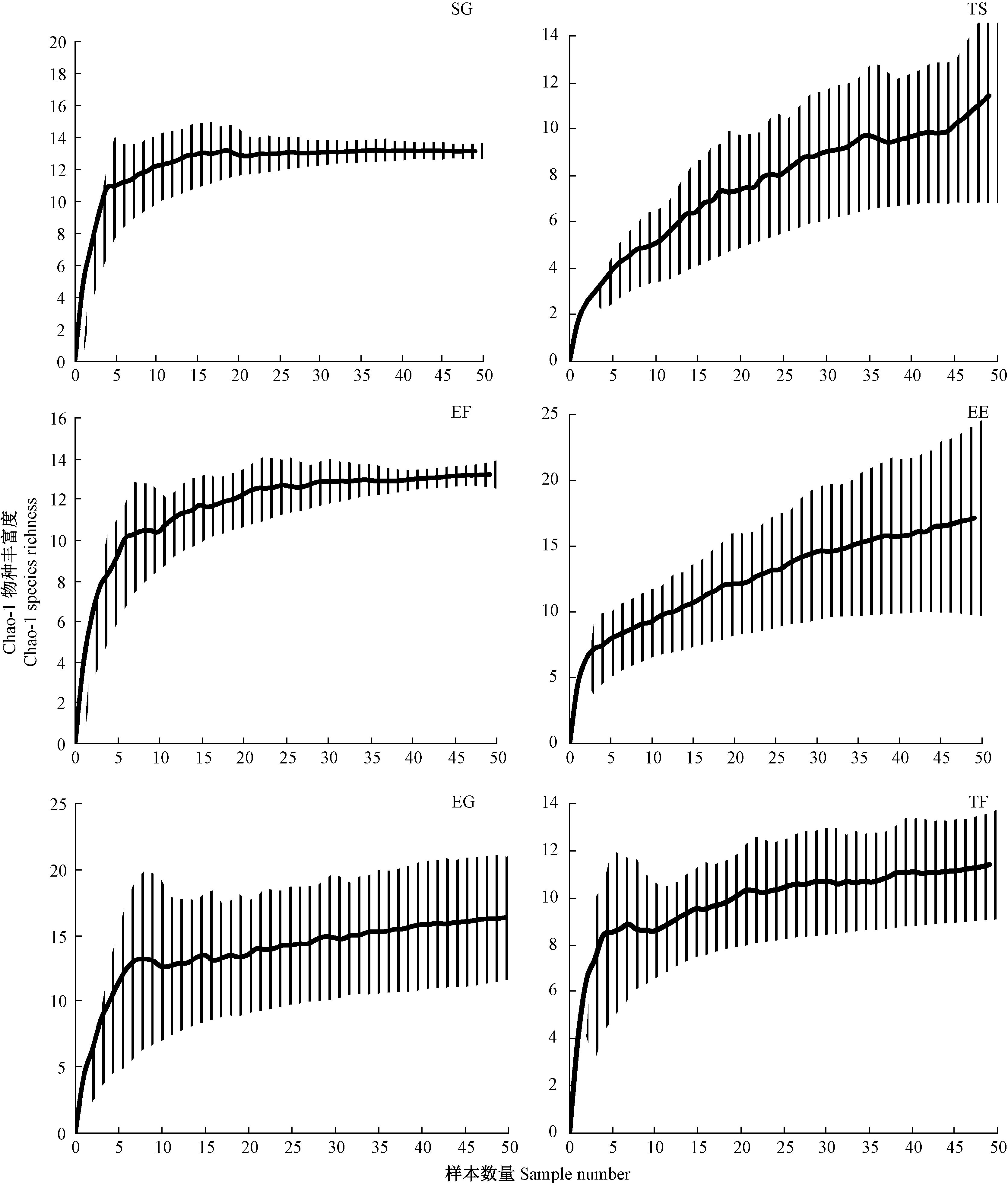
|
图1 步甲在不同生境中的物种丰富度估计曲线(Chao-1± SD) Fig.1 Species richness estimation curves(Chao-1±SD)for carabid beetles sampled at different habitats |
以直角通缘步甲、麻步甲和赤胸长步甲为研究对象,分析其不同生境中的优势种发生概率。结果显示,3物种在不同植被群落生境的发生概率不同(图 2)。直角通缘步甲在生态薪炭林林地中发生概率最高(97.92%),其次为灌草混交林地(93.75%),在水平农田中发生概率最低(37.50%); 麻步甲在生态薪炭林、灌草混交和乔灌混交林地中发生概率均较高,分别为100%,97.92%和95.83%,其次为天然封育草地(81.25%),在生态经济林林地中发生概率较低(12.50%); 赤胸长步甲在生态经济林林地和水平农田中发生概率较高,分别为81.25%和79.17%,其次为灌草混交林地(31.25%),而在乔灌混交林地中没有发生。

|
图2 不同生境中步甲优势种发生概率 Fig.2 Occurrence probabilities of carabid beetles dominant species in different habitats |
在构建物种生境选择模型之前,分别以3物种在不同生境中的有/无(1/0)为因变量,以测定的15个环境因子为自变量,进行单变量逻辑斯蒂回归,剔除P>0.3的环境变量,对剩余环境变量计算相应AUC值并进行Spearman秩相关分析,筛选出具统计学意义且相互独立影响的环境变量。以上述保留下来的环境变量为自变量,以每一物种在不同生境中的有无为因变量,采用向前筛选的逐步逻辑斯蒂回归,确定影响物种生境选择的关键环境因子。
多元逻辑斯蒂回归分析结果表明,对影响直角通缘步甲生境选择的环境变量拟合得到2个回归模型,根据模型AIC值确定模型Ⅱ为最佳模型,其表达式为:π(x)=eg(x)/1+eg(x),g(x)=31.09+0.33×HB-7.80×SW(式中:HB为草本植物生物量,SW为土壤含水量,下同)。
同理,麻步甲和赤胸长步甲的生境选择模型分别表示为:
π(x)=eg(x)/1+eg(x),g(x)=29.94-1.88×CC+10.90×SC+0.25×HB-6.91×土壤含水量(式中:CC为林冠层盖度,下同);
π(x)=eg(x)/1+eg(x),g(x)=-6.41-2.34×SC-6.79×HB-6.62×LD-0.32×HB+2.67×SW(式中:LD为枯落物厚度)。
同时,ROC曲线对直角通缘步甲和赤胸长步甲生境选择的评估结果为很好(excellent),AUC值均大于0.85,对麻步甲生境选择的评估结果为非常好(outst and ing),AUC值大于0.9,说明模型对3物种生境选择的模拟精度高,可信度较大(表 3)。
|
|
研究表明,在物种水平上,步甲个体数量和Shannon-Wiener多样性指数在6种不同生境中存在显著差异; 物种丰富度虽然在灌草混交林地中高于其他生境,但并未达到显著差异; Chao-1丰富度估计曲线显示,灌草混交和生态薪炭林林地中可诱集到几乎所有的步甲物种,天然封育草地和水平农田生境中可诱集到大部分的步甲物种,乔灌混交和生态经济林林地的步甲物种丰富度未达到渐进水平,对物种的丰富度估计存在较大变异。3种步甲优势种在不同生境中的发生概率存在显著差异。Logistic回归分析表明,草本植物生物量和土壤含水量是影响直角通缘步甲生境选择的关键环境因子; 林冠层盖度、灌木层盖度、草本植物生物量和土壤含水量是影响麻步甲生境选择的主要环境因子; 灌木层盖度、草本植物盖度、枯落物厚度、草本植物生物量和土壤含水量是赤胸长步甲生境选择的关键环境因子。
宁南黄土丘陵区步甲对微生境的选择表现出明显的差异性,生境类型代表不同生态恢复模式下生物群落特有的演替阶段,可通过指示生物间接评价不同生态恢复生境中的生境质量(Hein et al.,2007b)。直角通缘步甲作为宁南黄土丘陵区典型优势种,个体数占总个体数的40.64%,在生态薪炭林林地中发生率最高,该生境海拔高、坡度大且土壤含水量低,经Logistic回归分析,直角通缘步甲的发生与土壤含水量呈负相关,与草本植物生物量呈正相关。麻步甲在生态薪炭林和灌草混交林地中发生率明显高于其他生境,这2种生境是以柠条(Caragana intermedia)和山桃(Prunus davidiana)为主的灌木林,具有较高的灌木层盖度和草本植物生物量,Logistic回归分析显示,灌木层盖度和草本植物生物量与麻步甲的发生呈正相关。赤胸长步甲则主要在水平农田和生态经济林生境中发生,相比其他生境,水平农田和生态经济林林地由于人为活动造成草本植物盖度、草本植物生物量和枯落物特征显著低于其他未受人类干扰或受人类干扰较小的生境,而这又恰是影响赤胸长步甲生境选择的关键环境因子。
植被结构对步甲的影响包括多个方面,植物可为步甲提供食物和栖息地,还可通过调节地表特征来影响步甲的生活。有研究表明,步甲的生物量同植被生物量呈正相关(Tyler,2008),本研究中除赤胸长步甲与草本植物生物量呈负相关外,另2种步甲均与植物生物量呈正相关。此外,笔者在其他昆虫调查试验中发现,赤胸长步甲在紫花苜蓿(Medicago sativa)地中发生概率及数量均相对较大,这与本试验结果不十分一致,可能与其他环境因子有关,例如土壤含水量,这可能也是影响本研究Logistic回归结果的一个重要原因。步甲与土壤含水量的关系十分密切。李景科(1992)在对锥须步甲(Bembidinae sp.)的研究中发现,土壤含水量在21%~46%范围内,含水量越高,锥须步甲种类越丰富、个体数量越多; Boscaini等(2000)对不同环境条件下河岸交错区的结构和功能进行了分析,发现优势步甲的Shannon-Wiener多样性指数变化与环境由潮湿到干旱生境的趋势一致。此外,枯落物的厚度和组成可以调节地表的温度和湿度,并且为步甲提供隐蔽场所,进而影响步甲的生境选择(高光彩等,2009)。有报道认为枯落物对步甲种群具有中性或正效应(Sroka et al., 2006),也有报道认为枯落物厚度和植物残体量对森林地表甲虫物种数具有负效应(Christ et al., 1995),本文试验表明,地表枯落物厚度与赤胸长步甲物种的发生呈负相关,与相关研究结论不一致,原因可能是不同步甲对地表枯落物特征的反应不同。
本研究通过分析优势物种对微生境的选择,不仅探讨了不同生态恢复生境中指示性生物的物种多样性变化,而且较深入地了解了不同物种对于环境因子和空间变化的响应信息,揭示了不同生态恢复措施影响步甲科昆虫群落多样性的生态学机制以及制约其物种多样性的关键环境因子,是昆虫物种多样性研究方法的一次探索。宁南黄土丘陵区步甲优势物种对微生境的选择表现出明显的差异性,在生态恢复的实际生产中,综合考虑影响物种多样性的环境因素以及人为因素,对生物多样性保护及生态恢复建设均具有实际指导价值。
生境特征参数对物种出现与否的影响研究补充了环境变量对特定物种潜在影响的相关信息,这些信息可以通过建模的方式来验证不同植物群落对物种生存的影响(Rudner et al., 2007)。生境类型是反映小气候特征差异最直接的因素之一,例如生境中植物物种组成、植被结构和密度及地表枯落物特征,这些结构特征直接与物种的生境选择和物种在生境中是否存活直接相关(Hein et al., 2007b)。物种的发生率究竟是以某一类植被类型为主导因素还是针对某物种而言,还需要进一步研究(Negro et al., 2013)。此外,确定物种生境选择的模型稳定性和通用性的最好方法是从空间和时间2方面来评价(Fleishman et al., 2003; Oppel et al., 2004)。虽然本研究中采用AUC值对模型预测精度进行了评估,但仅利用了部分数据,是否利用更多数据有待进一步研究。关于物种生境选择模型是否在时间和空间上都具有良好的可转移性(Hein et al., 2007b),是下一步研究的首要任务。
| [1] |
曹铭昌, 刘高焕, 单凯, 等. 2010. 基于多尺度的丹顶鹤生境适宜性评价-以黄河三角洲自然护区为例. 生物多样性, 18 (3):283-291. (Cao M C, Liu G H, Shan K, et al. 2010. A multi-scale assessment of habitat suitability of red-crowned crane at the Yellow River Delta Nature Reserve, Shandong, China. Biodiversity Science, 18 (3):283-291.[in Chinese])(  1) 1)
|
| [2] |
高光彩,付必谦. 2009. 步甲作为指示生物的研究进展. 昆虫知识, 46 (2):216-222. (Gao G C, Fu B Q. 2009. Advances of researches on carabid beetles as bioindicators. Chinese Bulletin of Entomology, 46 (2):216-222.[in Chinese])(  2) 2)
|
| [3] |
高兆宁. 1999. 宁夏农业昆虫图志. 北京:中国农业出版社. (Gao Z N. 1999. Agricultural insect fauna of Ningxia. Beijing:China Agriculture Press.[in Chinese])(  1) 1)
|
| [4] |
杭佳, 石云, 刘文惠, 等. 2014. 宁夏黄土丘陵区不同生态恢复生境地表甲虫多样性. 生物多样性, 22 (4):516-524. (Hang J, Shi Y, Liu W H, et al. 2014. Diversity of ground-dwelling beetles (Coleoptera) in restored habitats in the hill and gully area of Loess Plateau, Ningxia Hui Autonomous Region. Biodiversity Science, 22 (4):516-524.[in Chinese])(  2) 2)
|
| [5] |
李景科. 1992. 锥须步甲的分布密度与土壤含水量的关系. 生物防治通报, (3):140. (Li J K. 1992. The relationship between the distribution density and soil water content of Bembidinae sp. Bulletin of Biological Control, (3):140.[in Chinese])(  1) 1)
|
| [6] |
李生宝, 蒋齐, 李壁成. 2006. 宁夏南部山区生态农业建设技术研究. 银川:宁夏人民出版社. (Li S B, Jiang Q, Li B C. 2006. Technology research on the construction of ecological agriculture in Ningxia southern mountain region. Yinchuan:Ningxia People's Press.[in Chinese])(  1) 1)
|
| [7] |
刘库, 谢应忠, 李应科, 等. 2006. 宁夏南部黄土丘陵区生态退化与恢复——以彭阳县为例. 水土保持通报, 26 (2):54-56. (Liu K, Xie Y Z, Li Y K, et al. 2006. Ecological degradation and restoration in loess hilly area of South Ningxia Hui Autonomous Region——taking Pengyang County as an example. Bulletin of Soil and Water Conservation, 26 (2):54-56.[in Chinese])(  1) 1)
|
| [8] |
马克平, 刘玉明. 1994. 生物群落多样性的测度方法 I:α 多样性的测度方法(下).生物多样性, 2 (4):231-239. (Ma K P, Liu Y M.1994. Measurement of biotic community diversity Ⅰ:α diversity (Part 2). Biodiversity Science, 2(4):231-239.[in Chinese])(  1) 1)
|
| [9] |
王新谱, 杨贵军. 2010. 宁夏贺兰山昆虫. 银川:宁夏人民出版社. (Wang X P, Yang G J. 2010. Insects fauna in Helan Mountain of Ningxia. Yinchuan:Ningxia People's Press.[in Chinese])(  1) 1)
|
| [10] |
于晓东, 罗天宏, 杨建,等, 2006a. 卧龙自然保护区落叶松林不同恢复阶段地表甲虫的多样性. 动物学研究, 27 (1):1-11. (Yu X D, Luo T H, Yang J, et al. 2006a. Diversity of ground-dwelling beetles (Coleoptera) in larch plantation with different stages of reforestation in Wolong Natural Reserve, southwestern China. Zoological Research, 27(1):1-11.[in Chinese])(  1) 1)
|
| [11] |
于晓东, 罗天宏, 杨建,等. 2006b. 边缘效应对卧龙自然保护区森林-草地群落交错带地表甲虫多样性的影响, 昆虫学报, 49 (2):277-286. (Yu X D, Luo T H, Yang J, et al. 2006b. Influence of edge effect on diversity of ground-dwelling beetles across a forest-grassland ecotone in Wolong Natural Reserve, southwestern China. Acta Entomologica Sinica, 40(2):277-286.[in Chinese](  1) 1)
|
| [12] |
张红玉, 欧晓红. 2006. 以昆虫为指示物种监测和评价森林生态系统健康初探. 世界林业研究, 19 (4):22-25. (Zhang H Y, Ou X H. 2006. Using insect for indicator to monitor and assess forest ecosystem health. World Forestry Research, 19(4):22-25.[in Chinese])(  1) 1)
|
| [13] |
Anderson R P, Lew D, Peterson A T. 2003. Evaluating predictive models of species'distributions:criteria for selecting optimal models. Ecological Modelling, 162 (3):211-232.( 1) 1)
|
| [14] |
Barton P S, Manning A D, Gibb H, et al. 2009. Conserving ground-dwelling beetles in an endangered woodland community:multi-scale habitat effects on assemblage diversity. Biological Conservation, 142:1701-1709.( 1) 1)
|
| [15] |
Beaufoy G, Baldock D, Clark J. 1994. The nature of farming:low intensity farming systems in nine European countries. London:Institute for European Environment Polica.( 1) 1)
|
| [16] |
Boscaini A, Franceschini A, Maiolini B. 2000. River ecotones:carabid beetles as a tool for quality assessment. Hydrobiologia, 422/423 (9):173-181.( 1) 1)
|
| [17] |
Christ T O, Wiens J A.1995. Individual movements and estimation of population size in darkling beetles (Coleoptera:Tenebrionidae). Journal of Animal Ecology, 64(6):733-746.( 1) 1)
|
| [18] |
Colwell R K. 2006. Estimates:Statistical estimation of species richness and shared species from samples. Version 8.0. User's Guide and Application Published at http://purl.oclc.org/estimates.( 2) 2)
|
| [19] |
Fielding A H, Haworth P F. 1995. Testing the generality of bird habitat models. Conservation Biology, 9(6):1466-1481.( 2) 2)
|
| [20] |
Fleishman E, Mac Nally R, Fay J P. 2003. Validation tests of predictive models of butterfly occurrence based on environmental variables. Conservation Biology, 17(3):806-817.( 1) 1)
|
| [21] |
González-Megías A, Gómez J M, Sánchez-Piñero F. 2011. Spatio-temporal change in the relationship between habitat heterogeneity and species diversity. Acta Oecologica, 37(3):179-186.( 1) 1)
|
| [22] |
Hein S, Binzenhoefer B, Poethke H J, et al. 2007a. The generality of habitat suitability models:a practical test with two insect groups. Basic Applied Ecology, 8 (4):310-320.( 1) 1)
|
| [23] |
Hein S, Voss J, Poethke H J, et al. 2007b. Habitat suitability models for the conservation of thermophilic grasshoppers and bush crickets-simple or complex? Journal Insect Conservation, 11 (3), 221-240.( 5) 5)
|
| [24] |
Hortal J, Borges P A V, Gaspar C. 2006. Evaluating the performance of species richness estimators:sensitivity to sample grain size. Journal of Animal Ecology, 75(1):274-287.( 1) 1)
|
| [25] |
Hosmer D W, Lemeshow S. 2000. Applied logistic regression. 2nd ed. New York:Wiley.( 2) 2)
|
| [26] |
McCullagh P, Nelder J A. 1989. Generalized linear models. 2nd ed. London:Chapman & Hall.( 1) 1)
|
| [27] |
McGrath M T, DeStefand S, Riggs R A. 2003. Spatially explicit influence on northern goshawk nesting habitat in the interior Pacific Northwest. Wildlife Monographs, 154:1-63.( 1) 1)
|
| [28] |
Menard S. 2002. Applied logistic regression analysis. London:Sage Publication.( 1) 1)
|
| [29] |
Mühlenberg M, Henle K, Settele J, et al. 1996. Studying species survival in fragmented landscapes:the approach of the FIFB//Settele J, Margules C, Poschlod P, et al. Species Survival in fragmented landscapes. Dordrecht:Kluwer Academic Publishers,35:152-160.( 1) 1)
|
| [30] |
Negro M, Rocca C L, Ronzani S, et al. 2013. Management tradeoff between endangered species and biodiversity conservation:the case of Carabus olympiae (Coleoptera:Carabidae) and carabid diversity in north-western Italian Alps. Biological Conservation, 157(2):255-265.( 1) 1)
|
| [31] |
Oppel S, Schaefer H M, Schmidt V, et al. 2004. Habitat selection by the pale-headed brush-finch, Atlapetes pallidiceps, in southern Ecuador:implications for conservation. Biological Conservation, 118(1):33-40.( 2) 2)
|
| [32] |
Poschlod P, Bakker J, Bonn S, et al. 1996. Dispersal of plants in fragmented landscapes//Settele J, Margules C, Poschlod P. Species survival in fragmented landscapes. Dordrecht:Kluwer Academic Publishers.( 1) 1)
|
| [33] |
Rudner M, Biedermann R, Schröder B, et al. 2007. Integrated grid based ecological and economic (INGRID) landscape model-a tool to support landscape management decisions. Environment Modelling & Software, 22(2):177-187.( 1) 1)
|
| [34] |
Settele J. 1998. Metapopulations Analyse auf rasterdatenbasis. Stuttgart:BG Teubner Verlagsgesellschaft.( 1) 1)
|
| [35] |
Sroka K, Finch O D. 2006. Ground beetle diversity in ancient woodland remnants in north-western Germany (Coleoptera:Carabidae). Journal of Insect Conservation, 10(4):335-350.( 1) 1)
|
| [36] |
Tyler G. 2008. The ground beetle fauna of abandoned fields, as related to plant cover, previous management and succession stage. Biodiversity Conservation, 17(1):155-172.( 1) 1)
|
| [37] |
Yu X D, Luo T H, Zhou H Z. 2006. Effects of carabid beetles among regenerating and natural forest types in Southwestern China. Forest Ecology and Management, 231(1):169-177.( 1) 1)
|
 2016, Vol. 52
2016, Vol. 52

