文章信息
- 谷艳菲, 闫伯前, 丁轲, 王宗义, 张忠杰, 韩涛
- Gu Yanfei, Yan Boqian, Ding Ke, Wang Zongyi, Zhang Zhongjie, Han Tao
- 纯化作用对五味子木脂素抗氧化性的影响
- Effect of Purification on Antioxidative Activity of Lignan Fractions from Schisandra chinensis
- 林业科学, 2015, 51(9): 96-105
- Scientia Silvae Sinicae, 2015, 51(9): 96-105.
- DOI: 10.11707/j.1001-7488.20150913
-
文章历史
- 收稿日期:2014-09-15
- 修回日期:2014-10-14
-
作者相关文章
2. 北京农学院植物科学技术学院 北京 102206;
3. 国家粮食局科学研究院 北京 100037
2. College of Plant Science and Technology, Beijing University of Agriculture Beijing 102206;
3. Academy of State Administration of Grain Beijing 100037
五味子(Schis and ra chinensis)别名味子、药葡萄、山花椒,为木兰科(Magndiaceae)五味子属藤本植物(王森等,2003)。国家卫生部于2000年印发的《可用于保健食品的物品名单》中,明确五味子可用于生产保健食品。
木脂素是一类主要通过p-羟基苯乙烯单体氧化耦合而成的小分子质量次生代谢产物(李欣等,2006)。五味子属木脂素类化合物是以1,2,3,4-联苯-1,3-环辛二烯为母核的木脂素,是五味子抗氧化能力的主要功能成分(皮子凤等,2012;应国清等,2005),其药用功能包括对肝脏、心血管、中枢神经系统、神经元的保护作用,抗肿瘤、抗HIV、降血脂及增强记忆力作用(杨放等,2003;Park et al.,2009;孙潇等,2009)。
五味子木脂素的提取常用溶剂提取法、超声波提取法、微波提取法及超临界萃取法(欧阳小光等,2012;周玲等,2010;黄惠华等,2006;戴军等,2010)。国内外已提取得到的五味子木脂素单体化合物有近40种(罗钟桓,2011),其中五味子甲素、五味子乙素、五味子酯甲及五味子醇甲为4个主要功能单体,均具有一定的抗氧化能力(徐冰等,2012;谢宇等,2010)。然而,经提取纯化得到不同纯度五味子木脂素的过程中,纯化作用是否对其抗氧化性产生影响未见报道。
本研究以五味子甲素、五味子乙素、五味子酯甲及五味子醇甲为研究对象,首先用AB-8大孔吸附树脂对五味子木脂素粗提液进行初步纯化,再用高效制备液相色谱分离木脂素单体,比较粗提液、部分纯化的粗提液及木脂素单体的还原能力,对·O2-、·OH、DPPH、ABTS自由基及H2O2的清除能力,评价纯化作用对五味子木脂素抗氧化性的影响,为开发富集木脂素的五味子功能食品提供理论依据。
1 材料与方法 1.1 材料、试剂及仪器原料:五味子(购自延边州和龙市八家子镇仲乡林场),果实60 ℃烘干12 h,粉碎后过60目筛,干燥保存。
试剂:五味子甲素、五味子乙素、五味子醇甲、五味子酯甲(中国食品药品检定研究院)均为标准品;AB-8大孔吸附树脂(天津市光复精细化工研究所);其他试剂除甲醇为色谱纯外,均为分析纯或生化试剂。
主要设备和仪器:日本Shimadzu高效液相色谱仪:DGV-20A5脱气机、LC-20AD二元泵、自动进样器(20 μL定量环)、CTO-20A/C柱温箱、SCL-10AVP控制器、SPD-M20A二极管检测器、Class-VP工作站软件;高效制备液相色谱仪:2PB00C系列平流泵(北京卫星制造厂)、手动进样器(5 mL定量环)、Lab Alliance Model 201型紫外检测器、N2000工作站软件;T6新世纪紫外-可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 试验方法 1.2.1 五味子木脂素的提取在五味子粉末中加入体积分数为80%的乙醇,料液比为1∶15,先微波功率160 W提取6.5 min,再超声波功率71 W提取23 min,进行微波-超声波联用法提取,旋转蒸发得浸膏,用蒸馏水复溶得到五味子木脂素粗提液(魏殿文等,2010)。
1.2.2 AB-8大孔吸附树脂对五味子木脂素粗提液分离纯化条件的确定参照文献(孟宪军等,2009),通过静态吸附试验,确定最适上样液pH、洗脱剂乙醇体积分数、洗脱剂乙醇pH;参照文献(尹湉等,2007),通过动态吸附试验,确定最大上样量、水洗终点,分别用90%,100%,pH 10.0、90%的乙醇溶液及pH 10.0、100%的乙醇溶液洗脱,优化洗脱结果。
1.2.3 高效液相色谱优化分离五味子木脂素单体1)高效液相色谱条件 Venusil XBP C18 柱(150 mm×4.6 mm,5 μm),流动相为甲醇(B)-水(A),梯度洗脱条件:0~7 min(67%B)、7~13 min(67%~75%B)、13~22 min(75%~80%B)、22~30 min(80%~67%B);检测波长220 nm,流速0.8 mL·min-1,进样量10 μL,柱温为室温。
2)高效液相色谱检测木脂素混合标准品及粗提液将混匀的4种五味子木脂素标准溶液、木脂素粗提液及部分纯化后的粗提液按上述色谱条件进行液相分析,并用面积归一法计算纯度(曲庆等,2010)。
1.2.4 制备液相色谱纯化木脂素粗提液1)制备液相色谱条件 Adsorbosphere XL C18柱(250 mm×22 mm,5 μm),流动相为甲醇(A)-水(B),梯度洗脱条件:0~10 min(75%A)、10~15 min(75%~78%A)、15~38 min(75%~80%A);检测波长220 nm,流速10 mL·min-1,进样量3 mL,柱温为室温。
2)制备液相色谱纯化木脂素粗提液 按上述制备液相色谱条件,将经AB-8大孔吸附树脂部分纯化后的粗提液注入手动进样器,根据紫外监测结果,收集保留时间相同的流出液。
3)定性及纯度检测 高效液相色谱分别对分离得到的化合物进行检测,与标准品对比,采用外标法及内标法确定化合物种类,并用面积归一法计算纯度(曲庆等,2010)。
1.2.5 不同纯度组分五味子木脂素的抗氧化性1)还原能力的比较 参照文献(Wittmann,2007),采用普鲁士兰法,分别取一定浓度的粗提液,部分纯化的粗提液,五味子醇甲、五味子酯甲、五味子甲素及五味子乙素溶液(以下简称样品溶液),测其还原能力。以蒸馏水作为空白,以与样品溶液浓度相同的抗坏血酸溶液用相同方法测定作为参比(下同)。还原能力ΔA=A样品-A空白。
2)对·O2-的清除作用 参照文献(郭春梅等,2005),采用邻苯三酚氧化法,分别研究一定浓度的样品溶液对·O2-的清除作用,以蒸馏水作为空白。清除率(%)=[(A0-Ai)/A0]×100%。
3)对·OH的清除作用 参照文献(许申鸿等,2000),采用结晶紫分光光度法,分别测定一定浓度的样品溶液对·OH的清除作用。清除率(%)=(As-Ab)/(A0-Ab)×100%。
4)对DPPH自由基的清除作用 参照文献(Yen et al.,1994),分别测定一定浓度的样品溶液对DPPH的清除作用。清除率(%)=[1-(Ai-Aj)/Ae]×100%。
5)对ABTS自由基的清除作用 参照文献(Salluca et al.,2008),分别测定一定浓度的样品溶液对ABTS的清除作用,以蒸馏水作为空白。清除率(%)=(A对照-A样品)/A对照×100%。
6)对H2O2的清除作用 参照文献(Lin et al.,2004),采用辣根过氧化物酶法,分别测定一定浓度的样品溶液对H2O2的清除作用,以蒸馏水作为空白。清除率(%)=(A对照-A样品)/A对照×100%。
2 结果与分析 2.1 AB-8大孔吸附树脂对五味子木脂素粗提液分离纯化条件的确定 2.1.1 静态吸附试验1)粗提液pH对五味子木脂素吸附率的影响 酸性粗提液的吸附率高于碱性粗提液(图 1)。pH10的粗提液吸附率为pH2的16%;粗提液的初始pH为3,吸附率为pH2的95%,相差不大,因此选用不调pH的粗提液进行大孔树脂吸附纯化。
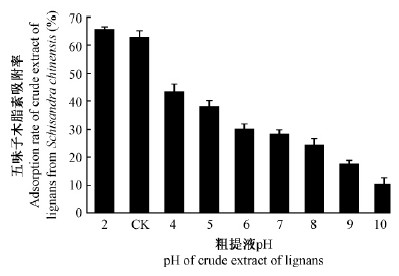 |
图 1 大孔吸附树脂对不同pH粗提液的吸附率 Fig. 1 Adsorption rate of macroporous resin adsorbing crude extract of lignans at different pH |
2)洗脱液乙醇体积分数及pH对五味子木脂素洗脱率的影响 随着乙醇体积分数的增大,五味子木脂素的洗脱率增大(图 2)。50%乙醇洗脱率为100%乙醇的40%,90%乙醇洗脱率为100%乙醇的93%,相差不大,因此选90%和100%乙醇做进一步洗脱优化。
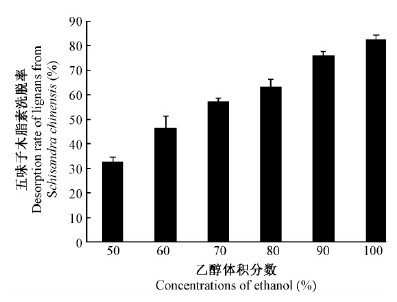 |
图 2 不同洗脱液乙醇体积分数的五味子木脂素洗脱率 Fig. 2 Desorption rate of lignans from S.chinensis elution at different ethanol concentrations |
洗脱液pH在3~11范围内,随着pH增大,五味子木脂素洗脱率增大(图 3),pH10的乙醇洗脱率为74.63%,pH11的乙醇洗脱率为76.64%;pH增大至12,乙醇洗脱率减小到72.19%。因此,调乙醇洗脱液pH为10进行洗脱。
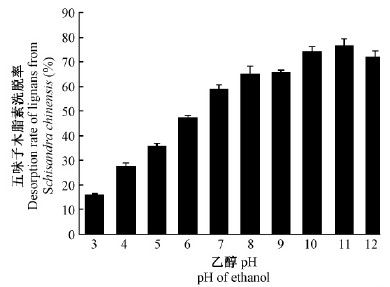 |
图 3 不同洗脱液乙醇pH的五味子木脂素洗脱率 Fig. 3 Desorption rate of lignans from S.chinensis elution at different ethanol pH |
1)动态吸附曲线及去离子水洗脱曲线 大孔吸附树脂对粗提液的动态吸附曲线见图 4。随收集管数增加,五味子木脂素浓度不断增大,收集液的前7管保持低浓度流出,第8管时五味子木脂素浓度开始明显增大,说明此时上样液饱和,最大上样量为80 mL,即8倍柱体积。
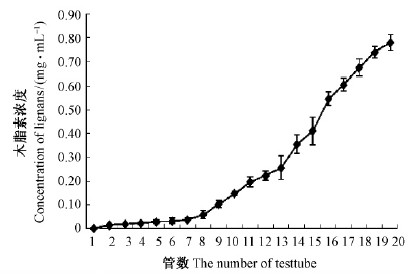 |
图 4 大孔吸附树脂对粗提液的动态吸附曲线 Fig. 4 Dynamic adsorption curve of lignans from S.chinensis adsorbing by macroporous resin 每管10 mL。10 mL per tube. |
去离子水对大孔吸附树脂的洗脱曲线见图 5。随收集管数增加,五味子木脂素浓度不断减小,第11管时五味子木脂素浓度开始增大,说明此时蒸馏水洗脱流出木脂素,因此水洗终点为100 mL,即10倍柱体积。
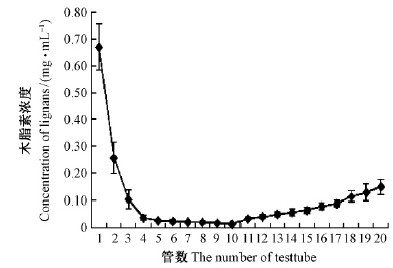 |
图 5 去离子水对大孔吸附树脂的洗脱曲线 Fig. 5 Adsorption curve of deionized water on macroporous resin 每管10 mL。10 mL per tube. |
2)不同体积分数、pH乙醇的洗脱曲线 不同体积分数、pH乙醇的洗脱曲线见图 6。按洗脱液开始检测出木脂素的管数、洗脱液木脂素浓度最高的管数、检测无木脂素的管数,结果见表 1。pH10、100%的乙醇洗脱效果优于其他洗脱剂,随着收集管数增加,五味子木脂素浓度不断减小,确定洗脱终点为70 mL,即7倍柱体积。
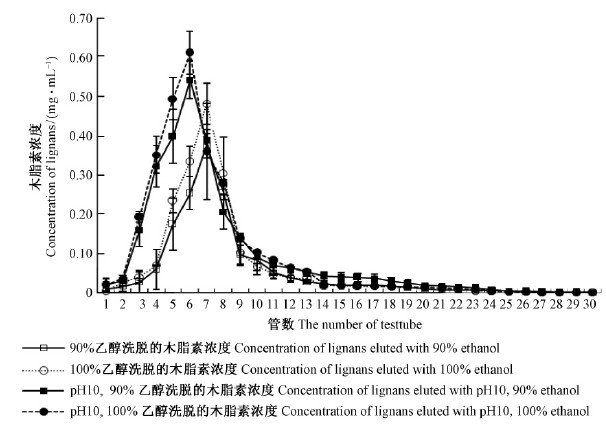 |
图 6 不同体积分数、pH乙醇对大孔吸附树脂的洗脱曲线 Fig. 6 The elution curve of macroporous resin with ethanol at different concentrations and pH 每管5 mL。5 mL per tube. |
|
|
比较单体色谱图保留时间,确定4个峰依次为五味子醇甲、五味子酯甲、五味子甲素和五味子乙素(图 7)。
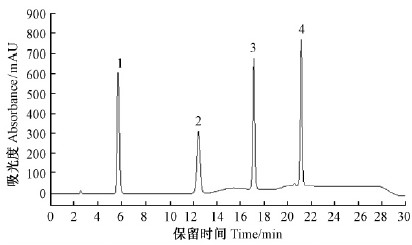 |
图 7 五味子木脂素混合标准品高效液相色谱 Fig. 7 HPLC Chromatograms of lignans from Schisandra chinensis 1. 五味子醇甲Schisandrin;2. 五味子酯甲Schisantherin A; 3. 五味子甲素Deoxyschizandrin;4. 五味子乙素Schizandrin B. 下同。The same below. |
根据五味子木脂素混合标准品色谱图,比较保留时间,确定粗提液中的木脂素种类(图 8,9)。面积归一法计算得粗提液中木脂素总纯度为29.33%,大孔树脂部分纯化后的木脂素纯度为58.95%,纯化倍数为2.01倍。
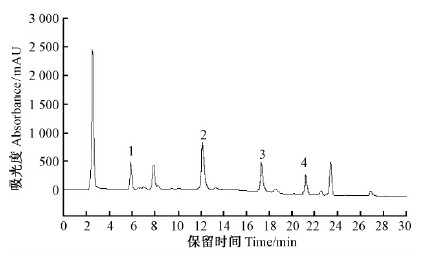 |
图 8 五味子木脂素粗提液高效液相色谱 Fig. 8 HPLC Chromatograms of the crude extracts of lignan from Schisandra chinensis |
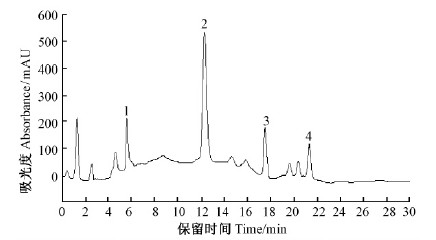 |
图 9 部分纯化后的木脂素粗提液高效液相色谱 Fig. 9 HPLC Chromatograms of the crude extracts of lignan separated by macroporous resin |
按照1.2.4制备液相色谱条件,对部分纯化后的粗提液进一步纯化,见图 10。
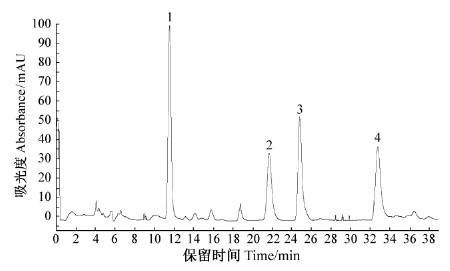 |
图 10 部分纯化后的木脂素粗提液制备液相色谱 Fig. 10 Preparative chromatogram of the crude extracts of lignan separated by macroporous resin |
收集保留时间相同的流出液,并用高相液相色谱对4个流出液进行色谱分析,经验证,所收集的流出液依次为五味子醇甲、五味子酯甲、五味子甲素及五味子乙素,各单体木脂素的高效液相色谱图如图 11所示。
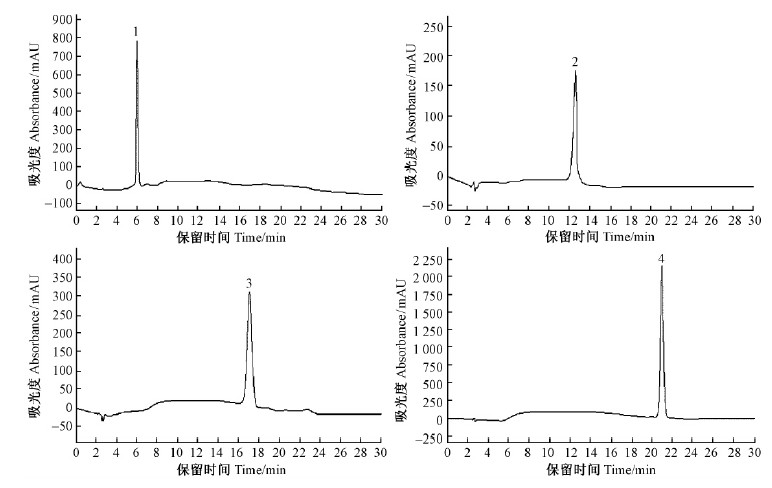 |
图 11 制备液相纯化后的木脂素单体高效液相色谱 Fig. 11 HPLC Chromatograms of the monomers of lignan from S.chinensis separated by PCL |
五味子木脂素粗提液经大孔树脂及高效制备液相色谱2次纯化,得到不同纯度组分的木脂素,面积归一法计算得到不同组分木脂素纯度见表 2。
|
|
高效制备液相色谱纯化后可以得到纯度较高的木脂素单体(表 2),与粗提液中各单体相比,五味子醇甲纯化倍数为33.36倍,五味子酯甲纯化倍数为6.58倍,五味子甲素纯化倍数为12.13倍,五味子乙素纯化倍数为26.57倍。
2.4 不同纯度组分五味子木脂素的抗氧化能力 2.4.1 还原能力的比较五味子木脂素具有一定还原能力(图 12)。在0.1~0.5 mg·mL-1范围内,不同纯度组分木脂素的还原能力均随浓度增大而增加,由大到小依次为粗提液>部分纯化的粗提液>五味子乙素>五味子酯甲>五味子甲素>五味子醇甲,其中,粗提液明显高于五味子乙素,五味子乙素明显高于部分纯化的粗提液,其他三组分差异不明显。各组分木脂素还原能力均明显低于抗坏血酸的还原能力。
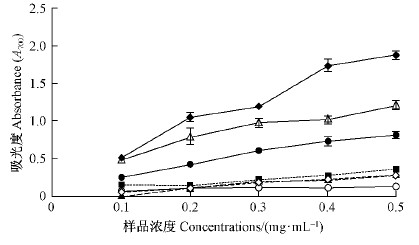 |
图 12 不同组分木脂素的还原能力 Fig. 12 Reducing power of lignan fractions from S.chinensis |
五味子木脂素具有一定清除·O2-的能力(图 13)。在0.1~0.5 mg·mL-1范围内,不同纯度组分木脂素对·O2-的清除能力均随浓度增大而增加,由大到小依次为粗提液>五味子乙素>部分纯化后的粗提液>五味子醇甲>五味子酯甲>五味子甲素,其中,粗提液明显高于其他组分,后者差异不明显。与相同浓度抗坏血酸(参比)的清除能力相比,粗提液为其25%~38%。
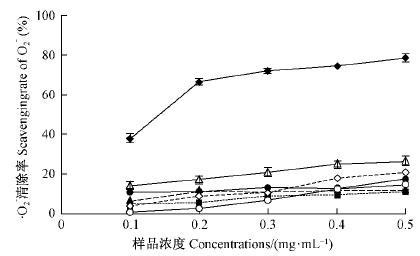 |
图 13 不同组分木脂素对·O2-的清除能力 Fig. 13 Scavenging ·O2- of lignan fractions from S.chinensis |
五味子木脂素具有一定清除·OH的能力(图 14)。在0.1~0.5 mg·mL-1范围内,不同纯度组分木脂素对·OH的清除能力均随浓度增大而增加,由大到小依次为粗提液>五味子乙素>部分纯化的粗提液>五味子酯甲>五味子甲素>五味子醇甲,其中,粗提液明显高于五味子乙素,后三者差异不明显。粗提液的清除能力为抗坏血酸的76%~80%,部分纯化的粗提液为抗坏血酸的41%~53%,五味子醇甲为抗坏血酸的24%~40%。
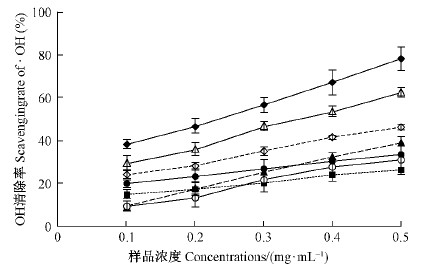 |
图 14 不同组分木脂素对·OH的清除能力 Fig. 14 Scavenging ·OH of lignan fractions from S.chinensis |
五味子木脂素具有一定清除DPPH自由基的能力(图 15)。在0.1~0.5 mg·mL-1范围内,不同纯度组分木脂素对DPPH自由基的清除能力均随浓度增大而增加,由大到小依次为粗提液>部分纯化的粗提液>五味子乙素>五味子醇甲>五味子酯甲>五味子甲素,其中粗提液明显高于部分纯化的粗提液,又明显高于五味子乙素,又明显高于其他三组分,后三组分差异不明显。粗提液的清除能力为抗坏血酸的55%~88%,部分纯化的粗提液为抗坏血酸的30%~69%。
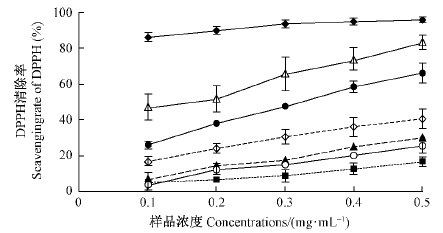 |
图 15 不同组分木脂素对DPPH自由基的清除能力 Fig. 15 Scavenging DPPH of lignan fractions from S.chinensis |
五味子木脂素具有一定清除ABTS自由基的能力(图 16)。在0.1~0.5 mg·mL-1范围内,不同纯度木脂素对ABTS自由基的清除能力均随浓度增大而增加,由大到小依次为粗提液>部分纯化的粗提液>五味子乙素>五味子酯甲>五味子甲素>五味子醇甲,其中,粗提液明显高于部分纯化的粗提液,又明显高于五味子乙素,又明显高于其他三组分,后三组分差异不明显。与抗坏血酸相比,粗提液对ABTS自由基的清除能力无明显差别,部分纯化的粗提液为抗坏血酸的23%~61%,五味子醇甲为抗坏血酸的7%~12%。
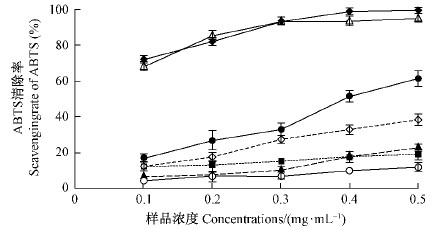 |
图 16 不同组分木脂素对ABTS自由基的清除能力 Fig. 16 Scavenging ABTS of lignan fractions from S.chinensis |
五味子木脂素具有一定清除H2O2的能力(图 17)。在0.1~0.5 mg·mL-1范围内,不同纯度组分木脂素对H2O2的清除能力均随浓度增大而增加,由大到小依次为粗提液>部分纯化的粗提液>五味子乙素>五味子甲素>五味子酯甲>五味子醇甲,各组分间几乎都存在明显差异。粗提液的清除能力为抗坏血酸的83%~93%,部分纯化的粗提液为抗坏血酸的56%~83%,五味子醇甲为抗坏血酸的19%~31%,五味子酯甲为抗坏血酸的29%~54%,五味子甲素为抗坏血酸的41%~60%,五味子乙素为抗坏血酸的43%~66%。
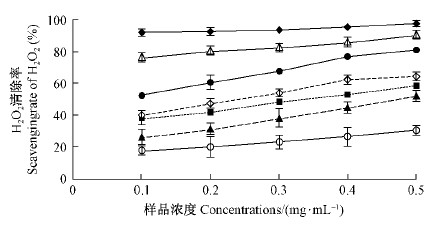 |
图 17 不同组分木脂素对H2O2的清除能力 Fig. 17 Scavenging H2O2 of lignan fractions from S.chinensis |
五味子木脂素的纯化常采用大孔吸附树脂法(孟宪军等,2007)。现有研究仅停留在通过改变吸附及洗脱条件,优化大孔树脂的纯化效果,获得纯度较高的木脂素(孟宪军等,2007;尹湉等,2007;李洪洋等,2011),目前未见对纯化是否会影响其生物活性的研究。本研究首先用大孔树脂纯化木脂素粗提液,初步纯化后的粗提液仍然含有部分小分子杂质,再采用制备液相色谱继续纯化(简洁等,2011;张翠萍等,2011;于丽丽等,2009)。以抗坏血酸为参比,比较不同纯度组分五味子木脂素的还原能力,对·O2-、·OH、DPPH、ABTS自由基及H2O2的清除能力,评价纯化作用对五味子木脂素抗氧化能力的影响,为五味子木脂素功能食品生产中木脂素的纯度条件提供了理论依据。
五味子木脂素在0.1~0.5 mg·mL-1范围内,不同纯度组分均表现出一定的抗氧化能力,但均低于抗坏血酸。纯化后的木脂素抗氧化能力均低于未纯化的木脂素粗提液。原因可能是木脂素粗提液中含有多糖等成分,五味子多糖具有抗氧化能力(高晓旭等,2009)。木脂素、多糖等成分协同作用,抗氧化能力强。经大孔树脂初步纯化后,除去了多糖等大分子物质,单独的木脂素抗氧化能力相对变弱。此结果表明随着纯化程度增大,物质组分单一程度高,其生物活性有可能降低,与熊双丽等(2006)和谢果凰(2010)鲨鱼硫酸软骨素纯化后,对·OH、DPPH自由基的清除能力反而下降的结果一致。
制备液相得到的单体中,五味子乙素的抗氧化能力较强,原因可能与其联苯环、辛烯环上的取代基有关(徐冰等,2012)。
| [1] |
戴军,徐佐旗,赵婷,等. 2010. 超临界CO2提取五味子木脂素的工艺研究. 食品与药品,12(5): 312-315. (Dai J, Xu Z Q, Zhao T, et al. 2010. Study on extraction process of lignans from fruits of Schisandra chinensis by supercritical CO2 fluid. Food and Drug, 12(5):312-315.[in chinese])(  1) 1)
|
| [2] |
高晓旭,李继海,姜贵全,等. 2009. 北五味子多糖超声波提取及对油脂的抗氧化性能研究. 东北林业大学学报,37(4): 34-36. (Gao X X, Li J H, Jiang G Q, et al. 2009. Ultrasonic wave extraction of polysaccharide from fruit of Schisandra chinensis and its antioxygenic property to oil. Journal of Northeast Forestry University, 37(4): 34-36[in chinese]).(  1) 1)
|
| [3] |
郭春梅,武荣兰,封顺,等. 2005. 香青兰多糖的提取、测定及其对活性氧自由基的清除作用. 食品与发酵工业,31(3): 129-131. (Guo C M, Wu R L, Feng S, et al. 2005. Extraction and determination of dracocephalum moldavica polysaccharides and its effects on reducing the free radical oxygen. Food and Fermentation Industries, 31(3):129-131[in chinese]).(  1) 1)
|
| [4] |
黄惠华,梁汉华. 2006. 利用微波辅助萃取技术提取五味子果实中五味子醇甲的研究. 天然产物研究与开发, 18(1): 112-116. (Huang H H, Liang H H. 2006. A study on extraction of schizandrin from Schizandra chinensis(Turcz.) baill fructus by microwave-assisted extraction (MAE). Natural Product Research and Development, 18(1):112-116[in chinese]).(  1) 1)
|
| [5] |
简洁,黄建春,焦杨,等. 2011. 制备液相色谱分离制备玉郎伞查尔酮类化合物. 中草药,42(7): 1313-1316. (Jian J, Huang J C, Jiao Y, et al. 2011. Isolation and preparation of chalcone compounds from tuber of Millettia pulchra var. laxior by pre-HPLC. Chinese Traditional and Herbal Drugs, 42(7):1313-1316[in chinese]).(  1) 1)
|
| [6] |
李欣,袁建平,刘昕,等. 2006. 木脂素-- 一类重要的天然植物雌激素. 中国中药杂志,31(24): 2021-2025. (Li X, Yuan J P, Liu X, et al. 2006. Lignan:an important natural estrogen from plants. China Journal of Chinese Materiamedica, 31(24):2021-2025[in chinese]).(  1) 1)
|
| [7] |
李洪洋,文连奎. 2011. 大孔树脂分离纯化五味子醇甲的研究. 食品与机械,27(3): 56-62. (Li H Y, Wen L K. 2011. Study on separation and purification of schisandrin by macropous resin. Food and Machinery, 27(3):56-62[in chinese]).(  1) 1)
|
| [8] |
罗钟桓. 2011. 五味子属木脂素的化学研究. 科技创新导报,(28): 127-129. (Luo Z H. 2011. Chemical studies on lignans from schisandra. Science and Technology Innovation Herald, (28):127-129[in chinese]).(  1) 1)
|
| [9] |
孟宪军,吴倩,商红军. 2009. 大孔树脂分离纯化五味子乙素. 食品工业科技,(9): 191-195. (Meng X J, Wu Q, Shang H J. 2009. Study on separation and purification of schisandrin B by macroporous resin. Science and Technology of Food Industry, (9):191-195[in chinese]).(  1) 1)
|
| [10] |
欧阳小光,杨璐. 2012. 星点设计-效应面法优选五味子提取工艺. 中国中医药信息杂志,19(4): 58-60. (Ouyang X G, Yang L. 2012. Optimization of reflux extraction process of Schisandrae chinensis fructus by central composite dedign/response surface methodology. Chinese Journal of Information on Traditional Chinese Medicine, 19(4):58-60.[in chinese])(  1) 1)
|
| [11] |
皮子凤,侯广月,艾军,等. 2012. 化学计量学方法研究北五味子中木脂素含量与抗氧化活性的相关性. 中国中药杂志,37(8): 1133-1138. (Pi Z F, Hou G Y, Ai J, et al. 2012. Correlation of lignans content and antioxidant activities of Schisandra chinensis fruits by using stoichiometry method. China Jounal of Chinese Materia Medica, 37(8):1133-1138[in chinese]).(  1) 1)
|
| [12] |
曲庆,寇有浩,张孝玉,等. 2010. 标准气体生产过程中定量分析方法的探讨. 计量学报,31(5): 59-65. (Qu Q, Kou Y H, Zhang X Y, et al. 2010. Quantatitive analysis methods in preparation process of standard gas. ACTA Metrologica Sinica, 31(5):59-65.[in chinese])(  1) 1)
|
| [13] |
孙潇,姜恩平,陈建光. 2009. 北五味子总木脂素对高脂血症大鼠心肌缺血再灌注损伤的保护作用及其机制. 吉林大学学报: 医学版,35,(2): 276-279. (Sun X, Jiang E P, Chen J G. 2010. Protective effect of schizandrae lignanoid on myocardial ischemia-reperfusion injury in hyperlipidemic rats and its mechanism. Journal of Jilin University:Medicine Edition, 35(2):276-279[in chinese]).(  1) 1)
|
| [14] |
王森,张建国. 2003. 五味子的研究概况及其开发前景. 经济林研究,21(4): 126-127. (Wang S, Zhang J G. 2003. Current research status and prospect of Schisandra chinensis. Economic Forest Researches, 21(4):126-127[in chinese]).(  1) 1)
|
| [15] |
魏殿文,王振宇,王志强. 2010. 响应面法优化超声波辅助提取五味子木脂素研究. 国土与自然资源研究, (4): 76-77. (Wei D W, Wang Z Y, Wang Z Q. 2010. Optimization of the ultrasonic assisted extaction technique of lignans from Schisandra chinensis (Turcz.)baill with response surface methodology. Territory & Natural Resources Study, (4):76-77[in chinese]).(  1) 1)
|
| [16] |
谢果凰. 2010. 鲨鱼硫酸软骨素的分离提纯及其抗氧化功能的研究. 宁波: 宁波大学硕士学位论文. (Xie G H. 2010. Studies on the extraction, purification and antioxidant activity of chondroitin sulfate from shark. Ningbo:MS thesis of Ningbo University[in chinese]).(  1) 1)
|
| [17] |
谢宇,陈建光,孙新.2010. 4种五味子木脂素抗氧化作用实验研究. 第十届全国心血管药理学术会议暨2010(重庆)国际心血管疾病与药物高峰论坛论文集. (Xie Y, Chen J G, Sun X. 2010. Antioxidation experiment research of 4 kinds of lignans from Schisandra. The 10th National Cardiovascular Pharmacology Academic Conference and the 2010(Chongqing) International Cardiovascular Disease and Drug Forum Proceedings[in chinese]).(  1) 1)
|
| [18] |
熊双丽,金征宇. 2006. 不同分子量硫酸软骨素的制备和抗氧化活性探讨. 中成药,28(9): 1343-1347. (Xiong S L, Jin Z Y. 2006. Preparation of chondroitin sulfate with different molecular weight and antioxitation capacity. Chinese Traditional Patent Medicine, 28(9):1343-1347[in chinese]).(  1) 1)
|
| [19] |
徐冰,杨盼盼,王佩龙,等. 2012. 五味子科木脂素类化合物抗氧化活性研究. 四川中医,30(5): 52-54. (Xu B, Yang P P, Wang P L, et al. 2012. Research on antioxidant activity of lignans compound from Schisandraceae. Journal of Sichuan of Traditional Chinese Medicine, 30(5):52-54[in chinese]).(  1) 1)
|
| [20] |
许申鸿, 杭瑚. 2000. 溶剂及pH值对1,1-二苯基-2-苦肼基自由基分析法的影响. 分析测试学报,(3): 50-52. (Xu S H, Hang H. 2000. Effects of solvents and pH on DPPH assay. Journal of Instrumental Analysis, (3):50-52.[in chinese])(  1) 1)
|
| [21] |
杨放,袁军,付平. 2003. 五味子的研究概况. 华西药学杂志,18(6): 438-440. (Yang F, Yuan J, Fu P. 2003. General situation of research of lignans form Schisandrae chinensis. West China Journal of Pharmaceutical Sciences,18(6):438-440[in chinese]).(  1) 1)
|
| [22] |
尹湉,刘严生,于叶玲,等. 2007. 用大孔树脂提取和纯化五味子总木脂素. 沈阳药科大学学报,24(2): 113-117. (Yi T, Liu Y S, Yu Y L, et al. 2007. Extraction and purification of total lignans from rude Schisandra chinensis by macroporous resins. Journal of Shenyang Pharmaceutical University, 24(2):113-117[in chinese]).(  1) 1)
|
| [23] |
应国清,俞志明,单剑峰,等. 2005. 北五味子有效组分的研究进展. 河南中医,25(6): 84-87. (Ying G Q, Yu Z M, Shan J F, et al. 2005. Research progress on the effective components of Schisandra chinensis. Henan Traditional Chinese Medicine, 25(6):84-87[in chinese]).(  1) 1)
|
| [24] |
于丽丽,刘巧,陈丹,等. 2009. 制备型高效液相色谱法在天然药物分离中的应用. 中华中医药学刊,27(7): 1465-1467. (Yu L L, Liu Q, Chen D, et al. 2009. Application of preparative high performance liquid chromatography in the isolation of natural medicines. Chinese Archives of Traditonal Chinese Medicine, 27(7):1465-1467[in chinese]).(  1) 1)
|
| [25] |
张翠萍,李行诺,陈鸳谊,等. 2011. 反相高效制备液相色谱法制备洋川芎内酯H和I. 浙江工业大学学报,39(4): 386-389. (Zhang C P, Li X N, Chen Y Y, et al. 2011. Isolation and purification of senkyunol ide H and I by preparative reversed-phase high performance liquid chromatography. Journal of Zhejiang University of Technology, 39(4):386-389[in chinese]).(  1) 1)
|
| [26] |
周玲,高毅颖,肖清贵,等. 2010. 超声循环提取北五味子木脂素的研究. 长沙: 第六届全国化学工程与生物化工年会. (Zhou L, Gao Y Y, Xiao Q G, et al. 2010. Research of ultrasonic circulation extraction of lignans from Schisandra chinensis. Changsha:The 6th national chemical and Biochemical Engineering Annual Meeting Proceedings[in chinese]).(  1) 1)
|
| [27] |
Lin H Y,Chun C. 2004. Antioxidative activities of water-soluble disaccharide chitosan derivatives. Food Research International,37(9): 833-889.( 1) 1)
|
| [28] |
Park C,Choi Y W,Sook K H,et al. 2009. Induction of G1 arrest and apoptosis by schisandrin C isolated from schizandra chinensis baill in human leukemia U937 cells. International Journal of Moleculor Medicine,24 (4): 495-502.( 1) 1)
|
| [29] |
Salluca T G,Peñarrieta J M,Antonio J A,et al. 2008. Determination of total phenolic compounds content and the antioxidant capacity of Andean tubers and roots(OCA,Ulluco and Arracacha). Revista Boliviana de Quimíca,25(1): 58-61.( 1) 1)
|
| [30] |
Wittmann V. 2007. Glycopeptides and glycoproteins. Heidelberg: Springer Verlag.( 1) 1)
|
| [31] |
Yen G C,Duh P D. 1994. Scavenging effect of methanolic extracts of peanut hulls on free-radical and active-oxyen species. Agricultural and Food Chemistry,42(3): 629-632.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

