文章信息
- 刘瑞强, 黄志群, 何宗明, 万晓华, 余再鹏, 郑璐嘉, 肖好燕
- Liu Ruiqiang, Huang Zhiqun, He Zongming, Wan Xiaohua, Yu Zaipeng, Zheng Lujia, Xiao Haoyan
- 根系去除对米老排和杉木凋落物分解的影响
- Effect of Root Removal on Litter Decomposition in Plantations of Mytilaria laosensis and Cunninghamia lanceolata
- 林业科学, 2015, 51(9): 1-8
- Scientia Silvae Sinicae, 2015, 51(9): 1-8.
- DOI: 10.11707/j.1001-7488.20150901
-
文章历史
- 收稿日期:2014-11-20
- 修回日期:2015-07-28
-
作者相关文章
2. 福建师范大学地理研究所 福州 350007;
3. 湿润亚热带生态地理过程教育部重点实验室 福州 350007;
4. 福建农林大学林学院 福州 350002
2. Institute of Geographical Science, Fujian Normal University Fuzhou 350007;
3. MOE Key Laboratory of Humid Subtropical Eco-Geographical Process Fuzhou 350007;
4. Forestry College, Fujian Agriculture and Forestry University Fuzhou 350002
凋落物分解是森林生态系统养分循环的关键生态学过程(Melillo et al.,1982)。凋落物分解促进了土壤肥力的形成(陈立新等,1998; 王清奎等,2007),提供植物再生长的养分,维持着森林生态系统的养分平衡(Berg et al.,1997)。据Waring(2013)估算,凋落物分解过程中每年释放的养分可满足森林生长所需量的69%~87%。同时,凋落物分解在陆地生态系统碳循环中起着重要作用(Zhang et al.,2008),是全球碳预算的重要组成部分(Aerts,1997; Hobbie et al.,2012)。
凋落物分解受温度、水分和土壤条件等环境因子的影响,也受凋落物质量(Melillo et al.,1982)以及土壤微生物、动物、植物根系等生物因子(陈法霖等,2011)的影响。植物根系是地下生态系统的关键组成部分,在植物生长过程中,根系不仅从土壤环境中摄取养分和水分,同时也释放大量的化学物质,这些物质和根组织脱落物一起统称为根系分泌物(朱丽霞等,2003)。植物根系分泌物可能会提高土壤生物活性并改变微生物群落结构(Kuzyakov et al.,2006),提高胞外酶活性,促进凋落物和有机质分解(Bengtson et al.,2012; Uselman et al.,2012)。植物根系还可能通过发展外生菌根,直接吸收凋落物层的养分(Mayor et al.,2006),加快凋落物的分解。另一些研究认为,外生菌根与腐生真菌对养分的竞争可能会阻碍凋落物的分解(Gadgil et al.,1975)。可见,植物根系对凋落物分解的影响及其机制还需要更深入、全面的研究。
近年来,随着全球范围内人工林造林面积不断扩大,人工林在森林碳汇中的贡献日益显著(方精云等,2001; 闫美芳等,2010)。我国是世界上人工造林面积最大的国家,研究不同造林树种凋落物分解对于准确评价人工林碳吸存潜力及其应对气候变化的能力(杨万勤等,2007)具有重要意义。杉木(Cunninghamia lanceolata)是我国中亚热带地区重要的速生造林树种。20 世纪 50 年代,由于人口迅速增长,木材、燃料及其他林产品的需求量增加,大面积的常绿阔叶林被杉木纯林所取代。第七次全国森林资源清查结果显示,全国杉木人工林面积为8.54×106hm2,占人工林总面积的21.35%,位居第一(国家林业局,2009)。在杉木营林过程中,多代连栽会导致林地生产力下降、土壤肥力降低;大规模营造杉木人工林则导致树种组成单一化。为此,近年来我国南方地区开始鼓励用阔叶树种造林,特别是在杉木林采伐迹地上营造阔叶林。米老排(Mytilaria laosensis)是亚热带一种典型的阔叶树种(Huang et al.,2013)。研究发现,米老排比杉木拥有更强的氮保留能力,能够为土壤提供更多的碳氮养分。但不同树种间养分循环机制尚不清楚。米老排林存在大量的凋落物层细根,而杉木没有发现这种现象。凋落物层细根对凋落物养分的直接利用可能会加速凋落物的分解(马承恩等,2012)。对比2个树种凋落物分解对根系去除的响应对于了解不同树种间的养分利用策略具有重要意义。本研究选择二代杉木林以及与之毗邻的米老排林布设样地,以新近凋落的杉木叶和米老排叶为分解对象,设计根系去除处理,探讨凋落物分解的影响机制,旨在为森林经营管理和理解森林碳氮循环提供理论依据。
1 研究区概况本研究样地设置在福建南平峡阳林场(117°59′ E,26°48′ N),位于武夷山脉东南侧,海拔229~246 m。中亚热带季风型气候,年均气温20.0 ℃,年均降水量1 644 mm,降水集中在春夏季。年平均空气相对湿度75.2%,年平均蒸发量1 143 mm。土壤为红黄壤。试验林为1993年春在二代杉木林采伐迹地上营造的米老排人工林和杉木人工林,初植密度均为2 500株 ·hm-2。林下植被主要有苦竹(Pleioblastus amarus)、粗叶榕(Ficus simplicissima)、芒萁(Dicranopteris dichotoma)、狗脊(Woodwardia japonica)、玉叶金花(Mussaenda pubescens)和杜茎山(Maesa japonica)等。林分概况见表 1。
|
|
采用完全随机区组设计方法,于2012年5月,在2种林分中各设置3块20 m×20 m样地(共6块)。在每块样地中部分别设置2个2 m×2 m的样方,保证样方内无乔木或灌木,其中一个样方为对照,另一个样方为根系去除处理(采用壕沟法,在样方外沿挖15 cm宽,50 cm深的壕沟,挖断树根,填入尼龙网袋隔离根系并回填土,并用剪刀剪除样方内的林下植被以去除样方内的所有活体根系)。
于2012年5—6月凋落高峰期内收集米老排和杉木纯林中的落叶,将收集来的落叶一部分于55 ℃条件下烘干至恒质量,测量初始碳氮含量,另一部分在室温下风干用做分解试验。采用常规的分解袋法,利用白色尼龙网制作25 cm×25 cm分解袋,网孔1 mm×1 mm。每个网袋的正面均匀分布有12个大小为0.25 cm2 的小孔方便土壤动物进入,每袋装入20 g风干凋落物。2012年7月30日,将网袋随机平铺在样方内,正面朝上。每个样方上面分别放20个分解袋。去除网袋下面凋落物层,使其直接接触土面。2012年10月10日—2013年12月10日,每2个月取样1次,取样次数共8次。每次每个样方取1袋。取样后去除分解袋上的杂物,于55 ℃条件下烘干至恒质量,称干质量并计算质量损失率。
将分解袋内的凋落物粉碎过0.154 mm的筛网,采用碳氮元素分析仪测定碳氮含量。
在分解试验的第8个月和第16个月,在每个试验小区均匀选取6个点,利用内径为3.7 cm的土钻钻取0~10 cm土层土样。6个点所取的土样装入自封袋中,均匀混合,用保温箱冷藏带回实验室,采用磷脂脂肪酸(PLFA)生物标记法测定土壤微生物群落结构,根据表 2来划分微生物类群(Jennifer et al.,2008)。
|
|
所有数据处理和统计分析均在Excel 2003和SPSS 17.0软件上进行。采用单因素方差分析比较不同参数之间的差异。
3 结果与分析 3.1 根系去除处理对2个树种凋落叶质量损失率的影响分解16个月后,根系去除处理下米老排和杉木凋落叶的质量损失率分别为32.3%±4.6%和33.4%±7.6%,比对照处理(38.1%±2.6%和38.7%±1.5%)相比分别降低了15.3%和13.1%(图 1)。多因素方差分析显示,树种、处理、时间、树种与时间的交互效应对凋落叶质量残留率均有显著影响(P < 0.05,表 3)。2种凋落物的质量损失率在分解初期(0~8个月)差异显著(P < 0.05),但在分解后期(8~16个月)差异不显著(P>0.05)。树种与处理的交互效应、处理与时间的交互效应以及树种、处理和时间的交互效应对凋落叶质量残留率均无显著影响(P>0.05,表 3)。
|
|
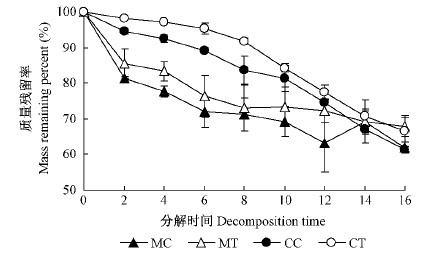 |
图 1 不同处理下米老排和杉木凋落叶质量损失过程 Fig.1 Leaf litter mass loss process of two tree species under different treatments |
分解16个月后,根系去除处理下米老排和杉木凋落叶碳含量分别为(257.8±43.4)和(227.6±63.7)mg ·g-1,与对照处理[(364.3±53.1)和(347.2±70.6)mg ·g-1]相比分别降低了29.3%和34.4%。根系去除处理下2个树种凋落叶氮含量分别为(10.8±1.8)和(8.3±1.4)mg ·g-1,分别比对照处理[(14.2±1.3)和(11.3±1.5)mg ·g-1]降低了24.2%和26.3%。根系去除处理下2个树种凋落叶碳氮比分别为23.9±3.0和27.0±3.1,分别比对照处理(25.6±3.3和30.6±2.2)降低了6.7%和11.9%(图 2)。多因素方差分析显示,树种、处理、时间对2个树种凋落叶碳氮含量和碳氮比均有显著影响(P < 0.05)。树种与处理的交互效应对凋落叶的碳氮含量均有显著影响,对凋落叶的碳氮比影响不显著(P>0.05)。树种与时间的交互效应对凋落叶碳氮含量均无显著影响,对凋落叶碳氮比影响显著(P=0.001)。随分解的进行,2个树种凋落物之间碳氮比的差异呈逐渐变小的趋势。处理与时间的交互效应,处理、树种与时间的交互效应对凋落叶碳氮含量和碳氮比均无显著影响(表 3)。
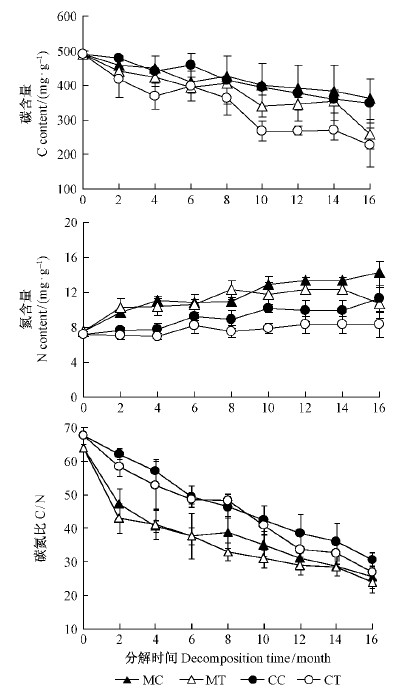 |
图 2 不同处理下米老排和杉木凋落叶碳氮含量和碳氮比 Fig.2 Leaf litter C, N contents and C/N of two tree species under different treatments |
分解8个月后,根系去除处理下米老排林土壤真菌、放线菌和总PLFA生物量分别为(2.6±0.5),(2.86±0.34)和(28.4±2.1)nmol ·g-1,与对照处理的(5.2±1.9),(2.93±0.37)和(32.6±7.0)nmol ·g-1相比分别降低了49.6%,2.5%和12.6%。根系去除处理下杉木林土壤真菌、放线菌和总PLFA生物量分别为(1.4±0.2),(1.73±0.33)和(15.0±0.19)nmol ·g-1,与对照处理的(1.9±0.1),(2.11±0.22)和(18.6±0.3)nmol ·g-1相比分别降低了24.5%,17.7%和19.3%。分解16个月后,根系去除处理下米老排林土壤真菌、放线菌和总PLFA生物量分别为(4.8±0.2),(6.14±1.42)和(51.5±9.1)nmol ·g-1,与对照处理的(6.6±0.8),(9.88±1.36)和(73.2±10.8)nmol ·g-1相比分别降低了26.8%,37.8%和29.6%。根系去除处理下杉木林土壤真菌、放线菌和总PLFA生物量分别为(2.8±0.4),(2.38±0.22)和(25.4±1.3)nmol ·g-1,与对照处理的(4.1±0.4),(3.40±0.22)和(35.5±8.9)nmol ·g-1相比分别降低了32.4%,30.0%和28.4%(图 3)。2次取样均表现为根系去除处理对2种林分下土壤革兰氏阳性、阴性细菌和真细菌生物量比均无显著影响。多因素方差分析显示,树种对土壤微生物群落各类群生物量均具有显著影响(P < 0.05);树种与时间的交互效应、处理与时间的交互效应以及树种、处理与时间的交互效应对土壤微生物群落各类群生物量均无显著影响(表 4)。2次土壤取样均表现为凋落叶氮含量与土壤革兰氏阴性细菌、 放线菌和总PLFA含量均显著正相关(P < 0.05),而凋落叶碳含量与土壤各微生物类群生物量的相关性均不显著。凋落物分解8个月后,凋落叶碳氮比与土壤革兰氏阴性细菌和放线菌生物量显著负相关(P < 0.05),但在16个月后与土壤各微生物类群含量的相关性均不显著(P>0.05)。
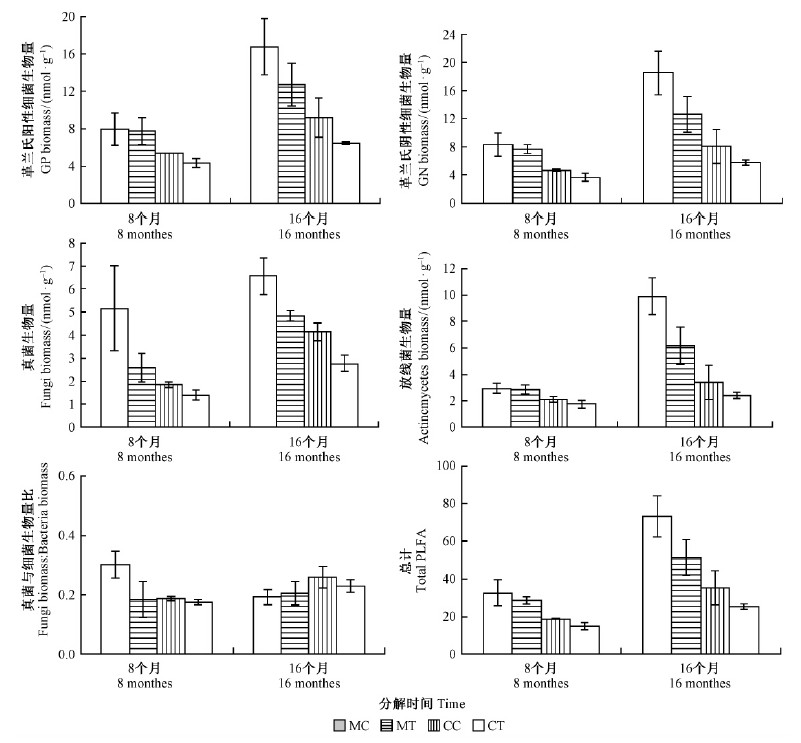 |
图 3 分解8个月和16个月后不同处理下米老排和杉木林土壤微生物生物量的差异 Fig.3 Differences of soil microbial biomass in two plantations under different treatments at different decomposition stages |
|
|
|
|
凋落物分解主要受到温度、水分、土壤条件等环境因子以及土壤微生物、动物、植物根系等生物因子的影响,也因凋落物质量(Melillo et al.,1982)、树种(李雪峰等,2007)、森林类型(莫江明等,2004)以及分解阶段而异。本研究中,2个树种凋落物质量损失率的差异在分解初期(0~8个月)显著而后期(8~16个月)不显著。这与张德强等(2000)和莫江明等(2004)的研究结果相一致。张德强等对鼎湖山几种林分凋落物分解的研究发现,凋落物在不同林分类型间的质量损失率存在显著差异,并且这种差异在分解初期显示出来。莫江明等在鼎湖山研究也发现,马尾松(Pinus massoniona)林和混交林凋落物质量损失率的差异在分解初期(3个月后)显著而分解后期(6个月后)不显著。李雪峰等(2007)认为,亚热带地区温度高、降水量大,微生物一年四季对凋落物进行有效分解。不同林型之间由于微生物种类和数量不同致使凋落物质量损失率在分解初期呈现显著差异。凋落物分解速率往往取决于凋落物的碳氮比(Melillo et al.,1982)。凋落物碳氮比越大,分解速率越慢。本研究中,随分解的进行2个树种凋落叶碳氮比的差异呈逐渐变小的趋势,这可能是造成不同分解阶段2个树种凋落叶分解速率变化的重要原因。
研究表明,根系去除会显著降低凋落物的分解速率(Zhu et al.,1996)。但也有研究认为,根系去除对凋落物分解无显著影响(Staaf,1988)甚至会促进凋落物的分解(Gadgil et al.,1975)。本研究发现,根系去除处理显著降低了2个树种凋落叶的分解速率。这与Zhu等(1996)的研究结果相一致。土壤微生物是凋落物的主要分解者,微生物的多度、组成和活性决定了凋落物的分解速率和养分循环(陈法霖等,2011)。Zhu等(1996)认为根系能否促进凋落物的分解取决于其能否刺激土壤微生物的活性。Kuzyakov等(2006)研究发现,植物根系分泌物可能改变微生物群落结构,提高胞外酶活性,促进凋落物和有机质的分解(Bengtson et al.,2012; Uselman et al.,2012)。但也有研究认为,根系和菌根真菌对凋落物养分的吸收会降低凋落物养分含量,限制微生物和腐生真菌生物量,进而限制凋落物分解(Zhu et al.,1996a。微生物可利用的碳源主要来自于地上凋落物及其淋滤物质、根系分泌物和土壤有机质(Brant et al.,2006)。许多研究发现,去除根系会显著降低土壤微生物和真菌生物量(Brant et al.,2006; Subke et al.,2004)。本研究中,根系去除处理显著降低了土壤真菌和微生物的生物量,与Brant等(2006)和Subke等(2004)的研究结果相一致。当根系的碳输入被切断后,土壤微生物因缺乏碳源而大量死亡,从而限制了凋落物的分解。
除土壤微生物外,根系还有可能通过改变凋落物质量影响凋落物分解速率(Zhu et al.,1996)。但相比根系对凋落物分解速率的影响,较少有根系对凋落物质量影响的报道。(Parmelee et al.,1993)。Gadgil等(1975)研究发现,根系去除对辐射松(Pinus radiata)凋落物氮含量没有显著影响。Staaf(1988)研究也表明,根系去除对凋落物养分含量影响不显著。与上述研究不同,本研究中根系去除处理显著降低了凋落物碳氮含量和碳氮比。凋落物分解速率往往取决于凋落物氮含量和碳氮比(Melillo et al.,1982)。凋落物分解过程中,微生物对氮的需求较高。凋落物氮含量的降低和碳氮比的提高会限制土壤微生物的生物量和活性(陈法霖等,2011),从而抑制凋落物的分解。本研究也发现,凋落物氮含量和碳氮比与土壤微生物含量具有显著的相关性。微生物的碳氮比通常在10以下,而凋落物通常缺乏氮导致多数氮被微生物固持(李雪峰等,2007)。本研究中,根系去除处理下凋落物碳氮的释放显著高于对照处理。这可能是由于当根系的碳输入被切断后,凋落物表面的微生物因缺乏碳源而死亡,同时释放大量的碳氮。
本研究发现,树种与处理的交互效应对凋落物分解速率无显著影响,但树种与处理的交互效应对凋落物碳氮的释放具有显著影响,米老排根系对凋落物碳氮的保留作用显著大于杉木根系。Huang等(2013)研究也发现,米老排比杉木拥有更强的氮保留能力,这与本研究结果相一致。凋落物分解速率往往取决于凋落物碳氮比(Melillo et al.,1982)和微生物的活性(陈法霖等,2011)。一般认为,凋落物碳氮比低,微生物活性高其分解速率快。本研究中,树种与处理的交互效应对凋落物的碳氮比和土壤微生物群落均无显著影响。这可能造成了树种与处理的交互效应对凋落物分解速率影响不显著。
| [1] |
陈法霖, 郑 华, 欧阳志云, 等. 2011. 土壤微生物群落结构对凋落物组成变化的响应. 土壤学报, 48(3): 603-611. (Chen F L, Zheng H, Ouyang Z Y, et al. 2011. Responses of microbial community structure to the leaf litter composition. Acta Pedologica Sinica, 48(3): 603-611.[in chinese])(  1) 1)
|
| [2] |
陈立新, 陈祥伟, 段文标. 1998. 落叶松人工林凋落物与土壤肥力变化的研究. 应用生态学报, 9(6): 581-586. (Chen L X, Chen X W, Duan W B. 1998. Larch litter and soil fertility. Chinese Journal of Apply Ecology, 9(6): 581-586[in chinese]).(  1) 1)
|
| [3] |
方精云, 陈安平. 2001. 中国森林植被碳库的动态变化及其意义. 植物学报, 43(9): 967-973. (Fang J Y, Chen A P. 2001. Dynamic forest biomass carbon pools in China and their significance. Acta Botanica Sinica, 43(9): 967-973[in chinese]).(  1) 1)
|
| [4] |
李雪峰, 张 岩, 牛丽君, 等. 2007. 长白山白桦(Betula platyphlla)纯林和白桦山杨(Populus davidiana)混交林凋落物的分解. 生态学报, 27(5): 1782-1790. (Li X F, Zhang Y, Niu L J, et al. 2007. Litter decomposition processes in the pure birch (Betula platyphlla) forest and the birch and poplar (Populus davidiana) mixed forest. Acta Ecologica Sinica, 27(5): 1782-1790[in chinese]).(  3) 3)
|
| [5] |
国家林业局. 2009. 中国森林资源报告-第七次全国森林资源清查. 北京: 中国林业出版社,18-22. (State Forestry Bureau. 2009. The seventh forest resources report in China. Beijing: China Forestry Press, 18-22.[in chinese])(  1) 1)
|
| [6] |
马承恩, 孔德良, 陈正侠, 等. 2012. 根系在凋落物层中的生长及其对凋落物分解的影响.植物生态学报, 36(11): 1197-1204. (Ma C E, Kong D L, Chen Z X, et al. 2012. Root growth into litter layer and its impact on littter decomposition: a review. Acta Botanica Sinica, 36(11): 1197-1204[in chinese]).(  1) 1)
|
| [7] |
莫江明, 薛 花, 方运霆. 2004. 鼎湖山主要森林植物凋落物分解及其对 N沉降的响应. 生态学报, 24(7): 1413-1420. (Mo J M, Xue H, Fang Y T. 2004. Litter decomposition and its responses to simulated N decomposition for major plants of Dinghushan forest in subtropical China. Acta Ecologica Sinica, 24(7): 1413-1420[in chinese]).(  2) 2)
|
| [8] |
王清奎, 汪思龙, 于小军, 等. 2007. 杉木与阔叶树叶凋落物混合分解对土壤活性有机质的影响. 应用生态学报, 18(6): 1203-1207. (Wang Q K, Wang S L, Yu X J, et al. 2007. Effects of Cunninghamia lanceolate-broadleaved tree species mixed leaf litters on active soil organic matter. Chinese Journal of Apply Ecology,18(6): 1203-1207[in chinese]).(  1) 1)
|
| [9] |
闫美芳, 张新时, 江 源, 等. 2010. 主要管理措施对人工林土壤碳的影响. 生态学杂志, 29(11): 2265-2271. (Yan M F, Zhang X S, Jiang Y, et al. 2010. Effects of management practices on forest plantation soil carbon: a review. Chinese Journal Ecology, 29(11): 2265-2271[in chinese]).(  1) 1)
|
| [10] |
杨万勤, 邓仁菊, 张 健. 2007. 森林凋落物分解及其对全球气候变化的响应. 应用生态学报, 18(12): 2889-2895. (Yang W Q, Deng R J, Zhang J. 2007. Forest litter decomposition and its responses to global climate change. Chinese Journal of Apply Ecology, 18(12): 2889-2895[in chinese]).(  1) 1)
|
| [11] |
张德强, 叶万辉, 余清发, 等. 2000. 鼎湖山演替系列中代表性森林凋落物研究. 生态学报, 20(6): 938-944. (Zhang D Q, Ye W H, Yu Q F, et al. 2000. The litter-fall of representative forests of successional series in Dinghushan. Acta Ecologica Sinica, 20(6): 938-944[in chinese]).(  1) 1)
|
| [12] |
朱丽霞, 章家恩, 刘文高. 2003. 根系分泌物与根际微生物相互作用研究综述. 生态环境, 12(1): 102-105. (Zhu L X, Zhang J E, Liu W G. 2003. Review of studies on interactions between root exudates and rhizopheric microorganisms. Ecology and Environment, 12(1): 102-105[in chinese]).(  1) 1)
|
| [13] |
Aerts R. 1997. Climate, leaf litter chemistry and leaf litter decomposition in terrestrial ecosystems: a triangular relationship. Oikos, 79(3): 439-449.( 1) 1)
|
| [14] |
Bengtson, PerBarker J, Grayston S J. 2012. Evidence of a strong coupling between root exudation, C and N availability, and stimulated SOM decomposition caused by rhizosphere priming effects. Ecology and Evolution, 2(8): 1843-1852.( 2) 2)
|
| [15] |
Berg B, Matzner E. 1997. Effect of N deposition on decomposition of plant litter and soil organic matter in forest systems. Environmental Reviews, 5(1): 1-25.( 1) 1)
|
| [16] |
Brant J B, Myrold D D, Sulzman E W. 2006. Root controls on soil microbial community structure in forest soils. Oecologia, 148(4): 650-659.( 2) 2)
|
| [17] |
Gadgil R L, Gadgil P D. 1975. Suppression of litter decomposition by mycorrhizal roots of Pinus radiata. New Zealand Forest Service, 5: 33-41.( 3) 3)
|
| [18] |
Hobbie S E, Eddy E C, Buyarski C R, et al. 2012. Response of decomposing litter and its microbial community to multiple forms of nitrogen enrichment. Ecological Monographs, 82(3): 389-405.( 1) 1)
|
| [19] |
Huang Z Q, Wan X H, He Z M, et al. 2013. Soil microbial biomass, community composition and soil nitrogen cycling in relation to tree species in subtropical China. Soil Biology and Biochemistry, 62: 68-75.( 2) 2)
|
| [20] |
Jennifer M K, Richard P D. 2008. PLFA profiling of microbial community structure and seasonal shifts in soils of a Douglas-fir chronosequence. Microbial Ecology, 55(3): 500-511.( 1) 1)
|
| [21] |
Kuzyakov Y, Hill P W, Jones D L, et al. 2006. Root exudate components change litter decomposition in a simulated rhizosphere depending on temperature. Plant and Soil, 290(1/2): 293-305.( 2) 2)
|
| [22] |
Mayor J R, Henkel T W. 2006. Do ectomycorrhizas alter leaf-litter decomposition in monodominant tropical forests of Guyana? New Phytologist, 169(3): 579-588.( 1) 1)
|
| [23] |
Melillo J M, Aber J D, Muratore J F. 1982. Nitrogen and lignin control of hardwood leaf litter decomposition dynamics. Ecology, 63(3): 621-626.( 6) 6)
|
| [24] |
Parmelee R W, Ehrenfeld J G, Tate III R L. 1993. Effects of pine roots on microorganisms, fauna, and nitrogen availability in two soil horizons of a coniferous forest spodosol. Biology and Fertility of Soils, 15(2): 113-119( 1) 1)
|
| [25] |
Staaf H.1988.Litter decomposition in beech forests-effects of excluding tree roots. Biology and Fertility of Soils, 6(4): 302-305.( 2) 2)
|
| [26] |
Subke J A, Hahn V, Battipaglia G, et al. 2004. Feedback interactions between needle litter decomposition and rhizosphere activity. Oecologia, 139(4): 551-559.( 1) 1)
|
| [27] |
Uselman S M, Qualls R G,Lilienfein J. 2012. Quality of soluble organic C, N, and P produced by different types and species of litter: root litter versus leaf litter. Soil Biology and Biochemistry, 54: 57-67.( 2) 2)
|
| [28] |
Waring B G. 2013. Exploring relationships between enzyme activities and leaf litter decomposition in a wet tropical forest. Soil Biology and Biochemistry, 64:89-95.( 1) 1)
|
| [29] |
Zhang D, Hui D, Luo Y, et al. 2008. Rates of litter decomposition in terrestrial ecosystems: global patterns and controlling factors. Journal of Plant Ecology, 1(2): 85-93.( 1) 1)
|
| [30] |
Zhu W, Ehrenfeld J G. 1996. The effects of mycorrhizal roots on litter decomposition, soil biota, and nutrients in a spodosolic soil. Plant and Soil, 179(1): 109-118.( 5) 5)
|
 2015, Vol. 51
2015, Vol. 51

