文章信息
- 刘方春, 马海林, 马丙尧, 杜振宇, 井大炜, 邢尚军
- Liu Fangchun, Ma Hailin, Ma Bingyao, Du Zhenyu, Jing Dawei, Xing Shangjun
- 干旱环境下接种根际促生细菌对核桃苗光合特性的影响
- Effect of Plant Growth-Promoting Rhizobacteria on Photosynthetic Characteristics in Walnut Seedlings under Drought Stress
- 林业科学, 2015, 51(7): 84-90
- Scientia Silvae Sinicae, 2015, 51(7): 84-90.
- DOI: 10.11707/j.1001-7488.20150709
-
文章历史
- 收稿日期:2014-01-05
- 修回日期:2014-09-09
-
作者相关文章
2. 德州学院 德州 253023
2. Dezhou University Dezhou 253023
光合作用是植物生长的生理基础。干旱胁迫下,植物气体交换因气孔因素或非气孔因素限制,光合速率降低,正常生长及干物质积累受到严重影响(欧立军等,2012;Guerfel et al.,2009)。我国干旱半干旱地区约占国土面积的50%(王宇超等,2010),且随着全球变暖,水热格局重新分布(Mouillon et al.,2006),干旱胁迫对植物的影响已成为人们关注的热点(杨玉珍等,2011)。
植物根际促生细菌(plant growth-promoting rhizobacteria,PGPR)是指生存在植物根圈范围内,可促进植物生长、拮抗病原菌的有益细菌。PGPR对植物生长及病害防治有极其重要的作用,特别是在常规水分供应条件下,PGPR可通过提高植物光合速率和根系活力等途径促进植物生长,增加干物质积累(Verma et al.,2010;刘方春等,2013)。然而,诸如水分、土壤性质或其他土著微生物活力等不同环境条件会影响PGPR活性(Ahmad et al.,2008; Liu et al.,2013)。迄今,在干旱环境中PGPR对植物光合特性的影响还鲜有报道。
核桃(Juglans regia)是一种重要的坚果和木本油料果树,在干旱瘠薄山地、道路、城镇绿化和农田林网建设中有巨大的发展潜力(李伟波等,2010)。蜡样芽孢杆菌(Bacillus cereus)L90是山东省林业科学研究院和山东农业大学利用小麦 (Triticum aestivum)叶片保绿法和萝卜(Raphanus sativus) 子叶增重法从核桃根际筛选出的一株PGPR(Abbasi et al.,2011),保藏于中国微生物菌种保藏管理委员会普通微生物中心(保藏编号为CGMCC No. 7069)。利用高效液相色谱测定该菌株产反式玉米素和激动素的能力分别为612.09和246.59 ng·mL-1,分泌吲哚乙酸的能力为12.17 μg·mL-1(刘琳等,2010),初步证明该菌具备一定的促进植物生长的潜力。本研究配制一定浓度的L90菌剂,将其接种到核桃根际土壤,在中度干旱胁迫下测定核桃苗叶片光合参数的变化,旨在评估PGPR在干旱逆境中对植物的作用,并探讨提高植物抗旱能力的新途径。
1 材料与方法 1.1 L90菌液配制将L90接入到牛肉膏蛋白胨培养基中,在37 ℃条件下,以180 r·min-1振荡培养2~3天。然后按10%接种量转接到液体培养基上,30~35 ℃、180 r·min-1摇床培养12 h,测定活菌数量后,用蒸馏水稀释至2×108 cfu·mL-1。
1.2 盆栽试验试验于2012年3月27日在山东省林业科学研究院温室进行。土壤为潮土,田间持水量34.15%,碱解氮、速效磷和速效钾含量分别为37.29,41.35和75.36 mg·kg-1,pH7.64。盆高25 cm、宽30 cm,每盆装土12 kg,每盆1株核桃实生苗,其平均地径为1.6 cm,定杆高度为0.5 m。核桃苗定植后,统一管理,保持土壤含水量为田间持水量的70%~75%。
试验分正常浇水(CK)、干旱(DR)和干旱环境下接种L90(L90)共3个处理,每个处理重复5次。6月7日,取L90菌液25 mL稀释至250 mL,均匀浇灌至L90处理的核桃苗根系周围。6月22日,L90和DR处理停止浇水,至6月27日土壤含水量自然干旱至田间持水量的44.2%开始干旱胁迫试验。参照杨玉珍(2011)等的方法,对照含水量为田间持水量的70%~75%,DR和L90处理的含水量为田间持水量的40%~45%。每天9:00利用便携式土壤水分/盐分/温度计(英国,WET-2-K1型)测量土壤含水量,DR和L90处理土壤含水量达到标准后,不定时补水,保持土壤含水量相对稳定。
1.3 光合测定2012年7月3日上午10:00—10:30开始第1次光合参数测定,利用LI-6400便携式光合作用仪(LI-COR,USA)测定叶片的净光合速率(P < n)、气孔导度(Gs)和胞间二氧化碳浓度(Ci),以spad-502型便携式叶绿素仪测定叶片SPAD(soil and plant analyzer development)值,通过标准曲线(1∶1的乙醇和丙酮混合液浸提,分光光度法)计算叶片叶绿素(Chl)含量。测定时,随机选择3株幼苗,每株选3个健康的功能叶片,叶片叶位相同、颜色一致,每叶片重复测定3次。此后,按照同样的方法,每6天测定1次光合参数和SPAD值,直至8月2日干旱胁迫试验结束。8月3日,对DR和L90进行恢复供水处理,土壤含水量至对照水平。8月8日,按照同样的方法测定3个处理核桃苗叶片的光合参数及SPAD值,并计算叶片的Chl含量。
1.4 数据处理数据处理使用SPSS11.5软件,采用one-way ANOVA(单因素差异显著性分析法)中的LSD(最小显著法)在α =0.05水平下检验不同处理对核桃苗叶片光合参数和Chl含量的影响。
2 结果与分析 2.1 净光合速率(P < n)光合性能变化可直接反映干旱胁迫对植物的伤害程度(郝敬虹等,2012)。 干旱胁迫下不同试验处理净光合速率(P < n)的动态变化如图 1所示。 由图 1可以看出,在整个干旱胁迫过程中,核桃苗叶片P < n均有不同程度的下降。与 CK相比,DR和L90处理导致叶片P < n分别降低21.78%和11.62%。
 |
图 1 干旱胁迫下不同试验处理净光合速率的动态变化 Fig. 1 Dynamic changes of net photosynthetic rate (P < n) of different treatments under drought stress |
在干旱胁迫初期(第6天),DR处理核桃苗叶片的P < n较CK显著下降19.23%(P < 0.05);在干旱至第12和第18天时,同CK相比,DR处理叶片的P < n分别下降17.07%和9.14%,其降幅较初期有一定程度的减小,说明随着干旱胁迫时间的增加,核桃本身产生了一定的适应机制;随着干旱胁迫时间继续延长,在胁迫末期叶片P < n的下降幅度又有一定程度增加;在胁迫至第36天时,同CK相比,DR处理叶片的P < n显著降低37.03%。
L90处理叶片P < n随干旱胁迫时间的变化规律与DR处理相类似。从整个胁迫期间P < n的平均值来看,L90处理的P < n比DR处理显著提高12.99%(P < 0.05)。在干旱胁迫初期(第6天),L90处理的P < n较DR处理显著提高11.11%(P < 0.05),表明不接种L90的核桃苗更易受到干旱胁迫;此后随干旱胁迫时间的增加,L90处理的P < n较DR处理分别提高5.88%,10.00%,12.51%,11.48%和31.73%,二者之间差异逐渐增大,说明随干旱胁迫时间增加,L90抑制P < n降低的效果逐渐增强。
2.2 气孔导度(Gs)干旱胁迫下不同试验处理气孔导度(Gs)的动态变化如图 2所示。由图 2可以看出,在干旱胁迫初期(第6天),DR处理核桃苗叶片的Gs较CK下降27.40%。随着干旱胁迫时间增加,在第12天时,DR处理的Gs略有上升,这可能是核桃苗逐渐适应干旱环境造成的。随后Gs持续下降,至胁迫末期,同CK相比,Gs显著下降37.08%(P < 0.05)。
 |
图 2 干旱胁迫下不同试验处理气孔导度的动态变化 Fig. 2 Dynamic changes of stomatal conductance (Gs) of different treatments under drought stress |
在干旱胁迫初期(第6天),L90处理的Gs较CK仅下降6.85%,但比DR处理显著提高28.30%(P < 0.05),说明接种L90在胁迫初期即可减轻干旱对Gs的抑制作用。随着干旱胁迫时间的增加,L90处理的Gs持续降低。在整个胁迫期间,L90处理的Gs较DR处理显著提高19.08%(P < 0.05),说明接种L90可提高核桃幼苗的干旱适应能力。
2.3 胞间CO2浓度(Ci)干旱胁迫下不同试验处理胞间CO2浓度(Ci)的动态变化如图 3所示。 由图 3可以看出,在干旱胁迫初期(第6天),同CK相比,DR处理核桃苗叶片的Ci显著下降9.47%(P < 0.05),说明短时间干旱胁迫可导致核桃苗叶片Ci降低。随着干旱胁迫时间增加,叶片Ci持续降低;但在从第18天开始Ci逐渐增加,至胁迫末期时甚至显著高于CK,如胁迫至第30和第36天时,DR处理叶片的Ci同CK相比显著提高9.80%和17.43%(P < 0.05)。
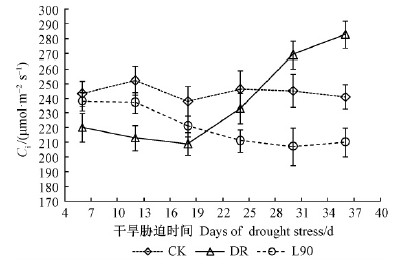 |
图 3 干旱胁迫下不同试验处理胞间CO2浓度的动态变化 Fig. 3 Dynamic changes of intercellular CO2 concentration (Ci) of different treatments under drought stress |
在整个胁迫过程中,L90处理叶片Ci随干旱胁迫时间的变化规律与DR处理并不一致。在干旱胁迫初期(第6天),同CK相比,接种L90处理的Ci并没有显著变化(P>0.05);但此后随着干旱胁迫时间增加Ci呈持续降低趋势。在干旱胁迫至第36天时,L90处理的Ci同CK相比显著下降12.86%(P < 0.05),其水平与DR处理至第18天时相当。
2.4 叶绿素(Chl)含量随着干旱胁迫时间的增加,各处理对Chl含量的影响不同(图 4)。在干旱胁迫初期(第6天),3种处理之间核桃苗叶片的Chl含量差异不显著(P>0.05),说明核桃本身具有较强的抵抗干旱能力。随着干旱胁迫时间增加(第18天以后),DR处理叶片的Chl含量开始持续下降,至第36天时DR处理的Chl含量同CK相比显著下降9.22%(P < 0.05),说明一定强度的干旱能造成核桃苗叶片中Chl的分解或流失。而在干旱胁迫至第36天时,L90处理叶片的Chl含量同DR处理相比显著增加9.49%(P < 0.05),表明接种L90可显著抑制干旱胁迫后期Chl的降解,使其能基本维持在CK水平。
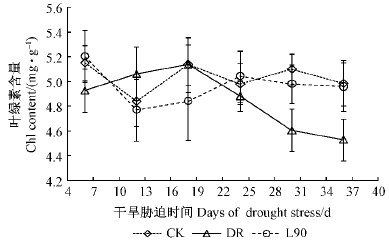 |
图 4 干旱胁迫下不同试验叶绿素含量的动态变化 Fig. 4 Dynamic changes of chlorophyll content of different treatments under drought stress |
经受干旱胁迫的核桃苗恢复供水5天后,其光合参数如表 1所示。同CK相比,DR处理叶片的P < n,Gs和Chl含量分别降低9.46%,10.29%和5.86%,Ci增加8.72%;而在干旱胁迫末期(第36天),P < n,Gs和Chl含量较CK的降低幅度分别为37.03%,37.08%和9.22%,Ci的增加幅度为17.43%。核桃苗恢复供水后,光合功能部分恢复。同DR处理相比,L90处理叶片的P < n,Gs和Chl含量分别提高7.01%,12.15%和5.81%,除Ci略有降低外,基本恢复到CK水平。由此可见,在本研究的干旱胁迫强度下,接种L90处理核桃苗受到的干旱胁迫是基本可逆的。
|
|
光合作用是植物生长的生理基础,能够反映植物的生长势和抗旱性强弱(Sharp et al.,2004)。大量文献证实,干旱胁迫会引起气孔关闭和Gs降低,导致P < n下降(Lawlor et al.,2002; Cornic,2000)。在本研究的干旱胁迫强度下,干旱胁迫初期,核桃苗叶片的P < n有一定程度的下降; 随着对干旱环境的适应,P < n逐渐上升;而随着干旱胁迫时间的继续增加,在胁迫末期P < n又有明显的下降,这与杨玉珍等(2011)对香椿 (Toona sinensis)的研究结论相一致。井大炜等(2013)在107欧美杨(Populus euramericana cv. ‘Neva’)扦插苗上的研究结果表明,随着干旱胁迫时间的增加,P < n持续下降,与本研究结论有较大差异,可能与不同植物对干旱胁迫的反应方式不同有关。
干旱环境下接种L90可显著抑制核桃苗叶片P < n和Gs的下降幅度。除干旱胁迫初期(第6天)外,随着干旱胁迫时间的增加,L90 缓解干旱对P < n的抑制效果逐渐增强。这说明植物受到的干旱胁迫强度越高,L90对P < n的促进作用也就越强。研究表明,在正常环境下,PGPR可提高植物叶片的P < n,促进干物质的积累(Liu et al.,2013)。气象、土壤性质或水分等环境条件的不同均会对微生物的生长繁殖造成影响,只有PGPR能定殖于根际,才能发挥其促生作用(Egamberdiyeva,2007; Arzanesh et al.,2011),也就是说PGPR对土壤环境的适应性是其功能效应的决定因素。因此,本研究选择从相对干旱环境中筛选出的PGPR,更有可能适应干旱生态环境并对植物的光合能力产生影响。
3.2 干旱、L90与气孔限制和非气孔限制干旱胁迫下,引起叶片P < n降低的植物自身因素主要有气孔限制和非气孔限制2类(Monneveux et al.,2006)。在轻度胁迫下,叶片P < n的降低主要是气孔部分关闭的结果;在重度胁迫下,叶绿体和细胞失水,叶绿体中一些参与碳固定的酶活性受到抑制,叶片P < n的降低主要受非气孔因素影响(杨玉珍等,2011)。Ci和Gs是区分P < n下降的气孔或非气孔因素的判断依据(Bai et al.,2006)。气孔限制使Ci降低,而非气孔限制使Ci升高。当气孔限制和非气孔限制这2种因素同时存在时,Ci变化的方向取决于占优势的因素。本研究显示,在干旱胁迫初期,核桃苗叶片P < n的下降伴随着Gs和Ci的降低,说明此时P < n的降低主要是受气孔因素限制;而随着干旱时间增加,Gs持续降低,但Ci先降低后逐渐升高,这表明P < n的下降除受气孔因素限制外,逐渐开始受非气孔因素的限制,其叶肉细胞光合活性下降,光合器官结构受到损伤,恢复供水后的P < n并不能完全恢复到正常供水水平。然而,接种L90后,整个胁迫处理期间Ci持续降低,这说明在本研究的干旱胁迫强度下,接种L90能够减少叶片光合器官的结构损伤,延缓水分胁迫下非气孔因素对叶片P < n的限制,并有利于恢复供水后光合功能的快速恢复。
3.3 干旱、L90与色素含量叶片是植物进行光合作用的主要场所,叶片中Chl含量高低在一定程度上能反映叶片的光合能力(冯慧芳等,2011)。 惠竹梅等(2007)研究认为,干旱胁迫可以引起叶片中Chl的分解,导致Chl含量降低,光合能力下降。抗旱性越强的植物,随干旱胁迫强度的增加,Chl含量降低的幅度会随之变小(尹丽等,2010)。本研究中,在干旱胁迫的初期和中期,无论是否接种L90,核桃苗叶片中的Chl含量并没有显著的变化,这在一定程度上说明核桃具有较强的干旱适应能力。然而,随着干旱胁迫时间的增加,叶片中Chl含量有所降低,且恢复供水后并没有恢复到正常水平,这说明核桃本身受到了不可逆的干旱伤害。有研究认为,随着干旱胁迫程度的加剧,Chl含量呈先增高后降低的趋势(欧立军等,2012;尹丽等,2010),与本研究结论有较大差异,这可能与植物对环境因子的补偿和超补偿效应的差异有关(喻晓丽等,2007)。如能在适度干旱环境下保持Chl含量的稳定性或有所提高,对抑制P < n下降和增强植物抗逆性是有利的(冯慧芳等,2011)。接种L90后,整个胁迫期间核桃苗叶片的Chl含量没有显著变化,说明接种L90在一定程度上提高了核桃在干旱环境中的适应能力。
蜡样芽孢杆菌L90可产一定浓度的细胞分裂素。 细胞分裂素可促进气孔开张,提高光速速率(Arkhipova et al.,2007),可一定程度上抑制Chl的流失(Abbasi et al.,2011)。本研究结果显示,在干旱胁迫后期,核桃苗叶片的Chl含量有一定程度的降低,而接种L90可显著抑制这种降低。因此,通过提高植物叶片中细胞分裂素含量,减少Chl流失,调节气孔开闭,可能是L90减轻干旱对植物叶片P < n抑制作用的机制之一。干旱环境下接种PGPR可有效抑制P < n下降,改善植物在干旱环境中的适应能力,这对干旱山地的造林和森林管理均具有重要意义。
| [1] |
冯慧芳,薛 立,任向荣,等. 2011. 4种阔叶幼苗对PEG模拟干旱的生理响应. 生态学报,31(2): 371-382. (Feng H F, Xue L,Ren X R, et al. 2011. Physiological responses of four broadleaved seedlings to drought stress simulated by PEG. Acta Ecologica Sinica, 31(2): 371-382[in Chinese]).(  2) 2)
|
| [2] |
郝敬虹,易 旸,尚庆茂,等. 2012. 干旱胁迫下外源水杨酸对黄瓜幼苗膜脂过氧化和光合特性的影响. 应用生态学报,23(3): 717-723. (Hao J H, Yi Y, Shang Q M, et al. 2012. Effects of exogenous salicylic acid on membrane lipid peroxidation and photosynthetic characteristics of Cucumis sativus seedlings under drought stress. Chinese Journal of Applied Ecology, 23(3): 717-723[in Chinese]).(  1) 1)
|
| [3] |
惠竹梅,孙万金,张振文. 2007. 外源Ca2+ 对水分胁迫下酿酒葡萄黑比诺主要抗旱生理指标的影响. 西北农林科技大学学报,35(9): 137-140, 146. (Hui Z M, Sun W J, Zhang Z W. 2007. Effect of exogenous Ca2+ on drought resistance physiological indexes of wine grape cultivar Pinot Noir under water stress. Journal of Northwest A & F University, 35(9): 137-140, 146[in Chinese]).(  1) 1)
|
| [4] |
井大炜,邢尚军,杜振宇,等. 2013. 干旱胁迫对杨树幼苗生长、光合特性及活性氧代谢的影响. 应用生态学报,24(7): 1809-1816. (Jing D W, Xing S J, Du Z Y, et al. 2013. Effects of drought stress on growth, photosynthetic characteristics and active oxygen metabolism of poplar seedlings. Chinese Journal of Applied Ecology, 24(7): 1809-1816[in Chinese]).(  1) 1)
|
| [5] |
李伟波,马 明,孙 翠,等. 2010. 核桃早实基因的SCAR标记. 林业科学,46(3): 56-61. (Li W B, Ma M, Sun C, et al. 2010. Development of a SCAR marker linked to precocious trait in walnut (Juglans regia). Scientia Silvae Sinicae, 46(3): 56-61[in Chinese]).(  1) 1)
|
| [6] |
刘方春,邢尚军,马海林,等. 2013. 根际促生细菌 (PGPR) 对冬枣根际土壤微生物数量及细菌多样性影响. 林业科学,49(8): 75-80. (Liu F C, Xing S J, Ma H L, et al. 2013. Effect of plant growth-promoting rhizobacteria (PGPR) on the microorganism population and bacterial diversity in winter jujube rhizosphere soil. Scientia Silvae Sinicae, 49(8): 75-80[in Chinese]).(  1) 1)
|
| [7] |
刘琳,孙 磊,张瑞英,等. 2010. 春兰根中可分泌吲哚乙酸的内生细菌多样性. 生物多样性,18(2): 195-200. (Liu L, Sun L, Zhang R Y, et al. 2010. Diversity of IAA-producing endophytic bacteria isolated from the roots of Cymbidium goeringii. Biodiversity Science, 18(2): 195-200[in Chinese]).(  1) 1)
|
| [8] |
欧立军,陈 波,邹学校. 2012. 干旱对辣椒光合作用及相关生理特性的影响. 生态学报,32(8): 2612-2619. (Ou L J,Chen B,Zou X X.2012. Effects of drought stress on photosynthesis and associated physiological characters of pepper. Acta Ecologica Sinica, 32(8): 2612-2619[in Chinese]).(  2) 2)
|
| [9] |
王宇超,王得祥,彭少兵,等. 2010. 干旱胁迫对木本滨藜生理特性的影响. 林业科学,46(1): 61-67. (Wang Y C, Wang D X, Peng S B, et al. 2010. Effects of drought stress on physiological characteristics of woody saltbush. Scientia Silvae Sinicae, 46(1): 61-67[in Chinese]).(  1) 1)
|
| [10] |
杨玉珍,张云霞,彭方仁. 2011. 干旱胁迫对不同种源香椿苗木光合特性的影响.北京林业大学学报,33(1): 44-48 (Yang Y Z, Zhang Y X, Peng F R,et al. 2011. Effects of drought stress on photosynthetic characteristics in Toona sinensis seedlings from different provenances. Journal of Beijing Forestry University, 33(1): 44-48.[in Chinese]) .(  4) 4)
|
| [11] |
尹丽,胡庭兴,刘永安,等. 2010. 干旱胁迫对不同施氮水平麻疯树幼苗光合特性及生长的影响. 应用生态学报,21(3): 569-576. (Yin L, Hu T X, Liu Y A, et al. 2010. Effect of drought stress on photosynthetic characteristics and growth of Jatropha curcas seedlings under different nitrogen level. Chinese Journal of Applied Ecology, 21(3): 569-576[in Chinese]).(  2) 2)
|
| [12] |
喻晓丽,邸雪颖,宋丽萍. 2007. 水分胁迫对火炬树幼苗生长和生理特性的影响. 林业科学,43(11): 57-61. (Yu X L, Di X Y, Song L P. 2007. Effects of water stress on the growth and eco-physiology of seedlings of the Rhus typhina. Scientia Silvae Sinicae, 43(11): 57-61[in Chinese]).(  1) 1)
|
| [13] |
Abbasi M K, Sharif S, Kazmi M,et al. 2011. Isolation of plant growth promoting rhizobacteria from wheat rhizosphere and their effect on improving growth, yield and nutrient uptake of plants. Plant Biosyst, 145: 159-168.( 2) 2)
|
| [14] |
Ahmad F, Ahmad I, Khan M S. 2008. Screening offree-living rhizospheric bacteria for their multiple plant growth promoting activities. Microbiological Research, 163: 173-181.( 1) 1)
|
| [15] |
Arkhipova T N,Prinsen E, Veselov S U, et al. 2007. Cytokinin producing bacteria enhance plant growth in drying soil. Plant Soil, 292: 305-315.( 1) 1)
|
| [16] |
Arzanesh M H, Alikhani H A, Khavazi K, et al. 2011. Wheat (Triticum aestivum L.) growth enhancement by Azospirillum sp. under drought stress. World J Microbiol Biotechnol, 27: 197-205.( 1) 1)
|
| [17] |
Bai L P,Sui F G,Ge T D, et al. 2006. Effect of soil drought stress on leaf water status, membrane permeability and enzymatic antioxidant system of maize. Pedosphere, 16: 326-332.( 1) 1)
|
| [18] |
Cornic G. 2000. Drought stress inhibits photosynthesis by decreasing stomatal aperture-not by affecting ATP synthesis. Trends Plant Science, 5: 187-188.( 1) 1)
|
| [19] |
Egamberdiyeva D. 2007. The effect of plant growth promoting bacteria on growth and nutrient uptake of maize in two different soils. Appl Soil Ecol, 36: 184-189.( 1) 1)
|
| [20] |
Guerfel M, Baccouri O, Boujnah D,et al. 2009. Impacts of water stress on gas exchange, water relations, chlorophyll content and leaf structure in the two main Tunisian olive (Olea europaea L.) cultivars. Scientia Horticulturae, 119: 257-263.( 1) 1)
|
| [21] |
Lawlor D W, Cornic G. 2002. Photosynthetic carbon assimilation and associated metabolism in relation to water deficits in higher plants. Plant Cell & Environment, 25: 275-294.( 1) 1)
|
| [22] |
Liu F, Xing S,Ma H, et al. 2013. Plant growth-promoting rhizobacteria affect the growth and nutrient uptake of Fraxinus Americana container seedlings. Applied Microbiology and Biotechnology, 97: 4617-4625.( 1) 1)
|
| [23] |
Monneveux P,Rekika D,Acevedo E, et al. 2006. Effect of drought on leaf gas exchange, carbon isotope discrimination, transpiration efficiency and productivity in field grown durum wheat genotypes. Plant Science, 170: 867-872.( 2) 2)
|
| [24] |
Mouillon J M, Gustafsson P, Harryson P. 2006. Structural investigation of disordered stress proteins comparison offull-length dehydrins with isolated peptides of their conserved segments. Plant Physiology, 141: 638-650.( 1) 1)
|
| [25] |
Sharp R E, Poroyko V, Hejlek L G,et al. 2004. Root growth maintenance during water deficits: Physiology to functional genomics. Journal of Experimental Botany, 55: 2343-2351.( 1) 1)
|
| [26] |
Verma J P, Yadav J, Tiwari K N, et al. 2010. Impact of plant growth promoting rhizobacteria on crop production. International Journal of Agricultural Research, 5: 954-983.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

