引用本文

梁玉琴, 张嘉嘉, 梁晋军, 李芳东, 韩卫娟, 傅建敏. 2015. 河南省柿种质资源的遗传多样性[J]. 林业科学, 51(6): 71-80.

Liang Yuqin, Zhang Jiajia, Liang Jinjun, Li Fangdong, Han Weijuan, Fu Jianmin. 2015. Genetic Diversity among Persimmon Germplasms in Henan Province. Scientia Silvae Sinicae, 51(6): 71-80. DOI: 10.11707/j.1001-7488.20150609

河南省柿种质资源的遗传多样性
梁玉琴1, 2,
张嘉嘉1, 2,
梁晋军1, 2,
李芳东1,
韩卫娟1,
傅建敏1
1. 国家林业局泡桐研究开发中心,郑州 450003;
2. 中国林业科学研究院经济林研究开发中心,郑州 450003
收稿日期:2014-09-22;修回日期:2014-12-15
基金项目:国家“十二五”农村领域科技计划课题(2013BAD14B0502)。
通讯作者:傅建敏
摘要:[目的] 对河南省柿种质资源的遗传多样性进行分析,揭示河南省柿种质资源的遗传多样性程度,分析不同资源之间的亲缘关系,并进行种质资源鉴定,判断同名异物和同物异名品种。[方法] 以柿近缘种君迁子、油柿、浙江柿、美洲柿、金枣柿及柿变种野柿共计9份材料作为对照,从已发表的柿属植物SSR引物中,筛选出多态性较高的,对来自河南省不同地区的柿主栽品种(18份)、农家品种(55份)及野生资源(20份),共计93份资源进行遗传多样性分析。[结果] 利用17对SSR引物对102份材料进行PCR扩增,共得到159个不同的DNA片段(即条带),平均每对引物9.35个,范围为5~14个,扩增条带最多的引物有2对,分别来自位点ssrDK11/DQ097479和ssrDK14/DQ097482,最少的来自位点8125/DC592401; 所得到的所有条带均具有多态性; 共得到508个谱带类型(即带型),平均每对引物29.88个,范围为8~53个,最多的引物对来自位点ssrDK11/DQ097479,而最少的则来自位点5553/DC585710; 特异带型总数为267个,平均每对引物15.71个,范围为2~37个,最多的依然来自位点ssrDK11/DQ097479,最少的同样是5553/DC585710; 特异带型比率73.68%~25.00%; 种质鉴定率1.96%~36.27%; 多态性信息含量(PIC)平均为0.839 7,范围是0.466 7~0.964 7; Shannon信息指数(I)平均为2.658 6,范围为1.112 1~3.596 7; 平均观察杂合度(Ho)为0.777 4,范围是0.147 1~0.960 8。综合对比,ssrDK11/DQ097479、ssrDK14/DQ097482和mDp17/EF567410这3个位点遗传变异程度最高。主坐标分析与聚类分析结果基本一致:柿及其近缘种彼此之间具有明显的遗传差异; 柿种下所有资源单独聚为一大类,能够与近缘种区别开; 与其他近缘种相比,美洲柿与柿的亲缘关系相对较远。扩增的位点可鉴别所有供试资源,并可判断部分同名异物或同物异名品种。[结论] 河南省柿种质资源遗传变异程度较大,杂合程度高,具有较高水平的遗传多样性; 本研究所用方法可有效应用于柿种质资源鉴定。
关键词:
柿 遗传多样性 SSR 亲缘关系 种质鉴定
Genetic Diversity among Persimmon Germplasms in Henan Province
Liang Yuqin1, 2,
Zhang Jiajia1, 2,
Liang Jinjun1, 2,
Li Fangdong1,
Han Weijuan1,
Fu Jianmin1
1. China Paulownia Research Center, State Forestry Administration, Zhengzhou 450003;
2. Non-Timber Forest Research and Development Center, Chinese Academy of Forestry, Zhengzhou 450003
Abstract: [Objective] The aim of the present study was to elucidate the genetic diversity and relationship among the germplasm accessions of Diospyros kaki in Henan province, meanwhile to identify the germplasms especially those of synonyms and homonyms. [Method] The genetic diversity among 102 germplasms including 93 accessions of D. kaki (18 major cultivars, 55 local varieties and 20 wild persimmons) originating from different areas in Henan and nine materials used as control which belong to five relative species i.e., D. lotus, D. oleifera, D. glaucifolia, D. virginiana and Jinzaoshi (D. spp.), and D. kaki var. sylvestris were analyzed based on the polymorphic SSR (simple sequence repeat) primers selected from those developed for Diospyros in previous reports. [Result] A total of 159 polymorphic DNA fragments i.e., bands, were obtained from the analysis of genetic variation among all 102 accessions by 17 pairs of SSR primers with an average of 9.35 bands per pair of primers ranging from 5 (8125/DC592401) to 14 (ssrDK11/DQ097479 and ssrDK14/DQ097482). The number of band patterns was 508 in total with an average of 29.88 per pair of primers ranging from 8 (5553/DC585710) to 53 (ssrDK11/DQ097479). The total number of unique band patterns was 267 with an average of 15.71 per pair of primers ranging from 2 (5553/DC585710) to 37 (ssrDK11/DQ097479). The rate of unique band patterns ranged from 73.68% to 25.00% and the rate of germplasm identified ranged from 1.96% to 36.27%. The average value of polymorphism information content (PIC) was 0.839 7 ranging from 0.466 7 to 0.964 7 and the average Shannon's information index (I) was 2.658 6 ranging from 1.112 1 to 3.596 7. Observed heterozygosity (Ho) ranged from 0.147 1 to 0.960 8 with an average value of 0.777 4. The highest genetic diversity level was found in three loci ssrDK11/DQ097479, ssrDK14/DQ097482 and mDp17/EF567410 by comprehensive comparison. The result obtained from principal coordinate analysis was roughly the same as that from cluster analysis: There were obvious genetic differences among different species. All germplasm accessions of D. kaki were divided into the same group which was clearly different from the samples of other closely related species. Compared with the other related species, the relationship between D. kaki and D. virginiana was relatively distant. All germplasm accessions tested including some homonymous or synonymous cultivars were identified by the 17 loci. [Conclusion] The results in present study revealed high level of genetic diversity among D. kaki germplasm accessions in Henan province with large variations and high heterozygosity. Moreover, the method was proved to be efficient in germplasm identification of D. kaki.
Key words:
Diospyros kaki genetic diversity SSR markers genetic relationship germplasm identification
柿(Diospyros kaki)属于柿科(Ebenaceae)柿属(Diospyros)植物,是我国重要的六大木本粮油树种之一,具有重要的经济、生态和社会价值(李树钢,1987;何方等,2004)。柿适生能力强,分布范围广,除西藏、新疆、青海、内蒙古、黑龙江、吉林6省(区)外,其他地区均有栽培与分布(左大勋等,1984;宗学普,2002)。柿种质资源数量繁多,存在丰富的遗传变异,中国现有品种1 000多个,居世界首位(李高潮等,2006)。虽然已经有学者对柿种质资源进行了遗传多样性研究,但是其试验材料主要是甜柿资源,然而我国除了大别山区有极少数甜柿分布外,其他各地柿资源均为涩柿(张青林,2006;郭大龙,2006;杜晓云,2008)。河南省是涩柿五大主产区之一,在全国柿分布区中占据重要地位,据农业部2011年统计,河南省柿产量约43万t,居全国第3位,该省西部属于秦岭东部余脉伏牛山区,拥有丰富的柿种质资源(丁向阳等,2001;韩德波等,2010),但是这些资源管理粗放,品种混杂,存在非常严重的同名异物或同物异名现象。目前未见关于河南省柿种质资源遗传多样性的研究报道。分子标记是分析物种多样性的常用方法,其中SSR(simple sequence repeat),即简单序列重复,又称微卫星,广泛分布于植物基因组中,具有数量多、多态性高、稳定性好、操作简单等优点,已广泛应用于植物遗传多样性研究(周炎花等,2011;黄平等,2012)。需特别注意的是,在进行多倍体植物遗传多样性分析时,许多常规的计算公式或者软件并不适用,因为它们基本都是针对二倍体和单倍体开发的。已有报道显示,利用SSR引物可对多倍体柿进行PCR扩增,将此共显性标记转化成简单有效的显性标记(等同于基因组DNA片段的PCR扩增技术),可有效进行多倍体柿遗传多样性分析(Naval et al.,2010)。本文在河南省各地柿种质资源调查收集的基础上,利用已发表的众多SSR引物,对来自不同地区的102份材料进行PCR扩增,分析资源的遗传多样性及亲缘关系,并进行种质资源鉴定,判断同名异物或同物异名品种,以期为河南省柿种质资源的合理保存、有效利用及杂交育种等工作提供科学理论依据。
1 材料与方法1.1 植物材料
以柿属植物6种、1变种共计102份种质资源为材料(表 1)进行试验,其中来自河南省各地柿种下资源93份,包括各地主栽品种、农家品种及野生资源,另外选取了9份材料作对照,包括柿变种(野柿 D. kaki var. sylvestris)、柿近缘种(君迁子D. lotus、浙江柿D. glaucifolia、油柿D. oleifera、美洲柿D. virginiana)及金枣柿(D. spp.)。春季在中国林业科学研究院经济林研究开发中心柿种质资源圃内采集刚展开的幼嫩叶片,液氮保存带回实验室,-70 ℃贮藏以备提取DNA。
表 1 试验材料类型及其来源
Tab.1 Types and origins of the materials analyzed

表 1 试验材料类型及其来源
Tab.1 Types and origins of the materials analyzed
| 序号No. | 种质名称Name of the germplasms | 类型Types | 产地Origins |
| 1 | ‘大火罐’ D. kaki ‘Dahuoguan’ | 农家品种Local cultivar | 洛阳Luoyang | | 2 | ‘小火罐’ D. kaki ‘Xiaohuoguan’ | 农家品种Local cultivar | 洛阳Luoyang | | 3 | ‘早熟柿’ D. kaki ‘Zaoshushi’ | 农家品种Local cultivar | 洛阳Luoyang | | 4 | ‘小镜面糊卵’ D. kaki ‘Xiaojingmianhuluan’ | 农家品种Local cultivar | 洛阳Luoyang | | 5 | ‘小面糊’ D. kaki ‘Xiaomianhu’ | 农家品种Local cultivar | 洛阳Luoyang | | 6 | ‘面糊卵’ D. kaki ‘Mianhuluan’ | 农家品种Localcultivar | 洛阳Luoyang | | 7 | ‘面窝窝’ D. kaki ‘Mianwowo’ | 农家品种Local cultivar | 洛阳Luoyang | | 8 | ‘磨盘柿’ D. kaki ‘Mopanshi’ | 农家品种Local cultivar | 洛阳Luoyang | | 9 | ‘树梢黄’ D. kaki ‘Shushaohuang’ | 农家品种Local cultivar | 洛阳Luoyang | | 10 | ‘羊烘烘’ D. kaki ‘Yanghonghong’ | 农家品种Local cultivar | 洛阳Luoyang | | 11 | ‘遮叶’ D. kaki ‘Zheye’ | 农家品种Local cultivar | 洛阳Luoyang | | 12 | ‘朱皮柿’ D. kaki ‘Zhupishi’ | 农家品种Local cultivar | 洛阳Luoyang | | 13 | ‘花疙瘩’ D. kaki ‘Huageda’ | 农家品种Local cultivar | 栾川Luanchuan | | 14 | ‘栾川八月黄’ D. kaki ‘Luanchuan-Bayuehuang’ | 主栽品种Major cultivar | 栾川Luanchuan | | 15 | ‘栾川出头柿’ D. kaki ‘Luanchuan-Chutou’ | 农家品种Local cultivar | 栾川Luanchuan | | 16 | ‘栾川牛心’ D. kaki ‘Luanchuan-Niuxin’ | 主栽品种Major cultivar | 栾川Luanchuan | | 17 | ‘水葫芦’ D. kaki ‘Shuihulu’ | 农家品种Localcultivar | 栾川Luanchuan | | 18 | ‘雁过红-1’ D. kaki ‘Yanguohong-1’ | 主栽品种Major cultivar | 栾川Luanchuan | | 19 | ‘石榴柿’ D. kaki ‘Shiliushi’ | 农家品种Local cultivar | 栾川Luanchuan | | 20 | ‘冻柿’ D. kaki ‘Dongshi’ | 农家品种Local cultivar | 孟津Mengjin | | 21 | ‘红柿’ D. kaki ‘Hongshi’ | 农家品种Local cultivar | 孟津Mengjin | | 22 | ‘孟津镜面柿’ D. kaki ‘Mengjin-Jingmianshi’ | 农家品种Local cultivar | 孟津Mengjin | | 23 | ‘算盘子’ D. kaki ‘Suanpanzi’ | 农家品种Local cultivar | 孟津Mengjin | | 24 | ‘天生蛋’ D. kaki ‘Tianshengdan’ | 农家品种Local cultivar | 孟津Mengjin | | 25 | ‘摘家烘’ D. kaki ‘Zhaijiahong’ | 农家品种Local cultivar | 孟津Mengjin | | 26 | ‘新安牛心’ D. kaki ‘Xinan-Niuxin’ | 主栽品种Major cultivar | 新安Xin’an | | 27 | ‘冬冬’ D. kaki ‘Dongdong’ | 农家品种Local cultivar | 新安Xin’an | | 28 | ‘冬青’ D. kaki ‘Dongqing’ | 农家品种Local cultivar | 新安Xin’an | | 29 | ‘方柿’ D. kaki ‘Fangshi’ | 农家品种Local cultivar | 新安Xin’an | | 30 | ‘红轱卵’ D. kaki ‘Hongguluan’ | 农家品种Local cultivar | 新安Xin’an | | 31 | ‘鸡心柿’ D. kaki ‘Jixinshi’ | 农家品种Local cultivar | 新安Xin’an | | 32 | ‘罗盘柿’ D. kaki ‘Luopanshi’ | 农家品种Local cultivar | 新安Xin’an | | 33 | ‘满天红’ D. kaki ‘Mantianhong’ | 农家品种Local cultivar | 新安Xin’an | | 34 | ‘小柿’ D. kaki ‘Xiaoshi’ | 农家品种Local cultivar | 新安Xin’an | | 35 | ‘门定’ D. kaki ‘Mending’ | 农家品种Local cultivar | 偃师Yanshi | | 36 | ‘南衙’ D. kaki ‘Nanya’ | 农家品种Local cultivar | 偃师Yanshi | | 37 | ‘七月早-1’ D. kaki ‘Qiyuezao-1’ | 主栽品种Major cultivar | 偃师Yanshi | | 38 | ‘小牛心’ D. kaki ‘Xiaoniuxin’ | 农家品种Local cultivar | 偃师Yanshi | | 39 | ‘偃师出头柿’ D. kaki ‘Yanshi-Chutou’ | 农家品种Local cultivar | 偃师Yanshi | | 40 | ‘偃师镜面柿’ D. kaki ‘Yanshi-Jingmianshi’ | 农家品种Local cultivar | 偃师Yanshi | | 41 | ‘偃师牛心’ D. kaki ‘Yanshi-Niuxin’ | 农家品种Local cultivar | 偃师Yanshi | | 42 | ‘盖柿’ D. kaki ‘Gaishi’ | 农家品种Local cultivar | 伊川Yichuan | | 43 | ‘火晶柿’ D. kaki ‘Huojingshi’ | 主栽品种Major cultivar | 伊川Yichuan | | 44 | ‘胎里红’ D. kaki ‘Tailihong’ | 农家品种Local cultivar | 伊川Yichuan | | 45 | ‘林州1号’ D. kaki ‘Linzhou 1’ | 农家品种Local cultivar | 安阳Anyang | | 46 | ‘林州2号’ D. kaki ‘Linzhou 2’ | 农家品种Local cultivar | 安阳Anyang | | 47 | ‘博爱八月黄’ D. kaki ‘Boai-Bayuehuang’ | 主栽品种Major cultivar | 博爱Bo’ai | | 48 | ‘灰子柿-1’ D. kaki ‘Huizishi-1’ | 主栽品种Major cultivar | 郏县Jiaxian | | 49 | ‘盘柿’ D. kaki ‘Panshi’ | 农家品种Local cultivar | 郏县Jiaxian | | 50 | ‘莲花柿’ D. kaki ‘Lianhuashi’ | 农家品种Local cultivar | 郏县Jiaxian | | 51 | ‘面黄蛋’ D. kaki ‘Mianhuangdan’ | 农家品种Local cultivar | 郏县Jiaxian | | 52 | ‘水丈红-1’ D. kaki ‘Shuizhanghong-1’ | 主栽品种Major cultivar | 郏县Jiaxian | | 53 | ‘水丈红-2’ D. kaki ‘Shuizhanghong-2’ | 主栽品种Major cultivar | 郏县Jiaxian | | 54 | ‘小面黄蛋’ D. kaki ‘Xiaomianhuangdan’ | 农家品种Local cultivar | 郏县Jiaxian | | 55 | ‘大白梨柿’ D. kaki ‘Dabailishi’ | 农家品种Local cultivar | 鲁山县Lushan | | 56 | ‘胡栾头-2’ D. kaki ‘Huluantou-2’ | 农家品种Local cultivar | 鲁山县Lushan | | 57 | ‘皮匠楼-2’ D. kaki ‘Pijianglou-2’ | 农家品种Local cultivar | 鲁山县Lushan | | 58 | ‘七月早-3’ D. kaki ‘Qiyuezao-3’ | 主栽品种Major cultivar | 鲁山县Lushan | | 59 | ‘树叉红-2’ D. kaki ‘Shuchahong-2’ | 农家品种Local cultivar | 鲁山县Lushan | | 60 | ‘四瓣面柿’ D. kaki ‘Sibanmianshi’ | 农家品种Local cultivar | 鲁山县Lushan | | 61 | ‘血柿’ D. kaki ‘Xueshi’ | 主栽品种Major cultivar | 鲁山县Lushan | | 62 | ‘雁过红-3’ D. kaki ‘Yanguohong-3’ | 主栽品种Major cultivar | 鲁山县Lushan | | 63 | ‘鬼脸青’ D. kaki ‘Guilianqing’ | 农家品种Local cultivar | 平顶山Pingdingshan | | 64 | ‘胡栾头-1’ D. kaki ‘Huluantou-1’ | 农家品种Local cultivar | 平顶山Pingdingshan | | 65 | ‘落花甜’ D. kaki ‘Luohuatian’ | 农家品种Local cultivar | 平顶山Pingdingshan | | 66 | ‘牛心柿’ D. kaki ‘Niuxinshi’ | 主栽品种Major cultivar | 平顶山Pingdingshan | | 67 | ‘皮匠篓-1’ D. kaki ‘Pijianglou-1’ | 农家品种Local cultivar | 平顶山Pingdingshan | | 68 | ‘七月早-2’ D. kaki ‘Qiyuezao-2’ | 主栽品种Major cultivar | 平顶山Pingdingshan | | 69 | ‘线穗柿’ D. kaki ‘Xiansuishi’ | 农家品种Local cultivar | 平顶山Pingdingshan | | 70 | ‘雁过红-2’ D. kaki ‘Yanguohong-2’ | 主栽品种Major cultivar | 平顶山Pingdingshan | | 71 | ‘十月红’ D. kaki ‘Shiyuehong’ | 主栽品种Major cultivar | 平顶山Pingdingshan | | 72 | ‘灰子柿-2’ D. kaki ‘Huizishi-2’ | 主栽品种Major cultivar | 叶县Yexian | | 73 | ‘水柿’ D. kaki ‘Shuishi’ | 农家品种Local cultivar | 叶县Yexian | | 74 | 野生柿01 D. kaki wild plant 01 | 野生资源Wild resource | 新安Xin’an | | 75 | 野生柿02 D. kaki wild plant 02 | 野生资源Wild resource | 新安Xin’an | | 76 | 野生柿03 D. kaki wild plant 03 | 野生资源Wild resource | 新安Xin’an | | 77 | 野生柿04 D. kaki wild plant 04 | 野生资源Wild resource | 新安Xin’an | | 78 | 野生柿05 D. kaki wild plant 05 | 野生资源Wild resource | 新安Xin’an | | 79 | 野生柿06 D. kaki wild plant 06 | 野生资源Wild resource | 新安Xin’an | | 80 | 野生柿07 D. kaki wild plant 07 | 野生资源Wild resource | 新安Xin’an | | 81 | 野生柿08 D. kaki wild plant 08 | 野生资源Wild resource | 新安Xin’an | | 82 | 野生柿09 D. kaki wild plant 09 | 野生资源Wild resource | 新安Xin’an | | 83 | 野生柿10 D. kaki wild plant 10 | 野生资源Wild resource | 新安Xin’an | | 84 | 野生柿11 D. kaki wild plant 11 | 野生资源Wild resource | 新安Xin’an | | 85 | 野生柿12 D. kaki wild plant 12 | 野生资源Wild resource | 新安Xin’an | | 86 | 野生柿13 D. kaki wild plant 13 | 野生资源Wild resource | 新安Xin’an | | 87 | 野生柿14 D. kaki wild plant 14 | 野生资源Wild resource | 新安Xin’an | | 88 | 野生柿15 D. kaki wild plant 15 | 野生资源Wild resource | 新安Xin’an | | 89 | 野生柿16 D. kaki wild plant 16 | 野生资源Wild resource | 新安Xin’an | | 90 | 野生柿17 D. kaki wild plant 17 | 野生资源Wild resource | 新安Xin’an | | 91 | 野生柿18 D. kaki wild plant 18 | 野生资源Wild resource | 新安Xin’an | | 92 | 野生柿19 D. kaki wild plant 19 | 野生资源Wild resource | 新安Xin’an | | 93 | 野生柿20 D. kaki wild plant 20 | 野生资源Wild resource | 新安Xin’an | | 94 | 野柿D. kaki var. sylvestris | 柿变种Variant of D. kaki | 浙江丽水Lishui, Zhejiang | | 95 | 金枣柿D. spp. | — | 浙江丽水Lishui, Zhejiang | | 96 | 君迁子1 D. lotus 1 | 近缘种Related species | 洛阳Luoyang | | 97 | 君迁子 2 D. lotus 2 | 近缘种Related species | 鲁山县Lushan | | 98 | 君迁子3 D. lotus 3 | 近缘种Related species | 洛阳Luoyang | | 99 | 浙江柿D. glaucifolia | 近缘种Related species | 浙江宜丰Yifeng, Zhejiang | | 100 | 油柿 D. oleifera | 近缘种Related species | 浙江丽水Lishui, Zhejiang | | 101 | 美洲柿1 D. virginiana 1 | 近缘种Related species | 美国U.S.A. | | 102 | 美洲柿2 D. virginiana 2 | 近缘种Related species | 美国U.S.A. |
|
1.2 DNA提取
采用改良CTAB法(梁玉琴等,2012)从叶片中提取柿全基因组DNA,1.0%琼脂糖凝胶电泳检测DNA质量,紫外分光光度计检测DNA浓度,合格样品置于-20 ℃保存备用。
1.3 PCR扩增及产物检测
从现已发表的110对柿属植物SSR引物中(Soriano et al.,2006;Guo et al.,2006; 2008;Luo et al.,2013;阮小凤等,2008;吴硕等,2012)筛选出17对多态性较高、重复性较好的引物用于最终试验测定(表 2)。PCR反应体系如下:总体积20 μL,DNA模板30 ng,20 mmol·L-1 Tris-HCl(pH8.3),1.5 mmol·L-1 MgCl2,50 mmol·L-1 KCl,0.25 mmol·L-1 dNTP,正反向引物各0.8 μmol·L-1,1U Taq DNA聚合酶。PCR循环体系如下:94 ℃预变性2 min;94 ℃变性45 s,按照各引物退火温度退火50 s,72 ℃延伸1 min,30个循环;72 ℃总延伸4 min。ABI Prism 3130 遗传分析仪检测PCR产物,GeneMapper 4.0软件分析扩增片段长度(即条带长度)。
表 2 试验所用SSR引物信息
Tab.2 Information of SSR primers used in the experiment

表 2 试验所用SSR引物信息
Tab.2 Information of SSR primers used in the experiment
| 位点Loci GenBank编号GenBank accession No. | 重复基元Repeat motif | 引物序列Primer sequence(5′-3′) | 退火温度Tm/℃ | 条带长度Band length/bp |
| 1430 | (GAG)5 | F: TCA GTA AAG CTG CGG GCA TC | 56 | 190~250 | | DC588341 | | R: ACG GTT CTC CTG ATC CTC ACG | | | | 1554 | (CAT)6 | F: CAC CGC ATC CTC TTC GAC ATC C | 56 | 190~223 | | DC586537 | | R: ACG CAT CCG TCA AAT CAC AAC A | | | | 4379 | (GAG)9 | F: TGA CTC TGC TCC ACA GGC ACT TC | 56 | 208~235 | | DC585084 | | R: CTC GTC TGG CAA TTC TGC TTC G | | | | 5553 | (GTAGTG)3 | F: CCA GTT GAT GGC AAT GGG AGG C | 56 | 226~254 | | DC585710 | | R: GGT GCG ATG TTG GAG GGA AGA G | | | | 6615 | (CTT)7 | F: ACA CTC CAC TCT ACC CAA ATA CC | 55 | 244~268 | | DC585737 | | R: GAC ATC ATA AGT CAA AGC ACG AA | | | | 6665 | (TA)9 | F: TGA CCA ACC CCA AAG TGT GGG AG | 60 | 171~209 | | DC592790 | | R: AGG TCC CTC TGG TGA GCA CAT GC | | | | 8125 | (GGC)4 | F: TTA TCC CAT CAA AGC AAC CCA C | 55 | 189~227 | | DC592401 | | R: CTG CCA ACT TCT TCT CCA TCT CC | | | | 8917 | (AT)10 | F: ACA CGT TCA GTA CCA GGA GGG A | 55 | 166~197 | | DC591591 | | R: AGT ACC ACA AAC CAC CAG TGG | | | | 9004 | (GCAGGA)3 | F: GCC ACA AAC TTC ACA GAG GAC C | 55 | 251~272 | | DC591297 | | R: AGG CGA GTG CGA GTA AGA CGA A | | | | DKs76 | (AGG)7 | F: TCG GCT TCA CCT ATG TTG | 52 | 111~138 | | DC585435 | | R: CGA TTC CTT GGA CCT TTG | | | | DKs91 | (AG)7 | F: CGG AAG AGG GAG AAA TCG | 55 | 191~207 | | DC592713 | | R: GAA TCG GGA AAG CAA GTT | | | | mDp17 | (GA)21 | F: CCA AAT CAT TCG AAG CCA AT | 52 | 128~168 | | EF567410 | | R: CCT TCA CCG ATG TCC TTT GT | | | | ssrDK11 | (GA)16 | F: ATG TTT CAG GGG TTC CAT TG | 53 | 155~191 | | DQ097479 | | R: TCA CTC GTC TTT GCC TTT CC | | | | ssrDK14 | (AG)16 | F: GTG AAG GAA CCC CAT AGA A | 52 | 158~192 | | DQ097482 | | R: CCA TCA TCA GGT AGG AGA GA | | | | ssrDK16 | (GA)12 | F: ACT ACA ACG GCG GTG AGA AC | 55 | 136~172 | | DQ097484 | | R: GTC CTT CAC TTC CCG CAT T | | | | ssrDK29 | (CCTTT)8 | F: ATC ATG AGA TCA GAG CCG TC | 53 | 112~152 | | DQ097497 | | R: CAC GTT AAC GTT ACG GAA CA | | | | ssrDK31 | (CT)15 | F: AGT TCT TGC GAT GGG ATT TG | 60 | 191~207 | | DQ097499 | | R: GAT GAG ATG GGC TGA TTG CT | | |
|
1.4 数据分析
所用近缘种中的样品多为2倍体,而很多柿种质属于6倍体,并且其多倍体来源不清楚,由于所用材料倍性不一致,无法按照传统的SSR分析方法进行数据分析,因此根据PCR产物扩增情况,统计每一扩增片段的有无,0代表无,1代表有,构建0/1数据矩阵,按照显性标记(Naval et al.,2010)方法进行数据处理。Excel软件计算每对引物扩增的条带总数(Nt)、多态性条带数(Np);根据样品中谱带类型,统计带型总数(N1);特异带型数(N2),即带型数目仅为1的所有样品总数;特异带型比率(P1)和种质鉴别率(P2),二者计算公式分别为P1=N2/N1,P2=N2/N,式中N为样品总数;并由带型频率代替等位基因频率计算多态性信息含量(PIC)和Shannon信息指数(I)(Nei,1987),计算公式分别为${\rm{PI}}{{\rm{C}}_i} = 1 - \sum\limits_{j = 1}^n {P_{ij}^2} ,{I_i} = - \sum\limits_{j = 1}^n {{P_{ij}}\ln {P_{ij}}} $式中Pij为第i个位点第j个带型的频率,n为第i个位点的带型数;根据带型状况计算每一位点的观察杂合度(Ho)。利用NTsys 2.10软件计算各样品彼此之间的Dice相似系数,并根据相似系数,利用SAHN程序,采用非加权组平均法(UPGMA)进行聚类分析;对相关系数矩阵中心化后进行主坐标分析,通过聚类分析及主坐标分析,判断资源间的亲缘关系,进行种质资源鉴定。
2 结果与分析2.1 遗传多样性分析
从毛细管电泳检测结果(图 1)可以看出,各条带分辨率高,结果准确可靠。表 3显示了不同引物的扩增片段在所有资源中的多态性,可以看出河南省柿种质资源具有丰富的遗传多样性:17对引物共得到159个不同的DNA片段(即条带),平均每对引物9.35个,这些条带均具有多态性;扩增条带数最多的引物有2对,分别来自于位点ssrDK11/DQ097479和ssrDK14/DQ097482,其条带数为14个,最少的来自于位点8125/DC592401,条带数为5个。17对引物共得到508个谱带类型(即带型),每对引物得到的带型数范围为8~53个,平均29.88个,最多的引物来自位点ssrDK11/DQ097479,最小的来自5553/DC585710;特异带型总数为267个,范围为2~37个,平均每对引物5.71个,最多的还是来自位点ssrDK11/DQ097479,最小的同样来自位点5553/DC585710。从特异带型比率(P1)来看,最高的引物来自位点6665/DC592790(73.68%),最小的仍为5553/DC585710(25.00%);而鉴定率(P2)高低与特异带型数(N2)相一致,最高的是ssrDK11/DQ097479(36.27%),最小的是5553/DC585710(1.96%)。多态性信息含量(PIC)除6665/DC592790外,其余均大于0.5,PIC范围是0.466 7~0.964 7,平均0.839 7;Shannon信息指数(I)平均为2.658 6,最高的是mDp17/EF567410(3.596 7),最小的是DKs91/DC592713(1.112 1)。平均观察杂合度(Ho)为0.777 4,范围是0.147 1(6665/DC592790)至0.960 8(4379/DC585084,8125/DC592401)。
表 3 基于17对SSR引物所扩增的产物在102份柿属植物种质中的遗传多态性①
Tab.3 Genetic diversity estimated based on the amplified products by 17 SSR primers among 102 germplasms of Diospyros

表 3 基于17对SSR引物所扩增的产物在102份柿属植物种质中的遗传多态性①
Tab.3 Genetic diversity estimated based on the amplified products by 17 SSR primers among 102 germplasms of Diospyros
| 位点LociGenBank编号GenBank accession No. | Nt | Np | N1 | N2 | P1 | P2 | h | I | Ho |
| 1430/ DC588341 | 7 | 7 | 26 | 8 | 30.77% | 7.84% | 0.934 5 | 2.940 8 | 0.862 7 | | 1554/ DC586537 | 10 | 10 | 38 | 19 | 50.00% | 18.63% | 0.956 4 | 3.345 8 | 0.921 6 | | 4379/ DC585084 | 9 | 9 | 38 | 22 | 57.89% | 21.57% | 0.940 4 | 3.197 2 | 0.960 8 | | 5553/ DC585710 | 6 | 6 | 8 | 2 | 25.00% | 1.96% | 0.580 6 | 1.193 0 | 0.872 5 | | 6615/ DC585737 | 7 | 7 | 33 | 14 | 42.42% | 13.73% | 0.949 3 | 3.194 0 | 0.852 9 | | 6665/ DC592790 | 10 | 10 | 19 | 14 | 73.68% | 13.73% | 0.466 7 | 1.318 8 | 0.147 1 | | 8125/ DC592401 | 5 | 5 | 15 | 3 | 20.00% | 2.94% | 0.841 8 | 2.158 5 | 0.960 8 | | 8917/ DC591591 | 9 | 9 | 20 | 11 | 55.00% | 10.78% | 0.792 8 | 2.125 4 | 0.725 5 | | 9004/ DC591297 | 9 | 9 | 20 | 12 | 60.00% | 11.76% | 0.750 3 | 1.993 2 | 0.872 5 | | DKs76/ DC585435 | 10 | 10 | 39 | 17 | 43.59% | 16.67% | 0.954 1 | 3.358 4 | 0.882 4 | | DKs91/ DC592713 | 7 | 7 | 10 | 4 | 40.00% | 3.92% | 0.510 8 | 1.112 1 | 0.313 7 | | mDp17/ EF567410 | 13 | 13 | 50 | 30 | 60.00% | 29.41% | 0.964 7 | 3.596 7 | 0.892 2 | | ssrDK11/ DQ097479 | 14 | 14 | 53 | 37 | 69.81% | 36.27% | 0.955 2 | 3.578 9 | 0.715 7 | | ssrDK14/ DQ097482 | 14 | 14 | 46 | 24 | 52.17% | 23.53% | 0.962 5 | 3.550 9 | 0.931 4 | | ssrDK16/ DQ097484 | 11 | 11 | 31 | 15 | 48.39% | 14.71% | 0.902 7 | 2.857 1 | 0.794 1 | | ssrDK29/ DQ097497 | 9 | 9 | 27 | 15 | 55.56% | 14.71% | 0.915 2 | 2.781 4 | 0.882 4 | | ssrDK31/ DQ097499 | 9 | 9 | 35 | 20 | 57.14% | 19.61% | 0.897 7 | 2.893 7 | 0.627 5 | | 平均Mean | 9.35 | 9.35 | 29.88 | 15.71 | | 15.40% | 0.839 7 | 2.658 6 | 0.777 4 | | 合计Total | 159 | 159 | 508 | 267 | | | | | |
① Nt:条带总数;Np:多态性条带数;N1:带型个数;N2:特异带型数;P1:特异带型比率;P2:种质鉴别率;PIC:多态性信息含量;I:Shannon信息指数;Ho:观察杂合度。
Nt:Number of total bands; Np:Number of polymorphic bands; N1:Number of band patterns; N2:Number of unique band patterns; P1: Rate of unique band patterns; P2: Rate of identified germplasms; PIC: Polymorphism information content; I: Shannon’s information index; Ho: Observed heterozygosity. |
|
2.2 主坐标分析
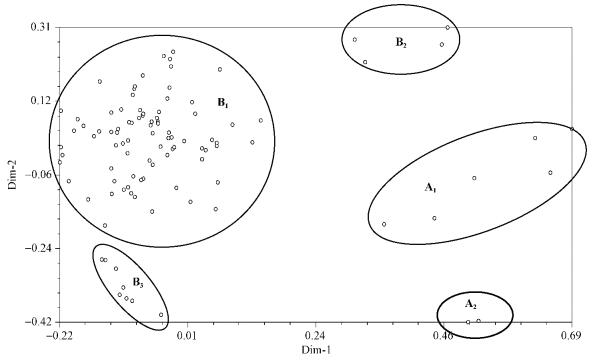
根据主坐标分析结果(图 2),所有资源可分为2大类群。A类群为柿近缘野生种,又明显分为2个亚类,其中A1包括君迁子、浙江柿、金枣柿和油柿共6份资源,A2包括美洲柿2份种质,可以看出美洲柿明显区别于其他种。B类群中的样品均为柿种下资源,又可分为3个亚类,其中大部分柿种质遗传特性较一致,构成B1亚类,包括各地主栽品种、地方品种以及全部野生资源,并且柿变种野柿也在此类群中;B2亚类包括‘大火罐’、‘小火罐’、‘冬青柿’和‘火晶柿’4份资源;B3亚类则包括‘遮叶’、‘偃师出头’、‘栾川出头’、‘新安牛心’、‘偃师牛心’、‘鲁山牛心’、‘大白梨柿’和‘鸡心柿’,共计8份资源。B2亚类虽然也都是柿种下品种,相对于B1和B3亚类里面的种质,它们与柿近缘种君迁子、浙江柿等A1亚类中的资源更为相近,并且4个品种均为河南当地古老农家品种,栽培历史悠久,可能与柿起源进化有关。结合形态特征,B3亚类中的柿品种可能是‘牛心柿’的不同类型,其品种因分布于不同地区,存在同名异物或同物异名现象。
2.3 种质资源亲缘关系及种质鉴定
从所有材料聚类图(图 3)可以看出各近缘种与柿具有明显的遗传差异,在相似系数0.481 6处,各物种彼此之间可完全区分开,所有资源可分为2组(a和b)。a组内均为柿近缘种,包括君迁子、浙江柿、金枣柿、油柿和美洲柿共计8份资源;这些近缘种中2份美洲柿亲缘关系最近,其相似系数为0.861 1;3份君迁子亲缘关系也较近,相似系数均大于0.6,其中来自洛阳的2份君迁子先聚类,再与来自平顶山的君迁子聚为一类。b组均为柿种下资源,其中b1小组里除了‘小镜面糊卵’、‘门定’和‘小柿’3份资源外,其他11份资源均为来自洛阳地区的实生野生柿,这些资源与柿变种野柿遗传差异较大,亲缘关系较远,其他几份野生柿也分别与不同的柿品种首先聚类,说明这些野生柿可能是当地柿品种的偶发实生资源。进一步分析,发现这些资源集中分布于洛阳新安县石井乡地区,相隔距离较近,树龄较小,聚类结果与实际分布状况基本相一致。b2小组包括‘大火罐’、‘冬青’、‘小火罐’、‘火晶’、‘小面糊’和‘落花甜’共计6份资源,此组柿资源单独聚类,与其余大部分柿资源有较远的亲缘关系,这与主坐标分析结果相类似。
根据亲缘关系,可鉴别全部102份种质,说明本文所用方法可有效应用于柿属种质资源鉴定。根据亲缘关系,结合形态特征,可初步判定同物异名及同名异物品种,如‘林州1号’和‘林州2号’相似系数为0.980 8,应为同一品种;‘栾川牛心柿’与‘线穂柿’相似系数为0.958 3,应为同物异名品种;b3小组中的4份样品彼此间相似系数均大于0.8,应该是‘七月早’的不同类型,其中‘雁过红-2’为同物异名品种;b4小组中的‘遮叶’与‘偃师出头’相似系数高达0.989 7,且与‘栾川出头’非常相似,三者首先聚为一类,而‘新安牛心’、‘大白梨柿’、‘鸡心柿’、‘偃师牛心’和‘牛心柿’这6份资源相互之间相似系数均大于0.9,这几份种质应为‘牛心柿’的不同类型,这与上述主坐标分析结果也相一致;b5小组中的‘血柿’与‘十月红’相似系数为0.968 4,且与‘灰子柿-1’、‘灰子柿-2’以及‘水丈红-2’亲缘关系较近,这些品种形态特征相似且均为晚熟品种。
3 结论与讨论
应用SSR标记进行植物遗传多样性研究时,通常是进行聚丙烯酰胺凝胶电泳,通过银染或者荧光染料来检测扩增产物大小(Hu et al.,2012),此方法不仅操作繁琐耗时,毒性大,而且通量低,大规模样品检测时,数据整合困难,人为主观因素在条带判读时也会造成很大误差,影响结果的准确性。柿是六倍体树种,相对二倍体或者单倍体,在检测PCR产物时,会得到更为复杂的带型,若采用聚丙烯酰胺凝胶电泳进行检测,将对实验数据分析造成更大困难,人为误差更大,严重降低结果的准确度。针对上述问题本文采用毛细管电泳法检测PCR产物,遗传分析仪通过峰值判断条带长度,不仅操作简单、快速、无毒害,而且此方法通量高,适合大批量样品的检测。另外,荧光检测法分辨率高,所得结果更准确。在数据分析时虽然因为柿多倍体来源不清,无法推断完整基因型,但是通过参照显性标记0/1记录方法,可判断扩增产物的谱带类型,以此判断多倍体柿的遗传多样性。研究结果显示,通过此方法17对SSR引物可鉴别所有供试材料,说明此方法的有效性。所用位点中,ssrDK11/DQ097479、ssrDK14/DQ097482和mDp17/EF567410扩增得到的DNA片段多态性最高,可能会在柿属植物种质资源深入鉴定及指纹图谱构建等工作中发挥更大作用。
河南省地处我国中部地区,属于温带季风气候,周边群山环绕,西部为秦岭东脉伏牛山区,北部少数地区处于太行山区,南部信阳等地为大别山区,气候地理条件非常适合柿生长。该省柿资源研究较少,仅有学者对河南南部平顶山地区的柿品种进行了简单调查(韩德波等,2010)。本课题组首次对全省范围内的柿种质资源进行了全面调查与收集,并对收集到的资源进行遗传多样性分析,结果显示:102份资源中共得到159条具多态性的条带,508个带型,267个特异带型,多态性信息含量平均为0.839 7,Shannon信息指数平均为2.658 6,观察杂合度平均为0.777 4,充分说明河南省柿种质资源具有非常丰富的遗传多样性。研究结果不仅为该地区柿杂交育种等工作奠定了基础,也为我国涩柿资源提供了更多分子生物学信息。
据调查,河南省柿种质资源虽然丰富多样,但这些资源绝大部分栽植于田间地头、房前屋后等四旁地,管理非常粗放。在资源命名方面尤其杂乱,无统一标准,当地百姓多根据柿果实特征如果色、果形、成熟期、果实口感等,给不同的种质起些土名,造成严重的同物异名或同名异物现象,加上各地长期相互引种过程中,常有品种名称混淆或记错等情况,导致资源同物异名或同名异物问题更加严重,对该省柿资源深入研究工作造成了很大阻碍。本文通过DNA标记技术,可将供试样品全部区分开,并根据亲缘关系,结合形态特征,判断出了‘七月早’、‘牛心柿’等部分同物异名或同名异物品种,为该地区柿资源有效保存与利用提供了科学依据。另外,众所周知,野生资源在植物遗传育种中占据重要地位,关于柿野生资源的研究极少,本课题组在资源调查过程中,着重加强了野生柿资源的收集与保存,文中亦对河南省发现的20份野生柿资源进行了遗传鉴定及亲缘关系研究,不仅是对柿遗传信息的重要补充,而且对柿杂交育种等工作具有重要意义。
柿起源于中国,具有2 000多年的栽培历史,众多学者采用不同的分析方法,对柿与柿属其他植物的亲缘关系进行了研究:Choi等(2003)通过对柿属植物10个种进行荧光原位杂交研究,认为二倍体君迁子可能参与了六倍体柿的形成,并发现来源于不同地理区域的柿属植物具有不同数目的rDNA拷贝数,根据杂交结果认为柿可能为同源异源多倍体;Yonemori等(2008)利用柿属15个种的ITS区域和matK基因序列进行了系统发育研究,认为与君迁子相比,油柿与柿的亲缘关系更近,此结果与Choi等(2003)的研究略有差异;Hu等(2008)利用叶绿体DNA PCR-RFLP技术对柿属植物进行了系统发育研究,结果显示,与柿亲缘关系最近的是君迁子和浙江柿,其次为油柿,关系较远的是金枣柿和美洲柿。另外,金枣柿一直作为柿种下的一个品种,但近几年的研究证实其为二倍体,并且形态特征与柿有明显差异,学者们利用不同的分子标记对二者亲缘关系进行了研究,均证实金枣柿与柿亲缘关系较远,应为柿属植物新种(郭大龙,2006;Du et al.,2009)。本文根据前人研究结果,选取了部分柿近缘种作为对照,证实几个近缘种与柿具有明显的遗传差异,特别是金枣柿和美洲柿,与柿遗传差异较大,并发现君迁子与浙江柿具有更近的亲缘关系。研究结果不仅是对前人研究的佐证,也为今后利用DNA标记深入分析柿起源进化奠定了基础。
参考文献(References)
| [1] |
丁向阳, 凌晓明, 王欣, 等. 2001. 河南柿品种资源与生产现状. 河南林业科技, 21(3): 6-8.
(Ding X Y, Ling X M, Wang X, et al. 2001. The variety resource of persimmon of Henan province and product situations. Journal of Henan Forestry Science and Technology, 21(3): 6-8[in chinese]).( 1) 1)
|
| [2] |
杜晓云. 2008. 系列逆转座子分子标记的建立及其在柿属植物中的应用研究. 武汉: 华中农业大学博士学位论文.
(Du X Y. 2008. Development of retrotransposon-based molecular markers and their utilization in Diospyros Linn. (Ebenaceae). Wuhan: PhD thesis of Huazhong Agricultural University[in chinese]).( 1) 1)
|
| [3] |
郭大龙. 2006. 几种分子标记技术的建立及其在部分柿属植物亲缘关系研究中的应用. 武汉: 华中农业大学博士学位论文.
(Guo D L. 2006. Establishment of several molecular markers and analysis of genetic relationships in Diospyros Linn. Wuhan: PhD thesis of Huazhong Agricultural University[in chinese]).( 2) 2)
|
| [4] |
韩德波,丁向阳, 杜道丽. 2010. 河南省中部地区柿品种资源调查.河南林业科技, 30(4): 24-26.
(Han D B, Ding X Y, Du D L. 2010. Resource survey of persimmon cultivars in midland of Henan province. Journal of Henan Forestry Science and Technology,30(4): 24-26[in chinese])..( 2) 2)
|
| [5] |
何方,胡芳名. 2004.经济林栽培学. 2版. 北京: 中国农业出版社, 383.
(He F, Hu F M. 2004.Non-timber forestry cultivation. 2nd ed. Beijing: China Agricultural Press, 383.[in chinese])( 1) 1)
|
| [6] |
黄平,崔鹏娇,郑勇奇,等. 2012. 基于SSR标记月季品种鉴定及遗传关系分析. 林业科学,48(10): 55-62.
(Huang P, Cui P J, Zheng Y Q,et al. 2012. SSR-based molecular identification and analysis of genetic relationship among rose varieties. Scientia Silvae Sincae, 48(10): 55-62[in chinese]).( 1) 1)
|
| [7] |
李高潮,杨勇,王仁梓. 2006.中国原产柿品种资源.中国种业, (4): 52-53.
(Li G C, Yang Y, Wang R Z. 2006. Cultivars originating in China. China Seed Industry, (4): 52-53[in chinese]).( 1) 1)
|
| [8] |
李树钢. 1987.中国植物志: 第60卷,第1册.北京: 科学出版社, 84.
(Li S G.1987. Flora of China: vol.60, no.1. Beijing: Science Press, 84.[in chinese])( 1) 1)
|
| [9] |
梁玉琴,李芳东,傅建敏,等. 2012. 柿属植物基因组DNA提取方法比价.中南林业科技大学学报, 32(4): 170-173.
(Liang Y Q, Li F D, Fu J M,et al. 2012. Comparison of two methods to extract DNA from trees of Diospyros L. Journal of Central South University of Forestry & Technology, 32(4): 170-173[in chinese]).( 1) 1)
|
| [10] |
阮小凤,Gabi Krczal,杨勇. 2008. 磁珠富集法分离柿微卫星标记.西北农林科技大学学报, 36(5): 97-102.
(Ruan X F, Gabi K, Yang Y. 2008. Isolation of micosatellite in Diospyros kaki by magnetic beads. Journal of Northwest A & F University: Natural Science Edition, 36(5): 97-102[in chinese]).( 1) 1)
|
| [11] |
吴硕,傅建敏,乌云塔娜,等. 2012.柿属EST-SSR引物设计及遗传多样性研究.中南林业科技大学学报, 32(3): 152-157.
(Wu S, Fu J M, Wuyun T N,et al. 2012. Study on EST-SSR primer design and genetic diversity of Diospyros L. Journal of Central South University of Forestry & Technology, 32(3): 152-157[in chinese]).( 1) 1)
|
| [12] |
张青林. 2006. 完全甜柿及部分雄性种质间的亲缘关系研究. 武汉: 华中农业大学博士学位论文.
(Zhang Q L. 2006.Genetic relationships between pollination constant non-astringent persimmons and some staminate germplasm native to China based on RAPD and ISSR analysis. Wuhan: PhD thesis of Huazhong Agricultural University[in chinese]).( 1) 1)
|
| [13] |
周炎花,乔小燕,马春雷,等.2011.广西茶树地方品种遗传多样性和遗传结构的EST-SSR分析.林业科学, 47(3): 59-67.
(Zhou Y H, Qiao X Y, Ma C L,et al. 2011. Genetic diversity and structure of tea landraces from Guangxi based on EST-SSR analysis. Scientia Silvae Sincae, 47(3): 59-67[in chinese]).( 1) 1)
|
| [14] |
宗学普.2002.柿树栽培技术.修订版.北京: 金盾出版社,33.
(Zong X P. 2002.Cultivation techniques of persimmon. Revised ed. Beijing: Shield Press,33.[in chinese])( 1) 1)
|
| [15] |
左大勋,柳鎏,王希蕖.1984.我国柿属植物的地理分布及利用.中国果树,(3): 27-34.
(Zuo D X, Liu L, Wang X Q. 1984.The distribution and utilization of Diospyros in China. China Fruits, (3): 27-34[in chinese]).( 1) 1)
|
| [16] |
Choi Y A, Tao R, Yonemori K, et al. 2003. Simultaneous visualization of 5S and 45S rDNAs in persimmon (Diospyros kaki) and several wild relatives (Diospyros spp.[in chinese]) by fluorescent in situ hybridization (FISH) and MultiColor FISH (MCFISH). J Amer Soc Hort Sci,128: 736-740.( 2) 2)
|
| [17] |
Du X Y, Zhang Q L, Luo Z R. 2009. Comparison of four molecular markers for genetic analysis in Diospyros L. (Ebenaceae). Plant Syst Evol, 281(1-4): 171-181.( 1) 1)
|
| [18] |
Guo D L, Luo Z R. 2006. Development of SSR primers using ISSR-PCR in Diospyros kaki Thunb. Molecular Ecology Notes, 6(3): 886-887.( 1) 1)
|
| [19] |
Guo D L, Luo Z R.2008. Microsatellite isolation and characterization in Japanese persimmon (Diospyros kaki Thunb.[in chinese]).Bioche Genet, 46(5/6): 323-328.( 1) 1)
|
| [20] |
Hu D C, Zhang Q L, Luo Z R. 2008. Phylogenetic analysis in some Diospyros spp. (Ebenaceae) and Japanese persimmon using chloroplast DNA PCR-RFLP markers. Scientia Horticulturae, 117(1): 32-38.( 1) 1)
|
| [21] |
Hu J H, Pan L, Liu H G, et al. 2012. Comparative analysis of genetic diversity in sacred lotus (Nelumbo nucifera Gaertn.[in chinese]) using AFLP and SSR markers. Mol Biol Rep, 39(4): 3637-3647.( 1) 1)
|
| [22] |
Luo C, Zhang F, Zhang Q L, et al. 2013.Characterization and comparison of EST-SSR and TRAP markers for genetic analysis of the Japanese persimmon Diospyros kaki. Genetics and Molecular Research, Doi: http://dx.doi.org/10.4238/2013.January.9.3.( 1) 1)
|
| [23] |
Naval M, Zuriaga E, Pecchioli S, et al. 2010. Analysis of genetic diversity among persimmon cultivars using microsatellite markers. Tree Genet Genom, 6(5): 677-687.( 2) 2)
|
| [24] |
Nei M. 1987. Molecular evolutionary genetics. New York: Columbia University Press, 187-192.( 1) 1)
|
| [25] |
Soriano J M, Peochioli S, Romero C, et al. 2006. Development of microsatellite markers in polyploid persimmon (Diospyros kaki) from an enriched genomic library. Molecular Ecology Notes, 6(2): 368-370.( 1) 1)
|
| [26] |
Yonemori K, Honsho C, Kanzaki S, et al. 2008.Sequence analyses of the ITS regions and the matK gene for determining phylogenetic relationships of Diospyros kaki (persimmon) with other wild Diospyros (Ebenaceae) species. Tree Genetics & Genomes, 4(2): 149-158.( 1) 1)
|
2
本文献在全文中的定位:
...
柿资源研究较少,仅有学者对河南南部平顶山地区的柿品种进行了简单调查(
韩德波等,2010)。本课题组首次对全省范围内的柿种质资源进行了全面调查与收集,并对收
...
1
本文献在全文中的定位:
...
资源数量繁多,存在丰富的遗传变异,中国现有品种1 000多个,居世界首位(
李高潮等,2006)。虽然已经有学者对柿种质资源进行了遗传多样性研究,但是其试验材料主
...
1
本文献在全文中的定位:
...
采用改良CTAB法(
梁玉琴等,2012)从叶片中提取柿全基因组DNA,1.0%琼脂糖凝胶电泳检测DNA质量,紫外分光光
...
2
本文献在全文中的定位:
...
多学者采用不同的分析方法,对柿与柿属其他植物的亲缘关系进行了研究:
Choi等(2003)通过对柿属植物10个种进行荧光原位杂交研究,认为二倍体君迁子可能参与
...
1
本文献在全文中的定位:
...
常是进行聚丙烯酰胺凝胶电泳,通过银染或者荧光染料来检测扩增产物大小(
Hu et al.,2012),此方法不仅操作繁琐耗时,毒性大,而且通量低,大规模样品检测时
...
2
本文献在全文中的定位:
...
(等同于基因组DNA片段的PCR扩增技术),可有效进行多倍体柿遗传多样性分析(
Naval et al.,2010)。本文在河南省各地柿种质资源调查收集的基础上,利用已发表的众多SSR引
...
...
每一扩增片段的有无,0代表无,1代表有,构建0/1数据矩阵,按照显性标记(
Naval et al.,2010)方法进行数据处理。Excel软件计算每对引物扩增的条带总数(
Nt)
...
1
本文献在全文中的定位:
...
型频率代替等位基因频率计算多态性信息含量(PIC)和Shannon信息指数(
I)(
Nei,1987),计算公式
...
1
本文献在全文中的定位:
...
物具有不同数目的rDNA拷贝数,根据杂交结果认为柿可能为同源异源多倍体;
Yonemori等(2008)利用柿属15个种的ITS区域和
matK基因序列进行了系统发育研究,认为与君
...


 1)
1)
 1)
1)
 2)
2)
 2)
2)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 2)
2)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 2)
2)
 1)
1)
 1)
1)
 1)
1)
 2015, Vol. 51
2015, Vol. 51

