文章信息
- 王丽丽, 赵韩生, 孙化雨, 董丽莉, 娄永峰, 高志民
- Wang Lili, Zhao Hansheng, Sun Huayu, Dong Lili, Lou Yongfeng, Gao Zhimin
- 毛竹miR397和miR1432的克隆及其逆境胁迫响应表达分析
- Cloning and Expression Analysis of miR397 and miR1432 in Phyllostachys edulis under Stresses
- 林业科学, 2015, 51(6): 63-70
- Scientia Silvae Sinicae, 2015, 51(6): 63-70.
- DOI: 10.11707/j.1001-7488.20150608
-
文章历史
- 收稿日期:2014-08-04
- 修回日期:2014-09-24
-
作者相关文章
MicroRNA(miRNA)是一类长度为21~30 nt的非编码小分子RNA(de Lima et al.,2012),miRNA的转录和加工是在细胞核中进行的,而其最终发挥功能的场所在细胞质中。已知miRNA发挥作用的机制包括降解靶mRNA(Kurihara et al.,2004)、抑制靶mRNA的翻译(Qi et al.,2005)以及对基因座位上的DNA进行甲基化修饰(Bao et al.,2004),在植物中主要通过切割靶基因导致靶基因沉默的方式参与生长发育过程。研究表明,miRNA在植物生长发育、细胞周期调控以及植物抗逆性等方面起着非常重要的作用(Lee et al.,2001),其中许多miRNA参与了植物非生物逆境的应答调节,如在低温(4 ℃)、 高温(38 ℃)胁迫条件下,旱芹(Apium graveolens)中miR160,miR164,miR394,miR395和miR408的表达均上调(Li et al.,2014);在高温(42 ℃)、NaCl(250 mmol·L-1)、干旱(20%PEG和300 mmol·L-1 甘露醇)等胁迫条件下,芥菜(Brassica juncea)miR395_2的表达上调,miR390_1和miR172_2的表达均下调(Bhardwaj et al.,2014);葡萄(Vitis vinifera)的Vvi-miR159b,Vvi-miR160f,Vvi-miR171e,Vvi-miR171f,Vvi-miR171h,Vvi-miR393a和Vvi-miR393b受外施GA3的诱导表达(Han et al.,2014a);在ABA和盐胁迫条件下,欧洲山杨(Populus tremula)miR398呈现动态调节,在3~4 h内其表达受到诱导,在48 h后开始下降,至72 h又开始积累,而盐胁迫条件下拟南芥(Arabidopsis thaliana)中miR398的表达稳定,并且在ABA胁迫条件下呈现与欧洲山杨中相反的情况(Jia et al.,2009)。随着全球环境的变化,干旱、高温、低温、盐碱等非生物胁迫已经成为影响植物正常生长的关键因素,开展植物抗逆研究对于培育植物抗逆新品种具有重要的价值。
竹子是重要的森林植物资源,在应对全球环境的恶化、森林资源匮乏、能源危机等方面发挥着重要作用。竹子在长期的进化过程中形成了对各种非生物胁迫的保护与适应机制,具有较强的可塑性。对竹子抗逆生理的研究主要集中于活性氧代谢、膜脂过氧化、抗氧化酶系统、渗透调节系统和光合生理等方面(刘玉芳等,2014),随着认识的不断深入,单纯从生理角度来认知竹子的抗逆机制存在着局限性,人们开始从分子水平来进行相关研究。目前已分离了甘油醛-3-磷酸脱氢酶基因(杨洋等,2010)、液泡膜Na+/H+逆向运输蛋白基因(张智俊等,2011)、BoBZF(高志民等,2012)、PheWRKY1(Cui et al.,2013)等许多抗逆相关基因,但多仅限于基因的克隆分析或功能的初步研究。关于竹类植物miRNA的研究也日趋受到重视,通过高通量测序技术与生物信息学技术相结合的方法,从麻竹(Dendrocalamus latiflorus)叶片中获得了84个保守的miRNA和81个新miRNA,并对其中30个新miRNA研究证明它们的表达受光照的诱导或抑制(Zhao et al.,2013)。对毛竹(Phyllostachys edulis)和麻竹叶片中的miRNA比较分析并通过试验验证表明,miR397,miR1432和miR7748只存在于毛竹叶片中(Zhao et al.,2014)。为研究miRNA在竹子非生物胁迫中的表达调控作用,本研究以毛竹为对象,分离miR397和miR1432的成熟序列、前体序列,在对前体上游启动子序列所包含的逆境应答元件分析的基础上,研究了温度、光照、干旱、激素等非生物胁迫对毛竹叶片中miR397和miR1432表达的影响,以期为进一步研究其功能以及未来竹子抗逆品种的分子设计提供参考。
1 材料与方法1.1 材料毛竹半年生实生苗,盆栽于本实验室的培养室内,栽培基质为腐殖质土和蛭石(7∶3),培养温度为25 ℃,光照200 μmol·m-2s-1,光/暗为16 h/8 h。
1.2 基因组DNA提取、总RNA提取与cDNA合成分别取毛竹的根、幼茎、顶端第3片叶的叶片及叶鞘以及不同处理后的毛竹叶片(顶端第3片叶),迅速放入液氮中研磨成粉末状,采用改良的CTAB法(高志民等,2006)提取基因组DNA,Trizol法(Gao et al.,2006)提取总RNA。按照反转录试剂盒说明书(Promega公司)合成cDNA。
1.3 miRNA克隆与测序分别根据毛竹miR397及miR1432成熟序列及前体序列(PH01000093/PH01011011)(http://www.bamboogdb.org/)设计反转录颈环引物(Chen et al.,2005)、正向引物(forward primer)和反向通用引物(universal reverse primer),其中茎环部分通用序列为:5′-CTCAACTGGTGTCGTGGAGTCGGCAA TTCAGTTGAG-3′(表 1),由上海生物工程技术服务有限公司合成。PCR反应体系为:10×PCR Buffer 2 μL,dNTP(2.5 mmol·L-1)2 μL,正向引物(10 μmol·L-1)1 μL,反向引物(10 μmol·L-1)1 μL,DMSO 1 μL,cDNA 0.5 μL,高保真酶(Pyrobest)0.1 μL(5 U·μL-1),加水补足至20 μL。反应条件: 94 ℃ 30 s,62 ℃ 30 s,72 ℃ 30 s,共35个循环。
|
|
回收PCR产物,进行加A反应,反应体系10 μL:10×PCR Buffer 1 μL,dATP(2.5 mmol·L-1)1 μL,PCR产物7.9 μL,LA Taq酶0.1 μL。反应程序:72 ℃ 30 min。反应结束后连接到pGEM-T easy载体上,转化大肠杆菌(Esherichia coli)DH 5α感受态细胞,阳性克隆经酶切检测分析后,送生物工程技术服务有限公司测序。
1.4 生物信息学分析利用公共数据库miRBase 21(http://www.mirbase.org/index.shtml)和Bamboo GDB下载水稻(Oryza sativa)、二穗短柄草(Brachypodium distachyon)、玉米(Zea mays)、大麦(Hordeum vulgare)、毛竹等禾本科植物的miR397和miR1432的成熟序列及前体序列,利用在线平台WebLOGO(http://weblogo.berkeley.edu/logo.cgi)分析miRNA成熟序列的碱基保守性,用MEGA 6.0软件构建基于miRNA前体的系统进化树。利用在线工具RNAfold WebServer(http://rna.tbi.univie.ac.at/cgi-bin/RNAfold.cgi)预测miRNA的前体二级结构。下载毛竹miR397和miR1432前体上游的1 500 bp序列,利用在线平台Plant CARE分析其所含作用元件(http://bioinformatics.psb.ugent.be/Webtools/plantcare/html/)。
1.5 胁迫处理选取长势一致的毛竹,分别进行处理。光照处理:将毛竹苗分别在黑暗处理24 h、1 500 μmol·m-2s-1光照处理2 h;温度处理:42 ℃ 处理2 h、4 ℃处理2 h;同时以实验室条件下生长的毛竹为对照。选取毛竹顶端第3片离体叶片,干旱处理:将叶片放入开口的空培养瓶中2 h,同样以浸入蒸馏水中2 h的叶片为对照(王京京等,2012);NaCl处理:浸于NaCl溶液(250 mmol·L-1)中2 h,蒸馏水处理作为对照;激素处理:将叶片分别浸入GA3溶液(100 μmol·L-1)、ABA溶液(100 μmol·L-1)中2 h,分别以浸入甲醇、乙醇中2 h的叶片为对照(Kayal et al.,2006)。处理后分别取第3片叶片存-80 ℃备用。
1.6 实时荧光定量RT-PCR分别用毛竹根、茎、叶和鞘不同组织以及不同胁迫处理后的样品RNA和颈环反转录引物合成miRNA特异性cDNA,作为模板,进行qRT-PCR,并用U6 snRNA为内参(Ding et al.,2011)。选用Roche公司的LightCycle 480 SYBR Green I Master试剂盒,PCR反应体系为:Mix 5 μL,cDNA 0.4 μL,正向引物0.2 μL,反向通用引物 0.2 μL,加水补足至10 μL。反应程序为:95 ℃,10 min;95 ℃ 10 s;62 ℃10 s,共50个循环。反应在Analytikjena公司的q-Tower仪上进行,重复3次,反应结束后应用2-△△Ct算法进行分析(Livak et al.,2001)。
2 结果与分析2.1 miRNA克隆与结构预测分别用毛竹miR397和miR1432前体及成熟序列特异性引物进行PCR扩增,产物经1%琼脂糖凝胶电泳检测,结果显示二者前体特异引物扩增产物均在450 bp左右有1条亮带,与预测的包含毛竹miR397和miR1432的前体序列的目的片段大小一致;成熟序列特异引物扩增产物均在70 bp左右有1条亮带,与预测的miR397及miR1432茎环法反转录扩增序列大小一致。测序结果表明,前体序列特异性引物扩增产物分别为443 bp 和439 bp,分别包含miR397和miR1432前体序列,均为88 bp;成熟序列特异性茎环引物扩增产物分别为65 bp 和66 bp,且分别包含其成熟miRNA序列,均为21 bp。
通过对前体序列二级结构的预测发现,毛竹miR397和miR1432的前体序列均能形成稳定的茎环结构,且成熟序列均产生于前体茎环结构5′端臂上(图 1),它们与其他单子叶植物miR397和miR1432的前体有着类似的结构,其前体分别命名为phe-MIR397和phe-MIR1432,成熟miRNA分别命名为phe-miR397和phe-miR1432。
 |
图 1 前体二级结构预测 Fig. 1 Secondary structure prediction of precursor |
对单子叶植物miR397和miR1432成熟序列碱基保守性分析结果表明,2个miRNA家族均具有较高的保守性,但miR1432家族的碱基保守性整体高于miR397家族。miR397家族主要在第6,8,10,11,12,13,19及21位上的碱基保守性较强些,phe-miR397的成熟序列(5′-UCAUUGAGUGCAGCG UUGAUG-3′)与其他单子叶植物miR397家族成员大部分序列保持一致(图 2);而来自单子叶植物的miR1432家族成员只有6个,其碱基保守性整体较高,尤其在第3,4,5,6,7,11,15和19位的碱基在不同家族成员间都是相同的,而phe-miR1432的成熟序列(5′-UUCAGGAAGUAGCUCGUAGGA-3′)也在第4,5,6,7,11,15和19位表现出较高的碱基保守性(图 1)。由此表明,miR397和miR1432两个家族成员在单子叶植物的进化过程中是比较保守的。
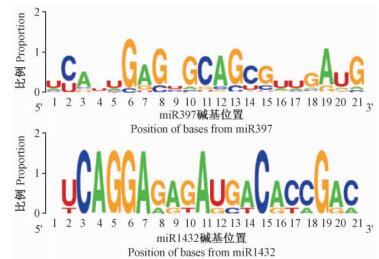 |
图 2 miR397和miR1432成熟序列碱基保守性分析 Fig. 2 Conserved nucleotide sequence analysis of miR397 and miR1432 |
构建基于前体序列系统进化树的结果表明,来自单子叶植物和双子叶植物的MIR397家族不同成员大多数分别聚类到2个大的分支,与植物进化的保守性相一致,当然也有例外,如来自葡萄的vvi-MIR397a和欧丹参(Salvia sclarea)的ssl-MIR397聚类到双子叶植物大分支之外的一个小分支,更有来自双子叶植物毛果杨(Populus trichocarpa)的ptc-MIR397c和单子叶植物玉米的zma-MIR397a聚类在另一个与2大分支较远的一个小分支(图 3A);另外,来自单子叶植物同一物种的MIR397家族不同成员被聚类到不同的分支,表明植物miRNA前体序列具有比较丰富的多样性。
 |
图 3 基于前体序列构建的系统进化树
Fig. 3 Phylogenetic tree based on the sequence of precursors
A:MIR397系统进化树;B:MIR1432系统进化树 A: Phylogenetic tree of MIR397; B: Phylogenetic tree of MIR1432 |
目前在miRBase 21中的miR1432的前体序列仅有6条,且差异较大,聚类分支比较分散,毛竹的
对毛竹phe-miR397和phe-miR1432前体上游调控区作用元件分析结果表明,二者均含有启动子基本作用元件,如TATA-box,CAAT-box;同时存在很多逆境(光、干旱、温度等)胁迫相关响应元件,另外还包括一些其他调节元件,如激素响应元件等(表 2)。这意味着phe-miR397和phe-miR1432可能受到一些逆境胁迫的调节,其表达将会因逆境胁迫而上调或者下调。
|
|
实时定量PCR结果表明:phe-miR397和phe-miR1432在毛竹根、茎、叶和鞘中都有表达,但是表达丰度存在一定的差异,在茎、叶和鞘中phe-miR397和phe-miR1432的表达量与根中的相比,差异均达到极显著水平(P <0.01);虽然phe-miR397和phe-miR1432均在叶鞘中表达丰度最高,但表达丰度最低的部位,phe-miR397出现在幼茎中,phe-miR1432则出现在叶片中(图 4)。
 |
图 4 phe-miR397和phe-miR1432在不同组织中的表达分析 Fig. 4 Expression analysis of phe-miR397 and phe-miR1432 in different tissues |
与对照相比,经过强光(1 500 μmol·m-2s-1)和黑暗处理后phe-miR397和phe-miR1432的相对表达量均呈现一定程度的下调,差异均达到极显著水平(P <0.01),其中黑暗处理比强光处理对phe-miR397的表达影响更大,处理后其表达量约为对照的57%;而黑暗和强光处理对phe-miR1432表达的抑制均比较明显,尤其是强光条件下其表达量仅为对照的30%(图 5A)。
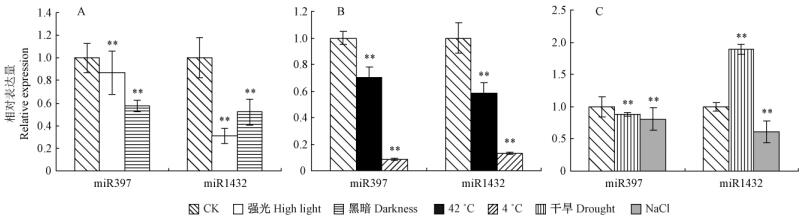 |
图 5 不同非生物胁迫处理毛竹叶片中 phe-miR397和 phe-miR1432表达分析
Fig. 5 Expression analysis of phe-miR397 and phe-miR1432 in leaf of P. edulis under different abiotic stresses
A:光照处理;B:温度处理;C:干旱、NaCl处理。**表示极显著水平(P <0.01),下同。 A: Treated with light; B: Treated with temperature; C: Treated with drought and NaCl.**indicates a significant level(P <0.01),the same below. |
经高温(42 ℃)和低温(4 ℃)处理后,phe-miR397和phe-miR1432的表达均不同程度的下调,差异均达到极显著水平(P <0.01),其中高温处理后phe-miR397和phe-miR1432表达量下降程度较低,分别为对照的70%和58%;而低温处理后二者的表达均受到较大程度的抑制,phe-miR397和phe-miR1432的表达量分别为对照的8%和13%(图 5B)。
在干旱处理后phe-miR397和phe-miR1432的表达呈现相反的情况,phe-miR397的表达下调为对照的89%,而phe-miR1432的表达却上调为对照的1.89倍,差异均达到极显著水平(P <0.01);NaCl处理后phe-miR397和phe-miR1432的表达均呈现一定程度的下调,差异也均达到极显著水平(P <0.01),其中phe-miR1432的表达下调更为明显,仅为对照的61%(图 5C)。
GA3和ABA处理后,与对照相比,phe-miR397和phe-miR1432的表达均呈现相反的情况,其中phe-miR397在GA3处理后明显上调(约为对照的1.7倍),phe-miR1432明显下调(约为对照的56%),差异均达到极显著水平(P <0.01)(图 6A);ABA处理后phe-miR397下调,差异达到极显著水平(P <0.01),phe-miR1432上调,但差异不显著(图 6B)。
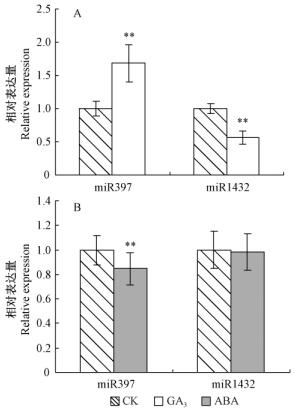 |
图 6 GA3和ABA处理毛竹叶片中 phe-miR397和 phe-miR1432表达分析
Fig. 6 Expression analysis of phe-miR397 and phe-miR1432 in leaf of P. edulis treated with GA3 or ABA
A:GA3处理;B:ABA处理。 A: Treated with GA3; B: Treated with ABA. |
环境的日益变化使得人们对非生物逆境条件下植物自身调节机制的研究越来越重视,这是培育抗逆新品种的前提条件之一。研究表明,在植物感受逆境胁迫而做出适应性调整过程中miRNA通过调控靶基因的表达来参与植物逆境的调控(Sunkar et al.,2004; Khraiwesh et al.,2012),且许多miRNA的表达都具有组织特异性(Meng et al.,2012; Han et al.,2014b)。本研究对 phe-miR397和phe-miR1432的表达分析发现,二者在根、茎、叶和鞘中均有表达,这可能与其参与多种非生物胁迫调控有关。miRNA本身的表达受到自身启动子以及相关转录因子的调控,植物可以通过启动子中顺式作用元件与转录因子的相互协调作用,对光、温度、水分等非生物逆境产生响应,来调控基因的表达。本研究通过对毛竹 phe-miR397和phe-miR1432启动子结构分析显示,它们都含有许多逆境胁迫相关响应元件,这意味着它们参与多种逆境胁迫的调控,这在对 phe-miR397和phe-miR1432的表达检测中得到了证实,二者的表达均受到NaCl、高温、低温、强光和黑暗等胁迫条件的抑制。在干旱条件下,phe-miR397表达受抑制,而 phe-miR1432表达则被诱导;经GA3和ABA处理后,phe-miR397和phe-miR1432的表达呈现相反的表达趋势。
miRNA的表达与调控是一个极为复杂的网络系统,存在1个miRNA能够调控多个靶基因的情况,决定了其所参与生物过程的广泛性;同时也存在多个miRNA共同调控1个靶基因的情况,体现了其精细调控,为植物细胞应对复杂的非生物胁迫环境变化做出精确的反应,在植物体内形成了miRNA-转录因子-靶基因前反馈环路网络(Meng et al.,2012)。在逆境胁迫条件下,植物miRNA处于较为复杂的调控网络之中,包括其他相关miRNA、激素、靶基因等多方面因素(Ding et al.,2013)。 phe-miR397和phe-miR1432作为2个保守型的miRNA,在受光照、温度、干旱、NaCl、激素等胁迫时,其表达均呈现了不同程度的变化,或下调或上调,说明二者可能参与了毛竹逆境胁迫的应答反应与调控。另外,研究表明过量表达miR397的拟南芥植株抗盐性有明显的提高(Liu et al.,2008),miR397b通过对木质素生物合成中漆酶的调控来实现对拟南芥的木质素含量以及种子数量的调控(Wang et al.,2014),说明具有多种功能,而在竹子中miRNAs是如何实现对靶基因精准调控的尚需进一步研究。因此,将多个miRNA及其靶基因相结合起来,对逆境胁迫条件下的竹类植物进行研究,揭示其网络调控机制,并进行分子设计,可能是未来竹类植物抗逆分子育种的有效途径。
| [1] |
高志民, 范少辉, 高健, 等. 2006. 基于CTAB法提取毛竹基因组DNA的探讨. 林业科学研究, 19(6): 725-728. (Gao Z M, Fan S H, Gao J, et al. 2006. Extract genomic DNA from Phyllostachys edulis by CTAB-based method. Forest Research, 19(6): 725-728[in chinese]).(  1) 1)
|
| [2] |
高志民, 刘青, 牟少华, 等. 2012. 绿竹锌指蛋白基因BoBZF的克隆及功能初步分析. 林业科学, 48(10): 49-54. (Gao Z M, Liu Q, Mu S H, et al. 2012. Cloning and primary functional analysis of a zinc finger protein gene of BoBZF from Bambusa oldhamii. Scientia Silvae Sinicae, 48(10): 49-54[in chinese]).(  1) 1)
|
| [3] |
刘玉芳, 陈双林, 李迎春, 等. 2014. 竹子生理可塑性的环境胁迫效应研究进展. 浙江农林大学学报, 31(3): 473-480. (Liu Y F, Chen S L, Li Y C, et al. 2014. Environmental stress on physiological plasticity of bamboo: a review. Journal of Zhejiang A & F University, 31(3): 473-480[in chinese]).(  1) 1)
|
| [4] |
王京京, 童再康, 黄程前, 等. 2012. 巨桉EgrCBF 1和EgrCBF 2 基因的克隆和胁迫响应表达分析. 林业科学, 48(10): 42-48. (Wang J J, Tong Z K, Huang C Q, et al. 2012. Cloning of EgrCBF 1 and EgrCBF 2 genes from Eucalyptus grandis and their expression under stresses. Scientia Silvae Sinicae, 48(10): 42-48[in chinese]).(  1) 1)
|
| [5] |
杨洋, 张智俊, 罗淑萍. 2010. 毛竹甘油醛-3-磷酸脱氢酶基因的克隆与序列分析. 经济林研究, 28(3): 7-13, 24. (Yang Y, Zhang Z J, Luo S P. 2010. Cloning and sequence analysis of glyceraldehyde-3-phosphate dehydrogenase gene in Phyllostachys edulis. Nonwood Forest Research, 28(3): 7-13, 24[in chinese]).(  1) 1)
|
| [6] |
张智俊, 杨洋, 罗淑萍, 等. 2011. 毛竹液泡膜Na+/H+逆向运输蛋白基因克隆及表达分析. 农业生物技术学报, 19(1): 69-76. (Zhang Z J, Yang Y, Luo S P, et al. 2011. Molecular cloning and expression analysis of a vacuolar Na+/H+ antiporter gene in moso bamboo. Journal of Agricultural Biotechnology, 19(1): 69-76[in chinese]).(  1) 1)
|
| [7] |
Bao N, Lye K W, Barton M K. 2004. MicroRNA binding sites in Arabidopsis class Ⅲ HD-ZIP mRNAs are required for methylation of the template chromosome. Dev Cell, 7(5): 653-662.( 1) 1)
|
| [8] |
Bhardwaj A R, Joshi G, Pandey R, et al. 2014. A Genome-Wide Perspective of miRNAome in response to high temperature, salinity and drought stresses in Brassica juncea (Czern) L. PLoS ONE, 9(3): e92456.( 1) 1)
|
| [9] |
de Lima J C, Loss-Morais G, Margis R. 2012. MicroRNAs play citical roles during plant development and in response to abiotic stresses. Genetics and Molecular Biology, 35(4): 1069-1077.( 1) 1)
|
| [10] |
Chen C, Ridzon D A, Gurgler K J, et al. 2005. Real-time quantification of microRNAs by stem-loop RT-PCR. Nucleic Acids Res, 33(20): e179.( 1) 1)
|
| [11] |
Cui X W, Ying Z, Qi F Y, et al. 2013. Overexpression of a moso bamboo (Phyllostachys edulis) transcription factor gene PheWRKY 1 enhances disease resistance in transgenic Arabidopsis thaliana. Botany, 91: 486-494.( 1) 1)
|
| [12] |
Ding Y F, Tao Y L, Zhu C. 2013. Emerging roles of microRNAs in the mediation of drought stress response in plants. J Exp Bot, 64(11): 3077-3086.( 1) 1)
|
| [13] |
Ding Y, Chen Z, Zhu C. 2011.Microarray-based analysis of cadmium-responsive microRNAs in rice (Oryza sativa). J Exp Bot, 62(10): 3563-3573.( 1) 1)
|
| [14] |
Gao Z M, Li X P, Li L B, et al. 2006. An effective method for total RNA isolation from bamboo. Chinese For Sci Tech, 5(3): 52-54.( 1) 1)
|
| [15] |
Han J, Fang J, Wang C, et al. 2014a. Grape vine microRNAs responsive to exogenous gibberellin. BMC Genomics, 15: 111.( 1) 1)
|
| [16] |
Han R, Jian C, Lv J, et al. 2014b. Identification and characterization of microRNAs in the flag leaf and developing seed of wheat (Triticum aestivum L.[in chinese]). BMC Genomics, 15: 289.( 1) 1)
|
| [17] |
Jia X, Wang W X, Ren L, et al. 2009. Differential and dynamic regulation of miR398 in response to ABA and salt stress in Populus tremula and Arabidopsis thaliana. Plant Mol Biol, 71(1/2): 51-59.( 1) 1)
|
| [18] |
Kayal E W, Navarro M, Marque G, et al. 2006. Expression profile of CBF-like transcriptional factor genes from Eucalyptus in response to cold. J Exp Bot, 57(10): 2455-2496.( 1) 1)
|
| [19] |
Khraiwesh B, Zhu J K, Zhu J. 2012. Role of miRNAs and siRNAs in biotic and abiotic stress responses of plants. Biochim Biophys Acta, 1819(2): 137-148.( 1) 1)
|
| [20] |
Kurihara Y, Watanabe K. 2004.Arabidopsis micro-RNA biogenesis through Dicer like 1 protein functions. Proc Natl Acad Sci USA, 101(34): 12753-12758.( 1) 1)
|
| [21] |
Lee R C, Ambors V. 2001. An extensive class of small RNAs in Caenorbabditis elegans. Science, 294: 858-864.( 1) 1)
|
| [22] |
Li M Y, Wang F, Xu Z S, et al. 2014. High throughput sequencing of two celery varieties small RNAs identifies microRNAs involved in temperature stress response. BMC Genomics, 15: 242.( 1) 1)
|
| [23] |
Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method. Methods, 25(4): 402-408.( 1) 1)
|
| [24] |
Liu H H, Tian X, Li Y J, et al. 2008. Microarray-based analysis of stress-getulated microRNAs in Arabidopsis thaliana. RNA, 14(5): 836-843.( 1) 1)
|
| [25] |
Meng Y, Shao C, Ma X, et al. 2012. Expression-based functional investigation of the organ-specific microRNAs in Arabidopsis. PLoS ONE, 7(11): e50870.( 2) 2)
|
| [26] |
Qi Y, Denli A M, Hannon G J. 2005.Biochemical specialization within Arabidopsis RNA silencing pathways. Mol Cell, 19(3): 421-428.( 1) 1)
|
| [27] |
Sunkar R, Zhu J K. 2004. Novel and stress-regulated microRNAs and other small RNAs from Arabidopsis. Plant Cell, 16: 2001-2019.( 1) 1)
|
| [28] |
Wang C Y, Zhang S, Yu Y, et al. 2014. MiR397b regulates both lignin content and seed number in Arabidopsis via modulating a laccase involved in lignin biosynthesis. Plant Biotechnol J, doi: 10.1111/pbi.12222.( 1) 1)
|
| [29] |
Zhao H S, Chen D L, Peng Z H, et al. 2013. Identification and characterization of microRNAs in the leaf of ma bamboo (Dendrocalamus latiflorus) by deep sequencing. PLoS ONE, 8(10): e78755.( 1) 1)
|
| [30] |
Zhao H S, Wang L L, Dong L L, et al. 2014. Discovery and comparative profiling of microRNAs in representative monopodial bamboo (Phyllostachys edulis) and sympodial bamboo (Dendrocalamus latiflorus). PLoS ONE, 9(7): e102375.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

