文章信息
- 徐刚标, 刘雄盛, 梁文斌
- Xu Gangbiao, Liu Xiongsheng, Liang Wenbin
- 极度濒危植物水松大孢子发生、雌配子体发育及胚形成
- Megasporogenesis, Female Gametophyte Development and Embryogenesis in Critically Endangered Glyptostrobus pensilis
- 林业科学, 2015, 51(6): 50-62
- Scientia Silvae Sinicae, 2015, 51(6): 50-62.
- DOI: 10.11707/j.1001-7488.20150607
-
文章历史
- 收稿日期:2014-10-27
- 修回日期:2015-01-26
-
作者相关文章
水松(Glyptostrobus pensilis)为落叶或半落叶乔木,单性花,雌雄同株,种子当年成熟。起源于中生代,第四纪广泛分布于北半球,是第三纪特有的单种属孑遗树种,对研究松杉类植物的系统发育、古植物学及第四纪冰期气候等都具有重要的科学价值(于永福,1995)。由于历史气候变化和人为破坏活动,水松种群片断化极为严重,现零星分布于我国长江流域以南、越南中部和老挝东部,天然种群和个体数量极少,林下没有幼苗,自然更新十分困难,已处于极度濒危状态(李发根等,2004; Tam et al., 2013),被列为我国一级保护植物和极小种群物种(国家林业局野生动植物保护管理司等,2013)。
目前,对松杉类演化过程认识不很清楚(杨永等,2001)。传统植物分类中,杉科(Taxodiaceae)、柏科(Cupressaceae)单独成科,但杉科、柏科中各属的系统关系存在着诸多分歧(李春香等,2003)。近年来,越来越多的研究资料表明,除杉科中金松属(Sciadopitys)应独立为金松科(Sciadopityaceae)外,柏科和杉科应合并为一个科(Gadek et al., 1993; 2000; 李春香等,2003; Singh,2006),即广义柏科(Cupressaceae sensu lato)。传统分类的杉科分为杉木亚科(Cunninghamioideae)、密叶杉亚科(Athrotaxidoideae)、台湾杉亚科(Taiwanioideae)、红杉亚科(Sequoioideae),柏科分为柏木亚科(Cupressoideae)和松柏亚科(Calliirtoideae)(Gadek et al., 2000; Singh,2006)。松杉类植物雌性生殖的形态特征及其演化过程具有重要的系统发育研究意义(杨永等,2001),有性生殖发育异常是植物濒危的主要原因之一(高润梅,2002;Owens et al., 1991; 1998; 2008; Owens,2006; Garcǐa et al., 2000; Gruwez et al., 2013)。因此,开展水松雌性生殖发育解剖特征研究显得尤为迫切。
近40年来,水松研究主要集中在系统分类(Schlarbaum et al., 1984; Hart,1987; Price et al., 1989; 李林初,1989; 1995; Gadek et al., 1993; 2000; Brunsfeld et al., 1994; Tsumura et al., 1995; Charles et al., 1999; 韩丽娟等,1997; Kusumi et al., 2000; 2002; 李春香等,2003)、遗传多样性(Li et al.,2005; 吴则焰等,2012a; Averyanov et al., 2009; Tam et al.,2013)、地理分布(李发根等,2004)、繁殖技术(吴则焰等,2012b)、化学组成(斯缨等,2003)等方面。有关水松生殖发育解剖结构研究,早在20世纪中叶,王伏雄(1952; 1953)曾描述水松雌、雄配子体发生及胚发育过程,Takaso等(1990)曾比较水松与落羽杉(Taxodium distichum)的个体发育特征,刘雄盛等(2014)开展了水松小孢子发生和雄配子体发育过程的显微观察。本研究拟采用石蜡切片法研究水松大孢子发生、雌配子体和胚发育的解剖特征,与部分松杉类植物进行比较,分析水松种子严重败育原因,旨在为水松的系统分类、繁殖和保护提供胚胎学基础资料。
1 材料与方法1.1 材料研究材料取自江西省上饶市弋阳县庙脚村(117° 21′ E,28° 22′ N,海拔100 m)保存完好的13株古老水松。
1.2 方法1.2.1 物候期观测根据水松生长生活习性,雌球果芽分化至球果成熟期,在树体不同方位选择10个观测点,观察球果外部形态。水松球果芽分化、大孢子发生和雌配子发育期,每5天观测1次; 胚发育期,每7天观测1次。每月中旬,用游标卡尺测量雌球果大小。
1.2.2 样本采集材料于2011年11月—2013年11月采集,每次采集15~20个样本。 9—11月为雌球果芽分化期、胚发育生长期(含8月),每5天采样1次; 12月—翌年5月为大孢子发生、雌配子体发育期,6月下旬至7月为原胚发育期,每3天采样1次; 6月为受精期,每天上、下午各采样1次。样本固定于FAA溶液中,带回实验室后,放入4 ℃冰箱保存。
1.2.3 显微结构观察参考李正理(1987)和徐明堂等(2008)石蜡切片方法。切片厚度为8~12 m,改良爱氏苏木精染色,中性树胶封片,用Motic BA410显微镜观察雌球果发育过程的解剖特征。
2 结果与分析2.1 水松大孢子发生、雌配子体和胚发育各时期的形态特征11月中下旬,雌球果芽开始分化形成雌球果。雌球果芽圆形,中部稍膨大,红褐色,外裹鳞叶,单生于具鳞叶的当年生或2年生小枝顶端(图 1A)。12月初至翌年1月初,分化形成的雌球果外裹赤褐色苞鳞。1月,雌球果,卵圆形,顶端展开小口,外裹数层苞鳞呈螺旋状排列(图 1B)。2月中旬,雌球果外被一轮珠鳞,呈漏斗状,浅绿色,顶端完全打开,露出胚珠(图 1C)。3月初至4月初,大孢子母细胞开始形成,珠鳞稍向后弯曲,小孢子叶球呈紫褐色(图 1D)。4月,雌球果绿色变浓,珠鳞向内合生,形成锥形胚珠,苞鳞加厚,向后弯曲(图 1E)。5月初至6月中旬,雌球果球形,顶端完全封闭,珠鳞加厚并与苞鳞合生,雌配子体发育成熟。6月下旬至7月下旬,受精后的雌球果生长迅速,卵圆形,浓绿色,种鳞木质化(图 1F)。8—11月,胚胎发育期。成熟的球果黄绿色,倒卵形或近球形(横径8~12 mm,纵径15~20 mm),具 15~20枚种鳞。木质化种鳞基部着生2粒种子,与较大的苞鳞合生。中部种鳞的上部有6~9个反曲三角形状尖齿(图 1G)。雌球果授粉前,少数球果发育异常、生长停滞(图 1H)。水松雌球果生长变化曲线呈逐步上升趋势(图 2),各月份的雌球果外部形态及内部发育特征变化的相互关系见表 1。
 |
图 1 水松部分具雌球果枝条照片,示雌球果发育
Fig. 1 Portions of photographs of branches with ovulate cone of G. pensilis, showing development of ovulate cone
A.示即将分化的雌球果芽(cb)(2012-11-20); B.示顶端略开的雌球果(oc)(2013-01-04); C.示顶端露出胚珠雌球果(oc) (2013-02-18); D.示珠鳞后弯雌球果(oc)及小孢子叶球(ms)(2013-04-04); E.示苞鳞加厚雌球果(oc)(2013-04-28); F.示种鳞木质化球果(oc) (2013-06-25); G.示成熟球果(oc) (2013-11-05); H.示发育异常雌球果(aoc) (2013-04-04)。 A. Showing differentiating cone bud (cb) (2012-11-20); B. Showing ovulate cone (oc), a small incision formed in the top (2013-01-04); C. Showing fully opened top to expose ovule cone (oc) (2013-02-18); D. Showing ovulate cone (oc) with ovuliferous scale bent backward and red microstrobilus (ms) (2013-04-04); E. Showing ovulate cone (oc) and ovuliferous scale thickened (2013-04-28); F. Showing ovuliferous scale lignifications of ovulate cone (oc) (2013-06-25); G. Showing mature ovulate cone (oc) (2013-11-05); H. Showing abortive ovulate cone (aoc) (2013-04-04). |
 |
图 2 水松雌球果生长曲线 Fig. 2 The growth curve of ovulate cone of G. pensilis |
|
|
11月中下旬,雌球果芽的苞鳞近轴面基部与雌球果轴之间出现细胞核大、细胞质浓、染色较深、排列紧密的珠鳞原基组织(图 3A)。12月初至翌年1月初,珠鳞原基组织细胞开始分裂。1月下旬,珠鳞原基细胞经多次有丝分裂形成椭圆形球状体,分化出珠鳞原基和胚珠原基(图 3B)。2月初至3月初,珠鳞原基分化形成珠鳞; 胚珠原基两侧细胞分化形成珠被,中央细胞分化形成珠心(图 3C)。在珠心与珠被相接的水平线上产生1团孢原细胞。孢原细胞的细胞质浓,细胞核大(图 3D)。珠被由3~4层长方形细胞组成,珠心由多层薄壁细胞和孢原细胞组成(图 3E)。3月中旬,孢原细胞经过连续多次有丝分裂形成造孢细胞。造孢细胞大,形状不规则,细胞内充满内含物(图 3F)。4月初,造孢细胞分化形成大孢子母细胞。大孢子母细胞细胞质浓,体积大,由3~5层海绵组织细胞包围(图 3G)。此阶段,显微观察发现,少部分胚珠发育异常(图 3J),外观表现为雌球果生长发育停滞(图 1F)。4月中上旬,大孢子母细胞进行减数分裂,形成直线型四分体(图 3H),随即靠近珠孔端的3个退化,并留有痕迹,只留下合点端的1个大孢子发育形成功能大孢子(图 3I)。
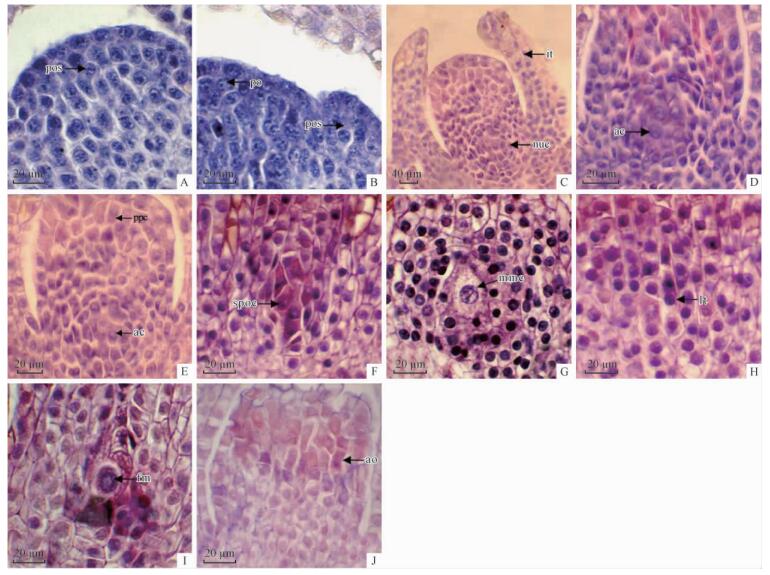 |
图 3 显微镜下水松部分雌球果纵切面照片,示大孢子发生过程
Fig. 3 A portions of micrographs of longitudinal section of ovulate cone of G. pensilis, showing megasporogenesis
A.示珠鳞原基(pos); B.示珠鳞原基(pos)和胚珠原基(po)部分; C.示胚珠已分化出的珠被(it)与珠心(nuc); D. 示珠心中的孢原细胞(ac); E. 示珠心组织中的薄壁细胞(pcc)和孢原细胞(ac); F.示珠心中的造孢细胞(spoc)部分; G. 示大孢子母细胞(mmc); H.示直线型四分体 (lt)。I. 示功能性大孢子(fm); J.示珠心中发育异常胚珠(ao)。 A.Showing primordium of ovuliferous scale (pos); B. Showing a portion of primordium of ovuliferous scale (pos) and primordium of ovule (po); C. Showing the differentiation of nucellus(nuc) and integument(it) of young ovule; D. Showing archesporial cell (ac) in nucellus; E. Showing parenchyma cells(pcc) and archesporial cells(ac); F. Showing sporogenous cell (spoc) in part of nucellus; G. Showing megaspore mother cell (mmc); H. Showing linear tetrad (lt) formed through meiosis of the megaspore mother cell; I. Showing functional megaspore (fm); J. Showing abortive ovule (ao) in part of nucellus. |
4月下旬至5月初,珠心中央保留下来的功能大孢子进行同步分裂,形成无壁、细胞质不分开的雌配子体游离核。新形成的雌配子体游离核分布在大液泡周围的稀薄细胞质中,其中,合点端和珠孔端的雌配子体游离核较多(图 4A)。随着进一步同步分裂,雌配子体游离核数目增多,分布均匀(图 4B)。5月下旬,雌配子体游离核开始细胞化,雌配子体为囊状,中央有1个大液泡(图 4C)。6月初,雌配子体游离核向中心分裂(图 4D),从珠孔端向合点端方向进行,直到完全充满雌配子体。6月上旬,雌配子体游离核汇合于雌配子体中央,原来无壁的雌配子体游离核全部形成有壁的细胞,雌配子体变为白色透明胶冻状。此时期,珠孔顶部一群细胞体积显著增大,形成颈卵器原始细胞(图 4E)。颈卵器原始细胞卵形或长圆形,细胞核较大,细胞质薄,中央被大液泡占据。颈卵器原始细胞经过1次不均等的平周分裂,形成中央细胞和初生颈细胞(图 4F)。初生颈细胞经过有丝分裂形成4~6个颈细胞,位于中央细胞顶部。中央细胞的液泡大,位于细胞边缘的细胞核明显(图 4G)。6月中旬,中央细胞直接发育为卵细胞。随着卵细胞进一步发育,卵细胞的液泡逐渐减少,细胞质变浓。成熟卵细胞呈梭形,有少量密集小液泡,细胞质浓,核仁较大(图 4H)。颈卵器6~17个,由成熟卵细胞和颈细胞组成,被一层具双核的套层细胞包围,构成复合颈卵器。大多数复合颈卵器顶生(图 4I),少数侧生(图 4J)。随着颈卵器进一步发育,雌配子体的周围细胞不断增殖,使颈卵器深深陷入雌配子体中,颈卵器壁不断增厚,雌配子体发育成熟。
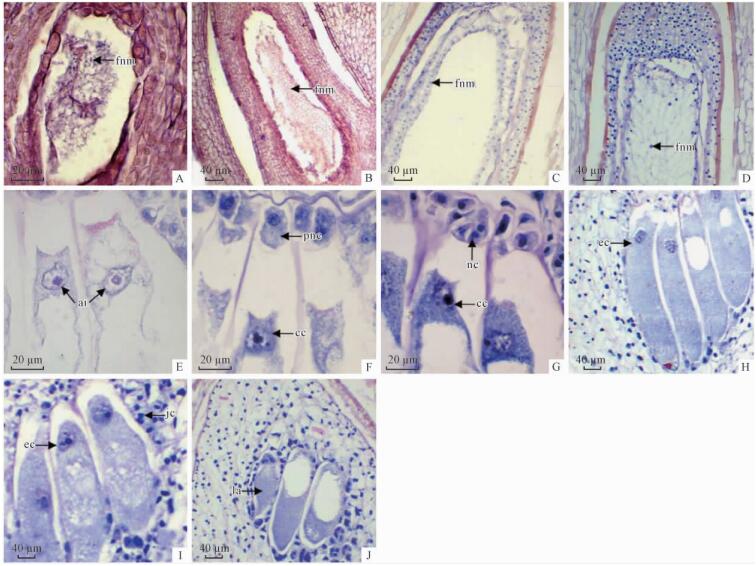 |
图 4 显微镜下水松部分雌配子体纵切面照片,示配子体发育过程
Fig. 4 Portions of micrographs of longitudinal section of megagametophyte of G. pensilis, showing female gametophyte development
A.示初期雌配子体游离核(fnm); B.示中期雌配子体游离核(fnm); C.示有部分细胞壁雌配子体游离核 (fnm); D.示雌配子体游离核(fnm)向中心分裂; E.示颈卵器原始细胞(ai); F.示中央细胞(cc)和初生颈细胞(pnc); G. 示中央细胞(cc)和颈细胞(nc); H.示成熟卵细胞(ec); I.示卵细胞(ec)和套层细腻(jc); J. 示侧生颈卵器(la)。 A. Showing early free nucleus of megagametophyte (fnm); B. Showing metaphase free nucleus of megagametophyte (fnm); C. Showing the late free nucleus of megagametophyte(fnm); D. Showing free nucleus (fnm) division to the center; E. Showing archegonial initials (ai); F. Showing central cell (cc) and primary neck cell (pnc); G. Showing central cell (cc) and neck cell (nc); H. Showing mature egg cell (ec); I. Showing the mature egg cells (ec) and jacket cells (jc); J. Showing lateral archegonium (la). |
6月初,花粉管到达颈卵器顶部,雄配子体发育完全,形成2个精细胞。6月中旬,花粉管末端破裂,将2个精细胞及其花粉管中其他内含物释放到颈卵器中。精细胞进入颈卵器时,前端逐渐拉伸变细,后部逐渐变大(图 5A),从颈细胞的间隙中穿过,不损伤颈细胞。精细胞完全进入颈卵器后,变为圆形。精核与卵核接触时,精核和卵核的接触面变成扁平,紧接着卵核接触面向内凹陷,将精核吞入(图 5B)。精核体积小,卵核体积大,2个核周围细胞质出现小液泡(图 5C)。
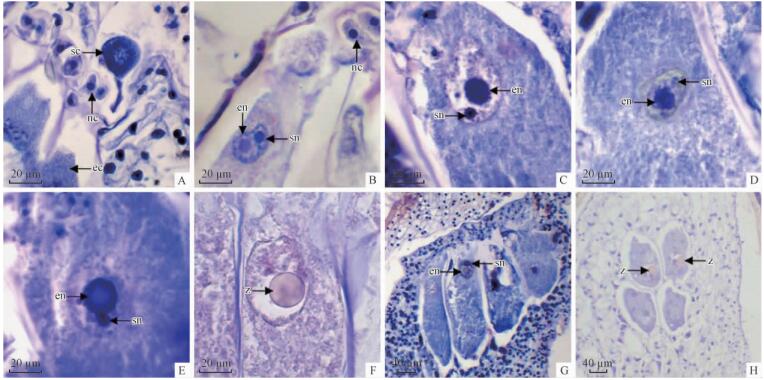 |
图 5 显微镜下水松部分颈卵器纵切面照片,示受精过程
Fig. 5 Portions of sectional micrographs of the longitudinal section of archegonia of G. pensilis, showing fertilization
A.示成熟卵细胞(ec)和进入颈卵器精细胞(sc),颈细胞(nc)没有损伤; B.示精卵融合时卵核(en)、精核(sn)和没有损伤的颈细胞(nc); C-E. 示精卵核融合在颈卵器中部[C.示精核(sn)进入卵细胞时卵核(en); D.示精核(sn)进入卵核后核仁解聚; E.示精卵核融合后卵细胞核(en)和复聚精核(sn)]; F.示受精完成形成合子(z ); G.示精卵融合发生在颈卵器上部; H.示授粉不充分: 上排2个颈卵器中卵细胞受精形成合子(z),下排2个颈卵器中卵细胞未受精。 A. Showing mature egg cell (ec) and sperm cell (sc) entry into archegonium,neck cells(nc) not damaging; B. Showing fusion between egg cell (en), sperm nucleus (sn) and neck cells (nc) not damaging; C-E. Showing nucleus fusions occur in the middle part of archegonium[C. Showing sperm nucleus (sn) into egg nucleus (en); D. Showing nucleolus breakdown of sperm nucleus (sn); E. Showing sperm nucleus (sn) and egg nucleus (en) after fusion]; F. Showing zygote (z) formed after fertilization; G. Showing fusion between sperm nucleus (sn) and egg nucleus (en) in the upper part of archegonium; H. Showing incomplete fertilization: zygotes (z) formed in the upper two archegonia, egg cells in the lower two archegonia. |
精卵融合过程中,首先是精核的核质逐渐散开,核仁逐渐松散,但卵核无明显的结构和形态变化(图 5D); 紧接着,精核的核仁重新聚合,与卵核融合(图 5E)。精核和卵核完全融合形成合子时,合子周围形成一层染色较深的细胞质(图 5F)。精核进入卵核后,能清楚观察到精核和卵核的核膜存在(图 5C)。精卵融合多数发生在颈卵器中部(图 5C,D,E),也可以发生在颈卵器两端(图 5G)。显微观察发现,一些颈卵器中卵细胞未发生受精作用(图 5H)。
2.4 胚发育7月初,卵细胞受精后,形成合子。新形成的合子,逐渐移动到颈卵器的合点端,经过有丝分裂形成2个原胚游离核(图 6A)。第2次分裂形成4个原胚游离核(图 6B),第3次分裂产生8个原胚游离核。8个原胚游离核分为上层的开放层和下层的原胚细胞。随着原胚进一步发育,开放层分裂形成上层细胞和原胚柄细胞。水松原胚由上层细胞、原胚柄和初生胚细胞3层组成(图 6C)。显微观察发现,合子发育成为原胚期间,双核套层细胞只分布在复合颈卵器的中下部(6D)。
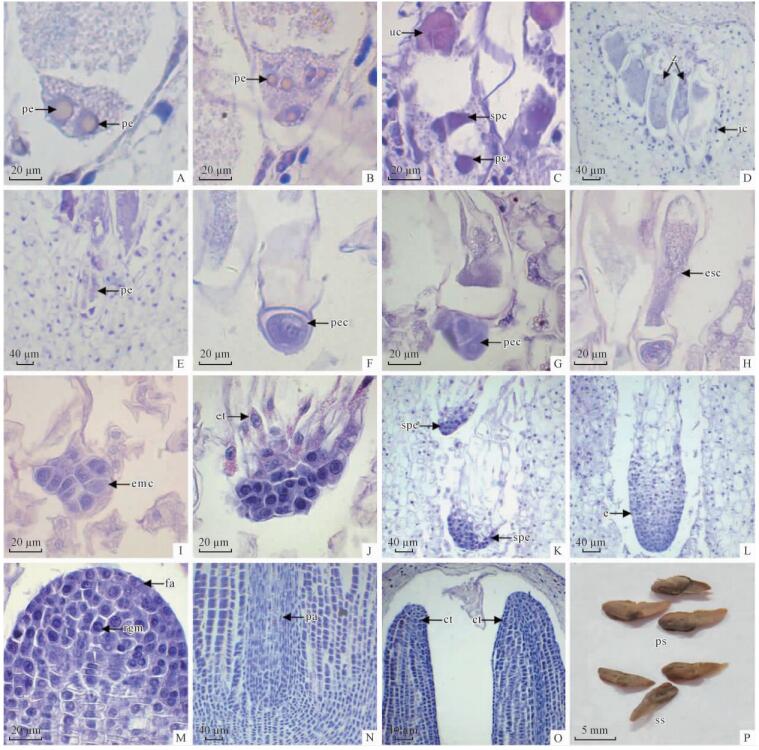 |
图 6 种子外观及显微镜下水松部分雌球果纵切面照片,示胚胎发育过程
Fig. 6 The seeds appearance and portions of micrographs of longitudinal section of ovulate cone of G. pensilis, showing the embryonic development
A.示合子分裂形成2个原胚游离核(pe); B.示4个原胚游离核(pe); C. 示8细胞原胚中的上层细胞(uc)、胚柄层细胞(spc)和原胚细胞(pc); D. 示合子(z)及分布在复合颈卵器下部的套层细胞(jc)部分:下排2个颈卵器中有合子但上排2个颈卵器中没有合子; E.示被推进颈卵器深处的原胚(pe); F.示未发生分裂的初生胚细胞(pec); G.示分裂形成2个细胞的初生胚细胞(pec); H.示初生胚柄细胞(esc); I.示胚细胞进行多次分裂形成的胚细胞群(emc); J.示胚细胞群向后生长形成的胚管(et); K.示简单多胚(spe); L.示幼胚(e); M.示自由先端(fa)和根原分生组织(rgm)部分; N.示成熟胚的胚轴(pa); O.示成熟胚的子叶(ct)部分; P.水松种子照片, 示饱满(ps)和瘪粒(ss)种子。 A.Showing proembryony (pe) with two nuclei by mitosis of the zygote; B. Showing proembryony (pe) with four free nuclei; C. Showing upper cells (uc), suspensor cells (spc) and proembryony cells (pc) of proembryony consisting of eight cells; D. Showing jacket cells(jc) sprinkled throughout the lower part of archegonia during zygote development, zygotes (z) formed in the lower two archegonia and no zygotes in the upper two archegonia; E. Showing proembryony (pe) in the bottom of an archegonium; F. Showing primary embryonal cell (pec); G. Showing cleavage of the primary embryonal cell (pec) into two cells with the upper one larger than the lower one; H. Showing embryonal suspensor cells (esc); I. Showing formation of embryonal cell group (emc) after multiple cleavages of primary embryonal cell; J. Showing formation of embryonal tube (et); K. Showing simple polyembryony (spe); L. Showing young embryo (e); M. Showing free apex(fa) and root generative meristem(rgm) of embryo; N. Showing embryonal axis(pa) of mature embryo; O. Showing the two cotyledons(ct) of mature embryo; P. The photograph of seeds of G. pensilis, showing plump seeds (ps) and shriveled seeds(ss). |
8月上旬,上层细胞逐渐消失解体,原胚柄细胞伸长,将初生胚细胞推入雌配子体深处(图 6E),此时,初生胚细胞尚未发生分裂(图 6F)。初生胚细胞经过1次有丝分裂,形成2层细胞,上部的细胞及下部的胚细胞(图 6G)。随着原胚柄伸长,细胞质变为稀薄(图 6H)。8月下旬,胚细胞经过多次有丝分裂,形成胚细胞群(图 6I)。胚细胞群的上部细胞形成胚管。胚管细胞较长,细胞质稀薄,液泡大(图 6J)。由于原胚时期存在多个初生胚细胞,每个初生胚细胞都有可能独立发育形成为幼胚,因此,水松早期胚发育阶段,存在简单多胚现象(图 6K)。8月下旬,仅有1个幼胚被选择留下,其他幼胚逐渐萎缩。留下来的幼胚不断生长,形成棒状的幼胚(图 6L)。
9月上旬,幼胚呈圆柱状。幼胚前端的自由先端呈半圆形(图 6M),位于自由先端中心的根原分生组织,其下面的细胞纵横排列,侧面的细胞斜向排列。随着幼胚进一步发育,自由先端发育成苗端,根原分生组织细胞向上分裂产生原形成层,向侧分裂形成胚皮层,向下分裂产生根冠。苗端与根冠之间的胚轴无髓(图 6N)。苗端两侧的细胞经过多次平周分裂,分化形成子叶(图 6O)。11月上旬,种子完全成熟。种子褐色,长4~7 mm,宽3~4 mm,椭圆形,略扁,有4~7 mm长翅(图 6P)。
2013年11月中旬,随机抽取500粒成熟水松种子统计发现,饱满种子172粒,种皮、外观与正常种子相似但没有胚或胚过小的“瘪粒种子”(图 6P)328粒,说明水松种子败育极为严重。
3 讨论3.1 水松大孢子发生和雌配子体发育裸子植物大孢子母细胞减数分裂形成四分体有3种方式:第1种是大孢子母细胞第1次减数分裂形成2个二分体,第2次分裂形成直列4个大孢子,其中靠近珠孔端的3个大孢子退化,合点端的大孢子发育为功能大孢子。太白红杉(Larix chinensis)(俞晓敏等,2004)、云南松(Pinus yunnanensis)(刘成运,1985)、樟子松(Pinus sylvestris var. mongolica)(田成玉等,2006)等属于这种类型。第2种是大孢子母细胞第1次分裂形成二分体,上面的二分体细胞停止分裂,下面的二分体细胞进行分裂,形成3个大孢子。乔松(Pinus wallichiana)、侧柏(Platycladus orientalis)(Maheshwari et al., 1967)等属于这种类型。第3种是大孢子母细胞减数分裂形成4个或3个大孢子,珠孔端大孢子不退化,几个大孢子同时发育,如白豆杉(Pseudotaxus chienii)(陈祖铿等,1979)。水松大孢子母细胞减数分裂属于第1种类型。
裸子植物雌配子体发育突出特征是雌配子体游离核时期较长。水松从进入雌配子体游离核到完全细胞化需2个月左右,这期间雌配子体游离核进行同步分裂,形成的雌配子体游离核数目成倍增加,细胞化雌配子体游离核数目为1 600~2 000(王伏雄,1952)。杉木亚科、台湾杉亚科、红杉亚科植物雌配子体游离核不进行同步分裂,雌配子体游离核数目不成倍增加。细胞化雌配子体游离核数目因物种不同而异,水杉(Metasequoia glyptostroboides)为1 764~1 872(王伏雄等,1964),柳杉(Cryptomeria fortunei)为3 000~4 000(刘洪谔等,1986),巨杉(Sequoiadendron giganteum)为6 000,台湾杉(Taiwania cryptomerioides)为 1 019~1 021,秃杉(Taiwania flousiana)为1 019~1 021(王伏雄等,1980; Williams,2009)。
裸子植物有单生型和复合型2种颈卵器类型。水松颈卵器聚集在一起(图 4H,I,J),为典型的柏科植物复合颈卵器类型,颈卵器和颈细胞的数目分别为6~17和4~6个。落羽杉属(Taxodium)颈卵器和颈细胞数目分别为12~20和4~6个、柳杉属(Cryptomeria)分别为13~37和4个、水杉属(Metasequoia)分别为8~11和4~6个、杉木属(Cunninghamia)分别为13~24和2个、巨杉属(Sequoiadendron)分别为50~60和4个、台湾杉属(Taiwania)分别为4~9和4个(于永福等,1996; Williams,2009)。生殖发育过程的简化是植物的演化趋势,游离核、颈卵器以及颈细胞数目多少在一定程度上反映了植物的进化状态(于永福等,1996)。据此分析,水松属与水杉属、落羽杉属、柳杉属和台湾杉属亲缘关系较近。
水松复合颈卵器与水杉属(王伏雄等,1964)、柳杉属(刘洪谔等,1986)、台湾杉属(胡玉熹等,1995)颈卵器一样,主要着生在雌配子体顶部(图 4I),偶尔着生于雌配子体侧面(图 4J)。落羽杉属、杉木属颈卵器为顶生,密叶杉属(Athrotaxis)、巨杉属和北美红杉属(Sequoia)为侧生(王伏雄等,1980)。颈卵器侧生可能是植物在进化过程中自身组织为适应环境而衍化出来的特化现象(王伏雄等,1964)。据此推测,水松属与水杉属、柳杉属和台湾杉属亲缘关系密切。
水松复合型颈卵器外周的双核套层细胞,结构非常特殊,与雄配子体中绒毡层细胞的结构特征(刘雄盛等,2014)非常相似。在合子发育为原胚期间,不像其他裸子植物那样完全包围在颈卵器外,只分布在复合颈卵器的中下部,具有明显极性分布特点(图 6D)。对云杉(Picea glauca×Picea engelmannii)(Owens et al., 1990)和加州山松(Pinus monticola)(Owens et al., 2000)颈卵器的结构与功能研究发现,在细胞间隙以及朝向颈卵器腔的细胞壁表面可以观察到许多分泌物质积累,颈卵器壁从套层细胞中吸收营养,套层细胞通过细胞壁的胞质通道与中央细胞或卵细胞进行交流,为其提供营养物质和信息来源。
裸子植物中央细胞一般在发育后期进行1次不均等分裂形成1个卵细胞和1个腹沟细胞,腹沟细胞形成不久后随即解体消失(王伏雄等,1964; 陈祖铿等,1980a; Pennell et al., 1988; Owens et al., 1990; 2000; 田成玉等,2006)。水松中央细胞发育过程与杉木(Cunninghamia lanceolata)、秃杉(王伏雄等,1980)相似,不分裂形成卵细胞和腹沟细胞,直接发育为成熟卵细胞。Friedman(1998)认为,腹沟细胞存在可能是一种较进化的性状。据此推测,水松属与杉木属、台湾杉属亲缘关系较近,为广义柏科中较为原始类群。
与白皮松(Pinus bungeana)(陈祖铿等,1982)和花旗松(Pseudotsuga menziesii)(Owens et al., 1991)一样,水松成熟卵细胞中出现大量内含物(图 4H,I)。柏木亚科、松柏亚科植物的成熟卵细胞中有一团浓稠的细胞质聚合物,这些聚合物由白色体、线粒体等细胞器组成(陈祖铿等,1980a)。穗花杉属(Amentotaxus)和三尖杉属(Cephalotaxus)植物卵细胞发育过程中,出现许多拟核仁颗粒星散分布,卵核下有成团的细胞质存在(陈祖铿等,1985)。这些现象说明针叶树雌配子体细胞中的内含物可能是其发育的主要营养物质(成小飞,1995)。
3.2 水松受精作用和胚发育裸子植物从传粉到受精时间间隔较长,松属(Pinus)植物需13个月左右,榧树属(Torreya)需3~4个月,红豆杉属(Taxus)需1~2个月,福建柏(Fokienia hodginsii)需2个月左右,北美乔柏(Thuja plicata)需3个月左右,白豆杉需1.5个月左右(陈祖铿等,1980b; 1982; 1985; Harrington et al., 2010)。水松撒粉期为2月中旬至3月初(刘雄盛等,2014),从传粉到受精大约4个月。
植物受精作用分为有丝分裂前和分裂后配子融合2种类型。被子植物一般属于有丝分裂前配子融合,大部分裸子植物属有丝分裂后配子融合(胡适宜等,1979)。三尖杉属、冷杉属(Abies)、油松(Pinus tabulaeformis)、欧洲黑松(Pinus nigra)、银杉(Cathaya argyrophylla)(王伏雄等,1974)以及白皮松(陈祖铿等,1982)等植物受精作用属有丝分裂后配子融合。与水杉、福建柏以及白豆杉一样,水松受精作用属于有丝分裂前配子融合类型,据此推测,水松属比松科(Pinaceae)、三尖杉科(Cephalotaxaceae)进化。
裸子植物颈细胞是雄配子进入颈卵器的通道,颈细胞结构是否保持完整可能与植物种类有关(田成玉等,2006)。崖柏属(Thuja)、短叶红豆杉(Taxus brevifolia)及云杉(Picea glauca×Picea engelmannii)颈细胞在花粉管进入颈卵器前自行解体(Runions et al.,1999)。水松与金松(Sciadopitys verticillata)(王頔等,2014)一样,受精作用过程中,颈细胞没有受到损伤(图 5A、5B)。颈细胞没有破坏被认为是较为古老的特征(王頔等,2014)。这进一步说明,水松在广义柏科中分类地位相对原始。
裸子植物受精作用一般发生在颈卵器中部,有丝分裂形成原胚游离核(陈祖铿等,1982; Pennell et al.,1988)。水松受精作用比较特殊,多数发生在颈卵器中部(图 5C,D,E),也可发生在颈卵器两端(图 5G)。精核与卵核融合前,精核的核仁发生解聚(图 5D)和复聚(图 5E),形成的合子大多数转移到合点端进行有丝分裂(图 6A)。这些特殊现象,在其他裸子植物中未见报道。
针叶树[南洋杉科(Araucariaceae)除外]原胚发育基本上分为2种类型。松科各属原胚发育属于松型原胚,罗汉松科(Podocarpaceae)、红豆杉科(Taxaceae)以及广义柏科中的柏木亚科、松柏亚科植物的原胚属于罗汉松型或称标准型,这是一种专化类型(陈祖铿等,1979)。水松原胚发育属于罗汉松型。
与三尖杉属植物、白豆杉和欧洲刺柏(Juniperus communis)一样(陈祖铿等,1979; Rohr et al., 1997; Gruwez et al., 2013),水松原胚柄层细胞伸长把初生胚细胞团推入雌配子体深处。
水杉属、巨杉属和金松属(Sciadopitys)原胚具有原胚柄和初生胚柄,红杉属只有初生胚柄没有原胚柄。水松属同台湾杉属、杉木属、柳杉属、落羽杉属一样,形成原胚柄但不形成初生胚柄(王伏雄等,1980)。
裸子植物原胚发育有简单多胚和裂生多胚2种类型。松属、银杉属(Cathaya)、雪松属(Cedrus)、油杉属(Keteleeria)、铁杉属(Tsuga)等多数针叶植物的多胚属裂生多胚(陈祖铿等,1982); 水松与云南油杉(Keteleeria evelyniana),落叶松属(Larix)、黄杉属(Pseudotsuga)、云杉属(Picea)、冷杉属(Abies)、金钱松属(Pseudolarix)植物(王伏雄等,1960; 1974; 陈祖铿等,1982; 李楠等,1996)一样,为简单多胚。对于裂生多胚的演化问题,存在2种对立的观点(于永福等,1996; 李楠等,1996)。
3.3 水松属系统地位水松与其他裸子植物雌性生殖构造的形态学比较表明,大孢子发生、雌配子体发育和胚形成等方面都表现出与许多广义柏科植物极相似之处。尤其是自由核数目,颈卵器类型、数目和位置,中央细胞发育方式,颈细胞不损伤、原胚发育特征,是对水松分类系统地位确定的有力补充。
基于水松与落羽杉球果形态特征极为相似,胚珠都起源于2个胚珠原基,Takaso等(1990)认为,它们有着密切的类群关系。水松茎次生韧皮部的显微结构分析表明,水松属与水杉属和落羽杉属有较近的亲缘关系(韩丽娟等,1997)。免疫学标记及雌球果、花粉特征研究表明,水松属、柏木属、金松属、落羽杉属、杉木属、柳杉属亲缘关系相近(Hart,1987; Price et al., 1989; Charles et al.,1999)。Tsumura等(1995)利用RFLP标记分析针叶树叶绿体DNA变异,证实水松属与金松属亲缘关系密切,与水杉属遗传距离相近。核型细胞学分析结果显示,水杉属、红杉属、巨杉属、落羽杉属、水松属亲缘关系很近(Schlarbaum et al., 1984; 李林初,1989; 1995)。基于叶绿体基因间隔序列rbcL(Gadek et al., 1993; Brunsfeld et al., 1994),matK,chlL,trnL-trnF IGS和trnL内含子标记(Kusumi et al., 2000),以及核基因组序列28S rRNA(李春香等,2003)探讨的广义柏科内各属关系不完全一致,但水松属与落羽杉属、柳杉属聚成一支系,红杉属、巨杉属、密叶杉属聚成一支系。
本研究根据水松雌配子体游离核数目、颈卵器类型和数目、颈细胞多少、颈卵器着生位置、中央细胞及原胚发育等特征综合分析表明,水松属与台湾杉属、柳杉属、水杉属、落羽杉属亲缘关系密切,与杉木属亲缘较近。这与大多数前人的研究结果基本一致。本研究为水松属系统地位的确定提供了胚胎学证据。
3.4 水松种子败育的可能原因王伏雄(1952; 1953)曾描述了水松雌配子体和胚发育过程,发现许多雌球果发育不正常,部分胚珠败育形成皱粒种子,作者将其归结为材料采集等原因(王伏雄,1952)。水松小孢子发育没有出现异常现象(刘雄盛等,2014),但本研究发现水松形成大量瘪粒种子。
引起针叶树种子败育因素很多,有性生殖过程各阶段,如,胚珠授粉不足、胚发育异常,早期或后期自交不亲和,以及种子成熟期病虫害等都可能引起(Owens et al., 2008)。雌配子体和胚发育不正常,经常产生保留着雌配子体或败育胚残迹的所谓“瘪粒种子”(Owens et al., 1998; 2008; Owens,2006; Garcǐa et al., 2000)。
一般认为,授粉不足是大多数针叶树种胚珠败育的主要原因,如,樟子松(王丽娟等,1993)、欧洲刺柏(Gruwez et al., 2013)、太平洋冷杉(Abies amabilis)(Owens et al., 1998)、欧洲云杉(Picea abies)(Owens et al., 2001)等树种。但由于授粉不足造成高达30%败育种子的针叶树并不多(Owens,1995; Owens et al., 1998)。多数广义柏科植物,没有受精的胚珠能继续正常发育,部分形成与正常种子外貌一样的瘪粒种子(Owens,1995; Gruwez et al., 2013)。
本研究发现,水松大孢子发生和雌配子体发育过程中虽然出现了一些异常现象,但整体上不影响水松雌配子体的正常发育,能形成正常的成熟卵细胞。这表明,水松雌配子体发育过程基本正常,授粉不足(图 5H,6D)可能是产生不育的瘪粒种子的主要原因。
为了进一步证实上述水松种子败育的可能机制,将对20世纪60年代种植在广东省斗门县水松人工林开展辅助授粉试验,比较人工辅助授粉与自然授粉的水松胚发育过程中显微结构,以探讨水松大量瘪粒种子产生的真实原因。
| [1] |
陈祖铿, 王伏雄. 1979. 白豆杉的配子体发育和受精作用. 植物学报, 21(1): 19-31. (Chen Z K, Wang F H. 1979. The gametophytes and fertilization in Pseudotaxus. Journal of Integrative Plant Biology, 21(1): 19-31[in chinese]).(  2) 2)
|
| [2] |
陈祖铿, 王伏雄. 1980a. 福建柏的配子体发育. 植物学报, 22(1): 6-22. (Chen Z K, Wang F H. 1980a. Development of gametophytes in Fokienia (Cupressaceae). Journal of Integrative Plant Biology, 22(1): 6-22[in chinese]).(  2) 2)
|
| [3] |
陈祖铿, 王伏雄. 1980b. 福建柏受精作用的研究. 植物学报, 22(3): 221-229. (Chen Z K, Wang F H. 1980b. Studies in fertilization of Fokienia. Journal of Integrative Plant Biology, 22(3): 221-229[in chinese]).(  1) 1)
|
| [4] |
陈祖铿, 王伏雄. 1982. 白皮松受精作用的研究. 植物学报, 24(1): 10-20. (Chen Z K, Wang F H. 1982. Fertilization in Pinus bungeana. Journal of Integrative Plant Biology, 24(1): 10-20[in chinese]).(  5) 5)
|
| [5] |
陈祖铿, 王伏雄. 1985. 穗花杉的胚珠结构与雌、雄子体的发育. 植物学报, 27(l): 19-25. (Chen Z K, Wang F H. 1985. The ovule structure and development of male and female gametophytes in Amentotaxus. Journal of Integrative Plant Biology, 27(l): 19-25[in chinese]).(  1) 1)
|
| [6] |
成小飞. 1995. 杉木胚胎选择期的淀粉动态及其种子败育. 林业科学, 31(6): 481-486. (Chen X F. 1995. Starch variation during the embryonic selection and embryo abortion in Cunninghamia lanceolata. Scientia Silvae Sinicae, 31(6): 481-486[in chinese]).(  1) 1)
|
| [7] |
高润梅. 2002. 珍稀濒危植物的胚胎学研究进展. 山西农业大学学报, 22(3): 139-245. (Gao R M. 2002. Study and improvement on embryology of rare and endangered plants. Journal of Shanxi Agricultural University, 22(3): 239-245[in chinese]).(  1) 1)
|
| [8] |
国家林业局野生动植物保护管理司, 中国科学院植物研究所. 2013. 珍稀濒危植物图鉴. 北京:中国林业出版社,114. (The Wildlife Conservation and Management Division of State Forestry Administration, Institute of Botany of the Chinese Academy of Sciences. 2013. Pictorial handbook of rare and endangered plants. Beijing: China Forestry Publishing House, 114.[in chinese])(  1) 1)
|
| [9] |
韩丽娟, 胡玉熹, 林金星, 等. 1997. 水松的次生韧皮部解剖及其系统位置的讨论. 植物分类学报, 35(6): 527-532. (Han L J, Hu Y S, Lin J X, et al. 1997. Anatomy of secondary phloem of Glyptostrobus pensilis in relation to its systematic position. Acta Phytotaxonomica Sinica, 35(6): 527-532[in chinese])..(  2) 2)
|
| [10] |
胡适宜, 朱澂. 1979. 高等植物受精作用中雄性核和雌性核的融合. 植物学报, 21(1): 1-10. (Hu S Y, Zhu C. 1979. The fusion of male and female nuclei in fertilization of higher plants. Journal of Integrative Plant Biology, 21(1): 1-10[in chinese]).(  1) 1)
|
| [11] |
胡玉熹, 林金星, 王献溥,等. 1995. 中国特有植物台湾杉的生物学特性及其保护. 生物多样性, 3(4): 206-212. (Hu Y S, Lin J X, Wang X P, et al. 1995. The biology and conservation of Taiwania cryptomerioides. Biodiversity Science, 3(4): 206-212[in chinese]).(  1) 1)
|
| [12] |
李春香, 杨群. 2003. 杉科、柏科的系统发生分析——来自28S rDNA序列分析的证据. 遗传, 25 (2): 177-180. (Li C X, Yang Q. 2003. Phylogenetic relationships among the genera of Taxodiaceae and Cupressaceae from 28S rDNA sequences. Hereditas, 25 (2): 177-180[in chinese]).(  4) 4)
|
| [13] |
李发根, 夏念和. 2004. 水松地理分布及其濒危原因. 热带亚热带植物学报, 12(1): 13-20. (Li F G, Xia N H. 2004. The geographical distribution and cause of threat to Glyptostrobus pensilis (Taxodiaceae). Journal of Tropical and Subtropical Botany, 12(1): 13-20[in chinese]).(  2) 2)
|
| [14] |
李林初. 1989. 杉科的细胞分类学和系统演化研究. 云南植物研究, 11(2): 113-131. (Li L C. Studies on the cytotaxonomy and systematic evolution of Taxodiaceae. Acta BotanicaYunnanica, 11(2): 113-131[in chinese]).(  2) 2)
|
| [15] |
李林初. 1995. 松科的核型和系统发育研究. 植物分类学报,33(5): 417-432. (Li L C. 1995. Studies on the karyotype and phylogeny of the Pinaceae. Acta Phytotaxonomica Sinica, 33(5): 417-432[in chinese]).(  1) 1)
|
| [16] |
李楠, 傅立国, 朱政德. 1996. 松科系统学研究(Ⅰ). 植物学通报, 16(1): 32-45. (Li N, Fu L G, Zhu Z D. 1996. Studies on systematic of the Family Pinaceae Lindl (I). Chinese Bulletin of Botany, 16(1): 32-45.[in chinese])(  1) 1)
|
| [17] |
李正理. 1987. 植物制片技术. 2版. 北京: 科学出版社, 10-15. (Lee C L. 1987. Plant sectioning techniques. 2nd ed. Beijing: Science Press, 10-15.[in chinese])(  1) 1)
|
| [18] |
刘成运. 1985. 云南松雌配子体的发育. 云南植物研究,7(2): 210-216. (Liu C Y. 1985. Development of the male and female gametophytes in Pinus yunnanensis. Acta Botanica Yunnanica, 7(2): 210-216.[in chinese])(  1) 1)
|
| [19] |
刘洪谔, 吴夏明. 1986. 柳杉的胚胎发育. 植物学报,28(3): 256-261. (Liu H E, Wu X M. 1986. The embryogeny of Cryptomeria fortunei. Journal of Integrative Plant Biology, 28(3): 256-261[in chinese]).(  2) 2)
|
| [20] |
刘雄盛, 徐刚标, 梁文斌, 等. 2014. 濒危植物水松小孢子发生和雄配子体发育的研究. 植物科学学报, 32(1): 58-66. (Liu X S,Xu G B,Liang W B,et al. 2014. Studies on microsporogenesis and development of male gametophytes in endangered species Clyptostrobus pensilis. Plant Science Journal, 32(1): 58-66[in chinese]).(  4) 4)
|
| [21] |
斯缨, 王日韦, 龚复俊, 等. 2003. 水松叶的总黄酮含量研究. 武汉植物学研究, 21(6): 547-549. (Si Y, Wang R W,Gong F J, et al. 2003. Study on the total flavonoids content in leaves of Glyptostrobus pensilis. Journal of Wuhan Botanical Research, 21(6): 547-549[in chinese]).(  1) 1)
|
| [22] |
田成玉, 赵春建, 李春英, 等. 2006. 樟子松大孢子的发生和雌配子体的形成过程. 植物研究, 26(6): 672-675. (Tian C Y, Zhao C J, Li C Y, et al. 2006. The emergence of macrospore and formation of female gametophyte in Pinus sylvestris var. mongolica. Bulletin of Botanical Research, 26(6): 672-675[in chinese]).(  3) 3)
|
| [23] |
王頔, 王莉. 2014. 颈卵器植物颈细胞结构与功能的研究进展. 西北植物学报, 34(5): 1067-1074. (Wang D, Wang L. 2014. Structure and function of neck cells in archegoniate. Acta Botanica Boreali-Occidentalia Sinica, 34(5): 1067-1074[in chinese]).(  2) 2)
|
| [24] |
王伏雄, 陈祖铿. 1974. 银杉的胚胎发育. 植物学报, 16(1): 62-69. (Wang F H, Chen Z K. 1974. The embryogeny of Cathaya (Pinaceae). Journal of Integrative Plant Biology, 16(1): 62-69[in chinese]).(  1) 1)
|
| [25] |
王伏雄, 李宪章, 陈祖铿. 1980. 秃杉的胚胎发育及其与杉科各属的比较. 植物分类学报, 18(2): 129-137. (Wang F H, Lee S C, Chen Z K. 1980. The embryogeny of Taiwania in comparison with that of other genera of Taxodiaceae. Acta Phytotaxonomica Sinica, 18(2): 129-137.[in chinese])(  4) 4)
|
| [26] |
王伏雄, 钱南芬. 1964. 水杉的胚胎发育. 植物学报, 12(3): 241-262. (Wang F H, Chien N F. 1964. Embryogeny of Metasequoia. Journal of Integrative Plant Biology, 12(3): 241-262[in chinese]).(  4) 4)
|
| [27] |
王伏雄, 杨联芳. 1960. 云南油杉初期胚胎的发育. 植物学报, 9(2): 153-157. (Wang F H, Yang L F. 1960. The early embryogeny of Keteleeria. Journal of Integrative Plant Biology, 9(2): 153-157[in chinese]).(  1) 1)
|
| [28] |
王伏雄. 1952. 水松的配子体. 植物学报, 1(1): 8-17. (Wang F H. 1952. The gametophytes of Glyptostrobus. Journal of Integrative Plant Biology, 1(1): 8-17[in chinese]).(  3) 3)
|
| [29] |
王伏雄. 1953. 水松后期胚胎发育. 植物学报, 2(3): 470-475. (Wang F H. 1953. Late embryogeny of Glyptostrobus. Journal of Integrative Plant Biology, 2(3): 470-475[in chinese]).(  1) 1)
|
| [30] |
王丽娟, 衣俊鹏, 车延江. 1993. 樟子松种子败育与形态解剖的研究. 东北林业大学学报, 21(4): 107-111. (Wang L J, Yi J P, Che Y J. 1993. Seeds abortion and morph-anatomy on Pinus sylvestris var. mongolica. Journal of Northeast Forestry University, 21(4): 107-111[in chinese]).(  1) 1)
|
| [31] |
吴则焰, 刘金福, 洪伟, 等. 2012a. 孑遗植物水松不同年龄级种群遗传多样性的ISSR分析. 生态学杂志, 31(8) : 1911-1916. (Wu Z Y, Liu J F, Hong W, et al. 2012a. Genetic diversity of different life stage population of Glyptostrobus pensilis,an endangered plant in China: ISSR analysis. Chinese Journal of Ecology, 31(8): 1911-1916[in chinese]).(  1) 1)
|
| [32] |
吴则焰, 刘金福, 洪伟, 等. 2012b. 水松扦插繁殖体系研究. 中国农学通报, 28(22): 22-26. (Wu Z Y, Liu J F, Hong W, et al. 2012b. The study on the cutting propagation of Glyptostrobus pensilis. Chinese Agricultural Science Bulletin, 28(22): 22-26[in chinese]).(  1) 1)
|
| [33] |
徐明堂, 何春年, 张秀智, 等. 2008. 苏木精染液的配制及染色方法的改进. 临床与实验病理学杂志, 24(3): 371-372. (Xu M T, He C N, Zhang X Z, et al. 2008. Improvement of the preparation and staining of hematoxylin stain. Journal of Clinical and Experimental Pathology, 24(3): 371-372[in chinese]).(  1) 1)
|
| [34] |
杨永, 傅德志. 2001. 松杉类裸子植物的水孢子叶球理论评述. 植物分类学报,39(2): 169-191. (Yang Y, Fu D Z. 2001. Review on the megastrobilus theories of conifers. Acta Phytotaxonomica Sinica, 39(2): 169-191[in chinese]).(  2) 2)
|
| [35] |
于永福, 傅立国. 1996. 杉科植物的系统发育分析. 植物分类学报, 34(2): 124-141. (Yu Y F, Fu L K. 1996. Phylogenetic analysis of the family Taxodiaceae. Acta Phytotaxonomica Sinica, 34(2): 124-141[in chinese]).(  3) 3)
|
| [36] |
于永福. 1995. 杉科植物的起源、演化及其分布. 植物分类学报, 33(2): 369-389. (Yu Y F. 1995. Origin, evolution and distribution of the Taxodiaceae. Acta Phytotaxonomica Sinica, 33(2): 369-389[in chinese])..(  1) 1)
|
| [37] |
俞晓敏, 赵桂仿. 2004. 太白红杉雌配子体的形成、受精、胚胎发育及其系统学意义. 西北植物学报, 24(6): 1024-1034. (Yu X M, Zhao G F. 2004. Female gametogeny, fertilization, embryogeny of Larix chinensis and its systematic significance. Acta Botanica Boreali-Occidentalia Sinica, 24(6): 1024-1034[in chinese]).(  1) 1)
|
| [38] |
Averyanov L V, Phan K L, Nguyen T H,et al. 2009. Preliminary observation of native Glyptostrobus pensilis (Taxodiaceae) stands in Vietnam. Taiwania, 54(1): 1-22.( 1) 1)
|
| [39] |
Brunsfeld S J, Soltis P S, Soltis D E,et al. 1994. Phylogenetic relationships among the genera of the Taxodiaceae and Cupressaceae: Evidence from rbcL sequences. Systematic Botany, 19(2): 253-262.( 2) 2)
|
| [40] |
Charles N, Miller J R. 1999. Implications offossil conifers for the phylogenetic relationships of living families. The Botanical Review, 65(3): 239-77.( 1) 1)
|
| [41] |
Friedman W E. 1998. The evolution of double fertilization and endosperm: an "historical" perspective. Sexual Plant Reproduction, 11(1): 6-16.( 1) 1)
|
| [42] |
Gadek P A, Quinn C J. 1993. An analysis of relationships within the Cupressaceae sensu stricto based on rbcL sequences. Annals of the Missouri Botanical Garden, 80(3): 581-586.( 3) 3)
|
| [43] |
Gadek P A, Alpers D L, Heslewood M M,et al. 2000. Relationships within Cupressaceae sensu lato: a combined morphological and molecular approach. American Journal of Botany, 87(7): 1044-1057.( 2) 2)
|
| [44] |
Garcǐa D, Zamora R, Gǒmez J M,et al. 2000. Geographical variation in seed production, predation and abortion in Juniperus communis throughout its range in Europe. Journal of Ecology, 88(3): 436-446.( 2) 2)
|
| [45] |
Gruwez R, Leroux O, De Frenne P. 2013. Critical phases in the seed development of common juniper (Juniperus communis). Plant Biology, 15(1): 210-219.( 4) 4)
|
| [46] |
Harrington C A, Devine W D. 2010. Stand development following precommercial thinning and fertilization treatments in a western red cedar (Thuja plicata) dominated forest. Canadian Journal of Forest Research, 41(1): 151-164.( 1) 1)
|
| [47] |
Hart J A. 1987. A cladistic analysis of conifers: Preliminary results. Journal of the Arnold Arboretum, 68(3): 269-307.( 2) 2)
|
| [48] |
Kusumi J, Tsumura Y, Yoshimaru H,et al. 2000. Phylogenetic relationships in Taxodiaceae and Cupressaceae sensu stricto based on matK gene, chlL gene, trnL-trnF IGS region, and trnL intron seqences. American Journal of Botany, 87(10): 1480-1488.( 2) 2)
|
| [49] |
Kusumi J, Tsumura Y, Yoshimaru H,et al. 2002. Molecular evolution of nuclear genes in Cupressaceae, a group of conifer trees. Molecular Biology Evolution, 19(5): 736-747.( 1) 1)
|
| [50] |
Li F G, Xia N H. 2005. Population structure and genetic diversity of an endangered species,Glyptostrobus pensilis (Cupressaceae). Botanical Bulletin Academia Sinica, 46(2): 155-162.( 1) 1)
|
| [51] |
Maheshwari P, Singh H. 1967. The female gametophyte of gymnosperms. Biological Review, 42(1): 88-129.( 1) 1)
|
| [52] |
Owens J N, Johnsen Ø, Dæhlen O G,et al. 2001. Potential effects of temperature on early reproductive development and progeny performance in Picea abies (L.[in chinese]) Karst. Scandinavian Journal of Forest Research, 16(3): 221-237.( 1) 1)
|
| [53] |
Owens J N, Kittirat T, Mahalovich M F. 2008. Whitebark pine (Pinus albicaulis Engelm.[in chinese]) seed production in natural stands. Forest Ecology and Management, 255: 803-809.( 1) 1)
|
| [54] |
Owens J N. 2006. The reproductive biology of lodgepole pine. Victoria, BC: Forest Genetics Council of BC, Ext. Note 07.( 2) 2)
|
| [55] |
Owens J N, Bruns D. 2000. Western white pine (Pinus monticola Dougl.[in chinese]) reproduction: I. Gametophyte development. Sexual Plant Reproduction, 13 (2): 61-74.( 1) 1)
|
| [56] |
Owens J N, Morris S J. 1990. Cytological basis for cytoplasmic inheritance in Pseudotsuga menziesii. I. Pollen tube and archegonia development. American Journal of Botany, 77(4): 433-445.( 2) 2)
|
| [57] |
Owens J N, Morris S J. 1991. Cytological basis for cytoplasmic inheritance in Pseudotsuga menziesii. II. Fertilization and proembryo development. American Journal of Botany, 78(12): 1515-1527.( 2) 2)
|
| [58] |
Owens J N, Morris S J. 1998. Factors affecting seed and cone development in Pacific sliver fir (Abies amabilis). Canadian Journal of Forest Research, 28(8): 1146-1163.( 4) 4)
|
| [59] |
Owens J N. 1995. Constraints to seed production: temperate and tropical forest trees. Tree Physiology, 15(7/8): 447-484.( 2) 2)
|
| [60] |
Pennell R L, Bell P R. 1988. Insemination of the archegonium and fertilization in Taxus baccata L. Journal of Cell Science, 89(4): 551-560.( 1) 1)
|
| [61] |
Price R A, Lowenstein J M. 1989. An immunological comparison of the Sciadopityaceae, Taxodiaceae, and Cupressaceae. Systematic Botany, 14(2): 141-149.( 2) 2)
|
| [62] |
Rohr R, Piola F, Pasquier P. 1997. Somatic embryogenesis in Cephalotaxus harringtonia embryo-megagametophyte co-culture. Journal of Forest Research, 2(2): 69-73.( 1) 1)
|
| [63] |
Runions C J, Owens J N. 1999. Sexual reproduction of interior spruce (Pinaceae). I. Pollen germination to archegonial maturation. International Journal of Plant Science, 160(4): 641-652.( 1) 1)
|
| [64] |
Schlarbaum S E, Tsuchiya T. 1984. The chromosomes of Cunninghamia konishii, C. lanceolata, and Taiwania cryptomerioides (Taxodiaceae). Plant Systematics and Evolution, 145(3): 169-181.( 2) 2)
|
| [65] | Sigh V P. 2006. Gymnosperm (naked seeds plant) structure and development. Delhi:Prabhat Kumar Sharma for Sarup & Sons, 445-453. |
| [66] |
Takaso T, Tomlinson P B. 1990. Cone and ovule ontogeny in Taxodium and Glyptostrobus (Taxodiaceae-Coniferales). American Journal of Botany, 77(9): 1209-1221.( 2) 2)
|
| [67] |
Tam N M, Duy V D, Xuan B T T,et al. 2013. Genetic variation and population structure in Chinese water pine (Glyptostrobus pensilis): A threatened species. Indian Journal of Biotechnology, 12(4): 499-503.( 2) 2)
|
| [68] |
Tsumura Y, Yoshimura K, Tomaru N. 1995. Molecular phylogeny of conifers RFLP analysis of PCR-amplified specific chloroplast genes. Theoretical and Applied Genetics, 91(8): 1222-1236.( 2) 2)
|
| [69] |
Williams C G. 2009. Coniferreproduction biology. Springer-Verlag New York Inc., 63-65.( 2) 2)
|
 2015, Vol. 51
2015, Vol. 51
