文章信息
- 郑翠芳, 陈晓倩, 陈友铃, 王爱芳, 王钊, 吴文珊
- Zheng Cuifang, Chen Xiaoqian, Chen Youling, Wang Aifang, Wang Zhao, Wu Wenshan
- 福州笔管榕传粉生物学特征
- Pollination Biology of Ficus superba var. japonica in Fuzhou
- 林业科学, 2015, 51(5): 28-36
- Scientia Silvae Sinicae, 2015, 51(5): 28-36.
- DOI: 10.11707/j.1001-7488.20150504
-
文章历史
- 收稿日期:2014-04-18
- 修回日期:2015-03-25
-
作者相关文章
榕树是榕属(Ficus)植物的统称,广泛分布于美洲、非洲、亚洲和大洋洲的热带、亚热带地区。目前全世界已知的榕树约有750种(Berg,1989),我国约有100种(张秀实等,1998)。榕树依赖其专属的榕小蜂为其传粉,同时传粉小蜂也需要在榕果的雌花子房内产卵才能繁衍后代,两者之间已形成了互惠共生、高度统一的协同进化关系(杨大荣等,1999)。
笔管榕(Ficus superba var. japonica)为榕属落叶乔木,雌雄同株,其榕果单生或成对腋生或簇生于叶腋,有时也生于主干上,形成“老茎生花”的景观,榕果球形,表面有白色圆斑点,成熟时红色或紫色,有长约5 mm的梗。笔管榕分布于缅甸、泰国、中南半岛诸国、马来西亚至日本琉球,在我国分布于台湾、福建、广东、广西、浙江、海南、云南南部等地(张秀实等,1998)。目前,榕树传粉生物学是当今植物生殖生物学研究的一个热点,榕树为榕小蜂提供具生态保护作用的栖息场所和生长发育必须的营养物质,榕小蜂为榕树传粉,二者是植物和昆虫间高度专一化的互惠共生伙伴,这为生殖生物学领域的诸多问题提供了优良的试验模型。国内外学者在榕树繁殖生物学方面已开展大量的研究(李宏庆等,2001; 杨大荣等,2001; 陈勇等,2003; Shi et al., 2006; Yu et al., 2008; Dunn et al., 2008; Peng et al., 2009; 张媛等,2010; Elias et al., 2012; 吴文珊等,2013),但关于笔管榕的繁殖特征的研究尚未见有相关报道,仅Yeo(2007)和Yeo等(2009)对分布于新加坡地区的笔管榕的原变种Ficus superba进行了榕果发育和落叶的物候观察,研究了传粉小蜂可能的飞行距离,并探讨了榕果发育和落叶的关系,以及气候因子对挂果、落叶以及传粉率的影响,此外,有少量关于笔管榕榕果内共寄生的榕小蜂的相关研究(Grandi, 1923; Wiebes,1977; Ishii,1934; 冯贵,2010)。笔者试验室自2010年起,定期对分布在福州地区的笔管榕榕果内的榕小蜂进行采集与鉴定,发现福州地区的笔管榕榕果内的榕小蜂种类极为丰富,它们隶属于小蜂总科中的5个科(亚科)7个属的7个种: 笔管榕的传粉小蜂为榕小蜂科(Agaonidae)的Platyscapa ishiiana,其余6种为非传粉小蜂,分别属于金小蜂科(Pteromalidae)的Otitesella ako和Philotrypesis sp.、广肩小蜂科(Eurytomidae)的Sycophila sp、隐针榕小蜂亚科(Epichrysomallinae)的Acophila mikii和Sycobiomorpha sp.,以及数量稀少的姬小蜂科(Eulophidae)的Aprostocetus sp.(陈晓倩等,2013)。本试验对福州地区笔管榕的发育周期、年动态变化、花序的形态结构、单果进蜂量及结实率、成瘿率进行了系统的研究与阐述,以期了解笔管榕的基本繁殖生物学特性,为榕-蜂协同共生研究提供基础资料。
1 材料与方法 1.1 试验材料用于试验的榕果采集自福州市区,分别为样地A: 福州旗山(26°3′30″ N,119°18′49″ E),有样株17棵(标记为A1-A17); 样地B: 福州鼓楼区(26°3′30″ N,119°18′49″ E),有样株5棵(标记为B1-B5); 样地C: 福州台江区(26°3′11″ N,119°18′52″ E),样株5棵(标记为C1-C5); 样地D: 仓山区(26°2′28″ N,119°18′51″ E),样株3棵(标记为D1-D3)。总计30株样本,树龄在30年以上,榕果内共生或寄生了多种昆虫,均隶属于膜翅目(Hymenoptera)、细腰亚目(Apocrita)、小蜂总科(Chalcidoidea)。样地平均海拔83.4 m,全年冬短夏长,温暖湿润,属于海洋性亚热带季风气候。
1.2 试验方法从2011年7月—2012年7月,对30株笔管榕进行每周1次的定时、定点标记观察,记录笔管榕榕果的年发育状况,记录各个发育时期花序的直径、颜色及发育状况; 记录样株上叶子的生长状态(Peng et al., 2009): 1.0(开始衰老脱落的叶子),1.5(衰老脱落的叶子+新生红色叶子萌发),2.0(新生的红色叶子或未成熟的绿叶),3.0(成熟的绿叶)。开展雌花期单果进蜂量调查,在2011年7月(2批次)和11月,以及2012年4月,共4批次采集正处于间花期初期的笔管榕榕果,每批采摘40个以上的榕果带回实验室,详细统计进入到每个花序腔内的传粉小蜂数量,观察记录小蜂的损伤状况,并在体视显微镜下测量传粉小蜂产卵器长度。利用SPSS 17.0软件对所调查数据进行统计分析。根据福州市气象台提供的资料绘制2011年7月—2012年7月间福州地区的月均气温、月总降水量和月总日照数变化图(图 1)。利用数码相机(Olympus μ1060)和体视显微镜(Nikon SMZ800),对笔管榕各个时期的花序进行解剖观察拍照,观察花序苞口的形态结构; 观察雌花期榕果内的雌花类型及分层状况,并统计数量。观察雄花期雄花分布方式,并统计数量。
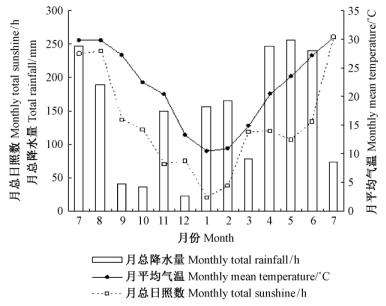 |
图 1 福州地区全年的月均气温,月总降水量和日照数变化 Fig. 1 The monthly average temperature,monthly total precipitation and sunshine in one year in Fuzhou |
通过对笔管榕植株1年的观察,参照Galil等(1968)的标准,将笔管榕榕果的发育时期划分以下5个时期:
雌前期(pre-female phase): 此期为花序芽形成,花原基不断发育至雌花发育成熟,苞片通道开放之前。小果单生或成对腋生或簇生于叶腋及老枝或主干上,果皮绿色,表面有白色圆斑点,基生苞片3枚,榕果苞口紧闭,雌花柱头光滑,末端钝尖,互相不粘连(图 2A)。此期一般1~3周左右,最长可达1个月。
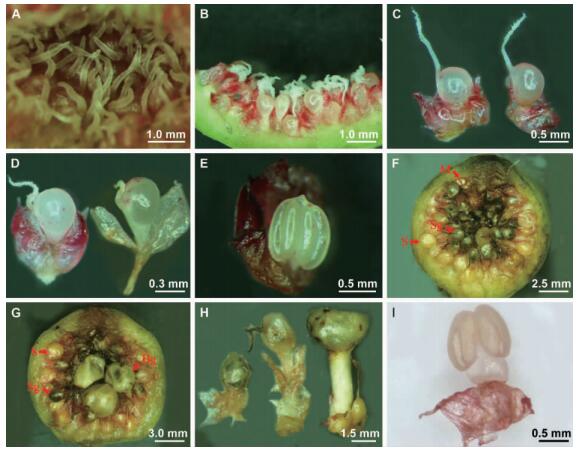 |
图 2 笔管榕花序和花的形态结构 Fig. 2 The morphologica structure of the syconia and flower of Ficus superba var.japonicaA.雌前期雌花花柱与柱头; B.雌花期雌花子房分层; C.雌花期I型雌花(左)和Ⅱ型雌花(右); D.雌花期Ⅲ型雌花(左)和Ⅳ型雌花(右); E.间花期雄花; F.均为小虫瘿的榕果; G.具大、小虫瘿的榕果; H.雄花期大、小虫瘿比较; I.雄花期雄花. S.种子; M.雄花; Bg.大虫瘿; Sg.小虫瘿。A.Style and stigma in pre-female phase; B.Female ovary position in female phase; C.I-type flower(left) and Ⅱ-type flower(right)in female phase; D.Ⅲ-type flower(left) and Ⅳ-type flower(right)in female phase; E.Male flower in inter-floral phase; F.The syconium in inter-flower phase,with small galls; G.The syconium in inter-flower phase,with big galls and small galls; H.Big galls and small galls in male phase; I.Male flower in male phase. S.Seed; M.Male flower; Bg.Big galls; Sg.Small galls |
雌花期(female phase): 雌花已发育成熟,苞口最外层苞片上翘,苞片通道打开,传粉榕小蜂进入榕果传粉(或产卵),此期以榕果苞口再次关闭为结束标志。榕果直径约为8.73 mm(SD=0.91,n=27),果皮绿色,基部苞片宿存。雌花200±38朵(n=17),雌花花被2~3裂,粉红色或红色,柱头呈羽毛状,大多相互粘连(图 2B)。根据雌花有无花柄和子房柄,以及花柱的长短,可以分为4种类型: I型花(长花柱无花柄无子房柄,图 2C,左),Ⅱ型花(长花柱无花柄具子房柄,图 2C,右),Ⅲ型花(短花柱无花柄具子房柄,图 2D,左),Ⅳ型花(短花柱具花柄和子房柄,图 2D,右)。雌花的花柄(含子房柄)越短,其花柱(含柱头)的长度越长,反之亦然,这使雌花柱头基本处于一个平面上(图 2B)。此期腔内有较大的空隙。雌花期榕果一旦有传粉小蜂进入,雌花期就很快结束,但在没有传粉小蜂状态下,榕果雌花期可达2~3周左右。
间花期(inter-floral phase): 果皮绿色或者微红色,苞口最外层苞片重新闭合,雄花开始发育(图 2E)。柱头逐渐枯萎脱落,被授粉的雌花子房开始膨大并硬化,由乳白色渐变成黄色,形成种子; 被产卵的雌花子房膨大形成虫瘿,不同种类的榕小蜂在榕树雌花子房内产卵所形成的虫瘿的大小是不同的,其中传粉小蜂和Philotrypesis sp.、Otitesella ako、Sycobiomorpha sp.产卵后形成的虫瘿较小,直径0.8~1.5 mm(图 1F),而Acophila mikii和Sycophila sp.小蜂产卵后形成的虫瘿较大,直径1.5~2.3 mm(图 1G)。随着小蜂发育日渐成熟,虫瘿由乳白色逐渐变成黄色或黄褐色; 未被传粉或产卵的雌花则停止发育,逐渐枯萎,形成败育花。间花期持续时长一般在3~4周左右,但在夏季间花期可短至1~2周,冬季则长达2个月左右。
雄花期(male-phase): 此期以雄花发育成熟(图 1I),榕小蜂羽化,携带花粉出飞为标志。此期榕果的直径约13.82 mm(SD=2.46,n=35),果皮变软,为绿色泛白或深粉红色,成熟雄花半集生分布,相对集中于近苞口的一侧。榕果内花药/胚珠比(anthers/ovules ratio,A/O ratio)为0.17(SD=0.07,n=65),大于0.16(Kjellberg et al., 2001)。虫瘿内小蜂发育成熟,雄蜂从虫瘿内掘孔爬出,有些雄峰寻找内有雌蜂的虫瘿,咬开虫瘿与雌蜂交尾,有些雄蜂则在苞口处开凿出蜂口。此后雄蜂大多留在榕果内直至死亡,雌蜂通过出蜂口飞离榕果,寻找处于雌花期的榕果并为其传粉或产卵。种子成熟呈黄色。此期约1~2周左右。
花后期(post-floral phase): 此期从小蜂出飞结束到榕果腐烂落地为止。果皮软化膨大,果皮呈白色、红色或紫色。多数笔管榕榕果在小蜂出飞后旋即脱落,少数在树上保持1~2周左右,在1~3月甚至可保持4~6周。此期榕果常被其他动物取食,从而使其种子可以传播到更远的地方。 2.2 榕果发育的年动态变化
对福州市区30株笔管榕榕果发育周期进行全年跟踪观察,结果表明: 笔管榕的结实批次是0~5次不等,其中1年结实1~2次的植株数量最多,占53.34%,而结5次果的株数最少,仅占6.67%; 有10%的植株在这1年中没有结实。从27株(除去3株未结实样株)笔管榕榕果的年动态变化图(图 3)中可知: 在福州市区1年中的任何月份都能看到笔管榕挂果,挂果株数4至十几株不等。在日照长、温度高的春季(3—5月)与夏季(7—10月)为挂果的高峰期,榕果发育明显快,其发育周期(A-E期)仅需要1~2个月; 在日照短、温度低的冬季(11月至次年的2月),果芽的形成数量少且发育减缓,榕果的发育期时长延长,需2~5个月。各发育期中,C期时长变化最为明显,C期时长短则15天,长则可达60天。降水量对笔管榕榕果发育没有明显的影响。榕果发育株内同步,株间有时同步,有时异步(图 3),在单株笔管榕上通常难以看到不同发育期交叠的现象。样株A4,A17,C4,C5各有一批榕果在发育早期夭折(图 3),可能是由于没有传粉小蜂进入B期榕果,或进入榕果腔内的传粉小蜂活性不强(比如小蜂在出飞时遇到雨季),授粉或产卵的数量少,从而出现落果现象。
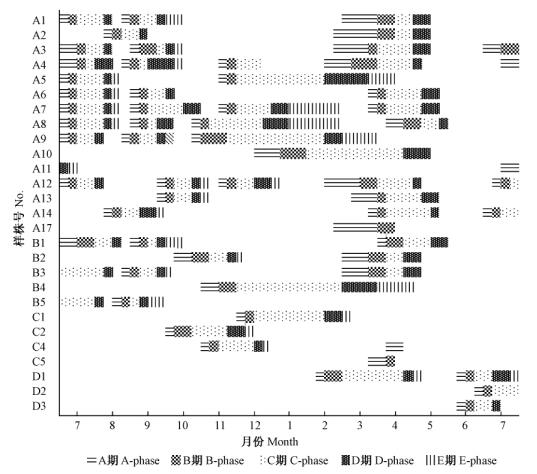 |
图 3 笔管榕榕果发育的年动态变化 Fig. 3 The dynamic changes of fig development of F.superba var. japonica in one year |
从图 4可知:笔管榕是落叶乔木,每年单株笔管榕一般发生1~2次换叶(少数植株3次)。冬末春初(2—4月)和夏末秋初(8—10月)是笔管榕落叶的高峰期,同时也是笔管榕长出新叶的高峰期,新叶一般在落叶后1~2周内萌发。叶的萌发、脱落与榕果萌发之间存在4种关系: 1)约43%批次的榕果在叶期内萌发; 2)约24%批次的榕果在其发育结束后,榕树开始落叶,表明榕果发育需要叶通过光合作用源源不断地提供营养成分; 3)约19%批次的榕果在榕树落叶后,伴随着新叶的萌发而萌发,新叶的光合作用能力比老叶更强,可为榕果发育提供充足的养分; 4)约14%批次的落叶,没有伴随榕果发育,榕树常出现连续不断的小部分换叶,这样避免了榕树叶量的大幅度变化,为榕树常年挂果提供了良好的物质基础。笔管榕的叶子和榕果的发育物候显示,叶片对榕果的发育有重要作用,基本上遵循“先叶后果”发育规律,叶为榕果发育提供坚实营养保障。
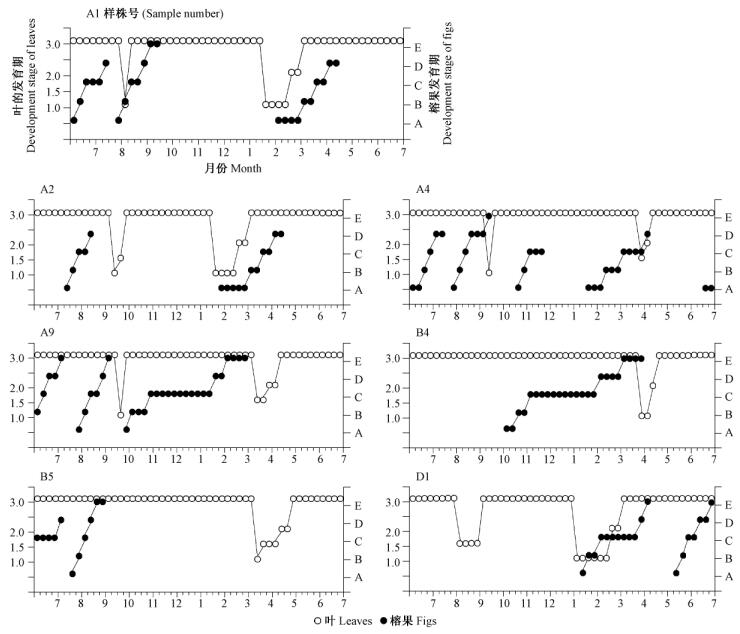 |
图 4 2011—2012年笔管榕的叶子和榕果的发育物候 Fig. 4 The phenology of leaf and syconium production by F.superba var. japonica from 2011-2012 |
分4批次,共观察统计了208个C前期榕果中的传粉小蜂进蜂数量(表 1),结果表明: 笔管榕雌花期榕果的进蜂量为0~6只不等,93.27%的榕果有传粉小蜂进入,在已进蜂的榕果中,进蜂1~3只的榕果占88.94%。笔管榕榕果较小但数量多,果期较整齐,其雌花期单果进蜂数量少,但榕果进蜂率高,表明同期出飞的大量的传粉小蜂,能够合理分散进入数量较多的榕果,既保证了榕果有限的雌花资源得到有效利用,也避免因大量小蜂涌入同一榕果造成的通道堵塞和互相打斗,大幅提高了传粉小蜂的传粉和产卵效率。
|
|
观察进入208个C前期花序中的388只传粉小蜂发现,其躯体均有不同程度的伤残: 97.68%的小蜂双翅脱落,83.76%的小蜂触角折断,其次三对足有较为明显的损伤(前足、中足和后足的损伤率分别为22.9%,5.67%和1.29%)。传粉小蜂的触角和双翅的残缺,对小蜂进入榕果后的产卵行为没有明显的影响,但足的损伤可能降低小蜂的传粉效率。
2.5 雌花花柱长度与产卵器长度之间的关系笔管榕雌花花柱(包含柱头)长度主要分布范围在0.40~1.20 mm之间,而传粉小蜂的产卵器长度变幅较小,长度分布范围为1.10~1.60 mm(图 5),传粉小蜂产卵器的平均长度显著长于雌花花柱的平均长度(Mann-Whitney U,U=23.0,P<0.001),表明笔管榕传粉榕小蜂产卵器可达到绝大部分的雌花子房。
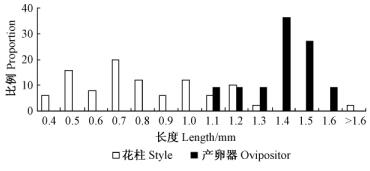 |
图 5 产卵器及花柱长度分布 Fig. 5 Distribution of the style and ovipositor length |
新加坡地区的笔管榕单株每年结果平均4次,榕果发育时长(A-E期)约7~8周,花序芽萌发无季节性(Yeo et al., 2009)。但福州地区的笔管榕,单株每年结果以1~2次为主,榕果发育时长因季节而异,在日照长、温度高的春夏季为挂果的高峰期,榕果发育周期仅需要1~2个月; 在日照短、温度低的冬季,果芽的形成数量少且发育期延长,需2~5个月,仅C期发育就需要近60天。福州和新加坡两地的笔管榕每株每年均要发生1至数次的换叶,但新加坡笔管榕的换叶无季节性,而福州笔管榕的换叶期呈明显的季节性。由此可见,与新加坡地区的笔管榕比较,福州地区的笔管榕榕果发育的物候特征具明显的季节性。榕果发育的季节性变化是榕-蜂发育对季节性气候的适应,在日照长、温度高的季节,榕-蜂发育期缩短,繁殖效率高; 在日照短、温度低的季节,榕-蜂发育期延长,以便度过不良环境。
与福州地区其他雌雄同株小果型榕树比较,例如大叶榕(F. virens)(陈友铃等,2012)、细叶榕(F. microcarpa)(吴文珊等,2013)等,它们的榕果发育的物候特征是相似的,但细叶榕榕果发育株内异步,即榕果发育周期交叠频繁。榕果发育株内异步有利于雄花期出飞的传粉小蜂能就近找到产卵场所,有效保证了榕树和小蜂的繁殖率; 若株内同步,由于榕果发育株间多异步,故一般情况下,也不会造成榕树和小蜂的繁殖率下降,但在种群小、植株个体分散、气候恶劣条件下,榕果因缺乏传粉小蜂,小蜂因寻找不到合适的产卵场所,双方都难以繁衍后代。
3.2 雌花花柱长度与产卵器长度之间的相关性雌雄异株榕树的雌花花柱(含柱头,下同)呈双峰分布(陈艳等,2010),即雌果中的雌花花柱长,多呈鞭状; 雄果中的雌花无雌性功能,特称瘿花,其花柱短,多呈喇叭状。传粉小蜂产卵器的平均长度一般是长于雄果内雌花(瘿花)花柱平均长度,短于雌果内雌花花柱平均长度,产卵器一般都可以到达瘿花子房,如粗叶榕(F. hirta)(于慧等,2004)、歪叶榕(F. cyrtophylla)(石章红等,2006)、木瓜榕(F. auriculata)(杨培等,2009)、斜叶榕(F. tinctoria)、鸡嗉子榕(F. semicordata)(马文娟等,2009)。雌雄异株的榕树雄果内,由于瘿花花柱短、柱头呈喇叭状,以及较为平整的产卵平台,便于小蜂传粉,故榕果的成瘿率较高。
雌雄同株榕树的雌花花柱呈单峰分布,即榕果内雌花花柱有长有短,花柱长度呈渐变变化,将花柱相对短的雌花称为短花柱雌花,花柱相对长的称为长花柱雌花。目前,关于雌花花柱长度与产卵器长度之间的相关性的研究结果表明,有些传粉小蜂产卵器长度的分布多集中于雌花花柱长度的分布范围内,即产卵器能到达短花柱雌花以及部分长花柱雌花的子房(到达率40%~85%),如垂叶榕(F. benjamina)(马文娟等,2009)、聚果榕(F. racemosa)(翟树伟等,2007)、细叶榕(吴文珊等,2013)等; 另一类传粉小蜂的产卵器长度分布在雌花花柱长度的分布范围之外,即产卵器能到达绝大部分(到达率接近100%)的雌花子房,如F. citrifolia(Otero et al., 2002)、钝叶榕(F. curtipes)(马文娟等,2009)以及笔管榕等。雌雄同株的榕果内,可能是由于小蜂产卵时产卵器穿越细长鞭状的柱头和花柱十分费时费力,同时,雌花柱头平台的整齐度较差,传粉小蜂找寻合适的雌花(短花柱雌花)产卵需要耗费较多的时间和精力,此外,花柱的粗细、柱头的形态、花柱和柱头是否联合,都可能对成瘿率造成影响,故其成瘿率较低。少数传粉小蜂在产卵时,其产卵器不穿越花柱,而是将产卵器从柱头基部插入子房(Zhang et al., 2009),这可能是传粉小蜂提高成瘿率的一种策略。
3.3 造成传粉小蜂肢体伤残的原因观察结果表明,传粉小蜂在穿越苞口通道,进入榕果果腔内的过程中,触角和双翅的伤残率普遍较高,其次为足。造成传粉小蜂肢体伤残的原因: 1)榕果苞口苞片的质地与数量。传粉小蜂的触角和双翅多在入苞口时被折断,苞口苞片的质地越硬、数量越多,传粉小蜂触角和翅膀的伤残率就越高。如果榕树种群的雌花期与雄花期同步性不高,即在传粉小蜂出飞时,榕果苞口未开启或已闭合,那么传粉小蜂要穿越苞口的难度将增大,其伤残率必然会升高。2)榕果通道苞片的形态、数量、排列方式及紧密程度。通道苞片有2种,一为短苞片,垂直于通道壁生长,螺旋状交叠排列于通道中,传粉小蜂在穿越这种通道时损伤较为严重; 二为长苞片,平行于通道壁生长,传粉小蜂在穿越时只要顺着苞片生长的方向就可以进入榕果腔内,故损伤较小。有些榕果的通道中均为螺旋状排列短苞片,例如薜荔(F. pumila)、爱玉子(F. awkeotsang)(陈勇等,2002,2006),小蜂穿越通道受到的阻力大,肢体伤残率高; 有些榕果的通道中均为平行于通道生长长苞片,例如榕亚属(Urostigma)Galoglychia组的榕树植物、白肉榕亚属(Pharmacosycea)Pharmacosycea组的榕树植物(Verkerke,1989),小蜂穿越通道受到的阻力小,肢体伤残率低; 但多数榕果的通道中2种苞片均有生长,短苞片位于近苞口端,长苞片位于近腔的一侧[例如:笔管榕、大叶榕、细叶榕、垂叶榕(F.benjamina)等],短苞片数量越多、排列越紧密,则传粉小蜂的肢体伤残率越高。榕果设置了苞口与苞口通道,意在通过层层设卡,限制传粉小蜂以外的其他昆虫进入榕果内产卵。传粉小蜂肢体的伤残一定程度上降低了传粉小蜂的产卵率,从而保证了榕树的自身利益。
| [1] |
陈晓倩, 吴文珊, 孙伶俐, 等. 2013. 福州笔管榕榕果中榕小蜂的种类. 福建师范大学学报: 自然科学版, 29 (2): 109-118. (Chen X Q, Wu W S, Sun L L, et al. 2013. Fig wasp species of Ficus superba Miq. var. japonica Miq. in Fuzhou. Journal of Fujian Normal University:Natural Science Edition, 29 (2): 109-118[in Chinese]).(  1) 1)
|
| [2] |
陈勇, 李宏庆, 马炜梁. 2002. 薜荔和爱玉及其传粉昆虫繁殖特性. 植物生态学报, 26 (1): 58-63. (Chen Y, Li H Q, Ma W L. 2002. The reproductive character of Ficus pumila var. pumila, F. pumila var. awkeotsang and their pollinators. Journal of Plant Ecology, 26 (1): 58-63[in Chinese]).(  1) 1)
|
| [3] |
陈勇, 李宏庆, 马炜梁. 2003. 福建省6种榕树及其传粉小蜂共生体系的比较. 吉首大学学报:自然科学版, 24 (1): 20-25. (Chen Y, Li H Q, Ma W L. 2003. Mutualism systems of six fig species (Ficus spp.[in Chinese]) and their fig wasps in Fujian Province. Journal of Jishou University:Natural Sciences Edition, 24 (1): 20-25[in Chinese]).(  1) 1)
|
| [4] |
陈勇, 李宏庆, 马炜梁. 2006. 栽培爱玉的传粉生态. 应用生态学报, 17 (12): 2403-2407. (Chen Y, Li H Q, Ma W L. 2006. Pollination ecology of cultivated Ficus pumila var. awkeotsang. Chinese Journal of Applied Ecology, 17(12): 2403-2407.[in Chinese])( 1) 1)
|
| [5] |
陈艳, 李宏庆, 刘 敏, 等. 2010. 榕-传粉榕小蜂间的专一性与协同进化. 生物多样性, 18 (1): 1-10. (Chen Y, Li H Q, Liu M, et al. 2010. Species-specificity and coevolution of figs and their pollinating wasps. Convention on Biological Diversity. 18 (1): 1-10[in Chinese]).(  1) 1)
|
| [6] |
陈友铃, 吴文珊, 叶海燕, 等. 2012. 福州大叶榕传粉生物学. 林业科学, 48(9): 76-81. (Chen Y L, Wu W S, Ye H Y, et al. 2012. Pollination biology of Ficus virens var. sublanceolata in Fuzhou. Scientia Silvae Sinicae, 48(9): 76-81[in Chinese]).(  1) 1)
|
| [7] |
冯贵. 2010. 中国榕小蜂群落初探及Epichrysomallinae和Sycoscapter的分类. 北京: 中国科学院研究生院博士学位论文. (Feng G. 2010. Preliminary survey of fig waps community in China, focusing on taxonomy of Epichrysomallinae and Sycoscapter (Hymenoptera: Chalcidoidea). Beijing: Doctoral Dissertation of Graduate University of Chinese Academy of Sciences.[in Chinese])(  1) 1)
|
| [8] |
李宏庆, 陈 勇, 鲁心安, 等. 2001. 天仙果的繁殖生物学研究. 生态学报, 21 (8): 1385-1387. (Li H Q, Chen Y, Lu X A, et al. 2001. Reproductive biology of Ficus erecta Thunb. Acta Ecologica Sinica, 21 (8): 1385-1387[in Chinese]).(  1) 1)
|
| [9] |
马文娟, 张凤萍, 彭艳琼, 等. 2009. 不同繁育系统的榕树雌花的花柱长度和繁殖率比较. 植物生态学报, 33 (5): 911-918. (Ma W J, Zhang F P, Peng Y Q, et al. 2009. Comparison of style length and reproductive success in Ficus of different breeding systems. Acta Phytoecologica Sinica, 33 (5): 911-918[in Chinese]).(  3) 3)
|
| [10] |
石章红, 杨大荣. 2006. 歪叶榕繁殖生态学. 植物生态学报, 30(4): 610-616. (Shi Z H, Yang D R. 2006. The reproductive ecology of Ficus cyrtophylla. Acta Phytoecologica Sinica, 30 (4): 610-616.[in Chinese])( 1) 1)
|
| [11] |
吴文珊, 张彦杰, 陈友铃, 等. 2013. 福州细叶榕传粉生物学. 林业科学, 49 (1): 41-47. (Wu W S, Zhang Y J, Chen Y L, et al. 2013. Pollination biology of Ficus microcarpa in Fuzhou. Scientia Silvae Sinicae, 49 (1): 41-47.[in Chinese])( 3) 3)
|
| [12] |
杨大荣, 李朝达, 韩灯保, 等. 1999. 热带雨林片断化对榕小蜂和榕树物种的影响. 动物学研究, 20 (2): 126-130. (Yang D R, Li C D, Han D B, et al. 1999. The effects of fragmenting of tropical rainforest on the species structure of fig wasps and fig trees, China. Zoological Research, 20 (2): 126-130[in Chinese]).(  1) 1)
|
| [13] |
杨大荣, 赵庭周, 王瑞武, 等. 2001. 西双版纳热带雨林聚果榕小蜂的传粉生态学. 动物学研究, 22 (2): 125-130. (Yang D R, Zhao T Z, Wang R W, et al. 2001. Study on pollination ecology of fig wasps (Ceratosolen sp.[in Chinese]) in the tropical rainforest of Xishuangbanna, China. Zoological Research, 22 (2): 125-130[in Chinese]).(  1) 1)
|
| [14] |
杨培, 李宗波, 彭艳琼, 等. 2009. 西双版纳大果榕亚组两种榕树花柱与其传粉榕小蜂产卵器的关系. 动物学研究, 30 (Suppl): 146-153. (Yang P, Li Z B, Peng Y Q, et al. 2009. The relationship between the style length of two dioecious Ficus species and the ovipositor length of their pollinators. Zoological Research, 30 (Suppl): 146-153.[in Chinese])( 1) 1)
|
| [15] |
于慧, 赵南先, 贾效成, 等. 2004. 粗叶榕繁殖系统的特征及其共生的榕小蜂. 植物学通报, 21 (6): 682-688. (Yu H, Zhao N X, Jia X C. Reproductive characters of Ficus hirta Vahl (Moraceae) and its symbiotic fig wasps. Chinese Bulletin of Botany, 21 (6): 682-688[in Chinese]).(  1) 1)
|
| [16] |
翟树伟, 杨大荣, 彭艳琼, 等. 2007. 聚果榕与大果榕隐头果内雌花花柱分布方式及与其传粉蜂间的关系. 林业科学, 43 (6): 67-71. (Zhai S W, Yang D R, Pen Y Q, et al. 2007. Compare of style length of female florets and relationship with their fig pollinating wasps in monoecious Ficus racemosa and dioecious Ficus auriculata. Scientia Silvae Sinicae, 43 (6): 67-71[in Chinese]).(  1) 1)
|
| [17] |
张秀实, 吴征镒, 曹子余. 1998. 中国植物志. 北京: 科学出版社, 23 (1): 12-113. (Zhang X S, Wu Z Y, Cao Z Y. 1998. Flora of China. Beijing: Science Press, 23 (1): 12-113.[in Chinese])(  2) 2)
|
| [18] |
张媛, 杨大荣, 彭艳琼. 2010. 高榕的3类雌花形态及其繁殖特征. 植物生态学报, 34 (11): 1303-1309. (Zhang Y, Yang D R, Pen Y Q. 2010. Reproductive characteristics of three different shaped stigma in flowers of the fig tree Ficus altissima. Acta Phytoecologica Sinica, 34 (11): 1303-1309[in Chinese]).(  1) 1)
|
| [19] |
Berg C C. 1989. Classification and distribution of Ficus. Experientia, 45 (7): 605-611.( 1) 1)
|
| [20] |
Dunn D W, Yu D W, Ridley J, et al. 2008. Longevity, early emergence and body size in a pollinating fig wasp-implications for stability in a fig-pollinator mutualism. Journal of Animal Ecology, 77 (5): 927-935.( 1) 1)
|
| [21] |
Elias L G, Teixeira S P, Kjellberg F, et al. 2012. Diversification in the use of resources by Idarnes species: by passing functional constraints in the fig-fig wasp interaction. Biological Journal of the Linnean Society, 106 (1): 114-122.( 1) 1)
|
| [22] |
Galil J, Eisikowitch D. 1968. On the pollination ecology of Ficus sycomorus in East Africa. Ecology, 49 (2): 259-269.( 1) 1)
|
| [23] |
Grandi G. 1923. Imenotteri dei fichi dell fauna olarctica e indo-malese. Annali del Museo Civico di Storia Naturale di Genova, 51: 101-108.( 1) 1)
|
| [24] |
Ishii T. 1934. Fig chalcidoids of Japan. Japanese Journal of Entomology, 8 (2): 84-100.( 1) 1)
|
| [25] |
Kjellberg F, Jousselin E, Bronstein J L, et al. 2001. Pollination mode in fig wasps: the predictive power of correlated traits. Proceedings of the Royal Society of London Series B: Biological Sciences, 268 (1472), 1113-1121.( 1) 1)
|
| [26] |
Otero J T, Ackerman J D. 2002. Flower style length and seed production in two species of Ficus (Moraceae) in Puerto Rico. Caribbean Journal of Science, 38 (3-4): 249-251.( 1) 1)
|
| [27] |
Peng Y Q, Compton S G, Yang D R. 2009. The reproductive success of Ficus altissima and its pollinator in a strongly seasonal environment: Xishuangbanna, Southwestern China. Plant Ecology, 209 (2): 227-236.( 2) 2)
|
| [28] |
Shi Z H, Yang D R, Peng Y Q. 2006. The style-length of the female florets and their fate in two dioecious species of Xishuangbanna, China. Trees, 20 (4): 410-415.( 1) 1)
|
| [29] |
Verkerke W. 1989. Structure and function of the Fig.Experientia, 45 (7): 612-622.( 1) 1)
|
| [30] |
Wiebes J T. 1977. Agaonid fig wasps from Ficus salicifolia Vahl and some related species of the genus Platyscapa Motschoulsky (Hym., Chalc.[in Chinese]). Netherlands Journal of Zoology, 27 (2): 209-223.( 1) 1)
|
| [31] |
Yeo C K. 2007. Phenology and demography of Ficus superba of Singapore. Singapore: National University of Singapore.( 1) 1)
|
| [32] |
Yeo C K, Tan H T W. 2009. Variation in reproductive output of Ficus superba despite aseasonal reproduction. Plant Ecology, 205 (2): 235-248.( 2) 2)
|
| [33] |
Yu H, Zhao N X, Che Y Z, et al. 2008. Male and female reproductive success in the dioecious fig, Ficus hirta Vahl. in Guangdong Province, China: Implications for the relative stability of dioecy and monoecy. Symbiosis, 45(1-3): 121-127.( 1) 1)
|
| [34] |
Zhang F P, Peng Y Q, Compton S G, et al. 2009. Floral characteristics of Ficus curtipes and the oviposition behavior of its pollinator fig wasp. Annals of the Entomological Society of America, 102 (3): 556-559.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51
