文章信息
- 李倩, 吴小芹, 叶建仁
- Li Qian, Wu Xiaoqin, Ye Jianren
- 一种马尾松菌根辅助细菌——短芽孢杆菌的筛选及鉴定
- Isolation and Identification of a Mycorrhiza Helper Bacteria(MHB)—Brevibacillus reuszeri on Pinus massoniana Roots
- 林业科学, 2015, 51(5): 159-164
- Scientia Silvae Sinicae, 2015, 51(5): 159-164.
- DOI: 10.11707/j.1001-7488.20150519
-
文章历史
- 收稿日期:2013-12-23
- 修回日期:2015-03-03
-
作者相关文章
植物促生根圈细菌(plant growth promoting rhizobacteria)是指根际微生物区系中能够促进植物生长、防治病害、增加作物产量的细菌。菌根辅助细菌(mycorrhiza helper bacteria,MHB)是一类特殊的植物促生根圈细菌,是指能够与菌根真菌特异性结合,并促进菌根真菌在宿主植物根部的定殖、生长,从而间接地促进植物生长的细菌(Garbaye,1994)。研究表明,菌根辅助细菌与菌根真菌双接种可显著促进菌根真菌孢子萌发、促进真菌菌丝生长,提高菌根侵染率等,从而有效地促进寄主植物生长(Aspray et al.,2006)。因此,菌根真菌与根际有益微生物(如菌根辅助细菌、植物促生根圈细菌)作为植物微环境中的重要组成部分,在提高林木产量、维持农林生态系统的稳定等方面都具有重要作用。
马尾松(Pinus massoniana)是我国南方主要的速生用材树种之一,也是我国农林生态系统的重要组成树种。马尾松的生长对菌根真菌依赖性很强,是典型的外生菌根营养型树种。研究表明,彩色豆马勃(Pisolithus tinctorius)(Pt2)是马尾松的优良外生菌根真菌,对马尾松苗生长有着显著的促进作用(吴小芹等,2006)。一些根围细菌以及它们的培养滤液能够促进摩西球囊霉(Glomus mosseae)孢子的形成(Mosse,1962)。外生菌根真菌覆盖物中大多数的细菌对黄色须腹菌(Rhizopogen luteous)(Rl)菌丝的生长和菌根的形成具有促进作用(Garbaye et al.,1989)。一株解磷细菌和外生菌根真菌红绒盖牛肝菌(Xerocomus chrysenteron)(Xc)双接种处理杨苗显著促进了其生长并提高了杨苗的菌根侵染率(刘辉等,2012)。将一株分离自黑松(P.thunbergii)的黄色须腹菌(Rl)菌根际的MHB菌株短小芽孢杆菌(Bacilus pumilus)HR10与黄色须腹菌(Rl)双接种处理黑松苗显著促进了其生长(盛江梅,2014)。本研究从野外马尾松林中采集有彩色豆马勃子实体的菌根根际土壤,分离筛选根际细菌并与本试验室前期筛选的优良外生菌根真菌彩色豆马勃、红绒盖牛肝菌进行离体互作和盆栽试验等,以期筛选出能够促进马尾松形成菌根并能促进马尾松生长的菌根辅助细菌,可为找到高效促进马尾松生长的途径、开发二元或多元生物肥料提供依据。
1 材料与方法 1.1 供试菌株供试外生菌根真菌彩色豆马勃和红绒盖牛肝菌保存于南京林业大学森林病理实验室,采用马铃薯葡萄糖琼脂培养基(PDA)培养。
1.2 马尾松根际微域土样的采集2010年9月在江苏省林业科学研究院30~40年生马尾松人工林中随机踏查采集彩色豆马勃子实体若干。采集时,将彩色豆马勃子实体附近的腐殖质轻轻除去,沿着彩色豆马勃子实体沿着土层向下挖深10~20 cm,采集与其相连的马尾松细根及其土壤。 菌根真菌侵染根后,根尖粗圆且有菌丝包裹,将这些颜色、形态一致的菌根装入无菌自封袋中,标记后迅速带回实验室,待用(张海涵等,2007)。
1.3 马尾松根际土壤细菌的分离用电子天平称取根际土和非根际土各1 g,在加有玻璃珠及100 mL无菌生理盐水的250 mL三角瓶中,200 r ·m-1震荡培养30 min,静置20~30 min后取出悬浮液稀释至10-4,10-3,无菌移液管吸取50 uL涂布于KMB培养基(蛋白胨20 g、K2HPO4 1.5 g、MgSO4 ·7H2O 1.5 g、甘油10 g、琼脂20 g、水1000 mL、pH 7.0~7.2),置于28 ℃培养箱中培养2天,观察菌落形态并挑取单菌落纯化培养,以备后期筛选使用。
1.4 细菌菌体与外生菌根真菌干皿对抗试验将分离获得的74株供试细菌接种于装有50 mL KMB液体培养基中,28 ℃、180 r ·min-1培养72 h。将菌悬液倒入灭菌的离心管中,4 ℃、5 000 r ·min-1离心5 min,倒去上清液,根据离心管内菌体的数量适量加入生理盐水,混匀后即为菌体悬浊液。将培养好的彩色豆马勃和红绒盖牛肝菌菌根真菌菌块分别倒置放入灭菌的空培养皿中,每皿接种3块,三角状放置,再用无菌移液器吸取25 μL供试细菌菌体悬浊液,滴加于各个真菌菌块上,以滴加生理盐水的作为对照,置于25 ℃培养箱中培养。每隔6天添加25 μL的葡萄糖溶液,防止菌块干燥。待菌块生长10~12天后,用装有测微尺的体式显微镜观测各个菌块的菌丝生长情况,计算供试菌株对菌根菌丝的平均促生长量(Dunstan et al.,1998)。
1.5 细菌胞外代谢产物对外生菌根真菌的促生测定将具菌根辅助细菌潜力的细菌菌株活化后,接种于装有50 mL KMB液体培养基中,28 ℃、180 r ·min-1培养72 h。将菌悬液倒入灭菌的离心管中,4 ℃、5 000 r ·min-1离心5 min,用无菌注射器吸取上清液,用细菌过滤器(滤膜孔径为0.22 μm,直径为0.25 mm)过滤后即为胞外代谢产物的无菌滤液。
1)细菌胞外代谢产物对外生菌根真菌菌丝生长的影响 将1 mL无菌滤液与45 ℃、 20 mL PDA混合倒平板,以无菌水处理作为对照。将菌根真菌菌块接种于培养皿中央,置于25 ℃恒温培养。10~12天后观测其菌落半径。
2)细菌胞外代谢产物对外生菌根真菌生物量的影响 用灭菌的打孔器打下菌饼(d=7 mm,¢=5 mm),每50 mL PDA液体培养基中加入菌饼3块,同时加入1 mL胞外代谢产物,25 ℃、140 r ·min-1共同摇瓶培养10~12天,定性滤纸过滤,再置于60 ℃烘箱中烘至恒质量,然后用电子天平进行测量。以KMB培养液为对照。
1.6 外生菌根菌与细菌双接种的盆栽试验用芽苗截根法移栽马尾松幼苗,基质土与固体菌剂比例为10 :1,细菌接种液的量为每株5 mL。取适量无菌的盆栽基质装入培养盆中,然后在土层表面覆约20 g的外生菌根菌剂;用解剖刀将子叶期的马尾松幼苗截取少量主根后移栽至培养杯中;用无菌移液管吸取5 mL的细菌菌体悬浊液,紧贴幼苗根系将其缓缓注入,然后再覆一层基质土;浇水定根(孙民琴等,2007)。以只接种细菌、只接种外生菌根菌和不接菌3种处理作为对照。置于25 ℃温室培养,适时浇水,统一管理。待生长3个月后测量苗高和地径。
1.7 MHB菌株鉴定1)生物学特征观察 将筛选出来的菌根辅助菌株接种于KMB培养基中,28 ℃培养24~36 h,待出现单菌落时,挑取菌落进行菌体形态、菌株培养特征、革兰氏染色、3%氢氧化钾溶解性试验和芽孢染色试验(程丽娟,1993)。
2)BIOLOG系统鉴定 根据革兰氏染色和芽孢染色结果选用BIOLOG鉴定板,采用BIOLOG微生物鉴定系统(ELX808型)对筛选获得的菌根辅助细菌菌株进行鉴定,具体步骤参照说明书。
3)细菌16SrDNA序列测定及系统发育树的构建 采用SDS法提取MHB菌株的DNA(Ausubel et al.,1999),溶解于适量的TE中,采用扩增细菌16SrDNA的一对通用引物(正向引物16Sf: AGA GTT TGA TCC TGG CTC AG;反向引物16Sr: ACG GCT ACC TTG TTA CGA CT,进行PCR产物的扩增(蒋萍等,2008)。获得的PCR产物用QIAGEN公司的纯化试剂盒纯化回收。
将得到的序列在NCBI上进行BLAST比对,选取数据库中的有代表性的菌株16SrDNA,采用MEGA4.0软件构建系统发育树。
2 结果与分析 2.1 MHB潜力菌株对彩色豆马勃和红绒盖牛肝菌的促生效应 将供试的74株细菌与彩色豆马勃(Pt2)和红绒盖牛肝菌(Xc)进行干皿对抗试验,其中MPt17菌株对二者菌丝生长的促进作用明显,与对照相比,菌丝长度增长率分别为48.6%和25.0%(表 1,图 1)。因此,可初步将MPt17视为具有菌根辅助细菌潜力的菌株。
|
|
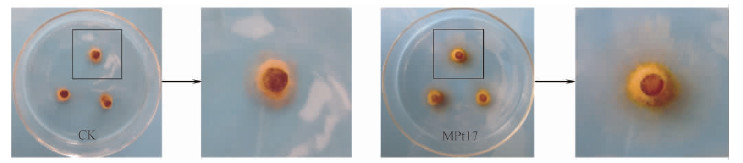 |
图 1 MPt17细菌菌体对彩色豆马勃(Pt2)菌丝生长的影响 Fig.1 The effect of the MPt17 bacteria suspension on the hypha growth of P.tinctorius (Pt2) |
MPt17潜力菌株胞外代谢产物与外生菌根真菌彩色豆马勃(Pt2)和红绒盖牛肝菌(Xc)的共培养试验表明,MPt17潜力菌株对彩色豆马勃(Pt2)的生长有明显的促进作用,与对照相比,菌丝直径增长率为129.6%(表 2,图 2-A);其对红绒盖牛肝菌(Xc)也有一定的促进作用,与对照相比,菌丝直径增长率为29.5%(表 2,图 2-B)。将MPt17潜力菌株胞外代谢产物与2种外生菌根真菌液体共培养试验表明,MPt17胞外代谢产物对彩色豆马勃(Pt2)和红绒盖牛肝菌(Xc)的生物量也有不同程度的促进作用,与对照相比,彩色豆马勃(Pt2)的生物量增长率为124.2%,红绒盖牛肝菌(Xc)的生物增长率为34.2%。
|
|
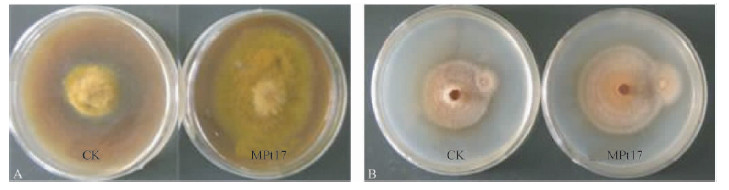 |
图 2 菌株MPt17无菌滤液对彩色豆马勃(Pt2)菌落和红绒盖牛肝菌(Xc)菌落生长的影响 Fig.2 The effect of the MPt17 bacterial extracellular metabolites on the colony growth of P. tinctorius (Pt2) (A)and X. chrysenteron(Xc)(B) |
单接种彩色豆马勃(Pt2)或MPt17菌株、双接种彩色豆马勃(Pt2)和MPt17于马尾松幼苗,3个月后的生长情况见(表 3)。与对照相比,单接种(细菌或真菌)和双接种马尾松苗都对其生长起到了一定的促进作用,且双接种处理的效果较单接种处理好。单接种菌根辅助细菌MPt17苗高和茎粗比对照增加了53.4%和25.0%,单接种彩色豆马勃(Pt2)苗高和茎粗比对照增加了32.7%和17.5%,Pt2+MPt17双接种的促生效果最好,苗高和茎粗比对照增加了78.0%和46.3%。MPt17菌株与红绒盖牛肝菌(Xc)双接种马尾松苗3个月后生长情况见(表 3),单接种外生菌根真菌红绒盖牛肝菌(Xc)苗高和茎粗比对照增加了39.2%和23.8%,Xc+MPt17双接种的促生效果最好,苗高和茎粗比对照增加了68.2%和57.5%。
|
|
在KMB培养基平板上,菌落较小,颜色米黄色,圆形,边缘整齐;菌体短杆状(图 3),革兰氏染色阳性,有芽孢。
 |
图 3 培养24 h后的MHB菌株的菌体形态 Fig.3 The cell morphology of MHB strains cultured after 24 h |
MPt17菌株在BIOLOG鉴定板上上培养16~24 h时的读数相似值(SIM值)均大于0.5,且菌株鉴定结果与数据库中所比对出的细菌种类的相似性为99%。结合形态、生理生化特征及16SrDNA序列分析,鉴定MPt17为短芽孢杆菌(Brevibacillus reuszeri)。
2.6 MPt17菌株16SrDNA序列分析及系统发育树构建序列去除载体序列后,获得MPt17菌株1 370 bp的16SrDNA序列,序列提交GenBank数据库,获得的登陆号为KF891383。将MPt17的16SrDNA序列与GenBank中的序列进行BLAST比对,获得同源性数值,比对结果中与MPt17菌株相似性最高的是短芽孢杆菌,同源性达99%。从图 4的进化树可以看出,MPt17菌株遗传进化距离与短芽孢杆菌亲缘关系较近。结合MPt17菌株的生物学特征及BIOLOG细菌鉴定结果,MPt17菌株鉴定为短芽孢杆菌。本菌已保藏于中国典型培养物保藏中心,保藏编号(CCTCC No.为M 2011433)。
 |
图 4 MHB菌株MPt17的系统发育树 Fig.4 The phylogenetic tree based on the MHB strain MPt17 |
MHB除了能从各种菌根与菌根圈中分离出来,还能从外生菌根真菌子实体、AMF的孢子、根瘿、白蚁堆以及重金属污染的土壤中分离出来(Garbaye et al.,1989; Xavier et al.,2003; Duponnois et al.,2006; Bianciotto et al.,1996)。在MHB的作用机制中,促进菌根真菌的生长是最直接、最重要的一个作用机制,因此这也成为筛选MHB的一个重要依据(盛江梅,2008)。本试验采集马尾松林中长有彩色豆马勃子实体的菌根根际土壤经传统稀释分离法分离,获得大量的根际细菌;并采用干皿对抗法进行MHB的筛选,获得1株对彩色豆马勃(Pt2)和红绒盖牛肝菌(Xc)2种外生菌根真菌生长都具有促进作用的细菌;经形态、生理生化以及16SrDNA序列分析鉴定为短芽孢杆菌。试验进一步证实了MHB可以从EMF子实体上采集到。
MHB对不同的真菌种类具有不同的作用效果,某些MHB可以与多种菌根真菌协同作用,具有广泛性,而有些MHB却具有极强的选择性,只能与某一种真菌相互作用(Riedlinger,2006)。本试验筛选获得的MHB菌株MPt17对Pt2和Xc都表现出促进作用,对美味牛肝菌(Boletus edulis)和劣味乳菇(Lactarius insulsus)未表现出促生作用(数据未发表)。这一现象表明MPt17菌株具有一定的真菌选择性。
根际细菌对外生菌根真菌的促进作用是通过多个方面共同作用的结果,其中包括菌体的作用和细菌分泌的次生代谢物的作用等。本试验筛选出的MPt17菌株的菌体和胞外代谢物对Pt2和Xc菌丝的生长都有明显的促进作用。
本研究通过温室盆栽试验对离体筛选获得的MHB潜力菌株是否具有MHB的作用进行了进一步的验证。试验结果表明,MPt17菌株与Pt2和Xc双接种马尾松幼苗对苗木的生长都具有明显的促进作用,而且MPt17菌株单接种马尾松幼苗也能在一定程度上促进苗木的生长。可见,MPt17既是菌根辅助细菌也是根际促生细菌。
有研究将马尾松林地分离筛选获得的马尾松外生菌根真菌、马尾松根际土壤溶磷菌进行组合、优化,制成复合微生物菌剂(黄鹏飞,2012)。本试验中的短芽孢杆菌MPt17菌株与Pt2、Xc均表现出对马尾松生长的协同作用,对其菌剂的制备有待进一步研究。外生菌根真菌-菌根辅助细菌-植物三者互作机制进行相关的研究将有利于更好地将外生菌根真菌与菌根辅助细菌的结合,这对促进植物生长、维持农林业的可持续发展具有重要的意义。
| [1] |
程丽娟.1993.微生物实验技术.西安:天则出版社. (Chen L J.1993.Laboratory Manual of Microbiology. Xi'an:Day,Press.[in Chinese])(  1) 1)
|
| [2] |
黄鹏飞.2012.马尾松复合微生物菌剂的研制及应用.长沙:中南林业科技大学硕士学位论文. (Huang P F.2012.Development and application of compound fungal and bacterial fertilizers of Pinus massoniana.Changsha:MS thesis of Central South University of Forestry&Technology[in Chinese]).(  1) 1)
|
| [3] |
蒋萍,叶建仁.2008.马尾松叶面拮抗细菌NA的分子鉴定.新疆农业大学学报,31(3):39-42. (Jiang P,Ye J R.2008.Identification on molecular of an antagonistic bacteria NA isolated from leaf surface of Pinus massoniana.Journal of Xinjiang Agricultural University,31(3):39-42[in Chinese]).(  1) 1)
|
| [4] |
刘辉,吴小芹,任嘉红,等.2012.荧光假单胞菌及红绒盖牛肝菌接种对NL-895杨生长和光合特征的影响.西部林业科学,41(1):53-59. (Liu H,Wu X Q,Ren J H,et al.2012.Effect of Inoculating Pesudomonas fluorenscens and Xerocomus chrysenteron on growth and photosynthetic characteristics of NL-895 poplar.Journal of West China Forestry Science,41(1):53-59[in Chinese]).(  1) 1)
|
| [5] |
盛江梅.2014.黑松—黄色须腹菌共生体根际菌根辅助细菌的筛选及鉴定.东北林业大学学报,42(5):110-114. (Sheng J M.2014.Isolating and identifying mycorrhiza helper bacteria from the rhizosphere soil of Pinus thunbergii inoculated with Rhizipogen luteous.Journal of Northeast Forestry University,42(5):110-114[in Chinese]).(  1) 1)
|
| [6] |
盛江梅.2008.黑松菌根根际菌根辅助细菌(MHB)筛选研究.南京:南京林业大学硕士学位论文. (Sheng J M.2008.Isolating and Identifying mycorrhiza helper bacteria from the Pinus thunbergii.Nanjing: MS thesis of Nanjing Forestry University[in Chinese]).(  1) 1)
|
| [7] |
孙民琴,吴小芹,叶建仁.2007.外生菌根真菌对不同松树出苗和生长的影响.南京林业大学学报:自然科学版,31(5):39-43. (Sun M Q,Wu X Q.Ye J R.2007.Effects of ectomycorrhizal fungi on germination and growth of pines.Journal of Nanjing Forestry University:Natural Sciences Edition,31(5):39-43[in Chinese]).(  1) 1)
|
| [8] |
吴小芹,孙民琴.2006.七株外生菌根真菌与三种松苗菌根的形成能力.生态学报,26(12):4186-4191. (Wu X Q, Sun M Q.2006.Mycorrhizal formation between seven ectomycorrhizal fungi and seedlings of three pines species.Acta Ecologica Sinica,26(12):4186-4191[in Chinese]).(  1) 1)
|
| [9] |
张海涵,唐明,陈辉,等.2007.不同生态条件下油松(Pinus tabulaeformis)菌根根际土壤微生物群落.生态学报,27(12):5463-5470. (Zhang H H,Tang M,Chen H.2007.Microbial communities in Pinus tabulaeformis mycorrhizosphere under different ecological conditions.Acta Ecologica Sinica,27(12):5463-5470[in Chinese]).(  1) 1)
|
| [10] |
Aspray T J,Frey-Klett P,Jones J E.2006.Mycorrhization helper bacteria:a case of specificity for altering ectomycorrhiza architecture but not ectomycorrhiza formation.Mycorrhiza,16(8):533-541.( 1) 1)
|
| [11] |
Ausubel F M, Brent R, Kingston R E, et al.1999.Short Protocols in Molecular Biology.4th ed.Greene Pub Associates,1-1319.( 1) 1)
|
| [12] |
Bianciotto V,Minerdi D, Perotto S.1996.Cellular interactions between arbuscular mycorrhizal fungi and rhizosphere bacteria.Protoplasma,193:123-131.( 1) 1)
|
| [13] |
Dunstan W A,Malajczuk N,Dell B.1998.Effects of bacteria on mycorrhizal development and growth of container grown Eucalyptus diversicolor F Muell seedlings.Plant Soil,201:241-249.( 1) 1)
|
| [14] |
Duponnois R,Kisa M.2006.The possible role of trehalose in the mycorrhiza helper effect.Can J Bot,84:1005-1008.( 1) 1)
|
| [15] |
Garbaye J.1994.Helper bacteria:a new dimension to the mycorrhizal symbiosis.New Phytologist,128(2):197-210.( 1) 1)
|
| [16] |
Garbaye J,Bowen G D.1989.Stimulation of mycorrhizal infection of Pinus radiata by some micro-organisms associated with the mantle of ectomycorrhizas.New Phytol,112:383-388.( 2) 2)
|
| [17] |
Riedlinger J.2006.Die stofflichen Grundlagen der Modulation des Myzelwachstums von sym-biotischen und pathogenen Pilzen durch Streptomyzeten. PhD thesis of University of Tubingen,Tubingen, Germany.( 1) 1)
|
| [18] |
Mosse B.1962.The establishment of vesicular-arbuscular mycorrhiza under aseptic conditions. J Gen Microbiol,27:509-520.( 1) 1)
|
| [19] |
Xavier L J C,Germida J J.2003.Bacteria associated with Glomus clarum spores influence mycorrhizal activity.Soil Biol Biochem,35:471-478.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

