文章信息
- 柏宏伟, 成军, 杨柳, 姜奕晨, 曹庆芹, 张卿, 秦岭
- Bai Hongwei, Cheng Jun, Yang Liu, Jiang Yichen, Cao Qingqin, Zhang Qing, Qin Ling
- 板栗雄花序萃取物抗氧化及抑菌效果
- Antioxidation and Antimicrobial Activities of Extracts Parts of Chestnut Catkins
- 林业科学, 2015, 51(5): 145-152
- Scientia Silvae Sinicae, 2015, 51(5): 145-152.
- DOI: 10.11707/j.1001-7488.20150517
-
文章历史
- 收稿日期:2014-08-21
- 修回日期:2015-02-06
-
作者相关文章
2. 北京农学院 农业部都市农业(北方)重点开放实验室 北京 102206;
3. 北京农学院生物科学与工程学院 北京 102206
2. Key Laboratory of Urban Agriculture (North) of Ministry of Agriculture Beijing University of Agriculture Beijing 102206;
3. College of Biological Science and Engineering, Beijing University of Agriculture Beijing 102206
板栗(Castanea mollissima)为壳斗科(Fagaceae)栗属(Castanea)植物。板栗是雌雄异花同株植物,雄花序数量明显高于雌花序。据《中药大辞典》记载,板栗花具有治泻痢、便血、瘰疬、日久赤白痢疾、大肠下血、小儿消化不良等功效,民间用其水煎剂治疗细菌性痢疾(江苏医学院,1985)。利用板栗花饲喂治疗家畜(猪、牛)泄泻病取得了令人满意的疗效,治愈率达96%(徐燏,1989),板栗花水提取物对多种大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)和绿脓杆菌(Pseudomonas aeruginosa)具有抑菌效果(孙永科等,2010),板栗雄花序中含有黄酮类、多种酚类和甾醇类等多种成分(马宏峰等2010;杜彬,2011)。采用不同提取方法得到的板栗花粗提物有较强的抗氧化活性,其清除DPPH ·自由基、 ·OH自由基和亚硝酸盐都有较好的效果(吴雪辉等,2008;张利燕等,2012a;2013b),但其主要作用成分尚未见进一步研究。Vekiari等(2008)在欧洲栗(Castanea sativa)树皮和果实中提取并鉴定出游离鞣花酸,而中国板栗中尚未见报道。
本研究以板栗雄花序为材料,进行乙醇粗提和不同极性试剂萃取,研究不同萃取物抗氧化和抑菌效果,进一步鉴定其主要作用成分,为板栗雄花序的进一步开发与利用提供基础。
1 材料和方法 1.1 试验材料选自北京市怀柔板栗试验站种植的‘燕山红栗’雄花序,置于阴凉处干燥,然后利用粉碎机将其粉碎,备用。试验用菌种均由北京农学院兽医学(中医药)北京市重点实验室提供(表 1)。
|
|
1)板栗雄花序活性成分提取 采用加热回流进行提取,取粉碎好的板栗雄花序粉末2 kg,加入15倍量的95%乙醇,80 ℃热回流提取2 h,重复3次。合并3次提取液,然后用布氏漏斗减压分离提取液,将所得到的滤液在旋转蒸发仪减压蒸馏(45 ℃,0.05 MPa),回收乙醇。最后在-50 ℃条件下冷冻干燥得到板栗雄花序浸膏,称质量。
提取率(%)=A0/2 000×100,
式中: A0为板栗雄花序醇提物提取量。
2)板栗雄花序浸膏萃取 将上述所得的板栗雄花序醇提物经系统萃取法依次用石油醚、二氯甲烷、乙酸乙酯及正丁醇分别萃取3~4次,然后各部分所得萃取液减压浓缩,得到相应的石油醚、二氯甲烷、乙酸乙酯及正丁醇萃取物。
提取率(%)=A1/A0×100,
式中: A0为板栗雄花序醇提物提取量,A1为板栗雄花序萃取物提取量。
3)DPPH ·清除能力的测定 利用DPPH溶液的紫红色团的吸收峰特征,以分光光度法测定加抗氧化剂或植物提取液后A517吸收的下降表示其对有机自由基消除能力(Larrauri et al.,1998;Yokozaw et al.,1998),重复3次。
4)抗脂质过氧化能力测定 以硫代巴比妥酸法(TBA法)测定样品对卵黄脂质过氧化的影响(邓胜国等,2006;杨君等,2014),重复3次。
5)板栗雄花序醇提物及不同极性萃取物的抑菌试验 分别取各萃取物0.6 g,用乙醇溶解并定容至10 mL,将无菌的滤纸片(6 mm)浸泡于此溶液24 h,烘干滤纸片。取试验菌0.1 mL涂布于LB固体培养基上。将干燥的滤纸片放入己接种的LB固体培养基上,用乙醇作对照,28 ℃培养24 h,测定试验菌的最大抑菌圈直径,重复3次。
6)板栗雄花序乙酸乙酯萃取物抑菌活性试验 供试药剂的准备与处理: 称取板栗雄花序乙酸乙酯萃取物,用灭菌蒸馏水中配制成7.84 mg ·mL-1溶液,然后用浓度为1 mol ·L-1 NaOH溶液,将药液pH调至7.2。
体外抑菌试验: 采用二倍稀释法测定板栗雄花序乙酸乙酯萃取物的MIC。每支试管加入2 mL灭菌营养肉汤,然后加入2 mL受试药物,依次倍比稀释,9个梯度,用1~9管表示,第10管为阳性对照(乙酸乙酯萃取物),第11管为阴性对照(营养肉汤培养基)。于37 ℃培养24 h观察结果。以无菌生长的最低稀释度为MIC,重复3次。
体外杀菌试验: 取上述清洁透明的各试管培养物,划线接种营养琼脂平板,37 ℃培养24 h后,以无细菌生长试管内药物的稀释度为该菌株的最小杀菌浓度(MBC),重复3次。
7)中压制备液相色谱法收集与检测色谱柱为TSKGEL ODS-80TS(5 μm,4.5 mm×150 mm),柱温25 ℃,流动相为乙腈和0.1%磷酸梯度洗脱(表 2),流速5.0 mL ·min-1,检测波长254 nm,上样量500 μL。
|
|
8)HPLC定量检测游离鞣花酸 色谱柱为TSKGEL ODS-80TS(5 μm,4.5 mm×150 mm),柱温25 ℃,流动相为乙腈和0.1%磷酸梯度洗脱(表 3),流速1.0 mL ·min-1,检测波长254 nm,上样量10 μL。
|
|
9)鞣花酸核磁共振波谱特征鉴定 采用BRUKER ULTRASHIELDTM 400MHs PLUS核磁仪,采集样品的1H-NMR谱、13C-NMR谱数据,结合化合物的核磁数据库,鉴定化合物结构。
2 结果与分析 2.1 板栗雄花序醇提物及不同极性萃取物的特点通过系统提取法得到板栗雄花序醇提物提取率为16.6%,其他4种萃取物提取率在2.6%~26.2%之间,其中乙酸乙酯萃取物提取率最高。除石油醚萃取 物难溶于水之外,其他4种萃取物可溶于水,pH2.80~3.23之间,平衡溶解度在 5.31~8.51 mg ·mL-1之间(表 4)。
|
|
1)板栗雄花序醇提物抗氧化能力分析 板栗雄花序醇提物对DPPH ·有一定的清除能力,随着样品浓度的增加,对DPPH ·清除能力均逐渐增强。当板栗雄花序醇提物浓度为0.1 mg ·mL-1时,其对DPPH ·的清除率为73.3%。但与Vc清除DPPH ·97.2%相比,效果较差(图 1)。
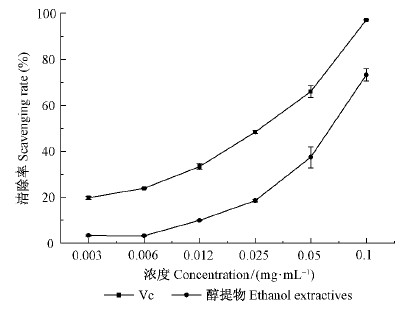 |
图 1 板栗雄花序醇提物对DPPH ·自由基的清除能力 Fig.1 Scavenging rate of DPPH · in ethanol extractives of the chestnut catkins |
板栗雄花序醇提物对卵黄脂质过氧化清除有一定作用,浓度在0.025~0.1 mg ·mL-1时,随浓度增加板栗雄花序醇提物对卵黄脂质过氧化清除能力有所提高,当板栗雄花序醇提物浓度为0.1 mg ·mL-1时,其对卵黄脂质过氧化清除率为51.21%(图 2)。
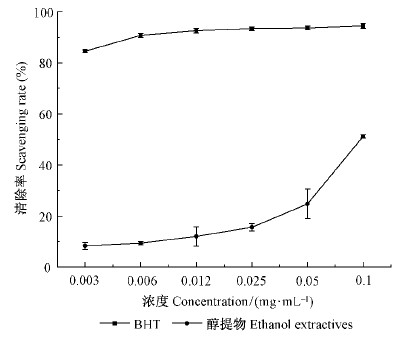 |
图 2 板栗雄花序醇提物抑制卵黄脂质过氧化能力 Fig.2 Scavenging rate of ethanol extractives of the chestnut catkins inhibited the yolk lipid |
2)板栗雄花序不同极性萃取物抗氧化能力分析 随着样品浓度的增加,乙酸乙酯萃取物和正丁醇萃取物对DPPH ·清除能力均逐渐增强,其中乙酸乙酯萃取相对DPPH ·清除能力与Vc相当。而石油醚萃取物、二氯甲烷萃取物对DPPH ·清除能力较差。乙酸乙酯萃取物浓度在0.05 mg ·mL-1时,对DPPH ·清除率为75.4%,明显高于对照组Vc的清除率(图 3)。
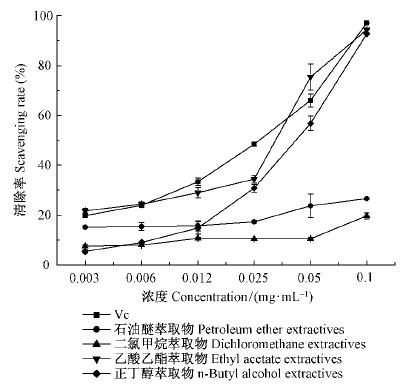 |
图 3 板栗雄花序不同萃取物对DPPH ·自由基的清除能力 Fig.3 Scavenging rate of DPPH · in different polar extraction of the chestnut catkins |
板栗雄花序石油醚萃取相对卵黄脂质过氧化清除能力较弱,随着样品浓度的增加,二氯甲烷萃取相、乙酸乙酯萃取相和正丁醇萃取相对卵黄脂质过氧化清除能力均逐渐增强,当样品浓度为0.05~0.1 mg ·mL-1时,乙酸乙酯萃取相其清除能力相当于同浓度的强抗氧化剂2,6-二叔丁基对甲酚(BHT),表现出较强的抗氧化活性(图 4)。
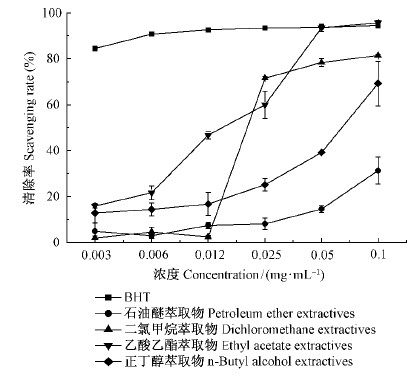 |
图 4 板栗雄花序不同萃取物抑制卵黄脂质过氧化能力 Fig.4 Scavenging rate of different fractions of the chestnut catkins inhibited the yolk lipid |
1)板栗雄花序醇提物的抑菌效果 板栗雄花序醇提取物对不同菌种抑菌圈大小都在11 mm以上,其中对油菜黄单胞菌油菜致病变种的抑菌效果最好,抑菌圈最大达到18 mm以上。与其他菌种抑菌圈相比,对油菜黄单胞菌油菜致病变种的抑菌效果有极显著差异,而对丁香假单胞菌番茄致病变种的抑菌效果最差,抑菌圈在11.73 mm(表 5)。板栗雄花序中所含的化学成分对革兰氏阳性菌和革兰氏阴性菌都有较好的抑制作用。
|
|
2)板栗雄花序不同极性萃取物的抑菌效果 利用板栗雄花序不同极性萃取物测定抑菌效果(表 6),结果表明,4种不同萃取物对大肠杆菌和金黄色葡萄球菌均有不同程度的抑菌作用,乙酸乙酯和正丁醇萃取物抑菌作用较强,对大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别达到12.51 mm及14.65 mm以上,与其他2种萃取物抑菌效果相比达到极显著水平。
|
|
3)板栗雄花序乙酸乙酯萃取物对细菌抑制作用 板栗雄花序乙酸乙酯萃取相对大肠杆菌体外抑菌的最高稀释度为24,最低抑菌浓度为1 :16,生药含量为0.98 mg ·mL-1(表 7)。板栗雄花序乙酸乙酯萃取物对大肠杆菌体外杀菌的最高稀释度为23,最低杀菌浓度为1 :8,生药含量为1.96 mg ·mL-1(表 8)。
|
|
|
|
1)中压制备液相色谱法纯化 按照中压制备液相色谱法分离纯化样品后,根据设定条件进行上样分析,出现一个主峰和多个其他小峰,主峰是其主成分(图 5A)。通过对主峰保留时间的分析,推测主成分可能是鞣花酸。对鞣花酸标品按同样色谱条件分析,经计算其与前后共存峰的分离度均大于1.5,符合分析要求(图 5B),初步证明主成分为鞣花酸。采用外标法定量计算样品中鞣花酸含量,结果表明每克栗花干粉中含游离鞣花酸2.267 mg。
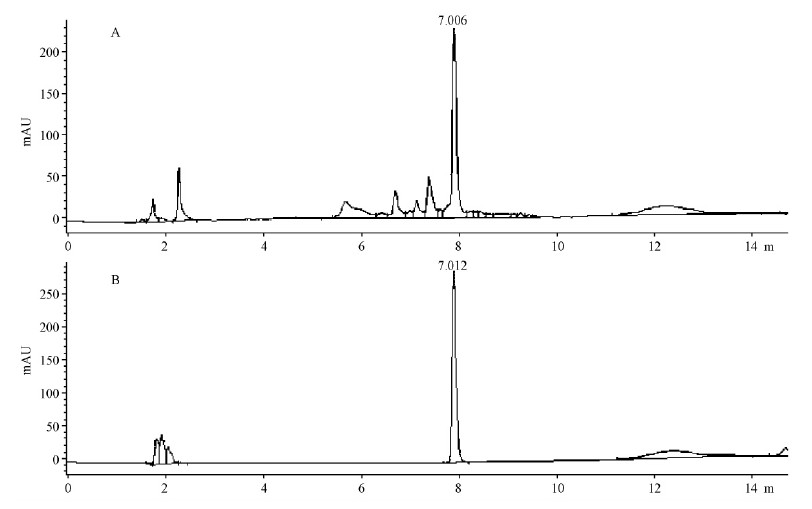 |
图 5 鞣花酸色谱图 Fig.5 Chromatogram of ellagic acid A.栗花样品Chestnut catkin sample;B.鞣花酸标准品 16 μg ·mL-1 Ellagic acid standard 16 μg ·mL-1. EA: 鞣花酸 Ellagic acid. |
2)鞣花酸的NMR结果分析 淡黄色粉末,1H NMR(DMSO-d6,400MHz)δ: 7.25(2H,s,H-5,5′). 13C NMR(DMSO-d6,100MHz)δ: 112.2(C-1,1′),136.3(C-2,2′),139.4(C-3,3′),148.0(C-4,4′),110.2(C-5,5′),107.7(C-6,6′),159.0(C-7,7′)。故鉴定该化合物为鞣花酸。
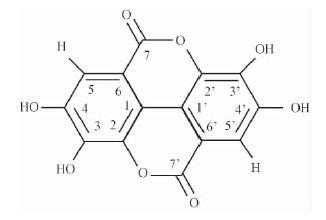 |
图 6 鞣花酸的化学结构 Fig.6 Chemical structure of ellagic acid |
板栗生产中会产生多种废弃物,如栗花、栗壳、栗蓬等,这些废弃物具有很高的化学和药用价值。目前对其提取工艺研究较多,杜彬等(2011)采用微波浸提法对板栗花中多酚物质提取最优条件为40%甲醇、提取时间60 s、微波功率480 W、料液比1 :25(g ·mL-1),在此条件下,得率为6.69%。鲁晓翔等(2008)提取板栗壳多酚物质最佳提取条件为30%乙醇,料液比1 :23(g ·mL-1),并在70 ℃水浴条件下振荡提取170 min,得率为7.9%。石恩慧等(2013)采用醇水溶液为提取剂提取板栗苞多酚,优化工艺为30%的乙醇,料液比1 :18(g ·mL-1),在80 ℃提取条件下提取140 min,在此条件下,得率为22.61%。从以上板栗废弃物提取率可以看出板栗壳和板栗总苞的提取率均高于板栗花,原因可能是板栗花中活性物质含量较低。本试验提取板栗雄花序的条件为95%乙醇,料液比1 :15(g ·mL-1),80 ℃热回流120 min,醇提物得率为16.6%。试验结果表明,本试验提取工艺可行,降低了原料的使用量,同时提高了活性物质的提取率。
抗氧化活性物质可以减少和清除自由基,具有延缓人体衰老、防治疾病的作用(成喜雨等,2006;陈会良等,2006)。脂质过氧化损伤与肿瘤、衰老、心脑血管病、炎症和辐射损伤等的发生和发展有密切关系(张尔贤等,1996)。Jelena等(2009)采用超声波提取法对欧洲栗叶、花序和栗壳进行物质提取,利用电子顺磁共振(EPR)光谱得出欧洲栗提取物都有较高的抗氧化活性,对保护细胞膜免受氧化应激损伤有很好的效果。吴雪辉等(2008)采用热回流提取得到的板栗雄花序粗提物,对DPPH ·清除率为85.8%。Muji等(2011)得到板栗提取物可以抑制脂质过氧化,其表现为降低丙二醛水平,这对治疗糖尿病有非常好的效果。板栗雄花序醇提物及不同极性萃取物的抗氧化能力存在较大差异,通过试验结果可知,乙酸乙酯萃取物抗氧化活性较高,其DPPH ·自由基清除率与Vc接近,清除率为94.4%,抗脂质过氧化抑制率与BHT相当,清除率为95.69%,说明板栗雄花序作为生产保健产品的原料具有一定的开发利用价值。长期和广泛使用抗生素不仅造成病原微生物产生耐药性,并且还会带来毒副作用、污染环境以及影响畜产品品质等诸多弊端(王强等,2009)。Hao等(2012)通过对板栗栗壳、表皮和栗叶提取物进行抗菌活性测定,表明3种提取物对细菌有较好的抑菌效果,对霉菌效果较差。孙永科等(2010)研究表明,板栗花提取物对大肠杆菌和金黄色葡萄球菌等有较好的抑菌效果,并且抑菌效果与浓度成正相关性。本试验通过对板栗雄花序醇提物进行抑菌试验,结果显示板栗雄花序醇提物对12种供试菌种的生长都有不同程度的抑制作用。此外,本试验板栗雄花序各萃取相抑菌效果表明,各个萃取物对G+菌和G-菌都有一定作用,其中乙酸乙酯萃取相的抑菌活性最好,对大肠杆菌的最低抑菌浓度为0.98 mg ·mL-1,最低杀菌浓度为1.96 mg ·mL-1,表明板栗雄花序中具有较高抑菌的活性物质。
鞣花酸具有抗肿瘤、抗病毒和抗菌活性(Okuda,2005),关于鞣花酸的高效液相色谱检测分析已有很多相关报道,涉及欧洲栗、葡萄(Vitis vinifera)、石榴(Punica granatum)皮、红树莓(Rubus idaeusl)、番石榴(Psidium guajava)等植物材料。不同欧洲栗品种的树皮和栗果中鞣花酸含量范围介于0.71~21.6 mg ·g-1 之间(Vekiari et al.,2008)。中国板栗‘燕山红栗’品种雄花序中的游离鞣花酸含量为2.267 mg ·g-1,高于红树莓(0.223 mg ·g-1)和番石榴叶(0.814 mg ·g-1)(李小萍等,2009;刘玉革等,2011)。由此可见,板栗雄花序可作为天然鞣花酸提取资源。
| [1] |
成喜雨,崔 馨,刘春朝,等.2006.中草药抗氧化活性研究进展.天然产物研究与开发,18:514-518. (Cheng X Y,Cui X,Liu C Z, et al.2006.Recent advances of antioxidant activity of Chinese Herbal Medicines.Nat Prod Res Dev,18:514-518[in Chinese]).(  1) 1)
|
| [2] |
陈会良,顾有方,王月雷.2006.中草药化学成分与抗氧化活性的研究进展.中国中医药科技,13(1):63-64. (Chen H L,Gu Y F,Wang Y L.2006. Recent advances of composition and antioxidant activity of Chinese Herbal Medicines.Chinese Medical Science and Technology,13(1):63-64[in Chinese]).(  1) 1)
|
| [3] |
邓胜国,邓泽元,黄 丽.2006.荷叶黄酮体外抗氧化活性的研究.食品科技,(7):274-276. (Deng S G,Deng Z Y,Huang L.2006. Study on the antioxidative activity of flavonoids extracted from lotus leaves in vitro. Food science and technology,(7):274-276[in Chinese]).(  1) 1)
|
| [4] |
杜彬,王同坤,侯文龙,等.2011.板栗花中总多酚提取工艺优化.食品科学,(16):121-126. (Du B,Wang T K,Hou Wen H L,et al.2011. Process optimization for extraction of total polyphenols from Chinese chestnut flowers. Food science and technology,(16): 121-126[in Chinese]).(  2) 2)
|
| [5] |
郭雷,郝倩,孙颖,等.2010.板栗壳活性成分的提取工艺条件研究.江苏农业科学,(3):356-357. (Guo L,Hao Q,Sun Y,et al.2010.Study on the process of the active ingredient of chestnut shell extraction.Jiangsu Agricultural Sciences,(3): 356-357[in Chinese]). |
| [6] |
江苏医学院.1985.中药大辞典(下册).上海: 上海科学技术出版社,1819-1821. (Jiangsu Medical College.1985.Traditional Chinese medicine dictionary(lower volume).Shanghai: Shanghai Science and Technology Press,1819-1821.[in Chinese])(  1) 1)
|
| [7] |
李小萍,梁琪,辛秀兰,等.2009.高效液相色谱法测定红树莓中鞣花酸含量.安徽农业科学,37(24): 11345-11346. (Li X P,Liang Q,Xin X L,et al.2009. Determination of the content of ellagic acid in red raspberry with HPLC. Journal of Anhui Agri Sci,37(24):11345-11346[in Chinese]).(  1) 1)
|
| [8] |
刘玉革,刘胜辉,臧小平,等.2011.高效液相色谱法测定番石榴叶提取物中的游离鞣花酸.食品科学,32(8): 252-254. (Liu Y G,Liu S H,Zang X P,et al.2011.Determination of free ellagic acid content in guava leaves by HPLC. Food Science,32(8): 252-254[in Chinese]).(  1) 1)
|
| [9] |
鲁晓翔,赵晨光,连喜军.2008.板栗壳多酚提取条件及其抗氧化性研究. 食品研究与开发,(3): 32-36. (Lu X X,Zhao C G, Lian X J.2008. Study on the extraction conditions and antioxidition of polyphenol from chestnut-shells.Food Research and Development,03:32-36[in Chinese]).(  1) 1)
|
| [10] |
马宏峰,高丽梅,赵光云,等.2010.比色法测定板栗花中总黄酮的含量.中国现代中药,(10): 25-28. (Ma H F,Gao L M,Zhao G Y,et al.2010.Colorimetric determination of total flavonoids in floral.Chinese Modern Medicine,(10):25-28[in Chinese]).(  1) 1)
|
| [11] |
石恩慧,郭凯军,李红,等.2013.板栗总苞多酚提取工艺优化及其抗氧化性研究.动物营养学报,(2): 406-414. (Shi E H,Guo K J, Li H,et al.2013.Castanea mollissima blume polyphenols: extraction technology optimization and its antioxidant activity.Chinese Journal of Animal Nutrition,(2): 406-414[in Chinese]).(  1) 1)
|
| [12] |
孙永科,杨林富,杨亮宇,等.2010.板栗花水提取物体外抑菌活性研究.中国动物传染病学报,(3): 41-44. (Sun Y K,Yang L F,Yang L Y,et al.2010.Study on antibacterial activity of water extract from chestnut flowers.Chinese Journal of Animal Infectious Diseases,(3): 41-44[in Chinese]).(  2) 2)
|
| [13] |
王强,王慧.2009.动物性食品抗生素残留的危害与解决对策.国外畜牧学:猪与禽,(5):87-89. (Wang Q,Wang H.2009.Antibiotic residues in animal food hazards and solutions.Foreign Animal Science, (5): 87-89[in Chinese]).(  1) 1)
|
| [14] |
吴雪辉,张喜梅,李廷群,等.2008.板栗花粗提物的抗氧化活性研究.现代食品科技,(1): 14-16, 19. (Wu X H,Zhang X M,Li T Q,et al.2008.Study on antioxidant activity of crude extract from chestnut flower.Modern Food Science and Technology,(1):14-16, 19[in Chinese]).(  2) 2)
|
| [15] |
徐燏,唐仁.1989.板栗花治疗家畜泄泻.中兽医学杂志,(4):19. (Xu Y,Tang R.1989.Livestock diarrhea treatment by chestnut flowers.Journal of Veterinary,(4):19[in Chinese]).(  1) 1)
|
| [16] |
杨君,吴俊清,Lenka Langhansova,等.2014.炭梅叶精油的化学成分分析与抗氧化、抑菌活性研究.食品科技,01: 286-290. (Yang J,Wu J Q,Lenka Langhansova,et al.2014.Chemical composition,antioxidant and antimicrobial properties of the essential oils of Myric rubra charcoal variety leaves. Food Science and Technology,(1): 286-290.[in Chinese])(  1) 1)
|
| [17] |
张利燕,常虹,赵丽芹,等.2012.理化因素对板栗花雄花序黄酮提取物清除DPPH自由基能力的影响研究.食品工业科技,(17): 81-84,88. (Zhang L Y,Chang H, Zhao L Q,et al.2012.Research on influence of physical and chemical factors to flavonoid extract of the male chestnut flowers's scavenging ability to DPPH free radical. Science and Technology of Food Industry,(17): 81-84,88[in Chinese]).(  1) 1)
|
| [18] |
张尔贤,俞丽君,周意琳,等.1996.Fe2+诱发脂蛋白PUFA过氧化体系及对若干天然产物抗氧化作用的评价.生物化学与生物物理学报,28(2): 218-221. (Zhang E X,Yu L J,Zhou Y L,et al.1996.Studies on the peroxidation of polyunsaturated fatty acid from lipoprotein induced by iron and the evaluation of the anti-oxidative activity of some natural products.Acta Biochimica and Biophysica Binica,28(2):218-221.[in Chinese])(  1) 1)
|
| [19] |
Hao J J, Liu H W, Donis-Gonzalez I R, et al.2012. Antimicrobial activity of chestnut extracts for potential use in managing soilborne plant pathogens. Plant Disease, 96(3): 354-360.( 1) 1)
|
| [20] |
Jelena I, Zoran Z, Ibrahim M, et al. Antioxidant properties of phenolics in Castanea sativa Mill. extracts. Food Technology and Biotechnology,47(4):421-427.( 1) 1)
|
| [21] |
Larrauri J A, Sánchez-Moreno C, Saura-Calixto F. 1998. Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels. J Agric Food Chem, 46(7):2694-2697.( 1) 1)
|
| [22] |
Muji A, Grdovi N, Muji I, et al. 2011 Antioxidative effects of phenolic extracts from chestnut leaves, catkins and spiny burs in streptozotocin-treated rat pancreatic β-cells. Food Chemistry, 125(3):841-849.( 1) 1)
|
| [23] |
Okuda T.2005. Systematics and health effects of chemically distinct tannins in medicinal plants. Phytochemistry, 66:2012-2031.( 1) 1)
|
| [24] |
Vekiari S A, Gordon M H, Garcca-Maccas P, et al. 2008. Extraction and determination of ellagic acid content in chestnut bark and fruit. Food Chemistry, 110(4):1007-1011.( 2) 2)
|
| [25] |
Yokozawa T, Dong E, Natagawa T, et al. 1998. In vitro and in vivo studies on the radical-scavenging activity of tea. J Agric Food Chem, 46(6):2143-2150.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

