文章信息
- 刘彩霞, 焦如珍, 董玉红, 孙启武, 周新华, 李峰卿
- Liu Caixia, Jiao Ruzhen, Dong Yuhong, Sun Qiwu, Zhou Xinhua, Li Fengqing
- 模拟氮沉降对杉木林土壤氮循环相关微生物的影响
- Response of the N-Cycling Associated Soil Microorganism to Simulated N Deposition in a Plantation of Cunninghamia lanceolata
- 林业科学, 2015, 51(4): 96-102
- Scientia Silvae Sinicae, 2015, 51(4): 96-102.
- DOI: 10.11707/j.1001-7488.20150412
-
文章历史
- 收稿日期:2014-03-27
- 修回日期:2015-02-25
-
作者相关文章
2. 中国林业科学研究院亚热带林业实验中心 分宜 336600
2. Centre of Subtropical Forestry, CAF Fenyi 336600
近年来,随着我国工农业的发展,氮沉降量持续升高,由此引发的环境问题也引起了广泛关注(Bai et al.,2010)。高氮沉降量导致土壤氮循环过程发生变化(张晶等,2002)、土壤系统大面积氮流失(Aber et al.,2003;Gundersen et al.,1998)以及氮循环相关微生物群落的数量及组成发生变化(薛璟花等,2007;袁颖红,2012;Horz et al.,2004)。
土壤微生物数量是衡量土壤氮素循环生化功能变化的重要指标(Zumft et al.,1997;Kowalchuk et al.,2001;Hayatsu et al.,2008),目前关于氮沉降对微生物数量的影响研究较多,多集中在微生物区系的变化方面(Frey et al.,2004;薛璟花等,2007)。氮循环微生物的研究多集中在湿地环境中(李谷等,2006),关于氮沉降对土壤氮循环微生物的影响研究较少,且氮输入形式多为铵态氮(李振高等,2004)。Tan(2003)的研究表明:氮输入显著改变了土壤固氮微生物的群落结构,导致固氮微生物多样性下降。 侯海军(2014)运用分子手段进行研究,得出氮输入抑制了固氮菌的生长但氨氧化微生物的数量和活性增加的结论。
本研究试验地设在杉木(Cunninghamia lanceolata)速生丰产林中,并将氮沉降细化为铵态氮沉降和硝态氮沉降,沉降量梯度划分更为细致。 研究短期内2种氮形态氮沉降量对土壤中可培养固氮菌、硝酸细菌、亚硝酸细菌和反硝化细菌数量的影响及其初期的变化趋势,对于森林的氮素调控和环境管理具有重要意义(袁颖红,2012),还可为深入研究氮沉降对杉木林森林生态系统的影响提供参考。
1 材料与方法 1.1 试验地概况试验地位于江西省分宜县大岗山东北部的山下林场,地处我国中亚热带(114°30′ E,27°30′ N)。属低山丘陵地貌,母岩以千枚岩为主,土壤为黄、红壤,地带性植被为常绿阔叶林。年均气温17.5 ℃,年降水量 1 597.3 mm,集中在4—6月,无霜期为268天。
1.2 试验设计2013年5月,选择杉木幼龄林(4年生)代表性样地,在样地中建立30个1 m×1 m的样方,各样方间设置3 m的缓冲带。依据江西九江至鹰潭不同区域的年氮沉降量(约15.2~62.6 kg·hm-2)(王体健,2008;陈能汪,2008),设定本研究的5种氮沉降量,分别为:N0(对照)、N1(20 kg·hm-2a-1)、N2(40 kg·hm-2a-1)、N3(60 kg·hm-2a-1)、N4(80 kg·hm-2a-1),并设定2种氮形态(I铵态氮、Ⅱ硝态氮),每个处理设3个重复。
从2013年5月开始对样地进行氮处理,铵态氮处理使用NH4Cl溶液,硝态氮处理使用KNO3溶液。将每个样方的施氮量分成5等份,于5,6,7,9,11月中旬分别施入样方(Frey et al.,2004;Li et al.,2013;Magill et al.,2004;Venterea et al.,2004),用喷雾器均匀喷洒,对照样地只喷施清水。
1.3 样品采集和测定从氮沉降量和微生物生长活性考虑,分别于2013年6,8,10月,从0~10 cm和10~20 cm土层中分别取土样(12月因温度低微生物活性差而未取样),在4 ℃条件下保存,并尽快带回实验室进行分析。固氮菌数量测定采用稀释平板计数法。硝酸、亚硝酸菌数量的测定采用MPN-Griess比色法,反硝化细菌(厌氧)采用酚二磺比色法(吴云汉等,1998)。
1.4 数据处理用SPSS19.0软件进行方差分析,用Duncan多重检验法和配对样本T检验法比较差异显著性,并使用Sigmaplot作图分析。
2 结果与分析 2.1 2种氮形态和氮沉降量对土壤可培养固氮菌数量的影响不同施氮处理后的可培养固氮菌数量为6月>10月>8月(图 1)。除8月外,各处理0~10 cm土层的固氮菌数量均高于10~20 cm土层。随着氮沉降量的增加,固氮菌数量呈现出先升高后降低的趋势。
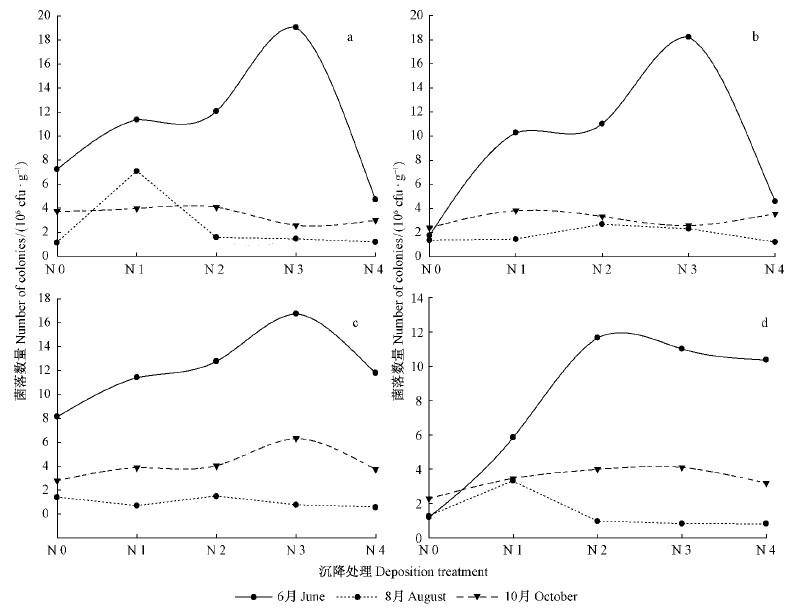 |
图 1 不同土层各氮处理条件下固氮菌的数量变化 Fig. 1 The amount of azotobacter in two soil layer of different nitrogen deposition 土层(铵态氮)Soil layer (NH+4-N):a. 0~10 cm;b. 10~20 cm. 土层(硝态氮)Soil layer (NO-3-N):c.0~10 cm;d. 10~20 cm. |
6月2种氮形态处理的0~10 cm土层中,固氮菌数量变化趋势相同且变化幅度相近,都随氮沉降量的增加表现先上升后下降的趋势,N1、N2处理的变化平缓,N3处理时达到最大值,其值分别为19.042×106,16.739×106 cfu·g-1。10~20 cm土层中,施加铵态氮时固氮菌数量变化趋势与0~10 cm一致,但施加硝态氮时则在N2处理时达到最大值。
8月10~20 cm土层中各氮处理对应的固氮菌数量高于或近似等于0~10 cm土层,其原因可能是受到土壤含水量(表 1)的影响。0~10 cm土层施加铵态氮时,N1处理为最大值,为7.058×106cfu·g-1,N2,N3,N4处理间变化不明显。而施加硝态氮虽然符合总体的变化趋势,但变化幅度较小。10~20 cm土层施加铵态氮时N2处理达到最大值,为2.691×106 cfu·g-1,硝态氮N1处理时达到最大值,为3.332×106 cfu·g-1。
|
|
10月0~10 cm土层中各氮处理的固氮菌数量均大于10~20 cm土层。施加铵态氮时,N3处理2土层中的固氮菌数量均达到最小值,分别为2.574×106,2.584×106 cfu·g-1; 而施加硝态氮时,N3处理均达到最大值,分别为6.325×106,4.108×106 cfu·g-1。
2.2 2种氮形态和氮沉降量对土壤可培养亚硝酸细菌数量的影响如表 2所示,0~10 cm土层施加铵态氮时,菌落数量为先升高再降低最后趋于平缓,N1或N2处理时达到最大值;施加硝态氮时,菌落数量为先降低再升高最终趋于平稳。这说明0~10 cm土层中 0~20 kg·hm-2a-1铵态氮对亚硝酸细菌的生长具有促进作用,而0~20 kg·hm-2a-1硝态氮则具有抑制作用。8月随沉降量的变化趋势略微滞后,到N2处理才下降。其原因为8月的土壤含水量较低,沉降的氮未被土壤团吸收,即可利用氮含量较低且分布不均匀。
|
|
二土层间的亚硝酸细菌数量差异没有明显规律,可能是因为0~10 cm土层的有机质含量高因而菌量高,而10~20 cm土层的缺氧程度高,适宜厌氧微生物活动,反硝化和氨化作用强,并且受到的扰动较小,即下层更有利于铵态氮的保存,菌量也高。所以双因素综合影响下亚硝酸菌的数量变化较为波动。月份间菌数变化较大,10月的菌落数量值明显低于其他月份,可能是受温度的影响。 2种氮形态对菌落数量影响不同。不同铵态氮沉降量时菌落数量变化幅度较大,不同硝态氮沉降量时则变化幅度较小且变化趋势与铵态氮沉降时相反,其原因为亚硝酸细菌可直接利用铵态氮,把其转化为亚硝酸,而硝态氮需要经过转化才能被利用。
从表 2可知,6月的0~10 cm土层中相同铵态氮和硝态氮处理时,亚硝酸细菌数量差异极显著,10~20 cm土层中则差异显著,8月和10月各土层对应处理间未出现显著性差异。可见,沉降初期铵态氮和硝态氮对亚硝酸菌数量的影响差异较明显。
2.3 2种氮形态和氮沉降量对土壤可培养硝酸细菌数量的影响如表 3所示,6月0~10 cm土层中各氮处理对应的硝酸菌数量大于10~20 cm土层。0~10 cm土层中沉降二种形态的氮对硝酸菌数量变化趋势影响相同,其数量随氮沉降量的增加先下降后上升最后趋于平缓。 二种形态氮处理均以对照样地中菌落数量为最大值(4.331×105 cfu·g-1和6.909×105 cfu·g-1),在铵态氮的N2处理和硝态氮的N1处理为最小值(1.995×105 cfu·g-1和2.853×105 cfu·g-1),其他处理间变化较平缓。10~20 cm土层中,施加铵态氮时硝酸细菌数量变化趋势与0~10 cm土层一致,但施加硝态氮时,N4处理时硝酸细菌数量明显上升。
|
|
8月与10月的变化趋势相同,均为随着氮沉降量的增加先上升后下降最后再上升,即0~20 kg·hm-2a-1氮沉降量促进硝酸细菌数量的增长,而中氮处理开始出现抑制作用。其原因为氮输入导致了氮的积累,游离出来的NH4+等物质会抑制了硝化作用。8月二土层的菌落数量分布没有明显的规律,其原因为8月二土层间土壤含水量差异的波动性(表 1)。0~10 cm土层沉降二种形态氮时菌落数量变化趋势相同且变化幅度相近,均为先升高再降低最后再升高。10~20 cm土层中施加硝态氮时的菌落数量与0~10 cm一致,但施加铵态氮时其变化趋势为先降低再升高最后再降低。10月二土层的硝酸细菌数量均低于其他月份,且各处理间的变化平缓。从配对样本T检验的显著性值可知,氮形态对硝酸细菌数量的影响不显著。
2.4 2种氮形态和氮沉降量对土壤可培养反硝化细菌数量的影响反硝化细菌与其他微生物数量随时间的变化不同,其在10月时数量达到最大值。0~10 cm土层中施加氨态氮,6月和8月的反硝化细菌的数量变化趋势为先增加再降低再增加,但10月的数据则为先降低再增加再降低,原因为每次沉降后氮量逐次累加。施加硝态氮时,反硝化细菌数量变化较为平缓,高氮处理时有轻微的抑制作用。10~20 cm土层中施加铵态氮时,6月和10月的菌落数量变化趋势为先降低再升高再降低。8月数据的变化动态与0~10 cm一致。施加硝态氮时,其变化曲线成波浪状,且变化幅度较小。
由图 2可知二土层间的菌落数量变化较为波动,没有呈现出明显的规律,其原因可能为表层土壤的氮素含量及有机质含量较高,但下层土壤与表层土壤比较,透气性较差,适合厌氧细菌的生长。二因素的综合作用导致了变化的不稳定性。反硝化细菌可直接利用硝态氮源,但在沉降硝态氮时变化却不显著,其原因可能为影响氮素转化的因素较多,仅增加氮输入量,对其生态系统的影响不能迅速显现,其影响存在滞后性。
 |
图 2 不同土层间各氮处理条件下反硝化细菌的数量变化 Fig. 2 The amount of denitrobacteria in two studied soil layer of different nitrogen deposition 土层(铵态氮)Soil layer (NH+4-N):a. 0~10 cm;b. 10~20 cm. 土层(硝态氮)Soil layer(NO-3-N):c. 0~10 cm;d. 10~20 cm. |
不同微生物的生理特性和氮需求各不同,因而不同形态氮的沉降对不同微生物群落的影响也有所差异。越来越多的证据表明,微生物生长常常受氮素水平的限制(Landi et al.,2006)。 氮沉降可改变微生物种群的生理特性,进而改变群落动力学,最终使得微生物群落数量和组成发生变化(Jangid et al.,2008),但变化不大(Waldrop et al.,2004)或是长期沉降才会发生较大变化(Avrahami et al.,2003)。
本研究中,固氮菌数量随着氮沉降量的增加先升高后降低,即低于60 kg · hm-2a-1铵态氮更有利于固氮菌的生长,而高于60 kg· hm-2a-1时反而抑制其生长。这与侯海军(2014)得出的氮输入可抑制固氮菌生长的结论不完全相同,其原因可能为本研究采用培养法测定,而侯海军则是使用分子标记法测定,测定的微生物数量间存在差异。多数样地中0~10 cm土层中固氮菌数量高于10~20 cm土层,但不同月份间变化略有差异。
硝酸细菌和亚硝酸细菌含量较小,原因为江西为偏酸性土壤,而硝酸细菌的生长最适pH值为6.5~7.5,亚硝酸细菌为7.0~8.5(金志刚等,1998)。硝酸菌在8月与10月的数量变化趋势相同,均为随着氮沉降量的增加先上升再下降再上升,但氮形态对硝酸细菌数量的影响不显著。亚硝酸数量在二土层间数量分布没有明显规律;但6月的0~10 cm土层中,沉降相同量的铵态氮和硝态氮时,亚硝酸细菌数量出现极显著差异,10~20土层中出现显著性差异。8月和10月各土层间未出现显著性差异,即沉降初期铵态氮和硝态氮对亚硝酸菌数量的影响差异较显著。
反硝化细菌与其他菌落随时间的变化不同,其在10月时数量达到最大值。二土层间的菌落数量变化较为波动,没有呈现出明显的规律,其原因可能为表层土壤的氮素含量及有机质含量较高,但下层土壤与表层土壤比较,透气性较差,二因素的综合作用,导致了变化的不稳定性。施加氨态氮时,二土层的变化趋势相反。施加硝态氮时,反硝化细菌的数量变化较为平缓,在高氮处理时有轻微的抑制作用。
相关性分析表明,不同处理间的菌落数量相关系数较低。整个氮素循环系统中的微生物数量还没呈现出明显的关联性变化。其原因为各处理和采样的间隔时间较短,虽然氮输入量不断增加,整个氮循环系统中菌落数量不断变化,但整个系统的调节需要一定的时间来稳定,然后才能呈现各菌落间的相关性变化,所以还需要长时间的观察和监测。
本试验仍存在需进一步研究的问题。首先是氮沉降影响的滞后性问题。由于土壤微生物分布广泛且数量巨大,在短期内氮沉降对土壤微生物的影响难以完全显现出来,需要进行长期现测。其次,本实验对固氮菌、硝酸细菌、亚硝酸细菌和反硝化细菌的记数均在28 ℃条件下进行,而实际土壤温度随气象条件(温度、降水等)的不同存在差异。常温下的记数结果能否准确反映沉降处理下的实际情况仍需进一步探讨,特别是结合氮素代谢过程中的相关酶活性,如脲酶、过氧化氢酶、硝酸酶、亚硝酸酶和反硝化酶活性来进一步研究(曹喜涛等,2004)。
| [1] |
曹喜涛, 黄为一, 常志州, 等. 2004. 鸡粪堆肥中氮转化微生物变化特征的初步研究. 土壤肥料, 40(4):40-43. (Cao X T,Huang W Y,Chang Z Z. 2004. Nitrogen transformations and the successions of microbial community during chicken manure composting.Soils and Fertilizers,40(4): 40-43[in Chinese]).(  1) 1)
|
| [2] |
陈能汪, 洪华生, 张珞平. 2008. 九龙江流域大气氮湿沉降研究. 环境科学,29 (1): 38-46. (Chen N W,Hong H S,Zhang G P.2008.Wet deposition of atmospheric nitrogen in Jiulong River watershed. Environmental Science,29(1):38-46[in Chinese]).(  1) 1)
|
| [3] |
侯海军, 秦红灵, 陈春兰, 等. 2014. 土壤氮循环微生物过程的分子生态学研究进展. 农业现代化研究, 5(35): 0-15. (Hou H J, Qin H L, Chen C L. Research progress of the molecular ecology on microbiological processes in soil nitrogen cycling.Research of Agricultural Modernization,5(35): 0-15[in Chinese]).(  2) 2)
|
| [4] |
金志刚, 屈计宁, 何群彪. 1998. 硝化细菌富集技术分析及方法研究. 上海环境科学, 17(8): 16-19. (Jin Z G,Qu J N,He Q B.1998.Study on analytical and methods of nitrifying bacteria enrichment technology. Shanghai Environmental Science,17(08): 16-19[in Chinese]).(  1) 1)
|
| [5] |
李谷, 吴振斌, 侯燕松, 等. 2006.养殖水体 氮的生物转化及其相关微生物研究进展.中国生态农业学报, 14(1): 11-15. (Li G, Wu Z B, Hou Y S. 2006. Nitrogen biotransformation and its relative microorganism in aquaculture waters.Chinese Journal of Eco-Agriculture,14(1): 11-15[in Chinese]).(  1) 1)
|
| [6] |
李振高, 俞 慎, 吴胜春, 等.2004. 不同氮肥对水稻根圈微生物生物量及硝化-反硝化细菌的影响. 土壤,35(6): 490-494. (Li Z G,Yu S,Wu S C.2004. Effects of different nitrogen fertilizers on the microbial biomass and the population of nitrifying-denitrifying bacteria in the rice rhizosphere. Soils,35(6):490-494.[in Chinese])(  1) 1)
|
| [7] |
王体健, 刘倩, 赵 恒, 等. 2008. 江西红壤地区农田生态系统大气氮沉降通量的研究. 土壤学报,45(02):280-287. (Wang T J,Liu Q,Zhang H,et al.2008. Atmospheric nitrogen deposition in agrecosystem in red soil region of Jiangxi Province. Acta Pedologica Sinica,45(02): 280-287[in Chinese]).(  1) 1)
|
| [8] |
吴云汉. 1998. 微生物学实验技术. 北京: 气象出版社. (Wu Y H.1998.Laboratory Manual of Microbiology.Beijing:China Meteorological Press.[in Chinese])(  1) 1)
|
| [9] |
薛璟花,莫江明,李炯,等. 2007.土壤微生物数量对模拟氮沉降增加的早期响应. 广西植物,27(2): 174-179. (Xue J H, Mo J M, Li J, et al.2007.The short term response of soil microorganism number to simulated nitrogen deposition.Guihaia, 27 (2): 174 - 179[in Chinese]).(  2) 2)
|
| [10] |
袁颖红,樊后保,李辉信,等. 2012. 模拟氮沉降对杉木人工林土壤微生物的影响.林业科学,48(9): 8-14. (Yuan Y H,Fan H B, Li H X,et al.2012.Effects of simulated nitrogen deposition on soil microorganism in a Chinese Fir plantation. Scientia Silvae Sinicae,48(09): 8-14[in Chinese]).(  2) 2)
|
| [11] |
张晶, 林先贵, 尹睿. 2009. 参与土壤氮素循环的微生物功能基因多样性研究进展. 中国生态农业学报, 17(5): 1029-1034. (Zhang J,Lin X G,Yin R.2009.Advances in functional gene diversity of microorganism in relation to soil nitrogen cycling.Chinese Journal of Eco-Agriculture,17(05): 1029-1034[in Chinese]).(  1) 1)
|
| [12] |
Aber J D, Goodale C L, Ollinger S V, et al. 2003. Is nitrogen deposition altering the nitrogen status of northeastern forests? BioScience, 53(4): 375-389.( 1) 1)
|
| [13] |
Avrahami S, Liesack W C.2003. Effects of temperature and fertilizer on activity and community structure of soil ammonia oxidizers. Environ Microb, 5(8): 691-705.( 1) 1)
|
| [14] |
Bai Y, Wu J, Clark C M, et al. 2010. Tradeoffs and thresholds in the effects of nitrogen addition on biodiversity and ecosystem functioning: evidence from Inner Mongolia grasslands. Global Change Biology,16(1): 358-372.( 1) 1)
|
| [15] | Compton J E, Watruda L S, Porteousa L A, et al.2004. Response of soil microbial biomass and community composition to chronic nitrogen additions at Harvard forest.Forest Ecology and Management, 196(1):143 -158. |
| [16] | Deforest J L, Zaka D R, Pregitzerc K S, et al.2004. Atmospheric nitrate deposition and the microbial degradation of cellobiose and vanillinin in a northern hardwood forest.Soil Biology and Biochemistry, 36(6):965-971. |
| [17] |
Frey S D, Knorr M, Parrent J L, et al.2004.Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests. Forest Ecol Manag,196(1): 159-171.( 2) 2)
|
| [18] |
Gundersen P, Emmett B A, Kjnaas O J, et al.1998. Impact of nitrogen deposition on nitrogen cycling in forests: a synthesis of NITREX data. Forest Ecology and management, 101(1): 37-55.( 1) 1)
|
| [19] |
Hayatsu M, Tago K, Saito M.2008. Various players in the nitrogen cycle: diversity and functions of the microorganisms involved in nitrification and denitrification. Soil Science and Plant Nutrition, 54(1): 33-45.( 1) 1)
|
| [20] |
Horz H P, Barbrook A, Field C B, et al.2004.Ammonia-oxidizing bacteria respond to multifactorial global change. Proceedings of the National Academy of Sciences of the United States of America, 101(42): 15136-15141.( 1) 1)
|
| [21] |
Jangid K, Williams M A, Franzluebbers A J, et al.2008. Relative impacts of land-use, management intensity and fertilization upon soil microbial community structure in agricultural systems. Soil Biology and Biochemistry, 40(11): 2843-2853.( 1) 1)
|
| [22] |
Kowalchuk G A, Stephen J R.2001.Ammonia-oxidizing bacteria: a model for molecular microbial ecology.Annual Reviews in Microbiology, 55(1): 485-529.( 1) 1)
|
| [23] |
Landi L, Valori F, Ascher J, et al.2006. Root exudate effects on the bacterial communities, CO2 evolution, nitrogen transformations and ATP content of rhizosphere and bulk soils.Soil Biology and Biochemistry,38(3): 509-516.( 1) 1)
|
| [24] |
Li F, Liu M, Li Z, et al.2013. Changes in soil microbial biomass and functional diversity with a nitrogen gradient in soil columns. Applied Soil Ecology, 64: 1-6.( 1) 1)
|
| [25] |
Magill A H, Aber J D, Currie W S, et al.2004. Ecosystem response to 15 years of chronic nitrogen additions at the Harvard Forest LTER, Massachusetts, USA. Forest Ecology and Management, 196(1): 7-28.( 1) 1)
|
| [26] |
Tan X Y, Hurek T, Reinhold-Hurek B.2003. Effect of N-fertilization,plant genotype and environmental conditions on nifH gene pools in roots of rice. Environmental Microbiology, 5 (10): 1009-1015.( 1) 1)
|
| [27] |
Venterea R T, Groffman P M, Verchot L V, et al.2004. Gross nitrogen process rates in temperate forest soils exhibiting symptoms of nitrogen saturation. Forest Ecology and Management, 196(1): 129-142.( 1) 1)
|
| [28] |
Waldrop M P, Firestone M K. 2004. Altered utilization patterns of young and old soil C by microorganisms caused by temperature shifts and N additions. Biogeochemistry, 67(2): 235-248.( 1) 1)
|
| [29] |
Zumft W G.1997.Cell biology and molecular basis of denitrification. Microbiology and Molecular Biology Reviews, 61(4): 533-616.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

