文章信息
- 韩淑梅, 李军, 吕蕊花, 王晓红, 刘长英, 赵爱春, 鲁成, 余茂德
- Han Shumei, Li Jun, Lü Ruihua, Wang Xiaohong, Liu Changying, Zhao Aichun, Lu Cheng, Yu Maode
- 桑树MLX56基因家族特性、克隆及表达分析
- Characteristics, Cloning and Expression of the MLX56 Gene Family in Mulberry
- 林业科学, 2015, 51(4): 60-70
- Scientia Silvae Sinicae, 2015, 51(4): 60-70.
- DOI: 10.11707/j.1001-7488.20150408
-
文章历史
- 收稿日期:2014-06-27
- 修回日期:2014-10-12
-
作者相关文章
地球上有1.2~3.6万种植物能够分泌乳汁(Dussourd et al., 1991; 1987; Farrel et al.,1991; Harborne,1993),桑树(Morus)的根、茎韧皮部及叶的维管束中均有乳管,是一种能分泌乳汁的木本植物(柯益富等,1997)。乳汁成分富含多种酶类及蛋白质,例如半胱氨酸蛋白酶、丝氨酸蛋白酶、几丁质酶、凝集素等。木瓜蛋白酶和无花果蛋白酶都是半胱氨酸蛋白酶的代表,其中,番木瓜(Carica papaya)植物乳汁中含有的木瓜蛋白酶,对杂食性昆虫具有较强的致死性,对黏虫的生长具有抑制作用(Konno et al.,2004)。白花牛角瓜(Calotropis procera)植物乳汁中含有几丁质酶,对四纹豆象(Callosobruchus maculatus)具有明显的毒害作用(Ramos et al.,2007),长叶莴苣(Lactuca dolichophylla)植物乳汁中含有多酚氧化酶(PPO)、过氧化物酶(POD)及苯丙氨酸解氨酶(PAL),对带状黄瓜甲虫具有较强的耐受性(Sethi et al.,2009)。
MLX56是从桑树乳胶中纯化出来的一种几丁质结合蛋白,大小为56 kDa,在很低浓度时就表现出对杂食性昆虫的抑制作用,N-端含有2个几丁质结合域,中间有一段伸展蛋白区域,C-端含有无活性的类几丁质酶结构域(Wasano et al.,2009)。MLX56蛋白对多种杂食性昆虫具有较强的毒害作用,但家蚕(Bombyx mori)却不受影响,说明MLX56基因在桑树抗虫防御过程中起重要作用。大量的研究显示,几丁质酶在植物中不仅起到抗真菌病害的作用,而且在植物发育、抗胁迫及共生固氮等方面有着重要作用。人们对植物乳汁的研究越来越深入,而桑科(Moraceae)植物均含有乳汁,不同种属间的乳汁成分也不一样,说明了研究桑树乳汁的必要性。
本研究以桑树全基因组序列为对象,利用生物信息学方法,鉴定桑树基因组中乳胶蛋白基因家族,从分子水平解析MLX56基因家族的基本结构和组织表达,并探讨桑树乳汁中的防御蛋白与其他植物乳汁中防御蛋白的进化关系,对进一步研究桑树MLX56基因与鳞翅目(Lepidoptera)昆虫(尤其是家蚕)的相互关系具有重要意义。
1 材料与方法 1.1 试验材料 1.1.1 植物材料白桑(M.alba)品种‘枝垂桑’、‘新一之濑’、‘红果1号’、‘红果2号’、‘紫荆桑’; 鲁桑(M. multicaulis)品种‘湖桑32号’、‘小鸡冠’; 华桑(M. cathayana)品种‘圆叶皮桑’; 广东桑(M. atropurpurea)品种‘大10’、‘伦教40号’、‘斯里兰卡1号桑’、‘桂优62号’; 鸡桑(M. australis)品种‘柬埔寨桑’; 山桑(M. bombycis)品种‘西农6071桑’; 瑞穗桑(M. mizuho)品种‘火桑1号’; 以及长果桑(M. laevigata)、印度桑(M. indica)、黑桑(M. nigra)均取自西南大学桑树种质资源圃,选取桑树幼嫩组织,用液氮速冻后保存于-80 ℃冰箱中备用。
1.1.2 试验试剂pMD19-T载体、RNA提取试剂盒(RNAiso plus)、反转录酶M-MLV、T4连接酶、限制性内切酶均购自TaKaRa公司,大肠杆菌(Escherichia coli)BL21(DE3)表达感受态细胞购自北京全式金公司,一抗(兔抗His标签多单克隆抗体)、二抗购自南京金斯瑞公司,其他试剂为国产分析纯。
1.2 方法 1.2.1 桑树MLX56基因家族的鉴定与引物设计根据NCBI已报道的桑树MLX56蛋白序列(GenBank: EF535852.2),在桑树基因组数据库中进行BLAST检索,获得相似度较高的序列,在NCBI数据库中利用BLASTX程序进行比对,以获得假定的蛋白序列。根据桑树MLX56基因序列的特点,设计引物F1,R1(F1: ATGAAGTTKAKAACTCTTTT AATMR; R1: CGAGCAACTTCYGAGAAATRCGTTT)用于扩增基因全长序列。
1.2.2 总RNA提取及反转录取0.1~0.2 g桑树组织于预冷的研钵中迅速研磨成粉末,参照TaKaRa公司RNA抽提试剂盒说明书提取桑树组织总RNA,利用DNA酶对总RNA进行消化。利用1%琼脂糖变性凝胶电泳及微量紫外分光光度计检测RNA质量和浓度。用DNA酶消化过的RNA为模板,以R and om primer为引物,利用M-MLV反转录酶合成cDNA第1链,-20 ℃保存备用。
1.2.3 PCR产物的克隆与测序用DNA凝胶回收试剂盒回收PCR产物,将回收产物与pMD19-T载体连接,经转化、抗性筛选后,随机挑选单菌落,扩大培养后进行菌落PCR鉴定。选取阳性克隆送至南京金斯瑞基因有限公司进行测序。
1.2.4 MLX56基因的生物信息学分析通过MUSCLE程序对克隆到的桑树MLX56基因序列进行比对分析,利用MEGA4.1程序,采用邻接法(Neighbor-Joining,NJ)生成MLX56基因的系统进化树,校验参数重复1 000 次。使用SMART(http://smart.embl-heidelberg.de/)数据库工具建立桑树MLX56基因结构域模型,同时使用SWISS-MODEL(http://swissmodel.expasy.org/)网站对桑树MLX56基因的三维结构进行分析。MLX56基因氨基酸序列的分子量、等电点分析在ExPasy网站(http://web.expasy.org/)上进行。信号肽预测在网站(http://www.cbs.dtu.dk/services/SignalP/)上进行。
1.2.5 18份桑树种质材料RT-PCR分析以18份桑树种质材料的幼叶RNA为材料,利用桑树肌动蛋白基因MaACT3(Actin-F: AGAACACCCTGTT CTCCTCACT; Actin-R: GATGACCTGTCCATCTGGC AA)(李军等,2011)为内参,调整各样品RNA浓度,根据鉴定到的MLX56基因家族相关序列设计特异引物(表 1),采用半定量RT-PCR法研究MLX56基因家族的7个基因在不同桑树种质材料幼叶中的表达情况。
|
|
以广东桑‘桂优62号’成熟叶、幼叶、叶柄、茎、表皮、根RNA为材料,调整各样品RNA浓度,根据鉴定到的MLX56基因家族相关序列设计特异引物(表 1),采用半定量RT-PCR法研究MLX56基因家族的7个基因在‘桂优62号’不同组织的表达情况。
1.2.7 桑树MLX56-6基因原核表达分析根据已克隆到的MLX56-6基因序列,设计原核表达引物MLX56-6F: 5′-CGAGCTCATGAAGTTKAGAACTCTT TTAAT-3′; MLX56-6R: 5′-CCCTCGAGTTAGATGCG AGCAACTTCYGAGA-3′(下划线为SacⅠ和XhoⅠ酶切位点)。将PCR产物经SacⅠ和XhoⅠ酶切消化后插入已被SacⅠ和XhoⅠ酶切消化后的表达质粒载体pET-28a(+),构建原核表达载体pET-28a-MLX56-6,将重组质粒转化大肠杆菌BL21(DE3)表达感受态细胞中,挑取阳性重组子,进行测序鉴定。
将鉴定好的阳性表达菌株pET-28a-MLX56-6接种于5 mL LB液体培养基(含50 μg·mL-1卡那霉素),37 ℃振荡培养12 h; 然后按1:100比例接种于100 mL TB液体培养基(含50 μg·mL-1卡那霉素)中,37 ℃培养至OD600 nm值在0.5~0.8之间,加IPTG至终浓度为0.5 mmol·L-1,28 ℃诱导蛋白表达,分别取0,2,3,4,5,6 h的菌体,对所收集菌体处理后,进行SDS-PAGE电泳验证。
1.2.8 融合蛋白Western Blot检测收集6 h的大肠杆菌BL21(DE3)菌液,4 ℃,12 000 r·min-1离心10 min,将得到的菌体用PBS缓冲液溶解后,进行超声波破碎,直到溶液透明度高、黏稠度低时,停止超声处理。将破碎后菌体离心(4 ℃,12 000 r·min-1,共10 min),分别收集上清和沉淀,经12%SDS-PAGE电泳后,80 V转膜1.5 h,用封闭液(TBST+5%脱脂奶粉)4 ℃封闭过夜,随后与鼠抗6×His单克隆抗体(1:1 000)室温孵育1 h,TBST 洗膜缓冲液清洗3次; 再与辣根过氧化酶标记的羊抗小鼠二抗(1:5 000)孵育1 h后,TBST 洗膜缓冲液清洗3次; ECL避光显色5 min,置于成像系统曝光1 min后拍照记录。
1.2.9 pET-28a-MLX56-6重组质粒不同培养时间生长速率的测定将鉴定好的阳性表达菌株pET-28a-MLX56-6接种于5 mL LB液体培养基(含50 μg·mL-1卡那霉素),37 ℃恒温振荡12 h; 然后按1:100比例接种于100 mL TB液体培养基(含50 μg·mL-1卡那霉素)中,37 ℃培养至OD600 nm值在0.5~0.8之间,加IPTG至终浓度为0.5 mmol·L-1; 混匀后,以每支5 mL分装于标记为0,0.5,1,1.5,2,2.5,3,…,6的13支试管中,迅速把标记为0除外的其余试管置于 28 ℃,220 r·min-1摇床上振荡培养; 以后每隔0.5 h取出试管,以无菌的TB液体培养基作为对照,在600 nm波长下,用分光光度计测定不同生长时间培养液的OD值。每个样品3个重复,取其平均值。
2 结果与分析 2.1 桑树MLX56家族基因结构及系统进化分析通过在桑树基因组数据库中BLASTX比对分析,获得了6个假定的MLX56基因,位于Scaffold 306上,为串联重复序列(图 1),各基因间核苷酸序列具有极高的相似性,仅有几个碱基的差别。将这6个MLX56基因分别命名为MLX56-1,MLX56-2,MLX56-3,MLX56-4,MLX56-5和MLX56-6。6个桑树MLX56基因编码区序列长约2 000 bp,其中,4个MLX56基因内含子数为1,另外2个MLX56基因含有2个内含子。通过对桑树MLX56基因家族的多重比对分析(图 2),结果显示MLX56-3,MLX56-1,MLX56-5和MLX56-6聚类于一支,MLX56-2和MLX56-4聚类于一支,2个类群各内部成员之间相似度较高,但基因结构差别较大。
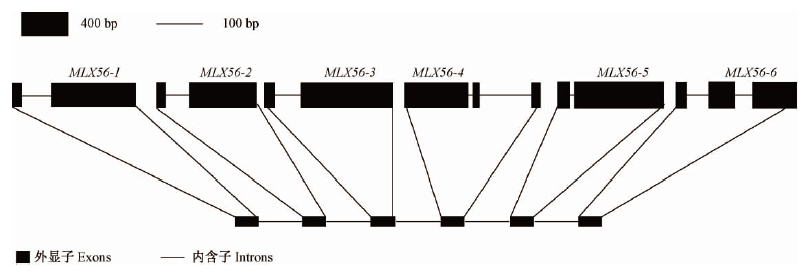 |
图 1 桑树MLX56基因家族结构 Fig. 1 The structure of MLX56 gene family in mulberry |
 |
图 2 桑树MLX56基因家族核苷酸序列多重比对 Fig. 2 Multiple sequence alignment of nucleic acid sequence of MLX56 gene family in mulberry |
在NCBI数据库中下载了葡萄(Vitis vinifera)、茶树(Camellia sinensis)、苦瓜(Momordica charantia)等8个种的9个相似MLX56基因,通过同源性比对发现桑树编码的氨基酸序列与西洋接骨木(Sambucus nigra)类橡胶蛋白(AAL30422.1)的同源性为66%,与欧洲栗(Castanea sativa)内切几丁质酶(AAB01895.1)、湖北海棠(Malus hupehensis)几丁质酶(ACJ38195.1)、苦瓜几丁质酶(ABD66068.1)、二色补血草(Limonium bicolor)几丁质酶(ABD92819.1)、异株荨麻(Urtica dioica)同工凝集素前体(AAD03614.1)的同源性分别为51%,51%,51%,51%,56%,与茶树几丁质酶(AET95643.1)、葡萄几丁质酶(CAC14015.1)的同源性分别为49%,48%。
进化分析发现这些氨基酸序列可以聚为2个亚群(图 3): Group I和Group Ⅱ。其中Group I包括桑树的MLX56蛋白、西洋接骨木类橡胶蛋白和异株荨麻同工凝集素前体,其中异株荨麻同工凝集素前体和MLX56蛋白是几丁质结合凝集素,西洋接骨木类橡胶蛋白是含有几丁质结合域的类橡胶蛋白; Group Ⅱ包括葡萄几丁质酶、茶树几丁质酶、二色补血草几丁质酶、苦瓜几丁质酶、湖北海棠几丁质酶、欧洲栗内切几丁质酶,它们都含有几丁质酶结构域; 桑树MLX56基因家族的7个基因与西洋接骨木类橡胶蛋白和异株荨麻同工凝集素前体关系较近,而与葡萄几丁质酶及茶树几丁质酶的关系最远。
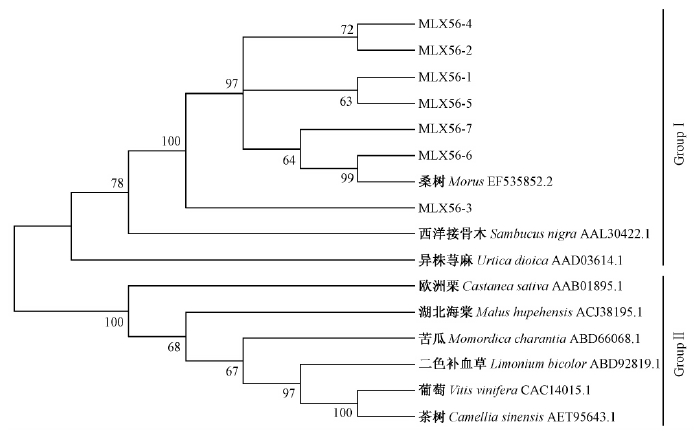 |
图 3 桑树MLX56基因家族系统进化树 Fig. 3 The Neighbor-Joining tree of MLX56 gene family in mulberry |
以18份桑树种质材料的幼叶cDNA为模板,采用引物F1,R1对桑树材料进行PCR扩增,获得大小约1 100 bp的DNA片段,将该片段克隆进pMD19-T载体,每份材料选取10个阳性克隆送至南京金斯瑞公司测序。通过序列比对分析发现这些基因片段的核苷酸序列高度相似,且多部分克隆为MLX56-5和MLX56-6(图 4)。此外,还克隆到1个新的基因,命名为MLX56-7。3个基因具有一个典型的特征重复序列,与预测的MLX56家族基因具有相同的特征。通过SWISS-MODEL工具对3个类群的蛋白质三维结构分析发现(图 5),N端重复序列与MLX56蛋白的三维结构直接相关。MLX56-7与MLX56-6的蛋白质结构相似度较高,MLX56-6的蛋白质三级结构比MLX56-7多了一段无规卷曲,MLX56-5与前2个类群的蛋白存在较大差异,此蛋白三级结构缺失了1个α螺旋,暗示该蛋白的功能可能与其他2类蛋白存在较大差异。3个MLX56基因的理化性质分析(表 2)表明: MLX56基因最长的有410个氨基酸,最短的有370个氨基酸,其等电点(pI)为6.03~6.48,分子量为41.54~44.88 kDa。信号肽预测显示,MLX56基因信号肽含有22个氨基酸,且含有较强的分泌信号,表明它是一种分泌蛋白。
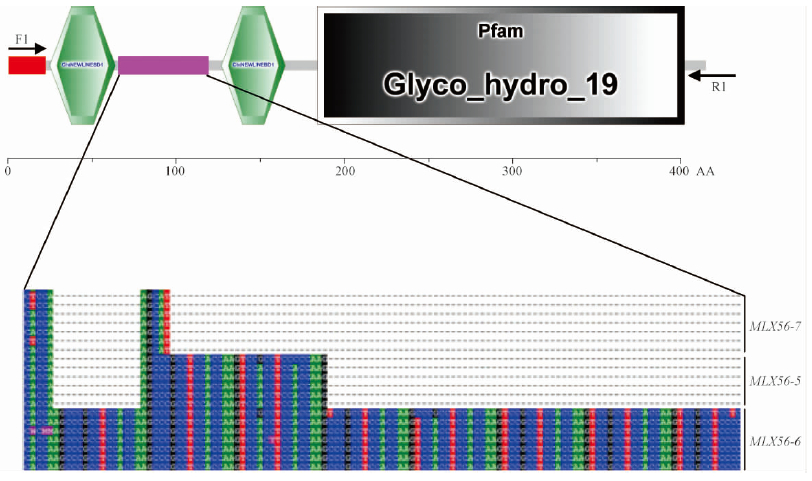 |
图 4 桑树MLX56基因家族结构域分析 Fig. 4 Domain analysis of MLX56 gene family in mulberry |
 |
图 5 桑树MLX56基因家族蛋白质三维结构 Fig. 5 3-D structure of MLX56 gene family in mulberry |
|
|
为研究MLX56基因在桑树中的多态性,利用半定量RT-PCR检测7个MLX56基因家族在18份桑树种质材料中的表达情况(图 6),结果表明MLX56-1,MLX56-2,MLX56-4,MLX56-5,MLX56-6,MLX56-7基因在白桑品种‘枝垂桑’和‘新一之濑’、鲁桑品种‘湖桑32号’和‘小鸡冠’中均有表达,MLX56-2和MLX56-4基因在18份桑树材料中均有表达,而MLX56-3基因在18份桑树材料中没有检测到表达。其中,MLX56-1基因在白桑品种‘枝垂桑’中的表达水平较高,而在白桑品种‘新一之濑’、鲁桑品种‘湖桑32号’和‘小鸡冠’中的表达水平较低,在其他桑树种质材料中未检测到表达;MLX56-2基因在白桑品种‘枝垂桑’、‘新一之濑’、‘红果1号’、‘红果2号’,鲁桑品种‘湖桑32号’和‘小鸡冠’中的表达水平较高,在其他桑树种质中的表达较低;MLX56-4基因在华桑品种‘圆叶皮桑’和广东桑品种‘伦教40号’中的表达水平较低,在其他桑树种质材料中的表达水平较高;MLX56-5基因在长果桑和白桑品种‘紫荆桑’中未检测到表达,在华桑品种‘圆叶皮桑’和广东桑品种‘伦教40号’中表达水平较低,在其余桑树种质材料中的表达水平较高;MLX56-6基因在华桑品种‘圆叶皮桑’和广东桑品种‘伦教40号’未检测到表达,在其余桑树种质材料中的表达水平较高; MLX56-7基因在白桑品种‘紫荆桑’和黑桑中未检测到表达,在白桑品种‘新一之濑’、 鲁桑品种‘小鸡冠’及广东桑品种‘桂优62号’和‘斯里兰卡1号桑’中的表达水平较高,在其他桑树种质中的表达水平较低。2.4 广东桑‘桂优62号’MLX56基因半定量RT-PCR分析利用半定量RT-PCR检测7个MLX56基因家族在广东桑‘桂优62号’各组织的表达情况(图 7),结果表明MLX56-1,MLX56-2,MLX56-4,MLX56-5,MLX56-6,MLX56-7基因在‘桂优62号’的叶柄和茎中均有表达,MLX56-3基因在各个组织中没有检测到表达。其中,MLX56-1基因在叶柄和茎中的表达水平较低,在幼叶、成熟叶、表皮和根中未检测到表达; MLX56-2,MLX56-4,MLX56-5,MLX56-6,MLX56-7基因在‘桂优62号’各个组织中都有表达,MLX56-4基因的表达水平较高。
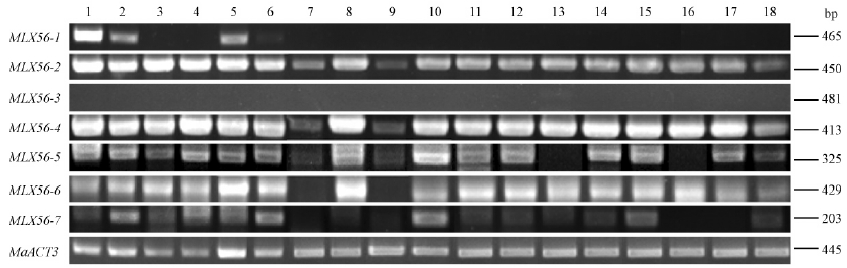 |
图 6 18份桑树材料MLX56基因的半定量RT-PCR分析
Fig. 6 Semi-quantitative PCR analysis of MLX56 gene in 18 mulberry materials
1:白桑‘枝垂桑’M. alba ‘Zhichui’;
2:白桑‘新一之濑’ M.alba ‘Shinicinose’;
3:白桑‘红果1号’M. alba ‘Hongguo1’;
4:白桑‘红果2号’M. alba ‘Hongguo2’;
5:鲁桑‘湖桑32号’M. multicaulis ‘Husang32’; 6:鲁桑‘小鸡冠’M.multicaulis ‘Xiaojiguan’; 7:华桑‘圆叶皮桑’M. cathayana ‘Yuanyepisang’; 8:广东桑‘大10’ M. atropurpurea ‘Da10’; 9:广东桑‘伦教40号’M. atropurpurea ‘Lunjiao40’; 10:广东桑‘桂优62号’M. atropurpurea ‘Guiyou62’; 11:鸡桑‘柬埔寨桑’M. australis ‘Jianpuzhai’; 12:山桑‘西农6071桑’M. bombycis ‘Xinong6071’; 13:‘长果桑’M. laevigata; 14:‘印度桑’M. indica; 15:广东桑‘斯里兰卡1号桑’M. atropurpurea ‘Sililanka’; 16:白桑‘紫荆桑’M. alba ‘Zijingsang’; 17:‘黑桑’M. nigra; 18:瑞德桑‘火桑1号’M. mizuho ‘Huosang1’. |
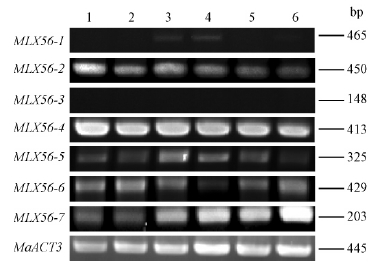 |
图 7 广东桑‘桂优62号’MLX56基因的半定量RT-PCR分析 Fig. 7 Semi-quantitative PCR analysis of MLX56 gene in M. atropurpurea ‘Guiyou 62’ 1:幼叶; 2:成熟叶; 3:叶柄; 4:茎; 5:表皮; 6:根。 1:Young leaves; 2:Mature leaves; 3:Petioles; 4:Stems; 5:Epidermis; 6:Roots. |
利用SacⅠ和XhoⅠ对重组子pET-28a-MLX56-6进行双酶切鉴定,此外重组质粒的测序结果与克隆序列完全一致,表明桑树MLX56-6基因原核表达载体pET-28a-MLX56-6构建成功。
将酶切鉴定和序列测定正确的重组质粒pET-28a-MLX56-6转化到大肠杆菌BL21(DE3)感受态细胞中,经0.5 mmol·L-1 IPTG诱导表达后,用12%SDS-PAGE凝胶电泳分析。结果表明,重组质粒pET-28a-MLX56-6产生了1条约56 kDa的条带(图 8)。诱导表达蛋白从pET28a(+)载体上的T7启动子开始翻译至终止密码子时分子量约为49 kDa,经SDS-PAGE电泳后,蛋白质分子量为56 kDa,蛋白质分子量实际值与预测值存在差异的原因可能与蛋白的结构有关,有些重组蛋白表达后,趋向于形成二聚体,同时,在表达过程中也有一些宿主菌的蛋白会附着在目的蛋白上,所以分子量与理论值相差10%属正常现象。诱导蛋白菌液经超声波破碎后,经12%SDS-PAGE凝胶电泳可溶性检测(图 9A)表明,目的蛋白主要以包涵体形式存在。对表达产物的Western Blot印迹分析(图 9B)表明,经0.5 mmol·L-1 IPTG诱导6 h产生的蛋白条带与抗体发生很强的交叉反应,表明融合蛋白得到表达。
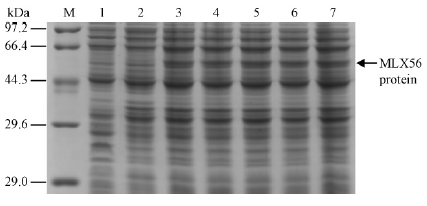 |
图 8 重组MLX56-6蛋白的原核表达 Fig. 8 Prokaryotic expression of recombinant MLX56-6 protein 1:pET-28a(+)空载; 2-7:诱导时间分别为0, 2, 3, 4, 5, 6 h的表达产物。 1:pET-28a(+); 2-7:Expression products of the induced pET-28a-MLX56-6 bacterial strain at the different time of 0, 2, 3, 4, 5, 6 h. |
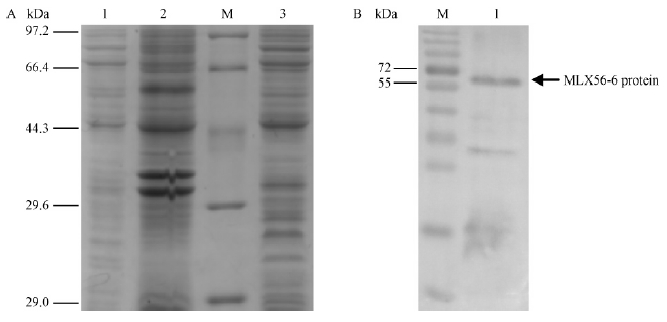 |
图 9 重组MLX56-6蛋白的可溶性分析及Western Blot检测
Fig. 9 Solubility and Western Blot analysis of recombinant MLX56-6 protein
A:可溶性分析 1:上清; 2: 沉淀; 3:pET-28a(+)空载。B:Western印迹杂交分析 1: 6×His 标签Western 印迹杂交。M: 蛋白分子质量标准。
A: Solubility analysis 1:Supernatant after ultrasonication; 2:Precipitation; 3: pET-28a(+). B: Western Blot analysis 1:6×His Western Blot. M:Protein molecular weight marker. |
在重组菌株达到对数生长期(OD≈0.6)时,在重组质粒的TB培养基中加入0.5 mmol·L-1 IPTG诱导,以加入IPTG诱导的空载pET-28a(+)及未加IPTG诱导的pET-28a-MLX56-6重组质粒为对照(图 10),结果表明,诱导后的空载随诱导时间的增加,菌液OD值也在增加,6 h后的菌液OD值达到4.15; 重组菌株在未经IPTG诱导的情况下,诱导时间增加,菌液OD值也在增加,但涨幅相较于空载较低,6 h后的菌液OD值达到1.85; 加入IPTG诱导后的重组质粒,诱导时间增加,菌液OD值变化不大,涨幅较于前两者最低,6 h后的菌液OD值为1.06。综上述,MLX56-6基因对大肠杆菌BL21(DE3)有抑制作用,主要表现在对菌的生长有抑制作用。
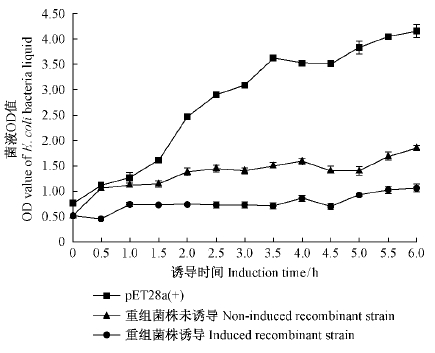 |
图 10 MLX56-6蛋白菌液生长速率 Fig. 10 Growth rate of MLX56-6 protein bacterial suspension |
与讨论本研究利用生物信息学方法从桑树基因组数据库中鉴定到6个MLX56基因,按进化关系可分为2个亚家族,表明MLX56基因可能来源于基因的重复事件,而且该基因在扩增的过程中,其结构发生了分化,这也暗示了MLX56基因家族的基因表达与功能的多样化。
成熟的MLX56蛋白含有3个部分: 第1部分包含2个橡胶素类似几丁质结合域,第2部分是由丝氨酸脯氨酸串联重复元件组成的伸展区域,第3部分由C端几丁质类似结合域组成,这种结构使桑树具有强大的防御作用。研究表明,几丁质酶通过水解真菌细胞壁中几丁质,从而抑制真菌生长(王志英等,2010)。而含有几丁质结合域的植物蛋白对昆虫是有毒的(Van Damme et al.,1998),伸展蛋白只在植物和一些藻类中表达,主要分布于细胞壁(Shpak et al.,2001)和分泌液(Estévez et al.,2006)中,在大多数植物蛋白中,伸展蛋白区域可能有防御功能,但具体的生物学功能尚不清楚。
桑树与其他植物系统进化关系表明,Group Ⅰ中的植物结构域中均含有1个几丁质结合域,Group Ⅱ中的植物几丁质酶为几丁质结合凝集素,它们含有1个或多个橡胶素结构域。橡胶素是从橡胶树(Hevea brasiliensis)的乳液中分离的,由43个氨基酸组成的小分子蛋白,属于具有1个几丁质结合位点的单凝集素。目前在荨麻科(Urticaceae)、罂粟科(Papaveraceae)、禾本科(Gramineae)等植物中发现了几丁质结合凝集素的存在,它们具有高度的序列同源性(舒晓燕等,2006)。植物几丁质酶根据序列同源性可以分成Ⅰ,Ⅱ,Ⅲ,Ⅳ,Ⅴ和Ⅵ类(Shinshi et al.,1990; Collinge et al.,1993; Meins et al.,1994; Melchers et al.,1994)。Ⅰ类的特征是含有几丁质结合域(CBD)和催化区,中间由可变交联区连接; Ⅱ类的主结构区与Ⅰ类的相似但缺乏CBD; Ⅲ类与前2类几丁质酶均不同,也无CBD; Ⅳ类与Ⅰ类有类似的CBD和保守的主结构区,但在CBD有1处缺失,在催化区有几处共约22个氨基酸的缺失,并且C-端延伸区也不完整,其成熟蛋白只有241~255个氨基酸,Ⅰ类约有300个氨基酸,Ⅰ类和Ⅳ类的氨基酸序列只有41%~49%相同; Melchers等(1994)从烟草(Nicotiana tabacum)中分离到一种新的几丁质酶,它的氨基酸序列与几种细菌的几丁质外切酶相似,与已报道的植物几丁质酶不同,建议设为Ⅴ类,并将Ⅴ类定义为刺荨麻凝血素UDA前体,成熟的UDA是由前体切去了催化区而留下2个CBD; Ⅵ类包括与Melchers等(1994)从烟草分离的烟草内切几丁质酶(ChiV)同源性达50%以上的几丁质酶,但Ⅵ类与Ⅰ到Ⅴ类的氨基酸序列无相似性而与来自细菌的环状芽孢杆菌(Bacillus circulans)、黏质沙雷氏菌(Serratia marcescens)、链霉菌(Streptomyces plicatus)等的外切酶的序列非常相似。研究表明,许多植物凝集素对鳞翅目(Lepidoptera)、同翅目(Homoptera)等害虫及尖孢镰刀菌(Fusarium oxysporum)、绿色木霉(Trichoderma viride)等真菌和某些细菌具有防治作用,同时具有对环境无污染、稳定性好及对高等动物相对安全等优点,成为防治病虫害的重要研究对象。
桑科植物中大约有1 000个种能产生乳汁,尽管它们具有相似的特性,但是乳胶成分在同一族、属的近缘种中仍然存在差异(Konno,2011)。不同桑种之间MLX56基因的表达情况表明,桑树MLX56基因的表达具有种间差异性。这在无花果亚属(Subgen.Ficus)植物中也有报道,该亚属植物乳胶中的主要防御物质是半胱氨酸蛋白酶,在大多数无花果亚属植物的乳胶中,可以检测到半胱氨酸蛋白酶活性,而在少数无花果亚属植物的乳胶中却没有检测到半胱氨酸蛋白酶活性(Konno,2011)。另外,MLX56基因在各桑种之间的表达水平存在较大差异,说明该基因的表达没有种间的相关性。MLX56基因在同一桑种的不同组织中的表达水平也存在差异,说明MLX56基因家族各成员之间可能存在功能的分化。
桑树乳汁含有多种化学物质及蛋白质,朱越雄等(1998)用桑树乳汁对部分细菌进行抑制试验,发现桑乳汁对变形杆菌(Proteusbacillus vulgaris)、链球菌(Streptococcus)的抑制效果最佳,但尚无法看出有明显的抑菌范围。本试验克隆了桑树MLX56-6基因,并构建原核表达载体pET28a-MLX56-6,在大肠杆菌BL21(DE3)中成功表达了带6×His标签的目的蛋白,表明MLX56蛋白能在原核细胞中得以表达,这为进一步研究该基因的功能提供了依据。
乳胶成分在植物近缘种中的差异性,是由植物与昆虫之间的进化关系及相互选择、适应所致。在植物与昆虫进化过程中,形成了相互适应机制,植物利用诱导防御物质抵抗昆虫的危害,昆虫则利用其特有的激发子(包括Volicitin、裂解酶、葡萄糖氧化酶、脂肪酸-氨基酸轭合物及豆象素)降低植物的防御反应(李新岗等,2008)。桑树乳胶中具有抗消化酶类,MLX56蛋白属于植物几丁质酶凝集素,通过抑制蓖麻蚕(Samia cynthia ricini)、甘蓝夜蛾(Mamestra brassicae)等鳞翅类昆虫的消化酶而影响它们的生理反应。家蚕是专食桑叶的一种特种经济动物,由于长期的进化与相互间的选择、适应,使得家蚕能对桑叶乳汁中的葡糖苷酶抑制剂产生耐受力,而不使之中毒; 而蓖麻蚕、甘蓝夜蛾等鳞翅类昆虫虽然也能取食桑叶,但桑叶乳汁中的防御蛋白对它们的生长具有很强的抑制作用,甚至致死(Hirayama et al.,2007)。Konno(2011)报道的MLX56是桑树乳汁中的一种防御蛋白质,它对鳞翅类昆虫毒性很强,而对专食桑叶的家蚕却不造成毒性,因此家蚕可能在长期的驯化过程中,对该蛋白具有很强的耐受性,具体机制还有待进一步的研究。
| [1] |
李 军,赵爱春,王茜龄,等. 2011. 三个桑树肌动蛋白基因的克隆与组织表达分析.作物学报,37(4):641-649. (Li J, Zhao A C, Wang X L, et al. 2011. Molecular cloning and tissues expression analysis of three actin genes from mulberry (Morus alba). Acta Agronomica Sinica, 37(4): 641-649[in Chinese]).(  1) 1)
|
| [2] |
李新岗,刘惠霞,黄 建.2008.虫害诱导植物防御的分子机理研究进展.应用生态学报,19(4):893-900. (Li X G, Liu H X, Huang J. 2008. Molecular mechanisms of insect pests-induced plant defense. Chinese Journal of Applied Ecology, 19(4):893-900[in Chinese]).(  1) 1)
|
| [3] |
柯益富,赵正龙,余茂德,等.1997.桑树栽培及育种学.北京: 中国农业出版社,10-11. (Ke Y F, Zhao Z L, Yu M D, et al. 1997. Mulberry cultivation and breeding. Beijing: China Agriculture Press, 10-11.[in Chinese])(  1) 1)
|
| [4] |
舒晓燕,阮期平,侯大斌.2006.植物凝集素的研究进展.现代中药研究与实践,20(6):53-56. (Shu X Y, Rui Q P, Hou D B. 2006. Progress on the study of plant lectins. Research and Practice of Chinese Medicine, 20(6):53-56[in Chinese]).(  1) 1)
|
| [5] |
王志英,张福丽,王占斌.2010.小黑杨转几丁质酶基因及酶活性.林业科学,46(2):148-151. (Wang Z Y, Zhang F L, Wang Z B. 2010. Transformation of chitinase gene into Populus simonii×P. nigra and chitinase activity of transgenetic plants. Scientia Silvae Sinicae, 46(2):148-151[in Chinese]).(  1) 1)
|
| [6] |
朱越雄,曹广力,许宏庆.1998.桑树乳汁对14种细菌生长的影响.江苏蚕业,(2): 50. (Zhu Y X, Cao G L, Xu H Q. 1998. Effects of mulberry latex on the growth of 14 species of bacteria. Jiangsu Sericulture, (2): 50[in Chinese]).(  1) 1)
|
| [7] |
Collinge D B, Kragh K M, Mikkelsen J D, et al. 1993. Plant chitinase. Plant J, 3(1): 31-40.( 1) 1)
|
| [8] |
Dussourd D E, Eisner T. 1987.Vein-cutting behavior: insect counterploy to the latex defense of plants. Science, 237:898-901.( 1) 1)
|
| [9] |
Dussourd D E, Denno R F. 1991. Deactivation of plant defense: correspondence between insect behavior and secretory canal architecture. Ecology, 72: 1381-1396.( 1) 1)
|
| [10] |
Estévez J M, Kieliszewski M J, Khitrov N, et al. 2006. Characterization of synthetic hydroxyproline-rich proteoglycans with arabinogalactan protein and extensin motifs in Arabidopsis. Plant Physiol, 142(2): 458-470.( 1) 1)
|
| [11] |
Farrel B D, Dussourd D E,Mitter C. 1991. Escalation of plant defense: do latex and resin canals spur plant diversification. Am Nat, 138: 881-900.( 1) 1)
|
| [12] |
Harborne J B.1993. Introduction to Ecological biochemistry. 4th ed. London: Academic Press, 77-78, 186-210.( 1) 1)
|
| [13] |
Hirayama C, Konno K, Wasano N, et al. 2007. Differential effects of sugar-mimic alkaloids in mulberry latex on sugar metabolism and disaccharidases of Eri and domesticated silkworms: enzymatic adaptation of Bombyx mori to mulberry defense. Insect Biochem Mol Biol, 37(12): 1348-1358.( 1) 1)
|
| [14] |
Konno K, Hirayama C, Nakamura M, et al. 2004. Papain protects papaya trees from herbivorous insects: role of cysteine proteases in latex. Plant J, 37(3): 370-378.( 1) 1)
|
| [15] |
Konno K. 2011. Plant latex and other exudates as plant defense systems: Roles of various defense chemicals and proteins contained therein. Phytochemistry, 72(13): 1510-1530.( 3) 3)
|
| [16] |
Meins F J, Bernard F, Linthorst H U M, et al. 1994. Plant chitinase genes. Plant Mol Bio Rep, 12(2): S22-S28.( 1) 1)
|
| [17] |
Melchers L S, Apotheker-de G M, van der Knaap J A, et al. 1994. A new class of tobacco chitinases homologous to bacterial exochitinase display antifungal activity. Plant J, 5(4): 469-480.( 3) 3)
|
| [18] |
Ramos M V, Freitas C D T, Staniscuaski F, et al. 2007. Performance of distinct crop pests reared on diets enriched with latex proteins from Calotropis procera: role of laticifer proteins in plant defense. Plant Sci, 173: 349-357.( 1) 1)
|
| [19] |
Sethi A, McAuslane H J, Rathinasabapathi B, et al. 2009. Enzyme induction as a possible mechanism for latex-mediated insect resistance in romaine lettuce. J Chem Ecol, 35(2): 190-200.( 1) 1)
|
| [20] |
Shinshi H U, Neuhas J M, Ryals J, et al. 1990. Structure of a tobacco endochitinase gene: evidence that different chitinase genes can arise by transposition of sequences encoding a cysteine-rich domain. Plant Mol Biol, 14(3): 357-368.( 1) 1)
|
| [21] |
Shpak E, Barbar E, Leykam J F, et al. 2001. Contiguous hydroxyproline residues direct hydroxyproline arabinosylation in Nicotiana tabacum. J Biol Chem, 276(14): 11272-11278.( 1) 1)
|
| [22] |
Van Damme E J M, Peumans W J, Barre A, et al. 1998. Plant lectins: a composite of several distinct families of structurally and evolutionary related proteins with diverse biological roles. Plant Sci, 17(6): 575-692.( 1) 1)
|
| [23] |
Wasano N, Konno K, Nakamura M, et al. 2009. A unique latex protein, MLX56, defends mulberry trees from insects. Phytochemistry, 70(7): 880-888.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

