文章信息
- 刘彤, 杨文凤, 校现周, 魏芳, 高宏华, 罗世巧, 吴明, 仇键
- Liu Tong, Yang Wenfeng, Xiao Xianzhou, Wei Fang, Gao Honghua, Luo Shiqiao, Wu Ming, Qiu Jian
- 橡胶树HbMYB20基因的克隆及其对拟南芥次生壁发育的调控
- Cloning of HbMYB20 from Hevea brasiliensis and Its Regulation of Secondary Wall Development in Arabidopsis thaliana
- 林业科学, 2015, 51(4): 52-59
- Scientia Silvae Sinicae, 2015, 51(4): 52-59.
- DOI: 10.11707/j.1001-7488.20150407
-
文章历史
- 收稿日期:2014-10-23
- 修回日期:2014-11-28
-
作者相关文章
2. 中国热带农业科学院橡胶研究所 儋州 571737
2. Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences Danzhou 571737
木质素是由单木质醇聚合而成,与纤维素、半纤维素相互交联组成植物细胞的次生壁。在植物体内,木质素含量仅次于纤维素,主要沉积在输导组织(如导管或管胞)、机械组织(如纤维、厚壁组织等)和保护组织(如表皮)的细胞次生壁中,是被子植物纤维和导管的基本骨架,在机械支撑、抵抗逆境、保证水分运输等方面有重要作用(Fratzl et al.,2008;Caño-delgado et al.,2003;于明革等,2003)。在农作物中,细胞壁中木质素含量高有利于植物抗倒伏、抗病虫害;在木材工业中,木质素含量高表明木材具有较强的机械强度(Fratzl et al.,2008;李伟等,2003)。因此,对植物木质素及其相关的次生壁形成机制和分子调控的研究将有助于通过生物技术手段,选择和培育出更便于人类利用的植物材料。
单木质醇合成途径是植物苯丙酸代谢的一个主要分支,涉及多种酶的共同作用,例如苯丙氨酸解氨酶(PAL)、4-香豆酸辅酶A连接酶(4CL)、咖啡酰辅酶A甲基转移酶(CCoAOMT)、肉桂酰辅酶A还原酶(CCR)和肉桂醇脱氢酶(CAD)(Marie et al.,1998;Raes et al.,2003;魏建华等,2001;范丙友等,2007)。近年研究结果表明,许多R2R3-MYB转录因子通过调节上述木质素合成相关酶基因的表达,参与植物次生壁发育的调控(Deluc et al.,2006;Zhong et al.,2010)。例如,拟南芥(Arabidopsis thaliana )中AtMYB26,AtMYB46/83,MYB103,MYB85/42,MYB52/54都被证实是次生壁形成和木质素合成的调控因子(Yang et al.,2007)。而在其他林木中,一些木质素合成调控相关的R2R3-MYB转录因子也被鉴定出来,如巨桉(Eucalyptus gr and is)的EgMYB2、毛白杨(Populous tomentosa)的PtMYB4,PvMYB4,PttMYB21a等(Shen et al.,2012)。
橡胶树(Hevea brasiliensis)是一种能生产天然橡胶的高大乔木树种,同时橡胶木也是胶林经济的重要组成。随着橡胶树更新面积不断增加以及天然橡胶价格的持续低迷,人们逐渐重视橡胶木的开发利用,并开始关注橡胶树的材性改良。木质素作为植物次生壁的重要组成成分,与林木的木材形成密切相关,研究橡胶树的木质素合成调控,对橡胶木材性改良和定向培育具有重要意义。近期,印度学者首先开展了橡胶树木质素代谢与木材质量的早期预测,通过比较不同品系橡胶树芽条的CAD活性,筛选出6个种质用于橡胶树优质材性改良育种(Reghu,2011)。马来西亚报道了橡胶树基因组草图的绘制,将木质素代谢作为仅次于橡胶合成途径进行阐述,凸显了木质素代谢在橡胶树生物学研究中的重要性(Rahman et al.,2013)。但总体上橡胶树木质素代谢调控研究还处于起步阶段,基因功能和转录调控方面还处于空白。
本研究从橡胶树转录组中分离克隆出1个木质素合成相关的G8亚组MYB转录因子,命名为HbMYB20,并利用模式植物拟南芥对其进行功能分析,探讨HbMYB20在橡胶树木质素形成过程中的作用,为揭示橡胶树木材形成过程中木质素合成和次生壁形成的分子调控机制及其遗传改良奠定基础。
1 材料与方法 1.1 植物材料与试剂药品橡胶树选取种植在中国热带农业科学院试验场五队的3年生无性系热研7-33-97。拟南芥为生态型Columbia(Col-0),栽培于光照培养箱。大肠杆菌(Escherichia coli)感受态DH5α购自北京全式金公司;质粒提取与胶回收试剂盒购自OMEGA公司;RNA提取试剂盒购自百泰克公司;反转录试剂盒购自Thermo公司;聚合酶与实时荧光定量PCR试剂盒SYBR Green I购自Takara公司;农杆菌(Agrobacterium)EHA105为本实验室保存;其他试剂为进口或国产分析纯。
1.2 橡胶树HbMYB20克隆与生物信息学分析参照RNA提取试剂盒说明书提取橡胶树树皮RNA。采用特异引物HbMYB20-F: 5′-GAGGAAGAT GGGTAGACAACC-3′和HbMYB20-R: 5′- TTACAGG ATCCCATATGTCCA-3′扩增基因片段,PCR反应程序为: 95 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,30个循环;72 ℃延伸 8 min,基因片段连接到pMD-18T载体上测序。运用NCBI网站上的ORF finder查找基因的开放读码框(ORF),根据ORF推导氨基酸序列,进行blast、进化树等生物信息学分析。分子进化树的构建使用MEGA5软件完成。
1.3 橡胶树HbMYB20表达分析提取橡胶树叶片、胶乳、茎干以及木质部与韧皮部RNA,反转录成cDNA。使用CFX96(Bio-Rad公司)实时荧光定量PCR检测系统分析HbMYB20在不同部位的基因表达。扩增反应程序为: 95 ℃预变性3 min;95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸30 s,39个循环。相对表达水平以橡胶树18S为内参进行归一化,用2-△△CT法表示基因的相对定量。所用引物HbMYB20-QTF: 5′-GCATTACCGAAG AAGCCAAG-3′和HbMYB20-QTR: 5′-TGAAGGCGA AGAAGTTGTCG-3′。
1.4 HbMYB20过表达载体构建及其拟南芥的转化植物表达载体PCXSN采用XcmⅠ酶切后,回收大片段,将HbMYB20的PCR扩增片段与PCXSN大片段用T4连接酶连接后转化DH5α,利用引物35S-F: 5′-ATGACGCACAATCCCACT-3′和特异引物HbMYB20-R筛选阳性克隆测序,即为过表达载体HbMYB20-OE。电激转化将上述载体导入农杆菌EHA105,扩大培养后收集菌体,重悬于1/2MS液体培养基(OD600为0.8左右),加入0.02%的Silwet L-77后喷施生长旺盛的拟南芥花序,收集种子置于附加25 mg·L-1潮霉素的1/2MS培养基上筛选阳性抗性植株,并利用特异引物(HbMYB20-F和HbMYB20-R)PCR验证,阳性结果即为T1代转基因植物。
1.5 转基因拟南芥中HbMYB20表达分析收集T1转基因植物种子,在含潮霉素的培养基上筛选阳性植株,并移栽到花盆,即T2转基因植物。将T2转基因和野生型拟南芥在22 ℃、光照16 h/暗8 h条件下培养50天左右后,比较株高并采集花序茎备用。提取上述拟南芥茎的总RNA,反转录成cDNA。以拟南芥EF1a基因为内参,检测HbMYB20在拟南芥各系转基因株系及野生型中的表达量,方法同1.3。EF1a基因引物为5′-GGTAAGGAGATTGAGAAGGA-3′,5′-CGCTCTTAATAACACCAACA-3′;HbMYB20基因引物为5′-GCATTACCGAAGAAGCCAAG-3′,5′-TGAAGG CGAAGAAGTTGTCG-3′。
1.6 木质素含量测定拟南芥茎用液氮研磨后冷冻干燥,称量30 mg冻干粉末或5 mg木质素标准品加入5 mL 25%乙酰溴。50 ℃条件下处理4 h后取上清,加入10 mL 2 mol·L-1 NaOH和12 mL冰醋酸混匀,之后加入1 mL 0.5 mol·L-1盐酸羟胺终止反应,测定280 nm下吸光度,根据样品和木质素标准品吸光值计算木质素含量。
1.7 木质素分布和细胞壁厚度分析参照传统的石蜡切片方法切取拟南芥茎基部横截面,用5%间苯三酚染色5 min后显微观察木质素分布。用0.3%甲苯胺蓝对横截面切片进行染色后,显微观察木质部细胞壁厚度,并使用imageJ软件测量导管、木质纤维和维管束间纤维细胞壁厚度,统计100个细胞的平均细胞壁厚度。
1.8 木质素和纤维素合成相关酶基因的表达分析采用实时荧光定量PCR检测拟南芥中4CL1,CCoAOMT,CesA7(纤维素合酶7)和CesA8(纤维素合酶8)基因的表达量,方法同1.5。4CL1基因所用引物为: 5′-GGTTACCTCAACAATCCGGCA-3′,5′-ACGCGACAACAGCAACATCAG-3′;CCoAOMT1基因所用引物为: 5′-TCGTTGATGCTGACAAAGACA-3′,5′-ACTGATCCGACGGCAGATAG-3′;CesA7基因所用引物为: 5′-TTGTTGCAGGCATCTCAGATG-3′,5′-GCAGTTGATGCCACACTTGGA-3′;CesA8基因所用引物为: 5′-TGAGCTTTACATTGTCAAATG-3′,5′-GCAATCGATCAAAAGACAGTT-3′。
2 结果与分析 2.1 橡胶树HbMYB20克隆和生物信息学分析对橡胶树树皮转录组序列进行blast分析,筛选出与拟南芥AtMYB20序列同一性较高的橡胶树MYB基因,根据该基因序列设计包含完整基因编码区的特异引物,以树皮cDNA为模板进行扩增,获得了1 000 bp左右的特异片段,测序表明该片段的核苷酸序列与转录组结果基本一致,含有927 bp的开放阅读框(ORF),编码309aa的蛋白,命名为HbMYB20。通过检索NCBI的CDD数据发现,HbMYB20基因编码蛋白含有2个SANT保守结构域,为典型的R2R3MYB转录因子。氨基酸序列分析显示,HbMYB20与AtMYB20/43和AtMYB85/42类似,其C端含有KKKL[RI]KMGIDPVTH[KQ]保守结构(图 1),该序列为MYB转录因子G8亚组特征,而拟南芥、玉米(Zea mays)和杨树的全基因组分析表明G8亚组中的部分MYB参与了植物的木质素代谢和次生壁发育(Stracke,2001;Zhao et al.,2014),这也暗示HbMYB20可能与次生壁发育相关。
 |
图 1 HbMYB20的核苷酸序列及其推导的氨基酸序列 Fig. 1 The nucleotide sequence and the deduced amino acid sequence of HbMYB20 下划线为G8亚组C端保守结构。The underlined represents the conserved domains in C terminal ends of G8 subgroup. |
为进一步分析HbMYB20与G8亚组MYB转录因子的进化关系,选取拟南芥、杨树、玉米和水稻(Oryza sativa)MYB家族转录因子进行进化树分析(图 2),结果显示HbMYB20与杨树POPTR0004s08480、POPTR0017s02850和拟南芥AtMYB20/43具有较高的同源性,聚在同一分支上,与玉米和水稻的同源MYB以及拟南芥AtMYB85/42进化关系较远。
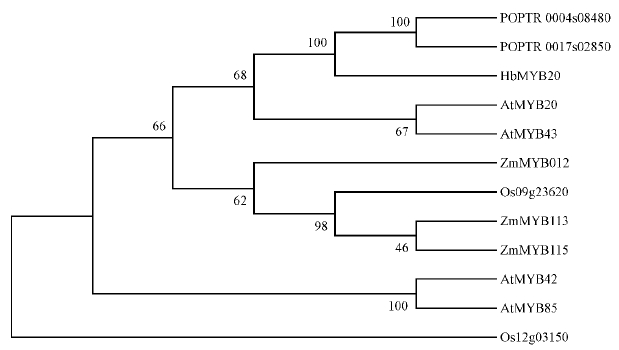 |
图 2 HbMYB20与不同植物的G8亚组MYB转录因子的进化分析 Fig. 2 The evolution analysis of MYB transcription factor G8 subgroup in HbMYB20 and different plants POPTR0004s08480,POPTR0017s02850: 杨树 Populus;AtMYB20,AtMYB42,AtMYB43,AtMYB85:拟南芥 Arabidopsis thaliana;ZmMYB012,ZmMYB113,ZmMYB115: 玉米 Zea mays;Os09g23620,Os12g03150: 水稻 Oryza sativa. |
通过实时荧光定量PCR检测HbMYB20在橡胶树不同部位的表达情况。由图 3可知,HbMYB20在橡胶树叶片、茎干、韧皮部、木质部以及胶乳中均表达,其中在木质部表达最高,其次是茎干,胶乳中表达最低。
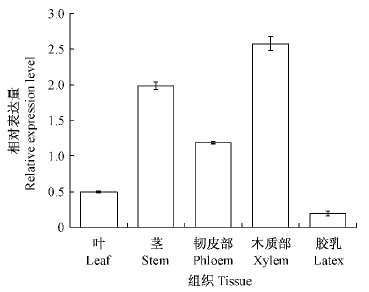 |
图 3 HbMYB20在橡胶树不同组织的表达分析 Fig. 3 Expression analysis of HbMYB20 in various tissues of H. brasiliensis |
过表达载体HbMYB20-OE采用花序浸染法转化拟南芥,获得3个转基因株系。PCR检测结果显示3个转基因株系中都扩增出目的片段,而野生拟南芥未检测到目的基因,表明3个转基因株系均为阳性转化系(图 4B)。实时荧光定量PCR检测显示,HbMYB20在3个转基因株系中均有表达,株系3表达量最高,而野生型拟南芥中未检测到该基因的表达(图 4C)。对比野生型和转HbMYB20拟南芥,在一致的生长条件下,转基因植物株型较野生型矮小(图 4A)。
 |
图 4 转基因拟南芥检测 Fig. 4 Identification of transgenic Arabidopsis thaliana plants A. WT: 野生型拟南芥Wild-type Arabidopsis thaliana;HbMYB20-OE-1,HbMYB20-OE-2,HbMYB20-OE-3: 转基因植株1,2,3 Transgenic plant line 1,2,3. B,C.M: DNA marker(DL2000);CK: 野生型拟南芥Wild-type Arabidopsis thaliana;1,2,3: 转基因植株1,2,3 Transgenic plant line 1,2,3. |
拟南芥茎横截面的间苯三酚染色结果显示,相对野生型拟南芥(图 5A,E),转HbMYB20基因拟南芥(图 5B,C,D,F,G,H)木质部和维管束间纤维的染色面积较少、染色程度变浅,主要集中木质纤维部位,表明转基因拟南芥茎中木质素的积累可能受到抑制。为验证上述推测,进一步测定了转基因和野生型拟南芥茎的木质素含量,结果表明转基因拟南芥茎的木质素显著低于野生型,其中株系3木质素含量最低,较对照减少了12.5%(图 6A)。
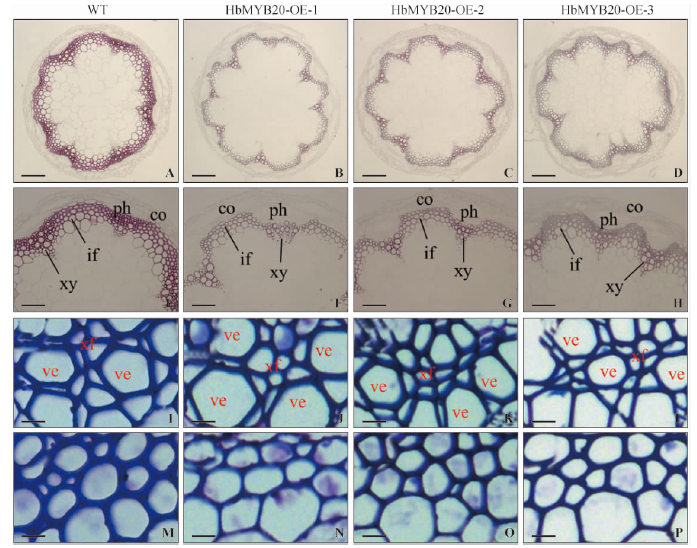 |
图 5 过表达 HbMYB20拟南芥次生壁的变化 Fig. 5 Variation of secondary wall by overexpression of HbMYB20 in Arabidopsis thaliana 标尺 Bar A-D: 156 μm;E-H: 59 μm;I-P: 5 μm.co: 皮层; ph: 韧皮部;if: 维管束间纤维;xy: 木质部; ve: 导管; xf: 木质纤维.B,F,J,N: HbMYB20-OE-1茎段;C,G,K,O: HbMYB20-OE-2茎段;D,H,L,P: HbMYB20-OE-3茎段;A,E,I,M: 野生型茎段。A-H茎段间苯三酚染色(红色)表明木质素在维管束间纤维和木质部; I-Q茎段为甲苯胺蓝染色(I-L:木质部;M-P:维管束间纤维)。co: Cortex; ph: Phloem; if: Interfascicular fiber; xy: Xylem; ve: Vessel; xf: Xylary fiber.B,F,J,N: Stem section of HbMYB20-OE-1; C,G,K,O: Stem section of HbMYB20-OE-2; D,H,L,P: Stem section of HbMYB20-OE-3; A,E,I,M: Stem section of Wild Type.A-H: Phloroglucinol-HCl staining(red color)of stem section showing the lignin deposition in the walls of interfascicular fibers and xylem cells. I-P: Stem sections were stained with toluidine blue(I-L: Xylem; M-P: Interfascicular fiber). |
拟南芥茎横截面的甲苯胺蓝染色结果显示,相对野生型拟南芥(图 5I,M),转HbMYB20基因拟南芥(图 5J,K,L,O,P,Q)在木质纤维、导管和维管束间纤维的细胞壁均变薄。通过对木质纤维、导管和维管束间纤维细胞的细胞壁统计分析,发现转HbMYB20基因拟南芥木质纤维、导管和维管束间纤维的细胞壁厚度均显著低于野生型,所有株系平均分别减少19.4%,22.5%和29.1%(图 6B)。
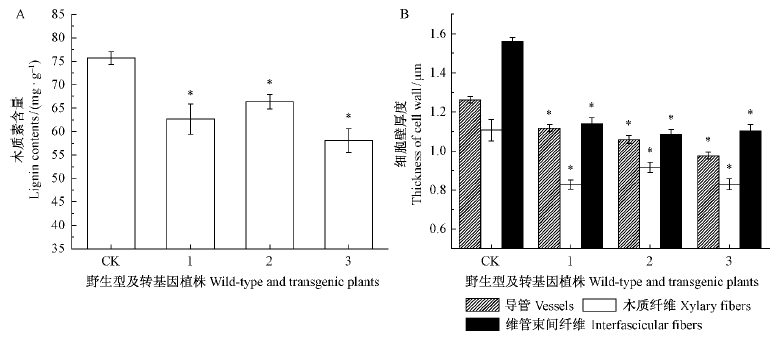 |
图 6 拟南芥木质素含量和细胞壁厚度测定 Fig. 6 Measurement of lignin contents composition and cell wall thinckness in Arabidopsis thaliana 1,2,3: HbMYB20-OE系 HbMYB20-OE lines; CK: 野生型 Wild type.*拟南芥野生型和转基因植株差异显著(P<0.05)Significant differences between wild-type and transgenic Arabidopsis thaliana at P<0.05. |
为确定HbMYB20对拟南芥的次生壁发育相关基因表达的影响,采用荧光定量PCR分析了次生壁形成密切相关木质素和纤维素合成的关键酶基因的表达(图 7)。结果显示,3个转基因株系中木质素合成关键酶基因4CL1和CCoAOMT的表达量显著低于野生型,表明HbMYB20转录因子基因负调控木质素合成基因的表达。同时纤维素合成关键酶基因CesA8的表达下调,表明HbMYB20转录因子基因对纤维素的合成同样具有抑制作用。
 |
图 7 拟南芥中木质素和纤维素合成关键酶基因表达量 Fig. 7 The expression of lignin and cellulose biosynthetic genes in Arabidopsis thaliana 4CL1: 4-香豆酸辅酶A连接酶4-Coumarate coenzyme A ligase;CCoAOMT: 咖啡酰辅酶A甲基转移酶 Caffeoyl-CoA-3-O-methyl transferase; CesA7: 纤维素合酶7 Cellulose synthase 7;CesA8: 纤维素合酶8 Cellulose synthase 8. |
MYB转录因子作为植物苯丙烷类物质代谢调控因子之一,参与木质素生物合成与沉积,在次生细胞壁形成中具有重要的调控作用(Hussey et al.,2013;Stracke,2001)。近年来研究表明次生壁形成相关的MYB转录因子具有较高的同源性,在不同物种间的结构和生物学功能较为保守。Du等(2012)对157个玉米MYB、125个拟南芥MYB 以及部分已知功能的MYB序列和功能开展进化和结构域分析,获得37个亚组,其中4个亚组的MYB与木质素合成以及次生壁增厚相关,分别为G3,G8,G30和G21。Zhao等(2014)采用类似方法对拟南芥、水稻、玉米、杨树以及柳枝稷(Panicum virgatum)MYB转录因子进行功能分组,发现5个物种的MYB转录因子可分成48个亚组,其中次生壁形成相关的MYB同样聚在上述4个亚族中。可见,基因的同源性及相似性分析在木质素合成以及次生壁增厚相关MYB基因功能推测和鉴定中具有重要的参考价值。本研究从橡胶树中克隆到一个MYB转录因子G8亚组成员,即HbMYB20,该基因的表达与G8亚组类似,在茎和木质细胞中高表达,暗示HbMYB20与木质素合成和次生细胞壁形成相关。
次生壁形成调控的MYB转录因子大多为激活因子,但一些MYB负调控因子也被鉴定出来,如金鱼草(Antirrhinum majus)AmMYB308和AmMYB300,拟南芥AtMYB4和AtMYB32,以及桉树EgMYB1等,它们的过表达均能抑制木质素的合成和次生细胞壁形成(Fornalé et al.,2006;Preston et al.,2004; Tamagnone et al.,2003)。在G8亚组成员中,AtMYB85的过表达导致木质素的异常沉积,而沉默OsMYB42/85导致植株矮化,该亚组成员普遍被认为是次生壁形成调控的激活因子;但AtMYB20的功能存在异议,虽然AtMYB20可以被次生细胞壁NAC掌控开关SND1和NST1激活,但未有任何遗传学证据表明其为次生细胞壁合成的激活因子(Zhong et al.,2008)。本研究中HbMYB20与AtMYB20序列的同一性最高,在拟南芥中过表达HbMYB20导致了转基因植株的矮小,细胞壁变薄,并且阻碍了木质部中木质素的合成和积累。分子检测也证实转基因植物中木质素和纤维素合成相关酶基因的表达显著下降。该结果与桉树EgMYB1异源过表达结果类似,桉树EgMYB1在木质部中表达最高,却对拟南芥和和杨树的次生壁发育具有负调控作用(Sylvain et al.,2007)。由此推测HbMYB20对拟南芥的木质素和纤维素合成都具有负调控作用,可能是一个橡胶树次生壁发育的负调控因子。
次生细胞壁在植物生命活动中扮演重要角色,同时也对人类的生产生活具有重要意义,例如造纸、木材利用等。橡胶树是胶木两用经济林木,其胶木材性和抗风特性都涉及次生壁发育。本研究中克隆到1个橡胶树木质素代谢和次生壁发育相关的MYB转录因子基因HbMYB20,通过模式植物拟南芥对其功能进行了初步鉴定,将有助于了解橡胶树木质素合成和次生壁的调控机制,为其相关的木材改良和抗风育种奠定基础。
| [1] |
范丙友,陆 海,蒋湘宁,等. 2007. 维管植物4-香豆酸: 辅酶A连接酶(4CL)研究进展. 林业科学,43(2): 96-103. (Fan B Y, Lu H, Jiang X N, et al. 2007. Review on 4-coumarate:coenzyme A ligase(4CL) of vascular plant. Scientia Silvae Sinicae, 43(2): 96-103[in Chinese]).(  1) 1)
|
| [2] |
李 伟,熊 谨,陈晓阳. 2003. 木质素代谢的生理意义及其遗传控制研究进展. 西北植物学报,23(4):675-681. (Li W, Xiong J, Chen X Y. 2003. Advances in the research of physiological significances and genetic regulation of lignin metabolism. Acta Botanica Boreali-Occidentalia Sinica, 23(4): 675-681[in Chinese]).(  1) 1)
|
| [3] |
魏建华,宋艳茹. 2001. 木质素生物合成途径及调控的研究进展. 植物学报,43(8): 771-779. (Wei J H, Song Y R. 2001. Recent advances in study of lignin biosynthesis and manipulation. Chinese Bulletin of Botany, 43(8): 771-779[in Chinese]).(  1) 1)
|
| [4] |
于明革,杨洪强,翟 衡. 2003. 植物木质素及其生理学功能. 山东农业大学学报: 自然科学版,34(1): 124-128. (Yu M G, Yang H Q, Zhai H. 2003. Lignin and physiological function in plant. Journal of Shandong Agricultural University: Natural Science Edition, 34(1): 124-128[in Chinese]).(  1) 1)
|
| [5] |
Caño-delgado A,Penfield S,Smith C,et al. 2003. Reduced cellulose synthesis invokes lignification and defense responses in Arabidopsis thaliana. The Plant Journal: for Cell and Molecular Biology, 34(3): 351-362.( 1) 1)
|
| [6] |
Deluc L,Barrieu F,Marchive C,et al. 2006. Characterization of a grapevine R2R3-MYB transcription factor that regulates the phenylpropanoid pathway. Plant Physiology,140(2): 499-511.( 1) 1)
|
| [7] |
Du H, Feng B R, Yang S S, et al. 2012. The R2R3-MYB transcription factor gene family in maize. PLOS ONE,7(6): e37463( 1) 1)
|
| [8] |
Fratzl P,Elbaum R,Burgert I. 2008. Cellulose fibrils direct plant organ movements. Faraday Discussions,139: 275-282.( 2) 2)
|
| [9] |
Fornalé S,Sonbol F,Maes T,et al. 2006. Down-regulation of the maize and Arabidopsis thaliana caffeic acid O-methyl-transferase genes by two new maize R2R3-MYB transcription factors. Plant Molecular Biology, 62(6): 809-823.( 1) 1)
|
| [10] |
Hussey S G,Mizrachi E,Creux N M,et al. 2013. Navigating the transcriptional roadmap regulating plant secondary cell wall deposition. Frontiers in Plant Science,4(1): 325.( 1) 1)
|
| [11] |
Marie B,Bernard M,Marc V M,et al. 1998. Biosynthesis and genetic engineering of lignin. Critical Reviews in Plant Sciences,17(2): 125-197.( 1) 1)
|
| [12] |
Preston J,Wheeler J,Heazlewood J,et al. 2004. AtMYB32 is required for normal pollen development in Arabidopsis thaliana. The Plant Journal, 40(6): 979-995.( 1) 1)
|
| [13] |
Raes J,Rohde A,Christensen J H,et al. 2003. Genome-wide characterization of the lignification toolbox in Arabidopsis. Plant Physiology,133(3): 1051-1071.( 1) 1)
|
| [14] |
Rahman A Y, Usharraj A O,Misra B B,et al. 2013. Draft genome sequence of the rubber tree Hevea brasiliensis. BMC Genomics,75(14): 1471-2164.( 1) 1)
|
| [15] |
Reghu C P. 2011. Early detection of wood quality in Hevea brasiliensis (Rubber wood) using cinnamyl alcohol dehydrogenase(CAD) activity. J Indian ACAD Wood SCI, 8(2): 177-183.( 1) 1)
|
| [16] |
Shen H,He X Z,Poovaiah C R,et al. 2012. Functional characterization of the switchgrass (Panicum virgatum) R2R3-MYB transcription factor PvMYB4 for improvement of lignocellulosic feedstocks. New Phytologist,193(1): 121-136.( 1) 1)
|
| [17] |
Stracke R B. 2001. The R2R3-MYB gene family in Arabidopsis thaliana. Cell Signalling and Gene Regulation,4(5): 447-456.( 2) 2)
|
| [18] |
Sylvain L,Eric L,Monica G,et al. 2007. Molecular characterization of EgMYB1, a putative transcriptional repressor of the lignin biosynthetic pathway. Canada Plant Science,173(5): 542-549.( 1) 1)
|
| [19] |
Tamagnone L,Angel M,Adrian P,et al. 2003. The AmMYB308 and AmMYB330 transcription factors from antirrhinum regulate phenylpropanoid and lignin biosynthesis in transgenic tobacco. The Plant Cell,10(2): 135-154.( 1) 1)
|
| [20] |
Yang C Y, Xu Z Y, Song J,et al. 2007. Arabidopsis MYB26/MALE STERILE35 regulates secondary thickening in the endothecium and is essential for anther dehiscence.The Plant Cell,19(2): 534-548.( 1) 1)
|
| [21] |
Zhao K M,Bartley L E. 2014. Comparative genomic analysis of the R2R3 MYB secondary cell wall regulators of Arabidopsis, poplar, rice, maize, and switchgrass. Plant Biology, 14(1): 135.( 2) 2)
|
| [22] |
Zhong R Q,Zheng H. 2010. Transcriptional regulation of lignin biosynthesis. Plant Signaling & Behavior, 4(11): 1028-1034.( 1) 1)
|
| [23] |
Zhong R Q, Lee C H, Zhou J L,et al, 2008. A battery of transcription
factors involved in the regulation of secondary cell wall biosynthesis
in Arabidopsis. The Plant Cell, 20(10):2763-2782.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

