文章信息
- 任子蓓, 王俊玲, 史宝胜
- Ren Zibei, Wang Junling, Shi Baosheng
- 热胁迫对连翘离体叶圆片光系统Ⅱ活性的影响
- Effects of Heat Stress on PhotosystemⅡActivity in Leaves of Forsythia suspensa
- 林业科学, 2015, 51(4): 44-51
- Scientia Silvae Sinicae, 2015, 51(4): 44-51.
- DOI: 10.11707/j.1001-7488.20150406
-
文章历史
- 收稿日期:2014-12-24
- 修回日期:2015-02-15
-
作者相关文章
2. 河北农业大学生命学院 保定 071001
2. College of Life Sciences, Agricultural University of Hebei Baoding 071001
连翘(Forsythia suspensa)是木犀科(Oleaceae)连翘属落叶灌木,具有药用和观赏价值,兼有保持水土的生态意义。为了苗木的繁育和经济林培育,近年来已从连翘多倍体诱导与鉴定(周玉丽等,2011)、四倍体连翘组培快繁(袁小亚等,2014)、连翘无公害规范化栽培关键技术(牛芳芳,2013)等方面开展研究,促进技术更新和产业发展。面对全球变暖带来的气温升高甚至高温炎热、水资源迅速耗竭带来的干旱、化学农业引发的土壤次生盐渍化以及天气骤然转换出现久阴乍晴或持续暴晴导致的连阴寡照或高温强光等环境恶化问题,一些实验室采用叶绿素荧光分析技术,进行盐(王娟等,2013)、干旱(卢广超等,2013)、弱光(王建华等,2011)等逆境胁迫下连翘叶片光合机构活性的研究探索,充实了相关生理研究。
本实验室在进行连翘叶片光合日变化研究时发现,无论是春、夏、秋季节,还是遮光处理,均呈现无“午休”的光合碳吸收特征,然而与之相伴的光合系统Ⅱ(PSⅡ)活性Fv/Fm却呈现中午低谷的“午休”特征(王建华等,2011)。综合分析露地小气候日变化因子表明,高温可能是主要影响因子之一。一些研究认为,PSⅡ的耐热性要强于整个光合作用过程(王俊玲等,2011)。因此,连翘叶片PSⅡ活性对热胁迫的反应有待探索。在野外自然条件下,高温胁迫往往是太阳高光强和高温(叶片体温或环境温度)的共同作用。然而,这种复合胁迫效应既包含热胁迫效应,又包含着强光胁迫效应,还包含着高温强光的交叉胁迫效应。为了辨析这3种胁迫效应,本文在完全避光下仅进行热胁迫处理,以期通过避免光照的干扰来观测纯热胁迫效应。
本试验以夏末初秋季节连翘叶片为试材,在完全避光下采用热胁迫温度和时间组合处理,通过叶绿素荧光参数和光化学反射指数测定,分析热胁迫对PSⅡ活性的影响,探索热胁迫下连翘叶片光合机构的行为特征,为植物光能高效利用提供理论基础。
1 材料与方法 1.1 试验材料供试材料在河北农业大学标本园露地种植的7年生连翘。于2014年8月上旬起选取长势一致,生长健壮的连翘,选取向阳主枝延长枝上的顶端起第7~9片叶,以大小和色泽一致为佳。采摘叶片后,迅速置于湿毛巾中带回实验室。
1.2 热胁迫处理将叶片避开主叶脉打取直径为1 cm的叶圆片,置于内铺湿润滤纸的封口聚乙烯薄膜袋中进行热胁迫处理,利用恒温水浴锅在完全避光下进行加热。温度设置为: 26,31,34,37,40,43,46,49,52 ℃。处理时间为: 5,25,45 min,处理完成后迅速转入26 ℃的室内环境中暗适应30 min,之后进行测定。在测定时,下铺湿润滤纸,尽可能减少叶片水分流失萎蔫而带来的影响。每个温度处理选取3个叶片的相应位置打取叶圆片作为3次重复。为了避免光照的干扰和保障叶片的充分暗适应,在暗室中进行上述操作和荧光测定。
1.3 叶绿素荧光参数的测定采用德国WALZ公司生产的调制式荧光成像系统(MINI-IMAGING-PAM)进行叶绿素荧光参数测定。叶片暗适应30 min后,在0.5 μmol·m-2s-1脉冲光强以1Hz脉冲频率下测得最小荧光Fo; 在4 800 μmol·m-2s-1的饱和脉冲光强度照射0.8 s测得最大荧光Fm。采用40 μmol·m-2s-1光化光进行诱导,随后每隔20 s打饱和脉冲进行光适应下最大荧光F′m和稳态荧光Fs的测定(许大全,2002)。根据以上荧光参数计算PSⅡ荧光动力学参数(许大全,2002)。
PSⅡ最大光化学量子产量Fv/Fm=(Fm-Fo)/Fm。实际光化学量子产量Y(Ⅱ)=(F′m-Fs)/F′m,调节性能量耗散的量子产量Y(NPQ)=1-Y(Ⅱ)-1/[NPQ+1+qL·(Fm/Fo-1)],非调节性能量耗散的量子产量Y(NO)=1/[NPQ+1+qL·(Fm/Fo-1)]。其中,NPQ=(Fm-F′m)/F′m, qL=qP·F′o/Fs, 光适应下最小荧光F′o=Fo/(Fv/Fm+Fo/F′m),光化学荧光猝灭系数qP=(F′m-Fs)/(F′m-Fo)。 开放的PSⅡ反应中心的激发能捕获效率 Fv/F′m=(F′m-Fo)/F′m (Genty et al.,1989)。PSⅡ激发能分配系数β=1/(1+f),PSⅠ激发能分配系数α=f/(1+f),f= (F′m-Fs)/(F′m-Fo), PSⅡ与PSⅠ间的激发能分配不平衡偏离系数=β/α-1(Braun et al.,1990)。PSII电子传输活性 Fm/Fo=(Fv/Fm)/(1-Fv/Fm) +1(Schreiber et al.,1986)。
1.4 光化学反射指数PRI的计算以HL-2000卤钨灯(400~900 nm)作为光源,采用美国产QE65光纤光谱仪(Ocean optics),积分时间为300 ms,结合ISP-30-6-R反射式积分球在室温(26±0.3)℃下测定叶片的漫反射率R。参照Gamon等(1992)和彭涛等(2009)的光化学反射指数计算改进为PRI=PRI光-PRI暗。其中,PRI光=(R531光-R570光)/(R531光+R570光),R531光、R570光分别为叶片在40 μmol·m-2s-1光化光适应30 min后,在531,570 nm下的漫反射率; PRI暗=(R531暗-R570暗)/(R531暗+R570暗),R531暗、R570暗分别为叶片暗适应30 min后在531,570 nm下的漫反射率(Gamon et al.,1992)。
2 结果与分析 2.1 热胁迫对连翘叶片PSⅡ原初光化学活性的影响Fo为全部PSⅡ反应中心开放时来自捕光天线叶绿素a的荧光(Ort et al.,1990),Fm为全部PSⅡ反应中心关闭时的荧光。与室温26 ℃相比,热胁迫5 min处理下,随着温度的升高至40℃以上,Fo,Fm会降至较低水平; 而热胁迫时间延长到25和45 min下,Fo则呈现先大幅度降低(31~37 ℃)后迅速升高(37 ℃以上)的趋势,Fm则呈现先大幅度降低(31~49 ℃)后略有升高(49 ℃以上)的趋势(图 1)。一般认为,捕光天线遭受破坏会导致Fo减小,而PSⅡ反应中心受到破坏会导致Fo增加(Lazar,1999; 许大全,2002; Yamane et al.,1997)。可见,在5 min短时间的热胁迫下,连翘叶片的捕光天线就会遭受破坏; 25和45 min较长时间的热胁迫下,温度不太高时,连翘叶片的捕光天线会遭受破坏,随着温度的升高,连翘叶片的PSⅡ反应中心会受到破坏。
 |
图 1 热胁迫对连翘叶片Fo和Fm的影响 Fig. 1 Effects of heat stress on Fo and Fm in F.suspensa —□— 5 min —△—25 min —○—45 min下同。The same below. |
从图 2可见,热胁迫5 min处理下,随着温度的升高Fv/Fm和Y(Ⅱ)呈现逐渐降低趋势,至43 ℃以上二者迅速降低; 相比之下,热胁迫时间延长到25和45 min下,随着温度的升高至37 ℃以上Fv/Fm就迅速降低,而升温至31 ℃以上Y(Ⅱ)就迅速降低。这表明,即使是5 min短时间的热胁迫下,PSⅡ原初光化学活性就会明显降低,而且25和45 min较长时间的热胁迫下,PSⅡ原初光化学活性会严重降低。
 |
图 2 热胁迫对连翘叶片Fv/Fm和Y(Ⅱ)的影响 Fig. 2 Effects of heat stress on Fv/Fm and Y(Ⅱ) in F. suspensa |
热胁迫下,PSⅡ的能量耗散也会受到显著影响(图 3)。热胁迫5 min处理下,40 ℃以上Y(NPQ)有明显上升趋势,而Y(NO)则平缓上升。25和45 min处理下,随着热胁迫温度增加,Y(NPQ)呈单峰曲线变化趋势,而Y(NO)呈现趋饱和升高趋势; 而且热胁迫时间越长,Y(NPQ)峰值和Y(NO)升高的温度越低。这表明,连翘叶片PSⅡ能量耗散会依赖于调节性能量耗散Y(NPQ)和非调节性能量耗散Y(NO),随着热胁迫时间延长,会从依赖于Y(NPQ)为主转向Y(NO)为主。
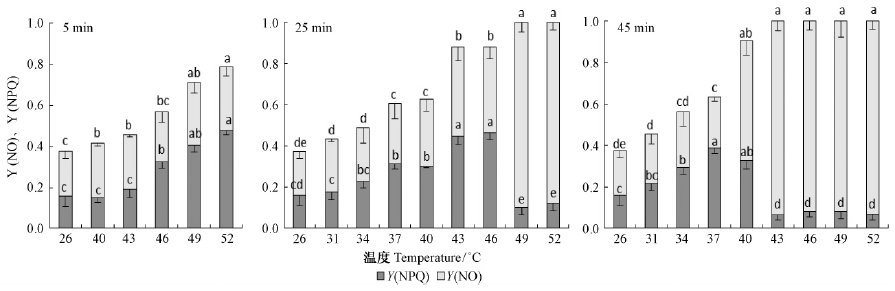 |
图 3 热胁迫对连翘叶片Y(NPQ)和Y(NO)的影响 Fig. 3 Effects of heat stress on Y(NPQ) and Y(NO) in F. suspensa |
植物叶片在暗适应下的光化学反射指数PRI与充分光适应下的PRI之差可以较好地反映叶黄素循环库的大小(Gamon et al.,1999)。无论叶片水平还是冠层水平上的光化学反射指数PRI的变化均与叶黄素的脱环氧化程度之间呈显著的负相关(彭涛等,2009)。从图 4可见,热胁迫时间为5 min时,连翘叶片的光化学反射指数PRI略有变化; 随着热胁迫时间延长到25或45 min,分别在40或37 ℃以上PRI明显下降。
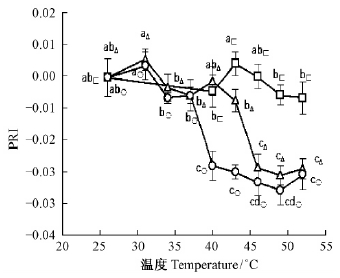 |
图 4 热胁迫对连翘叶片PRI的影响 Fig. 4 Effects of heat stress on PRI in F. suspensa |
热胁迫处理5,25或45 min下,F′v/F′m均与Fv/Fm呈现相似变化(图 5),表明热胁迫下原初光化学活性Fv/Fm的降低直接与开放的PSⅡ反应中心的激发能捕获效率F′v/F′m相关联。
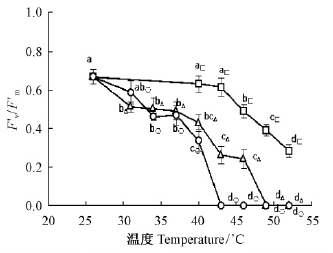 |
图 5 热胁迫对连翘叶片Fv’/F′m的影响 Fig. 5 Effects of heat stress on Fv’/F′m in F.suspensa |
光化学荧光猝灭系数qP是表示总PSⅡ反应中心中开放的反应中心所占比例,反映PSⅡ电子传递的原初醌受体QA的氧化程度,它决定PSⅡ的激发能捕获速率(许大全,2002)。从图 6可知,5 min热胁迫处理,随着温度的增加qP缓慢降低; 而25 min和45 min下,随着温度的增加qP呈现先降低后升高的趋势。显然,随着热胁迫时间延长,连翘叶片PSⅡ的激发能捕获速率也受到较大影响。
 |
图 6 热胁迫对连翘叶片qP的影响 Fig. 6 Effects of heat stress on qP in F.suspensa |
从图 7可知,在5 min短时间热胁迫下,温度增加对PSⅡ和PSⅠ间的激发能分配不平衡偏离系数β/α-1的影响不显著。热胁迫时间为25或45 min时,温度增加至43~46 ℃或40 ℃时β/α-1会骤然增大,激发能分配倾向于PSⅡ; 而后的温度增加时,β/α-1又骤然降低,激发能分配倾向于PSⅠ。图 8则表明,随着热胁迫时间的延长和热胁迫温度的增加,连翘叶片的Fm/Fo均呈现逐渐降低趋势。
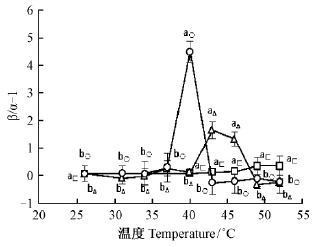 |
图 7 热胁迫对连翘叶片β/α-1的影响 Fig. 7 Effects of heat stress on β/α-1 in F.suspensa |
 |
图 8 热胁迫对连翘叶片Fm/Fo的影响 Fig. 8 Effects of heat stress on Fm/Fo in F.suspensa |
一般情况下,使用PAM-2100测定的活体植株上的连体叶片Fv/Fm范围在0.80~0.85之间(许大全,2002),而使用MINI-IMAGING-PAM测定的连体叶片Fv/Fm在0.75~0.81之间(王俊玲等,2011; 王梅等,2007)。本试验为了模拟高温处理,采用离体叶圆片。然而,离体叶圆片的荧光参数Fv/Fm测定结果会比活体植株上的连体叶片有明显降低。经过分析和预备试验发现,离体叶圆片的水分散失萎蔫是导致荧光参数Fv/Fm降低的主要原因。为了保证测定结果与连体叶片相接近,在试验全过程中采取了试材保湿的对策: 第一,采摘叶片后,迅速置于湿毛巾中带回实验室; 第二,热胁迫处理时,置于内铺湿润滤纸的封口聚乙烯薄膜袋中进行; 第三,在测定时,下铺湿润滤纸,尽可能减少水分散失带来的影响。本试验中采取上述试材保湿的条件下,作为对照的离体叶圆片测定的Fv/Fm范围在0.728~0.828之间(图 2),这一测定结果较为接近连体叶片的正常变化范围。
在热胁迫引起PSⅡ结构和功能伤害的研究中表明,PSⅡ的热胁迫发生在多位点(Srivastava et al.,1995; 温晓刚等,1996; Yamane et al.,1997; Yoshihiro et al.,1998; 王梅等,2007),还呈现温度和时间(简称“温时”)的热胁迫剂量效应(王梅等,2007),本研究也呈现出类似结果。不仅连翘叶片PSⅡ活性Fv/Fm和Y(Ⅱ)降低呈现出“温时”剂量效应(图 2),而且热胁迫也会发生PSⅡ蛋白复合体的多个位点上。通过Fo(图 1)和qP(图 6)先减后增变化、F′v/F′m降低(图 5)、Y(NPQ)与Y(NO)和值增加(图 3),分别反映出的捕光天线遭受破坏或是PSⅡ反应中心会受到破坏、PSⅡ的激发能捕获速率减增变化、开放的PSⅡ反应中心的激发能捕获效率降低、能量耗散的增加均呈现出多位点的“温时”热胁迫剂量效应。同时将Fv/Fm(图 2)与F′v/F′m(图 5)的变化趋势对比可见,热胁迫下原初光化学活性Fv/Fm的降低直接与开放的PSⅡ反应中心的激发能捕获效率F′v/F′m相关联。
针对热胁迫会引起叶片PSⅡ活性降低的问题,一些研究也将关注点从PSⅡ结构和功能上扩展到导致整个光合机构各组分之间的机能衰减上。植物光合作用是将光能转化为化学能的过程,由光反应(PSⅡ和PSⅠ)与暗反应(卡尔文循环)构成的整个光合机构来完成。热胁迫对暗反应的酶活性(王梅等,2007; 罗祎等,2010; 蒋德安等,2008; Schreiber et al.,1977)或整个光合机构(王俊玲等,2011)比PSⅡ更为敏感。而本试验中25和45 min热胁迫下,与随着温度的升高Y(Ⅱ)呈现持续降低趋势相比,Fv/Fm呈现先缓慢降低,至37 ℃以上迅速降低的趋势。因此推测较弱的“温时”热胁迫剂量下连翘叶片的整个光合作用过程或暗反应的酶活性受影响较大,较强的“温时”热胁迫剂量下PSⅡ活性受影响较大。这种热胁迫对光合机构影响的差异性可能会影响到连翘叶片Fv/Fm日变化特征和光合碳吸收日变化特征。
在热胁迫下PSⅡ蛋白复合体会通过自身的结构和功能的系列变化或功能组分转换构建协调保护机制来减轻热伤害。普遍认为,在PSⅡ的能流分配中,能量耗散对PSⅡ具有较强的保护能力(王梅等,2007; 王俊玲等,2011)。本研究还表明,随着“温时”热胁迫剂量的增强,连翘叶片Y(NPQ)与Y(NO)二者的彼此消长变化(图 3),反映出热耗散机制从调节性能量耗散为主向非调节性能量耗散为主转换。许大全(2002)认为,光合机构可能会有依赖于叶黄素循环、PSⅡ反应中心可逆失活、PSⅡ循环电子流、跨类囊体膜质子梯度的多种能量耗散机制。Demming-Adams等(1996)指出,依赖叶黄素循环的热耗散是一种关键的能量耗散机制。本研究中对比图 3和图 4可知,连翘叶片的叶黄素循环脱环化程度负相关的PRI与Y(NO)呈现相反变化趋势。这表明,较强的“温时”热胁迫剂量下连翘叶片光合机构主要依赖于叶黄素循环的能量耗散机制; 较弱的“温时”热胁迫剂量下连翘叶片光合机构的能量耗散是否还有其他途径有待深入研究。
逆境下,植物叶片会采取多种防御方式相互配合保护PSⅡ反应中心(钟传飞等,2008)。本研究中,较弱的“温时”热胁迫剂量下连翘叶片的Fo降低(图 1),表明PSⅡ会通过减小捕光天线系统的方式来减少过多光能对PSⅡ反应中心的激发压。较强的“温时”热胁迫剂量下,光化学荧光猝灭系数(qP)始终较高(图 6),表明PSⅡ会转向通过保持较高的开放程度来减少激发能在PSⅡ供体侧的积累(钟传飞等,2008)。一些研究表明,Fm的下降是天线降解造成的(Sundby et al.,1986),但Schreiber(1997)、王梅等(2007)提出,Fm下降与供体侧放氧复合体(OEC)在高温下失活有关。可见,本研究在“温时”热胁迫下Fm呈现大幅度降低,也会有利于减少激发能在PSⅡ供体侧的积累。
另外,热胁迫引起PSⅠ和PSⅡ 2个光系统间电子传递或激发状态的不平衡。刘超等(2014)发现在强光、高温胁迫初期PSⅠ比PSⅡ更易受到光抑制。王俊玲等(2011)试验表明,热胁迫下PSⅡ和PSⅠ间激发能分配不平衡偏离系数β/α-1的增加说明热胁迫影响了激发能在2个光系统之间的分配,导致光系统间激发能分配的不平衡,PSⅡ和PSⅠ间线性电子传递的协调性降低。本试验中却发现随着热胁迫温度增加,β/α-1先会骤然增大而后又骤然降低的趋势。这种激发能分配从倾向于PSⅡ而后转向于PSⅠ的现象是否与光合机构的状态转换(许大全,2002)有关尚待深入研究的问题。
Fm/Fo可以反映PSⅡ与PSⅠ之间的天线系统的状态转变,这是植物的一种保护机制,如果只发生光吸收截面的变化Fm/Fo比值不变,而PSⅡ向PSⅠ的激发能满溢变化则会使Fm/Fo降低(Schreiber et al.,1986)。本试验结果显示出随“温时”热胁迫的加剧Fm/Fo显著降低趋势,说明热胁迫下可能会引起PSⅡ的激发能向PSⅠ满溢来促使光合机构向状态2转变,从而来维持PSⅠ和PSⅡ 2个光系统协调运转。
| [1] |
高 玉,高志奎,张晓慧,等. 2009. 通过快速荧光动力学曲线探测白黄瓜光系统Ⅱ的热激胁迫效应. 生态学报,29 (6): 3335-3341. (Gao Y, Gao Z K, Zhang X H, et al. 2009. Heat shock stress on photosystemⅡin white cucunbers probed by the fast fluorescence rise OJIP. Acta Ecologica Sinica, 29(6): 3335-3341[in Chinese]). |
| [2] |
蒋德安,王 盾,杨万军,等. 2008. Rubisco活化酶与植物抗逆性//纪念殷宏章先生百年诞辰暨全国光合作用学术研讨会论文摘要汇编. 北京: 中国植物生理学会, 60. (Jiang D A, Wang D, Yang W J, et al. 2008. The enzyme activities of Rubiso and the stress resistance of plants// The abstract compilation of photosynthesis for commemorating the centenary of the birth of Mr. Yin Hongzhang. Beijing: Chinese Society for Plant Physiology, 60.[in Chinese])(  1) 1)
|
| [3] |
刘 超,袁 野,盖树鹏. 2014. 强光高温交叉胁迫对牡丹叶片PSⅡ和PSⅠ之间能量传递的影响. 园艺学报,41(2): 311-318. (Liu C, Yuan Y, Gai S P. 2014. Effects of strong light coupled with high temperature treature on energy transfer between PSⅡand PSⅠin tree peony leaves. Acta Horticulturae Sinica, 41(2): 311-318[in Chinese]).(  1) 1)
|
| [4] |
罗 祎,邓启云,常硕其,等. 2010. 高温对水稻光合作用的影响研究进展. 作物研究,24(3): 201-204. (Luo Y, Deng Qi Y, Chang S Q, et al. 2010. Research progress on the effects of high temperature on photosynthesis of rice. Crop Research, 24(3): 201-204[in Chinese]).(  1) 1)
|
| [5] |
卢广超,许建新,薛 立,等. 2013. 干旱胁迫下4种常用植物幼苗的光合和荧光特性综合评价. 生态学报,33(24): 7872-7881. (Lu G C, Xu J X, Xue L, et al. 2013. Comprehensive evaluation on photosynthetic and fluorescence characteristics in seedlings of 4 drought resistance species. Acta Ecologica Sinica, 33(24): 7872-7881[in Chinese]).(  1) 1)
|
| [6] |
牛芳芳. 2013. 河北太行山连翘药用林栽培关键技术调查研究. 保定:河北农业大学研究生硕士论文. (Niu F F. 2013. Investigation on key cultivation techniques of medicinal Forsythia suspensa in Taihang Mountain of Hebei. Baoding:The MS thesis of Hebei Agricultural University[in Chinese]).(  1) 1)
|
| [7] |
彭 涛,姚 广,高辉远,等. 2009. 植物叶片和冠层光化学反射指数与叶黄素循环的关系. 生态学报,29(4): 1987-1992. (Peng T, Yao G, Gao H Y, et al. 2009. Relationship between xanthophyll cycle and photochemical reflectance index measured at leaf or canopy level in two field-grown plant species. Acta Ecologica Sinica, 29(4): 1987-1992[in Chinese]).(  2) 2)
|
| [8] |
王建华,任士福,史宝胜,等. 2011. 遮荫对连翘光合特性和叶绿素荧光参数的影响. 生态学报,31(7): 1811-1817. (Wang J H, Ren S F, Shi B S, et al. 2011. Effects of shades on the photosynthetic characteristics and chlorophyll fluorescence parameters of Forsythia suspensa. Acta Ecologica Sinica, 31(7): 1811-1817[in Chinese]).(  2) 2)
|
| [9] |
王 梅,高志奎,黄瑞虹,等. 2007. 茄子光系统Ⅱ的热胁迫特性. 应用生态学报,18(1): 63-68. (Wang M, Gao Z K, Huang R H, et al. 2007. Heat stress characteristics of photosystemⅡin eggplant. Chinese Journal of Applied Ecology, 18(1): 63-68[in Chinese]).(  5) 5)
|
| [10] |
王 娟,敖 红,张会慧,等. 2013.6种绿化灌木叶片PSⅡ的耐盐性研究及综合评价. 经济林研究,33(1): 64-69. (Wang J, Ao H, Zhang H H, et al. 2013. Salt tolerance of PSⅡin leaves of six kinds of evergreen shrubs and comprehensive evaluation. Nonwood Forest Research, 33(1): 64-69[in Chinese]).(  1) 1)
|
| [11] |
王俊玲,高志奎,赵 飞. 2011. 热激胁迫对番茄果实表面光系统活性的影响. 园艺学报,38(4): 675-682. (Wang J L, Gao Z K, Zhao F. 2011. Effects of heat shock stress on the photosystem activity of tomato fruit surface. Acta Horticulturae Sinica, 38(4): 675-682[in Chinese]).(  5) 5)
|
| [12] |
温晓刚,林世青,匡延云. 1996. 高温胁迫对光系统Ⅱ异质性的影响. 生物物理学报,12(4): 714-718. (Wen X G, Lin S Q, Kuang Y Y. 1996. Effects of high temperature stress on the heterogeneity of photosystemⅡ. Acta Biophysica Sinica, 12(4): 714-718[in Chinese]).(  1) 1)
|
| [13] |
许大全. 2002. 光合作用效率. 上海: 上海科学技术出版社,29-159. (Xu D Q. 2002. Photosynthetic efficiency. Shanghai: Shanghai Science and Technology Press, 29-159.[in Chinese])(  6) 6)
|
| [14] |
袁小亚,王阿丽,任子蓓,等. 2014. 多倍体连翘外植体初代培养. 林业科技开发,28(2): 119-121. (Yuan X Y, Wang A L, Ren Z B, et al. 2014. A study of primary culture of polyploidy forsythia explants. China Forestry Science and Technology, 28(2): 119-121[in Chinese]).(  1) 1)
|
| [15] |
钟传飞,高志奎,李 伟,等. 2008. 北京地区大叶黄杨越冬进程中光系统Ⅱ的行为特征. 河北农业大学学报,31(5): 9-14. (Zhong C F, Gao Z K, Li W, et al. 2008. Study on characteristic of chlorophyll a fluorescence kinetics of overwintering Euonymus japonicas in Beijing. Journal of Agricultural University of Hebei, 31(5): 9-14[in Chinese]).(  2) 2)
|
| [16] |
周玉丽,任士福,张成合. 2011. 连翘多倍体诱导与鉴定. 河北农业大学学报,34(1): 73-77. (Zhou Y L, Ren S F, Zhang C H. 2011. Polyploidy induction and identification in Forsythia suspensa. Journal of Agricultural University of Hebei, 34(1): 73-77[in Chinese]).(  1) 1)
|
| [17] |
Braun G, Malkin S. 1990. Regulation of the imbalance in light excitation between photosystemⅡand photosystem I by cations and by the energized state of the thylakoid membrane. Biochimicaet Biophysica Acta, 1017(1): 79-90.( 1) 1)
|
| [18] |
Demming-Admas B, Adams W W, Barker D H, et al. 1996. Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation to of excess excitation. Physiol Plant, 98(2): 253-264.( 1) 1)
|
| [19] |
Gamon J A, Peñuelas J, Field C B. 1992. A narrow-waveband spectral index that tracks diurnal changes in photosynthetic efficiency. Remote Sens Environ, 41(1): 35-44.( 2) 2)
|
| [20] |
Gamon J A, Surfus J S. 1999. Assessing leaf pigment content and activity with a reflectometer. New Phytol, 143(1): 105-117.( 1) 1)
|
| [21] |
Genty B, Briantais J M, Baker N R, et al. 1989. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. Biochimicaet Biophysica Acta, 990(1): 87-92.( 1) 1)
|
| [22] |
Lazar D. 1999. Chlorophyll a fluorescence induction. Biochimicaet Biophysica Acta, 1412(1): 1-28.( 1) 1)
|
| [23] |
Ort D R, Whitmarsh J. 1990. Inactive photosystemⅡcenters: A resolution of discrepancies in photosystemⅡquantitation. Photosynthesis Research, 23(1): 101-104.( 1) 1)
|
| [24] |
Schreiber U. 1997. ChlorophyⅡfluorescence and photosynthetic energy conversion: simple introductory experiments with the TEACHING-PAM chlorophyⅡfluorometer. Heinz Walz GmbH, 23-24.( 1) 1)
|
| [25] |
Schreiber U, Berry J A. 1977. Heat induced changes in chlorophyll fluorescence in intact leaves correlated with damage of the photosynthetic apparatus. Planta, 136(3): 233-238.( 1) 1)
|
| [26] |
Schreiber U, Schliwa U, Bilger W. 1986. Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of. Photosynthesis Research, 10(1): 51-62.( 2) 2)
|
| [27] |
Srivastava A, Greppin H, Strasser R J. 1995. Acclimation of land plants to diurnal changes in temperature and light//Mathis P. Photosynthesis: from light to biosphere. Netherlands: Kluwer Academic Publishers.( 1) 1)
|
| [28] |
Sundby C, Melis A, Maenpaa P, et al. 1986. Temperature dependent changes in the antenna size of PhotosystemⅡ: Reversible conversion of PhotosystemⅡA to Photosystem ⅡB. Biochimicaet Biophysica Acta, 851(3): 475-483.( 1) 1)
|
| [29] |
Yamane Y, Kashino Y, Koike H, et al. 1997. Increases in the fluorescence Fo level and reversible inhibition of photosystemⅡreaction center by high-temperature treatments in higher plants. Photosynth Res, 52(1): 57-64.( 2) 2)
|
| [30] |
Yoshihiro Y, Yasuhiro K, Hiroyuki K, et al. 1998. Effects of high-temperatures on the photosynthetic systems in spinach: Oxygen evolving activities, fluorescence characteristics and the denaturation process. Photosynthesis Research, 57(1): 51-59.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

