文章信息
- 杨蕾, 梁军, 周国英, 倪杨, 吕全, 张星耀
- Yang Lei, Liang Jun, Zhou Guoying, Ni Yang, Lü Quan, Zhang Xingyao
- 土壤中杨树溃疡病生防菌的分离鉴定
- Isolation and Identification of Bio-control Microorganisms in Soil to Poplar Canker
- 林业科学, 2015, 51(4): 116-125
- Scientia Silvae Sinicae, 2015, 51(4): 116-125.
- DOI: 10.11707/j.1001-7488.20150415
-
文章历史
- 收稿日期:2013-04-09
- 修回日期:2015-01-12
-
作者相关文章
2. 中南林业科技大学林学院 长沙 410004;
3. 国家林业局森林保护重点试验室 中国林业科学研究院森林生态环境与保护研究所 北京 100091
2. College of Forestry, Central South University of Forestry & Technology Changsha 410004;
3. The Key Laboratory of Forest Protection of China State Forestry Administration, Research Institute of Forest Ecology, Environment and Protection, Chinese Academy of Forestry Beijing 100091, China
杨树溃疡病 [有性型病原菌(Botryosphaeria dothidia),无性型聚生小穴壳菌(Dothiorella grearia)是中国杨树(Populus)干部病害中的主要类型,在中国华北、西北及南方杨树栽培区均有分布,在杨树幼林上发生较多,危害严重,一般在感病品种上发病率高达80%~100%,死亡率达30%~50%(向玉英等,1996)。该病是中国杨树人工林重大生物灾害之一,是一种寄主主导型病害,其发生与寄主的树势强弱、健康状况密切相关,严重制约了杨树人工林的发展(张星耀等,2003;梁军等,2005;焦一杰等,2010)。 研究表明,寄主体内微生物的种群和数量对于病害的发生有着密切的关系,噬菌体(Phage)对柑橘溃疡病(Xanthomonas ampestris)和柑橘细菌性病害有良好的抑制作用(Balogh et al.,2008),An and等用荧光假单胞菌(Pseudomonas fluorescens)和化学杀菌剂联合作用控制了辣椒根腐病(Colletotrichum apsici)和粉霉病(Leveillula taurica)的发生,任嘉红等(2010)发现吡咯伯克霍尔德氏菌(Burkholderia pyrrocinia)JK-SH007产生的抗菌蛋白可很好地抑制杨树溃疡病菌的生长 。杨树溃疡病有多种类型,分别由葡萄座腔菌属(Botryosphaeria)、疡壳孢属(Dothichiza)、盾囊霉属(Coniothyrium)、腐皮壳属(Valsa)、棒盘孢属(Coryneum)、从赤壳属(Nectria)、茎点霉属(Phoma)等真菌引起(任飞娟等,2011),其中病原菌葡萄座腔菌的寄主种类最多,分布地域最广,侵染能力最强,为害较为严重。目前对杨树溃疡病的防治主要通过调整杨树林生态系统空间结构及物理和化学方法完成(洪少明,2011)。但生态系统空间结构调控是一个相对较长的过程而化学防治对于环境的污染和破坏已成为不容忽视的问题。在人们愈来愈关注环境安全的情况下,对杨树溃疡病的防治也提出了越来越高的安全要求。随着社会经济的发展和人们环境保护意识的增强以及生物防治技术的愈加成熟,用生物防治的方法治理杨树溃疡病极有可能成为取代化学防治的有效方法。本研究旨在筛选具有开发潜力的优良生防菌株,为杨树溃疡病的生物防治奠定基础。
1 材料与方法 1.1 采样点基本情况 1.1.1 河北廊坊造林地位于廊坊广阳区,为冲积平原,气候条件基本一致,年均温度11.8 ℃,年均降水量593.4 mm,年均日照时间2 689 h,无霜期183天,海拔10.0~13.8 m,地下水位3~5 m。影响立地条件的主要因子为土壤差异和水分供应情况。本实验基地的杨树品种为欧美杨107杨(Populus×euramericana ‘Neva’)(简称107杨)、欧美杨108杨(P.×euramericana ‘Guariento’)(简称108杨)和毛白杨(P.tomentosa),栽种模式为各无性系块状混交,品种构成上107杨占35%,108杨占31%,毛白杨占34%。株行距为(3 m×4 m)×6 m。平均树高9.82 m,胸径10.32 cm,冠幅0.87 m。
1.1.2 河南原阳位于原阳县蒋庄乡靳屋村北,面积约53.33 hm2,属黄河冲击平原,属暖温带大陆性季风气候,年平均气温13.4 ℃,年均湿度68%,年平均降雨656.3 mm,无霜期220天,全年日照时间约2 400 h,土地肥沃、光热充沛,地下水源富足。本试验基地的杨树品种为中林46(P.×euramricana ‘Zhonglin46’)和毛白杨无性系块状混交,品种构成上中林46占43%,毛白杨占57%。株行距为(2.5 m×3 m)×4 m。平均树高8.63 m,胸径9.78 cm,冠幅0.77 m。
1.2 试验材料 1.2.1 培养基细菌分离选用NA培养基,配方为:牛肉膏5 g,蛋白胨10 g,蔗糖10 g,琼脂15~ 20 g,H2O 1 000 mL,pH7.2~7.4;放线菌的分离选用高氏1号培养基,配方为:可溶性淀粉20 g,氯化钠0.5 g,硝酸钾1 g,硫酸铁0.01 g,磷酸氢二钾0.5 g,水硫酸镁0.5 g,琼脂20 g,水1 000 mL,pH7.2~7.4;真菌分离培养采用PDA培养基,配方为:去皮马铃薯200 g,葡萄糖20 g,琼脂15~20 g,水 1 000 mL,pH值自然。
1.2.2 供试病原菌葡萄座腔菌(Botryosphaeria dothidica)由中国林业科学研究院森林保护实验室菌种保藏中心提供,编号为72②B。
1.2.3 杨树扦插苗离体组织试验中选用的杨树扦插苗为毛白杨当年生苗木。在温室内采用枝接顶端封蜡的方法进行扦插,扦插时间为当年3月,使用时间为当年8月。使用时苗高90~120 cm,主干枝条直径为5~10 mm。扦插苗生长状况良好,无病虫害。
1.3 试验方法 1.3.1 土样采集在廊坊和原阳县各选择2块样地,在每个样地根据杨树树势生长情况、病虫害是否发生以及土壤及林下植被情况选择采样点,其中廊坊11个,原阳5个,共16个采样点。采土样时,按照不同土层分别采集距杨树主干20 cm范围内的土样,去除土壤表层杂物后,上层(S)土壤为5~ 15.99 cm,中层(Z)为16~ 25.99 cm,下层(X)为26~ 40 cm。采集采样点各层土壤50 g,共48份,装入塑封袋内。记录采集人姓名,采集时间,地点,立地条件,海拔、地形、气候及植被、土壤类型、寄主及其附近植物、种类及生长情况、发育阶段等。采集的土壤置于4 ℃冰箱内保存,并尽快分离。
1.3.2 土壤微生物的分离培养采用稀释平板涂布法分离土壤微生物。将1 g土壤置于装有100 mL无菌水的250 mL三角瓶中制成土壤悬浮液母液。将母液置于28 ℃摇床中震荡1 h。无菌条件下对土壤母液进行10倍梯度稀释,稀释倍数为10-2~ 10-7,细菌选用10-5~10-7稀释梯度的土壤悬浊液进行分离,放线菌选用10-3~10-5稀释梯度的土壤悬浊液进行分离,真菌选用10-2~10-4稀释梯度的土壤悬浊液进行分离。用无菌移液枪吸取0.1 mL土壤悬浊液涂布于相应的平板培养基上,每个梯度设3个重复,并将上述平板培养基放入培养箱中培养。其中,细菌培养温度为37 ℃,真菌和放线菌的培养温度为28 ℃。NA平板培养2天后,高氏1号和PDA平板培养4天后进行观察计数。根据菌株的不同形态特征,将培养分离的不同种类微生物进一步纯化,直至获得纯培养物。
1.3.3 拮抗微生物的初步筛选选择杨树溃疡病病原菌葡萄座腔菌为指示菌株,提前7天将病原菌活化待用。拮抗能力的测定选择平板对峙法: 1)拮抗细菌和放线菌:在PDA平板中央接入直径为5 mm的已活化5天的病原菌菌块,然后在距培养皿边缘2 cm的同心圆上每相距120°的培养基上用接种针接入分离的菌株,28 ℃下培养3天后,测得其抑菌圈大小。每个菌株在一个培养皿内接3个点并重复3次。 2)拮抗真菌:分别取5 mm的活化5天后的病原菌与土壤真菌菌饼,接种于PDA平板培养基中线距边缘1 cm处,每个土壤真菌重复3次,置于28 ℃下,黑暗恒温培养3天,每天记录相对横向生长长度,并拍照。此方法中,病原菌和土壤真菌在同一培养皿内生长,会竞争培养基中的营养、生存空间等,即此方法主要判定土壤真菌对病原菌的竞争作用强弱。在本文中将对峙试验中的竞争作用根据郭润芳等(2002)的方法进行修正,按以下标准进行等级分类:
Ⅰ:土壤真菌菌落直径占据平板100%;
Ⅱ:土壤真菌菌落直径占据平板>2/3;
Ⅲ:土壤真菌菌落直径占据平板 < 2/3但>l/3;
Ⅳ:土壤真菌菌落直径占据平板 < l/3;
Ⅴ:病原菌菌落直径占据平板100%。
1.3.4 拮抗微生物的发酵液复筛发酵培养液的制备:将初筛的拮抗菌株分别在NA或PDA培养基上活化。细菌用接菌环移取一环置入装有100 mL NA液体培养基的250 mL三角瓶中,在 35 ℃、 120 r·min-1 的摇床上振荡培养48 h,拮抗放线菌和真菌用打孔器取4 mm的菌饼,接入PDA培养基中,28 ℃、140 r·min-1的摇床上振荡培养96 h。采用2种方法进行发酵液复筛,用“三明治法”来判定拮抗菌株发酵液难挥发物质的拮抗活性强弱,用改良的琼脂扩散法来衡量接抗菌易挥发扩散物质的抗菌物质活性高低。经初筛选出的拮抗菌都需分别进行这2种方法的复筛。
1)三明治法(邱思鑫,2004):在直径9 cm的培养皿中倒入约3 mL PDA培养基,凝固后加入1 mL分离菌株的培养液和3 mL冷却至45 ℃左右的PDA培养基,摇匀凝固后再加入约15 mL PDA培养基(要求倒好的平板表面不长细菌),以加1 mL无菌水和3 mL PDA为对照,然后在平板上接入直径为5 mm的病原菌菌饼,28 ℃黑暗培养5天后用十字交叉法测量病菌菌落直径,计算抑制率。按以下公式计算抑制率。选出抑菌效果最好的菌株,保存备用。
| $抑菌率\left(\% \right)= \frac{{对照菌落直径-处理菌落直径}}{{对照菌落直径}} \times 100\%$ |
2)改良的琼脂扩散法:在凝固的PDA琼脂平板距边缘1.5 cm处的圆周上等距离打3个孔,孔洞直径为4 mm;将预先培养好的病原菌用打孔器取4 mm的菌饼接在培养皿中央,再将液体培养4天的拮抗菌的上清液20 μL滴加到各孔中,28 ℃恒温培养,4天后观察记录。以在孔洞中加入20 μL无菌水作为对照。所有处理进行3次重复试验。
1.3.5 拮抗菌的离体复筛1)杨树溃疡病菌孢子液的制备 杨树溃疡病菌在PDA平板上28 ℃培养,待充分产孢后,加无菌1%葡萄糖溶液10 mL浸15 min,用无菌的棉签洗下孢子和菌丝体,经无菌脱脂棉过滤,除去菌丝体,再用无菌1%葡萄糖溶液配成悬浮液,将孢子含量调到10×10倍视野含80~100个孢子。
2)拮抗菌发酵液的制备 用250 mL的三角瓶装入100 mL培养液(pH7.0),细菌用NA培养基,真菌和放线菌用PDA培养基;灭菌冷却后,接种10 mL活化的拮抗菌菌液;细菌35 ℃120 r·min-1振荡培养48 h,放线菌和真菌28℃,140 r·min-1振荡培养96 h。
3)试验方法 选取生长一致的当年生杨树扦插苗,截取约7 cm长的干部枝条放入直径为9 cm的培养皿内,皿底铺上一层约2 mm厚的脱脂棉并加入少量无菌水保湿培养。每个培养皿中放置3根枝条,每个处理分别设3次重复,即每个生防菌株处理9根枝条。用已灭菌的接种针沾取拮抗菌发酵液在枝条上进行刺伤接种,蘸取的发酵液量以不从接种针上滴下为宜,刺伤接种的伤口大小约1 mm。将蘸有预先制好的病原菌孢子悬浮液的脱脂棉覆盖在刺伤接种的伤口上,清水对照,28 ℃保湿培养,10天后待对照枝干充分发病后,进行病情调查并计算病情指数和防治效果。室内离体组织试验病级分类按表 1标准进行。
indoor inoculation experiment
|
|
|
$病情指数 = \frac{{\Sigma \left({病级枝数×该病级代表数值} \right)}}{{调查枝数 ×发病最高一级代表值}} \times 100 \end{document} |
综合初筛、复筛及离体复筛的结果,筛选出拮抗效果强的菌株作为目的菌株进行下步试验。
1.3.6 拮抗菌株的鉴定1)形态培养特征观察 使用PDA固体培养基和插片接种法接种,于28 ℃下培养,分别于7,15,30天后将盖玻片取出,在显微镜下观察基内菌丝、气生菌丝形态以及孢子丝的形态特征。
2)rDNA-ITS PCR纯化扩增和序列测定 对拮抗菌依据核糖体基因内转录间隔区(rDNA-ITS)序列进行分子鉴定。以真菌rDNA-ITS序列的通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对菌株的基因组DNA进行PCR扩增。扩增体系: 2×Pfu PCR Mix 25 μL,上游引物(10 μ mol)2 μL,下游引物(10 μ mol)2 μL,基因组模板1 μL,总体积为50 μL; 扩增程序:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,共35个循环,最后72 ℃延伸8 min。取3 μL PCR产物经过1%的琼脂糖凝胶电泳检测,以DNA Marker DL2000为分子量标准,电泳结束后,拍照记录电泳结果。
序列经BioEdit等软件分析和手工校正后,用NCBI的BLAST(2.2.12version)程序将测出的序列与在GenBank(http://www.ncbi.nlm.nih.gov/BLAST)中已知菌种的ITS序列进行同源性比较分析,从而确定菌株的分类地位。
2 结果与分析 2.1 不同层次间土壤微生物的变化规律根据培养特性和菌落特征判定,从上、中、下3层土壤中共分离得到菌株259株,其中细菌122株,放线菌106株,真菌31株。各土层微生物种类分布情况见表 2。细菌在分离出的菌株中占有优势,其次是放线菌,而真菌的数量最少。这与土壤中微生物的分布规律相符。在下层土壤中,3类微生物的数量差别不大。
|
|
通过平板对峙试验,从259株菌中共分离得到有抑菌效果的菌株69株,其中细菌和放线菌36株,真菌33株。各菌株拮抗作用或竞争作用情况见表 3。从细菌和放线菌中筛选出抑菌带直径>4 mm的菌株8株,真菌中生防菌菌落直径>40 mm的菌株8株为后续研究对象。在细菌和放线菌中,菌株YX5B1和TLZ1A5的抑菌直径可达到9 mm以上;在有效果的真菌中,大部分的抗生等级处于Ⅲ或Ⅳ级,而菌株LX6F2的抑菌等级为Ⅱ级。
|
|
 |
图 1 拮抗菌株对葡萄座腔菌的平板对峙效果 Fig. 1 Antagonistic effect of antifungal strains to Botryosphaeria dothidea in plate confrontation experiment A:细菌YX5B1 Bacteria strain YX5B1; B:细菌LZ8B2 Bacteria strain LZ8B2; C:真菌TLZ2F2 Fungus strain TLZ2F2; D真菌LX5F1 Fungus strain LX5F1 |
通过三明治法的筛选结果可知,初筛出的16株菌株,除LZ8F9,LX6F1,LX1F2外,其余各株的抑菌率均可达60%以上。在三明治法测定中,病原菌和拮抗菌只隔着一层约0.5 mm厚的培养基,减小了拮抗菌分泌物扩散能力对拮抗作用的影响,使得接种后拮抗菌与病原菌间可以很快形成强作用的营养竞争和相互作用,同时避免了对峙试验中的物理障碍问题。在本次试验中,用此方法各拮抗菌株均表现出较好的防治效果,可能是因为加入的发酵液为1 mL,抑菌活性物质含量较高,抑菌效果明显。
2.3.2 改良琼脂扩散法测发酵液抑菌活性在改良琼脂扩散法中,筛选出拮抗菌菌落直径>38 mm的菌株为后续研究对象。
综合三明治法和改良琼脂扩散法的结果,筛选出的拮抗菌株有8株,分别为细菌TYZ1B3和YX5B1,真菌LS10F1,LX5F1,LZ10F1,LS6F1中,LX6F2和TLZ2F2。
|
|
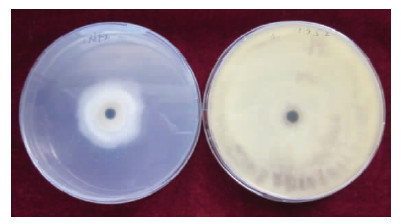 |
图 2 拮抗菌LX6F2发酵液三明治法复筛效果 Fig. 2 Effect of biocontrol strain LX6F2 fermented liquid rescreening by sandwich method |
|
|
 |
图 3 拮抗菌株发酵液改良琼脂扩散法复筛效果 Fig. 3 Effect of biocontrol strain LX6F2 fermented liquid rescreening by Improved agar diffusion method |
在筛选出的8株拮抗菌中,各株在离体组织上表现出的拮抗活性各不相同,其中菌株LX6F2的防治效果最好,可达76.04%。经SPSS软件对不同菌株的防治效果进行单因素方差分析显示,不同菌株对杨树组织溃疡病的防治效果差异非常显著(P < 0.01)。衡量生防菌株是否优良的一个最重要的标准就是在实际应用中防治效果能否保持稳定高效。通过组织离体试验筛选出的菌株虽然和大田或是林间的实际应用情况有差别,但这是林间试验的基础,在很大程度上可以预示生物防治的效果。
通过离体组织试验,从8株对杨树溃疡病有良好防治效果的拮抗菌株筛选到1株生防菌株LX6F2,该菌株在离体组织上表现出的对溃疡病的生防效果显示了其抑菌活性良好的适用性和稳定性,这对于对后续开发利用至关重要。
|
|
在PDA培养基上,LX6F2菌株菌落呈圆形或椭圆形,气生菌丝初期为白色,绒毛絮状,质地较为疏松,和培养基结合不是很紧密,易挑取(图 4A),生长率为6.89 mm·d-1,培养后期表面具有浅橙黄色孢子堆。菌丝有隔,少分支(图 4B)。分生孢子梗分枝或在菌丝上直接形成产孢细胞,小型分生孢子极少。大型分生孢子略弯,顶细胞延长成钩状,多为3~6个分隔,大小约为(21.57~44.62)μm×(3.21~5.04)μm,但孢子堆内的大型分生孢子多为5~7个分隔,大小为(52.38~62.15)μm×(3.85~5.43)μm(图 4C)。
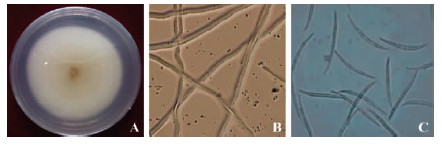 |
图 4 生防菌株LX6F2的形态特征 Fig. 4 Morphological characteristics of the bio-control strain LX6F2 (A.菌落Colony; B.菌丝Hypha; C.分生孢子Conidium) |
对生防菌株LX6F2 的ITS基因序列进行PCR扩增,产物纯化后测序(图 5)。测得生防菌株LX6F2的序列长度为 563 bp,序列登录号为FR872729.1。将所测得的ITS序列与GenBank中的已知序列进行比,分别调出与LX6F2菌株相近种模式菌株的ITS序列,经Clustal W进行多重对比发现LX6F2菌株与编号为JN038467的木贼镰刀菌相似度高达100%(图 6)。综合菌株的培养和形态学特征,确定生防菌株LX6F2为木贼镰刀菌(Fusarium equiseti)。
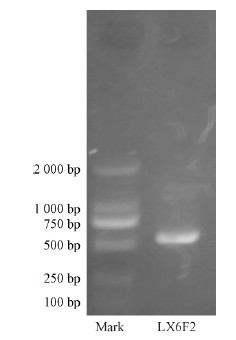 |
图 5 真菌通用引物ITS1/ITS4 PCR扩增生防菌株LX6F2凝胶电泳图像 Fig. 5 Gel electrophoresis of fungi of ITS1/ITS4 PCR amplification by universal primers |
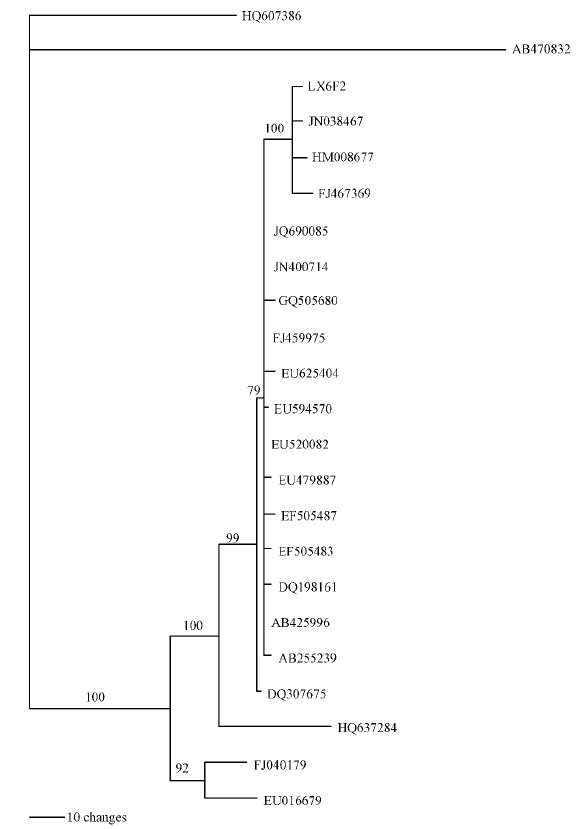 |
图 6 菌株LX6F2与相关模式菌株的系统发育树 Fig. 6 The phylogenetic tree of relationship between strain LX6F2 and related strains |
本研究主要取得了以下结论:1)从杨树林土壤中分离得到的259株土壤微生物中经初筛、复筛及离体组织筛选,挑选出一株编号为LX6F2的优良生防菌株;2)经形态学观察和分子生物学鉴定,确定为木贼镰刀菌;3)经试验验证,该菌株对杨树溃疡病病原菌葡萄座腔菌表现出良好的抗生效果,对杨树离体组织溃疡病的防治效果可达76.04%。该菌株的发现和研究为杨树溃疡病的生物防治提供新的原材料,对杨树溃疡病的可持续控制具有重要意义。
3.1 土壤拮抗菌的筛选方法土壤是微生物的大本营,由于土壤的温度、pH值、养分及其他理化性质等条件都非常适合微生物的生长繁殖(Brookes et al.,1985;Powlsond et al.,1987),因此,在这一环境下微生物多样性丰富、数量巨大(牛红榜等,2007)。要从土壤中分离筛选出专一性强的生防菌就必须有一套方便、准确、快捷的方法。本试验中选用的筛选方法是以拮抗菌株能快速生长,更好地占据生长空间、竞争营养为先决条件,但这样做可能使一些生长速度慢而能产生强的抑菌作用代谢产物的菌株在初筛时就被淘汰。筛选功能微生物的方法很多,要根据每项研究的实际情况和需求来选择最适宜的方法。
3.2 木贼镰刀菌目前的研究结果表明,一些镰刀菌可作为防治病虫害的优良资源。很多镰刀菌可以使昆虫染病,如嗜蚧镰孢(Fusarium coccophilum),在自然条件下可以控制害虫虫口密度。陕西省农科院的苑森行等(1986)对虫生真菌木贼镰刀菌进行了初步研究,发现它对菜青虫(Pieris rapae)有很好的防治效果等。镰刀菌在植物线虫防治方面也具有重要意义,镰刀菌菌株Snef332杀线能力遗传稳定性较很高,在南方根结线虫(Meloidogyne incongnita)生防领域具有较大潜力,适宜作为南方根结线虫的生防因子加以开发利用(段玉玺等,2010)。此外非致病性镰刀菌还可以用来防治镰刀菌病害,如生防镰刀菌可以减轻列当(Orobance sp.)对烟草(Nicotiana tabacum)的危害(吴元华等,2011)。从2000年开始,杨涛等即采用紫外线诱变的方法获得黄瓜(Cucumis sativus)和甜瓜(Cucumis melo)的非致病性镰刀菌,并对其生防潜力进行了初步研究(杨涛等,2001)。有的镰刀菌在自然界中分解利用各种物质,参与物质循环,对环境保护起着不可忽视的作用。
在本研究中,笔者从杨树林土壤中分离到了一株生防菌,经鉴定它是一株木贼镰刀菌,经试验验证,该菌对溃疡病菌葡萄座腔菌有良好的拮抗抑制作用。笔者已经得到了该优良的生防菌株资源,但目前对它的生防机理和应用等却鲜有报道,因此在后续研究中需要对其抑菌机制、有效拮抗成分及毒素等进行细致研究。作为1株镰刀菌,在应用中要趋利避害,找到适宜的开发途径和方法,实现其有利价值的最大化,在尽量发挥其生物防治作用的同时避免对其他作物及人畜造成伤害。
| [1] |
段玉玺,曲泽岚,王媛媛,等.2010.南方根结线虫生防镰刀菌菌株筛选.农药,49(8): 607-620. (Duan Y X, Qu Z L, Wang Y Y, et al. 2010. Screening the strains of Fusarium against Meloidogyne incognita. AGROCHEMICALS, 49(8): 607-620 [in Chinese]).(  1) 1)
|
| [2] |
郭润芳.2002.木霉菌(Trichoderma spp.)对林木病害生防机制的研究.河北保定:河北农业大学硕士学位论文,46. (Guo Y F. 2002. Studies on biocontrol mechanism of Trichoderma species on trees disease. Baoding: MS thesis of Agricultural University of Hebei.[in Chinese])(  1) 1)
|
| [3] |
焦一杰,黄逢龙,梁 军,等.2010.杨树林分的胸径特征与溃疡病感病指数的关系.林业科学研究,23(3):342-348. (Jiao Y J, Huang F L, Liang J. 2010. The impact of poplar diameter characteristics on disease index of canker. Forest Research, 23(3):342-348[in Chinese]).(  1) 1)
|
| [4] |
洪少明.2011.杨树防护林常见病害的诊断与防治.安徽农学通报,17(16):84-85. (Hong S M. 2011. Diagnosis and prevention of poplar shelterbelt common diseases. Anhui Agricultural Science Bulletin, 17(16):84-85[in Chinese]).(  1) 1)
|
| [5] |
梁军,姜俊清,刘会香,等.2005.我国杨树与溃疡病菌互作的病理学研究.林业科学研究,18(2):214-221. (Liang J, Jiang J Q, Liu H X, et al. 2005. Study on the pathology of poplar-canker pathogen interaction in China. Forest Research, 18(2):214-221[in Chinese]).(  1) 1)
|
| [6] |
牛红榜,刘万学,万方浩,等.2007. 紫茎泽兰根际土壤中优势细菌的筛选鉴定及拮抗性能评价.应用生态学报,2007,18(12):2795-2800. (Niu H B, Liu W X, Wan F H, et al. 2007. Screening, identification and antagonism assessment of dominant bacteria in Ageratina adenophora sprengel rhizosphere soil. Chinese Journal of Applied Ecology, 18(12):2795-2800[in Chinese]).(  1) 1)
|
| [7] |
邱思鑫.2004.防病、促生植物内生芽孢杆菌的研究.福州:福建农林大学. (Qiu S X. 2004. Biological control and plant growth promoting endophytic Bacillus sp. Fuzhou: PhD thesis of Fujian Agriculture and Forestry University(  1) 1)
|
| [8] |
任飞娟.2011.欧美杨溃疡病病原鉴定.北京:北京林业大学硕士学位论文. (Ren F J. 2011. Pathogen identification of Populus euranericana canker disease. Beijing: MS thesis of Beijing Forestry University[in Chinese]).(  1) 1)
|
| [9] |
向玉英,郭树云.1996.杨树水泡型溃疡病防治指标研究.林业科学研究,9(4):409-412. (Xiang Y Y, Guo S Y. 1996. Study on the control index of Dothiorella gregaria canker of poplar. Forest Research, 9(4):409-412[in Chinese]).(  1) 1)
|
| [10] |
吴元华,宁繁华,刘晓琳,等.2011.生防镰刀菌(Fusarium spp.)对烟草列当的防效.烟草科技,291(10):78-80. (Wu Y H, Ning F H, Liu X L, et al. 2011. Biological control effects of Fusarium sp. against orobance in tobacco field. Tobacco Science & Technology, 291(10):78-80.[in Chinese])(  1) 1)
|
| [11] |
杨涛,张贵锋,关天舒.2001.黄瓜、甜瓜专化型尖孢镰刀菌人工诱变非致病菌筛选及其生防应用研究.辽宁农业科学, (4):11-13. (Yang T, Zhang G F, Guan T S. 2001. Screening and bio-control application research of specialization artificial mutagenesis nonpathogenic Fusarium oxysporum sp.Cucumerinum and Fusarium oxysporum sp. Melon. Liaoning Agricultural Science, (4):11-13[in Chinese]).(  1) 1)
|
| [12] |
苑森行,杨玉景.1986.虫生真菌-木贼镰刀菌的初步研究.微生物学通报,3(2):13-14. (Yuan S X, Yang Y J. 1986. Preliminary study on entomogenous fungi Fusarium equiseti. Microbiology China, 3(2):13-14.[in Chinese])(  1) 1)
|
| [13] |
张星耀,骆有庆.2003.中国森林重大生物灾害.北京:中国林业出版社,127. (Zhang X Y, Luo Y Q. 2003. Major forest diseases and insect pests in China. Beijing: China Forestry Publishing House.[in Chinese])(  1) 1)
|
| [14] | Anand T C, Kuttalam A, et al. 2010. Integrated control of fruit rot and powdery mildew of chilli using the biocontrol agent Pseudomonas fluorescens and a chemical fungicide. Biological Control,52(1):1-7. |
| [15] |
Balogh B,Canteros B I, Jones J B, et al. 2008. Control of citrus canker and citrus bacterial spot with bacteriophages. Plant Disease,92(7):1048-1052.( 1) 1)
|
| [16] |
Brookes P C, Landman A, Pruden G, et al. 1985. Chloroform fumigation and the release of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen in soil. Soil Biology & Biochemistry,17(6):837-842.( 1) 1)
|
| [17] |
Powlsond S, Brookes P C, Christensenbt.1987. Measurement of soil microbial biomass provides an early indication of changes in total soil organic matter due to straw in corporation. Soil Biology & Biochemistry,19(2):159-164.( 1) 1)
|
| [18] | Ren J H, Ye J R, Liu H, et al. 2011. Isolation and characterization of a new Burkholderia pyrrocinia strain JK-SH007 as a potential biocontrol agent. World J Microbiol Biotechnol, 27:2203-2215. |
 2015, Vol. 51
2015, Vol. 51

