文章信息
- 刘泽彬, 程瑞梅, 肖文发, 郭泉水, 王娜
- Liu Zebin, Cheng Ruimei, Xiao Wenfa, Guo Quanshui, Wang Na
- 遮荫对中华蚊母树苗期生长及光合特性的影响
- Effects of Shading on Growth and Photosynthetic Characteristics of Distylium chinense Seedlings
- 林业科学, 2015, 51(2): 129-136
- Scientia Silvae Sinicae, 2015, 51(2): 129-136.
- DOI: 10.11707/j.1001-7488.20150216
-
文章历史
- 收稿日期:2013-10-10
- 修回日期:2014-12-01
-
作者相关文章
近年来,城市园林建设越来越注重乔、灌木及地被植物混合搭配的复层结构布置格局,但不同植物具有不同光环境适应能力,生长在乔木下的灌木及地被植物势必会受到不同程度遮荫的影响,因此,园林植物光环境适应性研究及耐荫植物的筛选对于科学配置乔、灌木及地被植物具有重要意义。植物对低光量子通量的反应,如形态结构的改变、光合响应参数及叶绿素荧光特性的调整等是评价植物耐荫性的重要方面(Nygren et al.,1983;王雁等,2002;Dai et al.,2009),目前已围绕这些方面做了大量有关大叶黄杨(Euonymus japonicus)(包玉等,2009)、连翘(Forsythia suspensa)(王建华等,2011)、三角梅(Bougainvillea spectabilis)和黄金榕(Ficus microcarpa cv.coldenleaves)(陆銮眉等,2011)等城市园林物种耐荫性的研究,对于揭示植物耐荫性及其机制起到了重要作用。
已有研究表明,具有耐荫能力的植物可以通过形态及生理的调整来适应低光量子密度的光环境,如:植株可以通过株高增加、叶片变大、比叶质量变小、叶绿素含量增加以及叶绿素a/b减小等(Evans et al.,2001;刘鹏等,2008)来保持吸收光量子的最大能力;通过降低表观量子效率和光补偿点以及增加最大光化学效率来提高光能利用效率等(Bjorkman et al.,1988;刘建锋等,2011);减少基径生长的能量分配和降低暗呼吸速率等来尽可能减少能量的消耗(王建华等,2011)等。这些形态和生理的调整对于保证植物在较低的光合有效辐射内有机物质的平衡起到了至关重要的作用(王雁等,2002)。中华蚊母树(Distylium chinense)为金缕梅科(Hamamelidaceae)蚊母树属(Distylium)常绿灌木,具有生命力强,生长较快,萌芽、发枝力强,耐修剪等特性,在我国特别是长江中上游地区城市园林绿化和风景区景观设计中极具开发应用前景。已有研究(杨丽,2008)表明,中华蚊母树在轻度遮荫环境下(50% 全光)有利于自身生长,但目前对于中华蚊母树在中度遮荫和重度遮荫环境下的适应性仍缺乏足够的认识。本研究通过人工遮荫法设置不同光环境梯度(全光、中度遮荫和重度遮荫),对苗期中华蚊母树的形态特征、光合作用及叶绿素荧光参数进行比较研究,分析苗期中华蚊母树对不同光环境的适应性,以期为城市园林建设中合理进行乔、灌木布置提供科学依据。
1 材料与方法 1.1 材料与处理2012年9月将100株中华蚊母树1年生幼苗移栽入花盆(直径22 cm,高17 cm)中,每盆2株,将所有植株置于中国林业科学研究院长江三峡库区(秭归)森林生态环境定位站(110°54′E,30°53′N,海拔296 m)进行相同土壤基质(当地沙壤土)、光照条件和水分条件等的管理。2013年4月1日选取27盆长势基本一致的中华蚊母树进行试验布置,此时植株平均基径为3.48 mm,株高为24.13 cm。利用人工遮荫的方法,设置3种光环境梯度:全光CK、中度遮荫L1(1层遮荫网,光照强度相当于全光下的25%)和重度遮荫L2(2层遮阴网,光照强度相当于全光下的7%),每个光梯度9盆,18株中华蚊母树植株。于第61天进行生长、光合及叶绿素荧光参数的测定。
1.2 生长指标测定于试验前(2013年4月1日)和结束后(2013年5月31日)利用数显游标卡尺测定植株基径,利用卷尺测量植株的株高;在试验结束后,利用数显游标卡尺测定植株从顶端数第3~5片叶片(健康功能叶)的叶长及最大叶宽,每处理随机选取3盆,每盆测定2株,取平均值作为1次重复,每处理3次重复;采集植株从顶端往下数第3~5片叶片,用于比叶面积测定,每处理选取3盆,每盆采集2株,取平均值作为1次重复,每处理3次重复。测定时首先将植物叶片放入带有坐标纸的透明夹板上,利用数码相机获取图像,将图像导入计算机,用AutoCAD 2007软件计算叶片面积,然后将叶片放入80 ℃烘箱中烘干至恒重,24 h后取出称量干质量,比叶质量(g·m-1)为叶干质量与叶面积之比值,即叶干质量/叶面积。
1.3 光响应曲线的测定利用Li-6400XT便携式光合测定仪测定不同光环境下苗期中华蚊母树成熟功能叶净光合速率的光响应过程。每处理选取植株3盆,每盆选1株植株进行测定,每植株测定1片叶片(从顶端数第3或第4片叶片),每处理各3次重复,时间为上午8:00—11:30。测定时,控制叶室温度为25 ℃,空气相对湿度为60%~65%,CO2浓度为380~390 μmol·mol-1,利用LED红蓝光源控制光合有效辐射强度2 500,2 200,2 000,1 800,1 500,1 200,1 000,800,600,400,200,100,50,20,10,5,0 μmol·m-2s-1,在每个光强下仪器将维持120 s后自动记录净光合速率等光合生理参数。以光合有效辐射强度PAR为横坐标、净光合速率Pn为纵坐标绘制净光合速率-光强(Pn-PAR)(曲线,利用非直角双曲线模型拟合得到表观量子效率(α)、最大净光合速率(Pn max)、暗呼吸速率(Rd)、光补偿点(LCP)、光饱和点(LSP)等光响应参数,模型表达式(Thornley,1976)如下:
| ${P_n}\left(I \right)= \frac{{\alpha I + {P_{{\text{nmax}}}} - \sqrt {{{\left({\alpha I + {P_{{\text{nmax}}}}} \right)}^2} - 4I\alpha k{P_{{\text{nmax}}}}} }}{{2k}} - {R_{\text{d}}}。$ |
若模型拟合较好,可采用以下公式计算光补偿点(LCP):
| ${\text{LCP = }}\frac{{{R_{\text{d}}} \times {P_{{\text{nmax}}}} - k \times R_{\text{d}}^{\text{2}}}}{{\alpha \left({{P_{{\text{nmax}}}} - {R_{\text{d}}}} \right)}}$。 |
利用Li-6400XT便携式光合测定仪的荧光叶室对叶绿素荧光参数进行测定。每处理选取植株3盆,每盆测定1株,每株选取3片健康功能叶进行测定,取平均值作为1次重复,每处理3次重复。测定前首先对待测植株叶片暗适应2 h(周珺等,2012),然后打开监测光测定初始荧光(F0),再打开一次饱和脉冲光(6 000 μmol·m-2s-1,频率20 kHz,0.8 s)测定最大荧光Fm。当饱和脉冲光结束后,打开光化学光(PFD为1 000 μmol·m-2s-1),待荧光基本稳定后测定稳态荧光Fs,然后再打开一次饱和脉冲光测定光下最大荧光Fm′,关闭光化学光,同时打开远红光照射3 s,测得光下最小荧光F0′,然后根据Genty等(1989)的方法计算最大光化学效率(Fv/Fm)、光化学猝灭(qP)、非光化学猝灭(qN)和电子传递速率(ETR)等荧光参数。
1.5 数据处理模型参数的拟合用SPSS 19.0统计分析软件中的非线性回归模块,利用SPSS 19.0软件对不同光环境对中华蚊母树生长指标、光合及叶绿素荧光参数的影响进行单因素方差分析(one-way ANOVA),用Duncan多重比较检验不同处理间的差异显著性,用SigmaPlot 11.0软件制图。
2 结果与分析 2.1 不同遮荫环境下中华蚊母树生长指标的变化由表 1可以看出,遮荫显著影响了中华蚊母树基径的生长,苗期中华蚊母树在遮荫60天后,各遮荫处理植株基径增量显著低于CK植株,并随遮荫水平的增加明显降低。
|
|
与基径对遮荫的响应有所不同,苗期中华蚊母树株高增量随着遮荫水平的增加表现出先增加后降低的趋势(表 1),经过60天的遮荫处理,L1植株株高增量显著高于CK植株,L2植株比CK植株略有下降,但无明显差异。
随着遮荫水平的增加,苗期中华蚊母树叶片叶长和最大叶宽均表现出逐渐升高的趋势(表 1),经过60天的遮荫处理,L1和L2植株叶长分别比CK植株增加了19.9%和23.1%,最大叶宽分别比CK植株增加了39.7%和44.5%,L1和L2植株叶长和最大叶宽均与CK植株差异显著。
苗期中华蚊母树叶片比叶质量与基径具有相似的变化规律(表 1),经过60天的遮荫处理,L1和L2中华蚊母树叶片比叶质量均显著小于CK植株,其中L1植株叶片比叶质量与CK植株相比降低了31.6%,L2植株叶片比叶质量与CK植株相比降低了49.1%。
2.2 不同遮荫环境下苗期中华蚊母树光合-光响应参数的变化由图 1可知,当PAR≤100 μmol·m-2s-1时,L1和L2处理苗期中华蚊母树叶片Pn均随光强的增加而迅速增加,植株叶片Pn与CK植株相当;当PAR>100 μmol·m-2s-1后,L2苗期中华蚊母树叶片Pn随光强的增加变化幅度逐渐减缓,植株叶片Pn小于CK和L1植株;当PAR>600 μmol·m-2s-1后,L1苗期中华蚊母树叶片Pn随光强的增加变化幅度也逐渐减缓,植株叶片Pn开始小于CK植株。
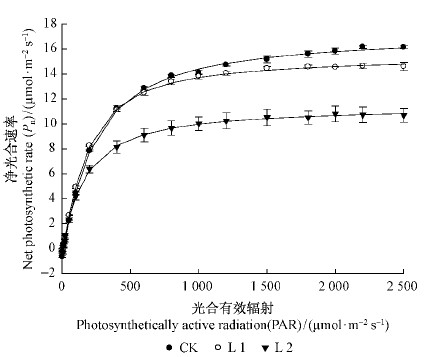 |
图 1 不同光环境下苗期中华蚊母树叶片的光合-光响应曲线 Fig. 1 Photosynthesis-light response curves of photosynthesis in Distylium chinense seedlings under different light levels |
从光响应曲线模型拟合得到的光合-光响应参数(表 2)可以看出,遮荫对苗期中华蚊母树最大净光合速率(Pn max)、暗呼吸速率(Rd)、光补偿点(LCP)和光饱和点(LSP)均有显著影响。随着遮荫水平提高,植株叶片Pn max,Rd,LCP和LSP均降低,其中,L1和L2植株叶片Pn max分别比CK植株降低了11.8%和35.2%,Rd降低了46.3%和65.7%,LCP降低了48.6%和64.2%,LSP降低了15.5%和20.4%。而遮荫对苗期中华蚊母树叶片表观量子效率(AQY)的影响并不明显,经过60天的遮荫处理,CK,L1和L2植株叶片AQY分别为0.066,0.066和0.064,三者之间并无明显差异。
|
|
从表 3可以看出,遮荫使苗期中华蚊母树叶片最大光化学效率(Fv/Fm)有所增加,经过60天的遮荫处理,L1植株叶片Fv/Fm显著高于CK植株,而L2植株叶片Fv/Fm虽有升高,但与CK植株差异并不显著。
|
|
遮荫显著影响苗期中华蚊母树叶片的光化学猝灭(qP)(表 3)。随着遮荫水平增加,苗期中华蚊母树叶片qP逐渐降低,与CK植株相比,L1植株叶片qP降低了16.2%,L2植株叶片qP降低了33.8%。
遮荫使苗期中华蚊母树叶片非光化学猝灭(qN)出现了一定程度的下降,经过60天的遮荫处理,L1植株仅比对照下降了2.5%,而L2植株叶片仅比对照下降了1.3%,二者均与CK植株差异不显著(表 3)。
随着遮荫水平增加,苗期中华蚊母树叶片电子传递速率(ETR)依次降低,表现出与qP类似的规律(表 3)。经过60天的遮荫处理,L1植株叶片ETR虽有下降,但与CK植株相比并无明显差异,而L2植株显著低于CK植株,相比CK植株降低了25.5%。
3 结论与讨论 3.1 遮荫对苗期中华蚊母树生长指标的影响植物在面对不断变化的外部环境时都有发生形态变异的可能,这种变异能力对于适应外部环境条件骤变具有特殊意义(洪明等,2011)。如植物在遭遇遮荫胁迫后,形态的调整对于植株能否适应遮荫环境起到了至关重要的作用。
基径和株高之间的调整是植株适应遮荫环境的一种策略。研究发现,植物在遭遇遮荫胁迫之后,往往会出现基径变细、株高增加的现象(洪明等,2011;薛思雷等,2012),即表现为“细长”的特征。这可能是植株为了最大程度地获取光照,减少了用于植株基径生长的碳,将同化的碳更多地分配于植株的垂直生长(张斌斌等,2009)。本研究发现,L1植株对遮荫的响应也表现出类似的现象,经过60天的遮荫处理,L1植株基径增量显著低于CK植株,而株高增量显著高于CK植株,说明L1植株对遮荫胁迫产生了积极的响应;L2植株经过60天的遮荫处理后,植株基径增量也明显低于CK植株,株高增量维持在CK水平上,这也说明了在光照极其不足的生长环境下(低于100 μmol·m-2s-1),苗期中华蚊母树植株能够将物质能量更多地分配给株高的生长,同时也暗示苗期中华蚊母树对重度遮荫环境仍具有一定的调节能力。
叶长和叶宽的调整对于植株适应遮荫环境也起到了重要的作用。当植物生长在弱光下时,太阳辐射能量的不足是限制植物生长的主要因素,植物为了最大限度地获取光能,会通过调整叶长和叶宽来增加叶片面积(王凯等,2009)。本研究发现,经过60天的遮荫处理,L1和L2植株叶片叶长和最大叶宽均显著高于CK植株,这就保证了苗期中华蚊母树叶片在弱光环境条件下能够尽可能多地吸收光能用于光合作用,这与其他耐荫植物的研究结果(Uba et al.,1980;Evans et al.,2001;王凯等,2009)一致。
叶片比叶质量的调整是植物对遮荫环境做出的典型形态学反应(Kitao et al.,2000)。弱光下叶片比叶质量降低,意味着相同生物量在弱光下形成的叶面积大,叶片薄,这样就增强了叶片的捕光能力,利于植株在弱光环境中生长(冯玉龙等,2002)。遮荫显著影响了苗期中华蚊母树叶片的比叶质量,随着遮荫水平增加,叶片比叶质量呈现降低的趋势,说明苗期中华蚊母树在遮荫环境下会通过调整叶片的比叶质量来增加叶片的捕光能力以弥补遮荫环境带来的光照不足,这与以往研究中耐荫植物随着遮荫水平的增加叶片比叶质量往往表现出降低的趋势(王俊峰等,2004;王凯等,2009;董如磊等,2010)的结论相吻合。
3.2 遮荫对苗期中华蚊母树光合-光响应参数的影响光补偿点与光饱和点的高低反映了植物对弱光的利用能力,代表了植物的需光特性和需光量,是判断植物耐荫性的重要指标(张旺锋等,2005)。低的光补偿点和光饱和点意味着植物在光照有限的条件下能够以最大能力利用低光量子通量,进行最大可能的光合作用,从而利于在较弱的光强下进行有机物的积累,满足遮荫环境下植株的正常生长(王雁等,2002;解小娟等,2013),是植物对遮荫环境的适应性表现。经过60天的遮荫处理,L1和L2苗期中华蚊母树叶片光补偿点和光饱和点显著低于CK植株,说明遮荫环境下的苗期中华蚊母树能够通过降低光补偿点和光饱和点来增强对弱光的利用能力。一般阴生植物的光补偿点在10 μmol·m-2s-1以下,阳生植物光补偿点在10 μmol·m-2s-1以上(马彦军等,2010),全光下苗期中华蚊母树光补偿点为10.29 μmol·m-2s-1,表现为阳生植物,而在2种遮荫环境下(L1,L2)苗期中华蚊母树光补偿点分别为5.29和3.68 μmol·m-2s-1,表现为阴生植物,说明苗期中华蚊母树对不同光环境具有一定的适应性和可塑性。
暗呼吸速率(Rd)反映了植物在黑暗条件下的呼吸速率,逆境胁迫下暗呼吸速率降低有利于植物在低 Pn条件下保持碳平衡(郭春芳等,2008),已有研究表明,连翘(王建华等,2011)、黄菠萝(Phellodendron amurense)(王凯等,2009)和崖柏(Thuja sutchuenensis)(刘建锋等,2011)等植物在弱光环境下能通过降低暗呼吸速率来减少对光合产物的消耗,本研究也得到了类似的结果,L1和L2苗期中华蚊母树叶片Rd显著低于CK植株,说明苗期中华蚊母树能够通过降低暗呼吸速率来保持弱光环境下碳的平衡。
表观量子效率(AQY)是光合作用中光能转化效率的指标之一,其值越高,则植物在弱光下转换利用光能的效率就越高(许大全,2002)。苗期中华蚊母树叶片AQY在全光和遮荫(L1,L2)环境下差异不显著,说明遮荫处理的苗期中华蚊母树在弱光环境下仍能保持较高的光能利用效率,对弱光具有一定的适应性。
3.3 遮荫对苗期中华蚊母树叶绿素荧光特性参数的影响叶绿素荧光作为植物光合功能快速、无损伤的探针,在研究植物光合机制及植物光合作用对外界环境胁迫的响应中发挥了重要的作用(Maxwell et al.,2000)。荧光参数Fv/Fm是PSⅡ潜在光化学活性的度量,反映了PSⅡ反应中心的光能转换效率,非胁迫下生长的植物Fv/Fm较稳定,一般为 0.75~0.85,且不受生长条件的影响(何炎红等,2005)。本研究表明,全光和遮荫环境下(L1和L2)Fv/Fm均处于正常范围内,但L1和L2苗期中华蚊母树Fv/Fm均高于CK植株,由于遮荫环境下光量子通量较低,Fv/Fm的增加可以提高中华蚊母树自身的光化学效率,是对遮荫环境的一种积极响应。这与川贝母(Fritillaria cirrhosa)(李西文等,2008)和崖柏(刘建锋等,2011)等耐荫植物对遮荫环境的响应类似。
荧光参数qP代表了PSⅡ反应中心捕获光能用于光化学电子传递的份额,反映了PSⅡ反应中心的开放程度和电子传递活性的大小(Genty et al.,1989;Mao et al.,2007)。苗期中华蚊母树随着光强的减弱,qP逐渐降低,说明遮荫降低了苗期中华蚊母树叶片PSⅡ的电子传递活性,这与电子传递速率随着光强的减弱而降低相吻合。荧光参数qN反映的是PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分,是植物光合机构的一种自我保护机制(Dai et al.,2009;Muller et al.,2001)。本研究中,虽然遮荫并没有明显影响苗期中华蚊母树的qN,但受遮荫影响,L1和L2苗期中华蚊母树qN均略有下降,由于遮荫环境下光量子通量相对较弱,植物产生光剩光能的概率要明显小于全光下,因此,qN的下降也一定程度上反映了苗期中华蚊母树对遮荫环境的适应。
耐荫植物对遮荫环境的适应主要表现在2个方面:一方面能够通过增强吸收低光量子密度的能量提高对光能的利用效率,使之高效率地转化为化学能;另一方面能够通过降低用于呼吸及维持其生长的能量消耗,使光合作用同化的能量以最大比例贮存于光合作用的组织中,来适应低光量子密度环境,以维持其正常的生长(王雁等,2002)。经过60天的遮荫处理,苗期中华蚊母树能够通过增加株高、叶长和叶宽,降低比叶质量等形态结构方面的调整以及降低光补偿点和光饱和点、维持较高的表观量子效率和最大光化学效率等光合生理方面的调整来尽可能多地捕获光能及提高对弱光的利用率,同时也能够减少对基径生长的能量分配以及降低暗呼吸速率来减少对光合产物的消耗。因此,苗期中华蚊母树对于中度和重度遮荫环境具有较强的适应和调节能力,但能否适应和耐受更长时间的遮荫环境还有待进一步研究。
| [1] |
包 玉, 王志泰. 2009. 不同遮阴处理大叶黄杨叶片生理响应. 安徽农业科学, 37(12): 5470-5471. (Bao Y, Wang Z T. 2009. Leaf physiological response of Euonymus japonicus to different shading treatments. Journal of Anhui Agriculture Science, 37(12): 5470-5471[in Chinese]).(  1) 1)
|
| [2] |
董如磊, 喻方圆, 欧阳献. 2010. 遮荫对东京野茉莉幼苗叶片形态和解剖结构的影响. 江西农业大学学报, 32(5): 974-981. (Dong R L, Yu F Y, Ouyang X. 2010. Effects of shading treatments on leaf morphology and anatomical structure of Styrax tonkinensis seedlings. Acta Agriculture Universitatis Jiangxiensis, 32(5): 974-981[in Chinese]).(  1) 1)
|
| [3] |
冯玉龙, 曹坤芳, 冯志立, 等. 2002. 四种热带雨林树种幼苗比叶重, 光合特性和暗呼吸对生长光环境的适应. 生态学报, 22(6): 901-910. (Feng Y L, Cao K F, Feng Z L, et al. 2002. Acclimation of lamina mass per unit area, photosynthetic characteristics and dark respiration to growth light regimes in four tropical rainforest species. Acta Ecological Sinica, 22(6): 901-910[in Chinese]).(  1) 1)
|
| [4] |
郭春芳, 孙 云, 张木清. 2008. 土壤水分胁迫对茶树光合作用-光响应特性的影响. 中国生态农业学报, 16(6): 1413-1418. (Guo C F, Sui Y, Zhang M Q. 2008. Effects of soil water stress on photosynthetic light response curve of tea plant (Camellia sinensis). Chinese Journal of Eco-Agriculture, 16(6): 1413-1418.[in Chinese])(  1) 1)
|
| [5] |
何炎红, 郭连生, 田有亮. 2005. 白刺叶不同水分状况下光合速率及其叶绿素荧光特性的研究. 西北植物学报, 25(11): 2226-2233. (He Y H, Guo L S, Tian Y L. 2005. Photosynthetic rates and chlorophyll fluorescence of Nitraria tangutorum at different leaf water potentials. Acta Botanica Boreali-occidentalia Sinica, 25(11): 2226-2233[in Chinese]).(  1) 1)
|
| [6] |
洪 明, 郭泉水, 聂必红, 等. 2011. 三峡库区消落带狗牙根种群对水陆生境变化的响应. 应用生态学报, 22(11): 2829-2835. (Hong M, Guo Q S, Nie B H, et al. 2011. Responses of Cynodon dactylon population in hydro-fluctuation belt of Three Gorges Reservoir area to flooding-drying habitat change. Chinese Journal of Applied Ecology, 22(11): 2829-2835[in Chinese]).(  2) 2)
|
| [7] |
李西文, 陈士林. 2008. 遮荫下高原濒危药用植物川贝母(Fritillaria cirrhosa)光合作用和叶绿素荧光特征. 生态学报, 28(7): 3438-3446. (Li X W, Chen S L. 2008. Effect of shading on photosynthetic characteristics and chlorophyll fluorescence parameters in leaves of Fritillaria cirrhosa. Acta Ecological Sinica, 28(7): 3438-3446.[in Chinese])(  1) 1)
|
| [8] |
刘建锋, 杨文娟, 江泽平, 等. 2011. 遮荫对濒危植物崖柏光合作用和叶绿素荧光参数的影响. 生态学报, 31(20): 5999-6004. (Liu J F, Yang W J, Jiang Z P, et al. 2011. Effects of shading on photosynthetic characteristics and chlorophyll fluorescence parameters in leaves of the endangered plant Thuja sutchuenensis. Acta Ecologica Sinica, 31(20): 5999-6004[in Chinese]).(  1) 1)
|
| [9] |
刘 鹏, 康华靖, 张志详, 等. 2008. 香果树(Emmenopterys henryi)幼苗生长特性和叶绿素荧光对不同光强的响应. 生态学报, 28(11): 5657-5664. (Liu P, Kang H J, Zhang Z X, et al. 2008. Responses of growth and chlorophyll florescence of Emmenopterys henryi seedlings to different light intensities. Acta Ecologica Sinica, 28(11): 5657-5664[in Chinese]).(  1) 1)
|
| [10] |
陆銮眉, 阎光宇, 杜晓娜, 等. 2011. 8种园林植物耐荫性与光合特性的研究. 热带作物学报, 32(7): 1249-1254. (Lu L M, Yan G Y, Du X N, et al. 2011. Photosynthetic and shade-tolerance characteristics of eight ornamental Plants. Chinese Journal of Tropical Crops, 32(7): 1249-1254[in Chinese]).(  1) 1)
|
| [11] |
马彦军, 曹致中, 李 毅. 2010. 绒毛胡枝子光合作用特性及其影响因子分析. 草地学报, 18(2): 183-187. (Ma Y J, Cao Z Z, Li Y. 2010. Photosynthetic characteristics of lespedeza tomentosa and influencing factors. Acta Agrectir Sinica, 18(2): 183-187[in Chinese]).(  1) 1)
|
| [12] |
王俊峰, 冯玉龙, 梁洪柱. 2004. 紫茎泽兰光合特性对生长环境光强的适应. 应用生态学报, 15(8): 1373-1377. (Wang J F, Feng Y L, Liang H Z. 2004. Adaptation of Eupatorium adenophorum photosynthetic characteristics to light intensity. Chinese Journal of Applied Ecology, 15(8): 1373-1377[in Chinese]).(  1) 1)
|
| [13] |
王建华, 任士福, 史宝胜, 等. 2011. 遮荫对连翘光合特性和叶绿素荧光参数的影响. 生态学报, 31(7): 1811-1817. (Wang J H, Ren S F, Shi B S, et al. 2011. Effects of shades on the photosynthetic characteristics and chlorophyll fluorescence parameters of Forsythia suspensa.Acta Ecologica sinica, 31(7): 1811-1817[in Chinese]).(  3) 3)
|
| [14] |
王 凯, 朱教君, 于立忠, 等. 2009. 遮阴对黄波罗幼苗的光合特性及光能利用效率的影响. 植物生态学报, 33(5): 1003-1012. (Wang K, Zhu J Z, Yu L Z, et al. 2009. Effects of shading on the photosynthetic characteristics and light use efficiency of Phellodendron amurense seedlings. Chinese Journal of Plant Ecology, 33(5): 1003-1012[in Chinese]).(  4) 4)
|
| [15] |
王 雁, 苏雪痕, 彭镇华. 2002. 植物耐荫性研究进展. 林业科学研究, 15(3): 349-355. (Wang Y, Su X H, Peng Z H. 2002. Review of studies on plant shade-tolerance. Forest Research, 15(3): 349-355[in Chinese]).(  1) 1)
|
| [16] |
解小娟, 杨晓红, 陈晓阳. 2013. 遮荫对转BADH基因的美丽胡枝子叶片形态和光合特性的影响. 林业科学, 49(3): 33-42. (Xie X J, Yang X H, Chen X Y. 2013. Effects of shading on leaf shape and photosynthetic characteristics of the transgenic Lespedeza formosa with expressing BADH gene. Scientia Silvae Sinicae, 49(3): 33-42[in Chinese]).(  1) 1)
|
| [17] |
许大全. 2002. 光合作用效率. 上海: 上海科学技术出版社, 33-51. (Xu D Q. 2002. Photosynthetic efficiency. Shanghai: Shanghai Science and Technology Press, 33-51.[in Chinese])(  1) 1)
|
| [18] |
薛思雷, 王庆成, 孙欣欣, 等. 2012. 遮荫对水曲柳和蒙古栎光合 生长和生物量分配的影响. 植物研究, 32(3): 354-359. (Xue S L, Wang Q C, Sun X X, et al. 2012. Effects of shading on the photosynthetic characteristics, growth, and biomass allocation in Fraxinus mandshurica and Quercus mongolica. Bulletin of Botanical Research, 32(3): 354-359[in Chinese]).(  1) 1)
|
| [19] |
杨 丽. 2008. 中华蚊母树(Distylium chinense (Fr.) Diels)生理生态及抢救技术研究. 重庆: 西南大学硕士学位论文. (Yang L. 2008. Study on physiological ecology and rescue technique of Distylium chinense (Fr.) Diels. Chongqing: MS thesis of Southwest University.[in Chinese])(  1) 1)
|
| [20] |
张斌斌, 姜卫兵, 翁忙玲, 等. 2009. 遮阴对园艺园林树种光合特性的影响. 经济林研究, 27(3): 115-119. (Zhang B B, Jiang W B, Weng M L, et al. 2009. Research progress on photosynthetic characteristics of horticulture and landscape tree species under shading condition. Nonwood Forest Research, 27(3): 115-119[in Chinese]).(  1) 1)
|
| [21] |
张旺锋, 樊大勇, 谢宗强, 等.2005. 濒危植物银杉幼树对生长光强的季节性光合响应. 生物多样性, 13(5): 387-397. (Zhang W F, Fan D Y, Xie Z Q, et al. The season photosynthetic responses of seedings of the endangered plant Cathaya argyrophylla to different growth light environments. Biodiversity Science, 2005, 13(5): 387-397[in Chinese]).(  1) 1)
|
| [22] |
周 珺, 魏 虹, 吕 茜, 等. 2012. 土壤水分对湿地松幼苗光合特征的影响. 生态学杂志, 31(1): 30-37. (Zhou J, Wei H, Lü Q, et al. 2012. Effects of soil water regime on leaf photosynthetic characteristics of slash pine (Pinus eliottii Engelm.) seedlings. Chinese Journal of Ecology, 31(1): 30-37[in Chinese]).(  1) 1)
|
| [23] |
Bjorkman Q, Demmig B, Andrews T J. 1988. Mangrove photosynthesis: response to high-irradiance stress. Australian Journal of Plant Physiology, 15(2): 43-61.( 1) 1)
|
| [24] |
Dai Y J, Shen Z G, Liu Y, et al. 2009. Effect of shade treatments on the photosynthetic capacity, chlorophyⅡ fluorescence, and chlorophyⅡcontent of Tetrastigma hemsleyanum Diels et Gilg. Environmental and Experimental Botany, 65(2/3): 177-182.( 2) 2)
|
| [25] |
Evans J R, Poorter H. 2001. Photosynthetic acclimation of plants to growth irradiance: the relative importance of specific leaf area and nitrogen partitioning in maximizing carbon gain. Plant, Cell and Environment, 24(8): 755-767.( 2) 2)
|
| [26] |
Genty B, Briantais J M, Barker N R. 1989. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. Biochimica et Biophysica Acta(BBA)-General Subjects, 990(1):87-92.( 2) 2)
|
| [27] |
Kitao M, Lei T T, Koike T, et al. 2000. Susceptibility to photoinhibition of three deciduous broadleaf tree species with different successional traits raised under various light regimes. Plant, Cell and Environment, 23(1): 81-89. ( 1) 1)
|
| [28] |
Mao L Z, Lu H F, Wang Q, et al. 2007. Comparative photosynthesis characteristics of Calycanthus chinensis and Chimonanthus praecox. Photosynthetica, 45(4): 601-605.( 1) 1)
|
| [29] |
Maxwell K, Johnson G N. 2000. Chlorophyll fluorescence—a practical guide. Journal of Experimental Botany, 51(345): 659-668.( 1) 1)
|
| [30] |
Muller P, Li X P, Niyogi K K. 2001. Non-photochemical quenching. A response to excess light energy. Plant physiology, 125(4): 1158-1166.( 1) 1)
|
| [31] |
Nygren M, Kellomaki S. 1983. Effect on shading in leaf structure and photosynthesis in yongbirch, Betula pendula Roth and B. pubesens Ehrh. Forest Ecology and Management, 7(2): 119-132.( 1) 1)
|
| [32] |
Richardson A, Berlyn G P. 2002. Changes in foliar spectral reflectance and chlorophyll fluorescence of four temperate species following branch cutting. Tree Physiology, 22(7): 499-506.( 1) 1)
|
| [33] |
Thornley J H M. 1976. Mathematical models in plant physiology. London: Academic Press, 86-110.( 1) 1)
|
| [34] |
Uba S E, Carpenter S B. 1980. Effect of shade on the growth, leaf morphology and photosynthetic capacity of an American sycamore clone. Castanea, 45(4): 191-227.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

