文章信息
- 张选, 肖薪龙, 李鹏勃, 孙玉芳, 郭琬莹, 姚银安
- Zhang Xuan, Xiao Xinlong, Li Pengbo, Sun Yufang, Guo Wanying, Yao Yin'an
- 新疆杨不同成熟度叶片在碱胁迫下的生理响应
- Physiological Responses of Populus alba var. pyramidalis Leaves with Different Maturity to Alkali Stress
- 林业科学, 2015, 51(12): 9-16
- Scientia Silvae Sinicae, 2015, 51(12): 9-16.
- DOI: 10.11707/j.1001-7488.20151202
-
文章历史
- 收稿日期:2014-11-16
- 修回日期:2015-04-08
-
作者相关文章
2. 中国科学院大学,北京 100049
2. University of Chinese Academy of Sciences Beijing 100049
生态环境的恶化及人类对土地的不合理开发利用导致土壤盐渍化加剧,目前已成为影响西北干旱、半干旱地区杨树生存的主要生态因子之一。影响植物生长的土壤盐渍化可分为2种,分别为盐胁迫(NaCl,Na2SO4)和碱胁迫(NaHCO3,Na2CO3)(迟春明等,2010; 李晓娜等,2005)。盐胁迫的主要毒害作用是渗透胁迫和离子毒害; 碱胁迫下,除了上述毒害外,还有高pH引起的胁迫。目前,国内外对植物的中性盐胁迫研究很多,但碱胁迫对植物的影响仅在很少的作物中有所涉及。 研究表明碱胁迫对向日葵(Helianthus annuus)(颜宏等,2005)、盐地碱蓬(Suaeda salsa)(Yang et al.,2008)和番茄(Lycopersicon esculentum)(Gong et al.,2013)等的伤害明显重于盐胁迫。而木本植物的碱胁迫研究则很少。我国北方地区土壤多偏碱性,碱土在我国的分布从内蒙古呼伦贝尔高原栗钙土一直到长江北的黄淮海平原潮土区,从东北松嫩平原草甸土到山西大同、阳高盆地、内蒙古河套平原到新疆的准格尔盆地均有局部分布。因此,系统研究该地区适生植物的耐碱机制并进行土壤脱碱改良有重要的理论和实践意义。
银白杨(Populus alba)的变种新疆杨(P.alba var.pyramidalis)作为一种重要的耐盐碱木本植物,兼具喜光和耐干旱等特点,在西北干旱区盐碱程度较低的地方分布面积较大,具有良好的生态和经济效益。本试验旨在从离子分配、光合色素变化以及抗氧化酶保护的角度来研究新疆杨不同成熟度的叶片在碱胁迫下的生理响应,为进一步研究木本植物的抗碱机制提供理论依据。
1 材料与方法 1.1 试验材料选取高度、大小一致的新疆杨扦插苗(高30 cm),栽种于高25 cm、直径33 cm的培养盆,每盆1株,室外培养,对照和碱处理均设6株。培养基质为新疆地区的棕钙土和蛭石按体积比1:1混合而成。培养基质的离子情况为:Na+含量为0.045 g·kg-1 DW; K+含量为0.012 7 g·kg-1 DW;Mg2+含量为0.188 9 g·kg-1 DW;Ca2+含量为0.821 6 g·kg-1 DW;CO32-含量为0.019 4 g·kg-1 DW;Cl-含量为0.191 1 g·kg-1 DW。生长3个月后进行100 mmol·L-1 Na+碱溶液(NaHCO3和Na2CO3摩尔比为1:1)的Hoagl and 营养液处理盆栽新疆杨3周,每周处理1次,3次处理时间点分别为2014年8月10日、8月17日和8月24日。
1.2 试验方法 1.2.1 样品采集在碱处理后第27天(2014年9月6日)取新疆杨不同成熟度叶片用于各项生理指标检测; 取整个植株的顶部倒数第4~6片上部叶且较小的叶片作为幼叶(叶功能不全的叶片)样品,取整个植株主茎上第4~6片的下部叶作为老叶(开始衰老的叶片)样品。每个处理均设3个重复。1.2.2 幼叶和老叶离子含量测定 将新疆杨幼叶和老叶鲜样于90 ℃杀青30 min,70 ℃烘干至恒质量,ddH2O 100 ℃下浸提后采用离子色谱仪(ICS-5000)、电感耦合等离子发射光谱(ICP-OES)测定样品中的Na+,K+,Mg2+,Ca2+含量。
1.2.3 幼叶和老叶叶绿素和类胡萝卜素含量测定叶绿素a、叶绿素b及类胡萝卜素含量测定采用乙醇-丙酮法(邹琦,2000),利用紫外线分光光度计Lambda35测定相应波长光吸收值。
1.2.4 幼叶和老叶生理指标测定CAT,SOD,POD活性及MDA含量测定分别采用紫外吸收法(王学奎,2006)、羟胺法、愈创木酚比色法(陈建勋等,2002)和硫代巴比妥酸(thiobarbituric acid,TBA)显色法(孔祥生等,2012)。相应波长光吸收值由紫外线分光光度计Lambda35(PE,Waltham,USA)测定。
1.3 数据处理采用SPSS 16.0软件,将对照组和碱处理组内幼叶和老叶对应的各项生理指标进行组内独立样本t检验分析,同时将对照组和处理组的幼叶及老叶对应的各项生理指标进行组间独立样本t检验分析。并利用Originlab8.5进行作图。
2 结果与分析 2.1 碱处理下新疆杨盆栽土壤pH监测如图 1所示,处理前盆栽土壤pH为7.3,在第1次碱处理后,花盆土壤的pH值略微增大,pH值在8.0上下波动; 在第2次碱处理后,pH值稳定在8.0以上;在第3次碱处理后,其pH值基本都在8.7~9.2波动,达到了北方地区中度碱土水平。对照土壤pH为7.3。
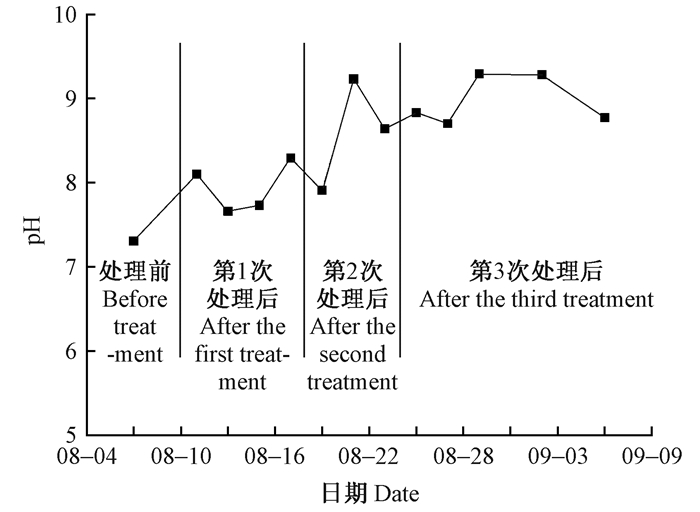 |
图 1 新疆杨盆栽土壤pH的连续监测 Fig. 1 Continuous monitoring of pot soil pH of P.alba var.pyramidalis |
如图 2所示,叶片的成熟度对Na+,K+,Mg2+,Ca2+含量和Na+/K+均有显著影响;老叶的Na+,Mg2+,Ca2+含量和Na+/K+均比幼叶高;相反,老叶的K+含量低于幼叶。碱胁迫对Na+,Mg2+,Ca2+含量和Na+/K+有显著影响,但对K+含量无显著影响; 另一方面,碱胁迫对杨树的老叶和嫩叶的离子含量影响不同,因此表现出显著的成熟度×碱胁迫交互作用。如图 2A所示,对照条件下老叶Na+含量高于幼嫩叶片,碱处理下老叶Na+大幅度升高,而幼嫩叶片没有变化,表明碱胁迫下叶片增加的Na+都进入了成熟老叶。相反,幼嫩叶片K+含量高于老叶,碱胁迫下成熟老叶的K+含量保持不变,而幼嫩叶片的K+略微下降(P<0.05)。因此,导致老叶较高的Na+/K+在碱胁迫下进一步大幅度提高,而幼叶Na+/K+仍然维持在较低水平。另一方面,老叶的二价离子(Ca2+,Mg2+)含量达到嫩叶的8倍左右,表明Ca2+,Mg2+离子主要分布在成熟老叶中。在碱胁迫下,3种叶片的Ca2+,Mg2+离子含量呈现相反的变化; 其中幼叶2种离子含量分别提高了30%以上(P<0.05),而老叶则分别降低了20%左右(P<0.05)。
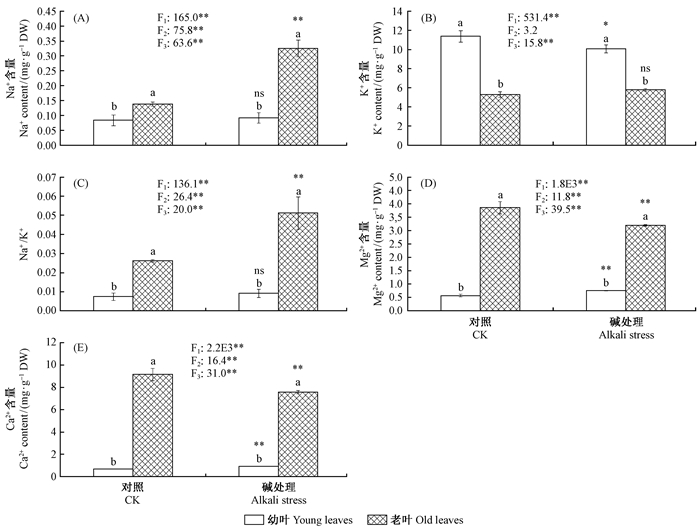 |
图 2 碱处理对新疆杨幼叶和老叶离子含量的影响 Fig. 2 Effects of alkali stress on ion contents of young and old leaves of P.alba var.pyramidalis 不同小写字母表示组内幼叶和老叶相应生理指标的差异显著(P<0.05),*和**分别表示组间幼叶或老叶相应生理指标差异显著(P<0.05)和差异极显著(P<0.01),ns表示无显著差异(P>0.05)。F1表示叶片的不同成熟度对指标变化的影响; F2表示对照和碱胁迫2种不同处理对指标变化的影响; F3表示叶片的不同成熟度和不同处理这二者的交互作用对指标变化的影响。下同。Different small letters denote significant difference(P<0.05)of corresponding physilogical indices between young leaves and old leaves among treatments CK or alkali salt stress; * and **,respectively,denote significant difference P< 0.05 and P< 0.01 between CK and alkali salt stress of young leaves or old leaves; ns denote no significance(P> 0.05). F1 denotes the effects of different maturity levels of leaves on the physiological indices,F2 denotes the effects of different treatments on the physiological indices,F3 denotes the interaction effects of different maturity levels of leaves and different treatments on the physiological indices. The same below. |
如图 3所示,叶片成熟度对叶绿素a和总叶绿素含量有显著影响; 碱胁迫对叶绿素a、叶绿素b、总叶绿素及类胡萝卜素含量均有显著影响。碱胁迫对不同成熟度叶片的影响不同,因此上述4个指标呈现出显著的成熟度×碱胁迫交互作用。与幼叶相比,在对照条件下老叶含有更高的叶绿素(叶绿素b及总叶绿素)和类胡萝卜素含量。碱胁迫对幼叶和老叶的影响完全相反; 幼叶叶绿素(a/b及总叶绿素)含量没有变化而类胡萝卜素含量显著升高; 然而,老叶的叶绿素(a/b及总叶绿素)和类胡萝卜素含量在碱胁迫下大幅度下降,这几种色素含量均不高于对照老叶的1/3水平。
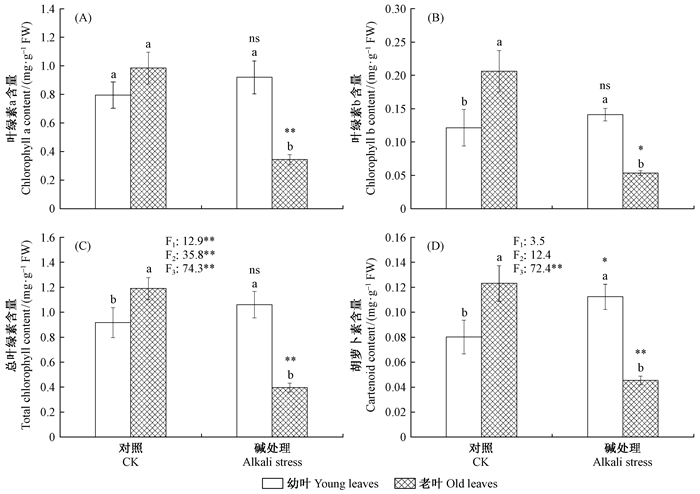 |
图 3 碱处理对新疆杨幼叶和老叶叶绿素和类胡萝卜素含量的影响 Fig. 3 Effects of alkali stress on the contents of chlorophyll and cartenoid of young and old leaves of P.alba var pyramidalis |
如图 4所示,叶片成熟度对CAT,SOD,POD活性和MDA含量均有显著影响; 碱胁迫对CAT,POD活性和MDA含量有显著影响,但对SOD活性无显著影响; 两者的交互作用对CAT,SOD,POD活性和MDA含量均有显著影响。对照条件下,除老叶的SOD水平略高于幼叶外,新疆杨老叶和嫩叶的其他抗氧化酶活性(CAT和POD酶)和丙二醛(MDA)含量没有显著差别。在碱胁迫条件下,幼叶除SOD活性水平略有降低外,其他抗氧化酶(CAT和POD酶)活性和丙二醛(MDA)含量均没有显著变化; 相反,老叶所有测试的抗氧化酶(SOD,CAT和POD酶)活性均升高,尤其是后2种酶提高了2倍以上,而老叶的丙二醛(MDA)含量也大幅度提高(P<0.01)。
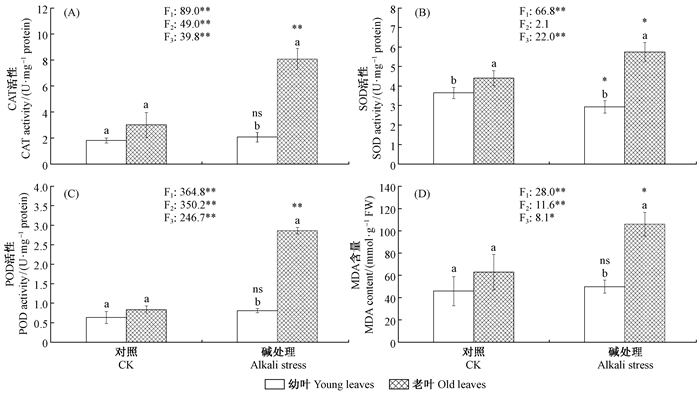 |
图 4 碱处理对新疆杨幼叶和老叶抗氧化酶活性和MDA 含量的影响 Fig. 4 Effects of alkali stress on the activities of protecting enzymes and the contents of MDA of young and old leaves of P.alba var pyramidalis |
杨树的碱胁迫研究还很少,笔者的研究发现碱胁迫下杨树能有效保护其幼叶不受影响。杨树盐碱伤害的重要指标如叶绿素含量和膜脂过氧化水平(丙二醛),在幼叶均未发生变化。碱胁迫下新疆杨能够有效地将多余Na+分配到老叶从而使幼叶Na+含量维持在对照低水平,由此推测这可能是杨树抵御碱胁迫的重要生存策略。基于盐胁迫的研究,前人已发现植株的不同成熟度的器官在中性盐胁迫下往往会有不同的响应,植物常将过多的盐毒害Na+富集于老叶,从而保护幼叶免于盐毒害,使整个植株更适应盐胁迫环境(Munns et al.,2008; Ashraf et al.,1997; Bhatti,2006; Nakamura et al.,1996; Parida et al.,2005; Vera-Estrella et al.,2005; Yasar et al.,2006)。究其原因,一是: 杨树老叶具有成熟的大液泡,可以依赖于膜上的ATP酶“泵”,从而区隔化过多的对植物正常生长有害的Na+于大液泡中,而幼叶的矿质元素在导管尚未分化前由韧皮部供应,加上新叶生长的稀释作用因此浓度较低,即使在碱胁迫下也处于较低水平; 二是: 当叶片成为代谢源时,Na+与同化产物一起由木质部向韧皮部,或由韧皮部运向幼叶花果或根系的再度运输能力比K+小得多,因此Na+多沉淀在老叶中(詹亚光等,1999),这种Na+运输特点有助于将碱胁迫局限于老叶中。因此碱胁迫对不同成熟度叶片的不同影响(成熟度×碱胁迫交互作用)对于新疆杨的碱胁迫适应是有利的。在盐胁迫下,新疆杨叶片中的Na+含量升高,K+含量基本维持不变,Ca2+含量下降(杨敏生等,2003)。本试验的碱胁迫条件下,与盐胁迫相比不同的是,K+含量下降。这可能是由于碱胁迫除了渗透胁迫和离子毒害外,还存在根际的高pH胁迫,使得植物对K+,Ca2+等营养离子的吸收比在盐胁迫下遭受到更严重的抑制作用,植物细胞内的离子平衡遭到极大破坏,膜系统受到严重损害(周建等,2008)。
不同杨树种的盐胁迫研究表明,耐盐极强的胡杨(P. euphratica)盐胁迫下其Ca2+,Mg2+离子含量有显著提高; 相反,盐敏感树种盐胁迫下二价离子含量降低(陈少良等,2002)。张振华等(2010)也发现Mg2+和Ca2+有利于对抗Na+毒害,可以提高其所在器官的抗盐性。根际的高pH胁迫可直接导致Ca2+,Mg2+,H2PO4-沉淀(Li et al.,2009),抑制植物对Ca2+,Mg2+离子的吸收,本研究中新疆杨老叶的Ca2+,Mg2+离子在碱胁迫下显著降低;新疆杨仍然显著提高了其幼叶Ca2+,Mg2+离子以利于其抵抗碱危害(图 2D,E),因此Ca2+,Mg2+不同成熟度叶片中的重新分配是新疆杨的重要抗碱策略。
虽然在碱胁迫下幼叶细胞内仍然保持了良好的离子平衡体系且没有受到生理伤害,幼叶可能仍然接受到一定程度的胁迫信号。在幼叶Na+含量没有改变的情况下,其Ca2+离子含量有升高。植物亚细胞内Ca2+离子保持在一个稳定水平,在盐碱胁迫下Ca2+充当第二信使(戴高兴等,2003; 王芳等,2012; 应叶青等,2013),在亚细胞水平上大幅度提高Ca2+含量,启动下游抗性响应。此外,笔者观察到幼叶的类胡萝卜素含量有显著提高。类胡萝卜素对于植物光化学保护及去除叶绿体活性氧危害起着重要作用(Demmig-Adams et al.,1996),推测这可能是幼叶感受到碱胁迫信号时的一种主动生理响应。另一方面,新疆杨成熟老叶细胞离子平衡被破坏,其Na+和Na+/K+大幅度升高,对植物形成了离子毒害; 且Ca2+,Mg2+离子含量降低。由于Ca2+主要分布在细胞壁,作为细胞壁胞间层果胶酸钙的构成物质(沈其荣等,2000)。因此杨树成熟老叶由于细胞壁形成,Ca2+含量远高于幼叶,Ca2+含量的降低必然损伤老叶细胞壁的结构并加重其碱胁迫危害,这可能是碱胁迫不同于盐胁迫之处。此外,Mg2+参与了细胞叶绿素形成及光合作用等过程(韩艳婷等,2011; 林世青等,1980),新疆杨的老叶Mg2+含量远高于幼叶,这可能与老叶含有更高的叶绿素含量并承担了主要的光合同化作用有密切关系。
碱胁迫下老叶细胞内离子失衡必然影响体内活性氧平衡。丙二醛(MDA)作为膜脂过氧化产物,通过与膜结构上的蛋白质和酶结合、交联而使其失去活性,产生细胞毒性物质,会破坏膜结构,其含量的多少可反映逆境胁迫对植物造成氧化损害的程度(张赛娜等,2008; 周芙蓉等,2013)。在碱处理下,细胞质膜首先受到盐离子胁迫影响而产生胁变,导致质膜受伤,同时产生大量的自由基和膜脂过氧化物,从而导致老叶中的MDA含量急剧升高。由于老叶细胞内活性氧的提高,促进了底物驱动型抗氧化酶活性的提高; 在本研究中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等保护酶系统有所增强,有助于提高杨树对碱胁迫的适应性,但总的来说,这些抗氧化酶的增强并未完全去除活性氧自由基。由于幼叶没有受到Na+胁迫,因此其丙二醛含量、SOD、POD和CAT等保护酶活性在碱胁迫下均没有变化; 因而新疆杨表现出显著的成熟度和碱胁迫相互作用,这些指标响应了新疆杨内离子含量的影响。
由于老叶细胞内离子失衡的直接作用及活性氧危害等间接作用,导致老叶叶绿素和类胡萝卜素等光合色素大幅度降低,在形态上也观察到碱胁迫下杨树老叶提前发黄凋落。中性盐胁迫使叶片内光合色素降解,叶绿体精细结构解体,光合作用受阻(李汉美等,2013)。在盐分胁迫下,可能导致植株细胞中叶绿素与类囊体膜上的蛋白结合变得松弛(董晓霞等,1985),叶绿素酶活性逐渐增强(殷立娟等,1993),从而加速叶绿素的降解。也可能因为盐胁迫引起叶片中5-氨基酮戊酸的合成前体谷氨酸含量下降,限制了以其为前体的叶绿素的合成(Santos,2004)。苗丽等(2014)的研究发现,NaHCO3胁迫下,黄瓜(Cucumis sativus)叶片中叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均显著降低。同样,碱胁迫下幼叶的叶绿素含量没有变化,而类胡萝卜素含量却显著升高。类胡萝卜素是植物保护光合器官的重要色素,幼叶类胡萝卜素含量的升高能够提高其碱胁迫下的光保护水平。
综上所述,通过研究在碱胁迫下,新疆杨不同成熟度叶片的离子分配和生理响应可知,碱胁迫下,成熟老叶受到较为明显的离子毒害和生理伤害; 而幼叶未遭到碱危害; 相反,幼叶通过提高其钙镁离子含量和类胡萝卜素含量进一步提高了其抗碱胁迫能力。本研究表明,这种有利于幼叶的离子分配策略是新疆杨抵抗碱胁迫的重要生存策略,同时为进一步研究木本植物的抗碱机制提供了理论依据。
| [1] |
陈建勋,王晓峰.2002.植物生理实验指导.广州:华南理工大学出版社, 6-93. (Chen J X, Wang X F. 2002. Experiment guidance of plant physiology. Guanzhou:South China University of Technology Press.[in Chinese])(  1) 1)
|
| [2] |
陈少良,李金克,尹伟伦,等.2002.盐胁迫条件下杨树组织及细胞中钾、钙、镁的变化.北京林业大学学报, 24(Z1):84-88. (Chen S L, Li J K, Yin W L, et al. 2002. Tissue and cellular K+, Ca2+ and Mg2+ of poplar under saline salt stress conditions. Journal of Beijing Forestry University,24(Z1):84-88[in Chinese]).(  1) 1)
|
| [3] |
迟春明,王志春.2010.重度苏打碱土饱和导水率特征分析.华北农学报, 25(3):205-208. (Chi C M, Wang Z C. 2010. The saturated hydraulic conductivity of hard sodic soil in Songnen Plain. Acta Agriculturae Boreali-Sinica, 25(3):205-208[in Chinese]).(  1) 1)
|
| [4] |
戴高兴,彭克勤,皮灿辉.2003.钙对植物耐盐性的影响.中国农学通报, 19(3):97-101. (Dai G X, Peng K Q, Pi C H. 2003. The effects of calcium on salt-tolerance in plant. Chinese Agricultural Science Bulletin, 19(3):97-101[in Chinese]).(  1) 1)
|
| [5] |
董晓霞,赵树慧,孔令安,等.1998.苇状羊茅盐胁迫下生理效应的研究.草业科学,15(5):10-13. (Dong X X, Zhao S H, Kong L A, et al. 1998. Physiological responses of tall fescue to salt stress. Pratacultural Science, 15(5):10-13[in Chinese]).(  1) 1)
|
| [6] |
韩艳婷,杨国顺,石雪晖,等.2011.不同镁营养水平对红地球葡萄叶绿体结构及光合响应的影响.果树学报, 28(4):603-609. (Han Y T, Yang G S, Shi X H, et al. 2011. Effects of different Magnesium concentrations on chloroplast ultrastructure and photosynthetic response of Vitis vinifera cv. Red Globe. Journal of Fruit Science, 28(4):603-609[in Chinese]).(  1) 1)
|
| [7] |
孔祥生,易现峰.2012.植物生理学实验原理与技术.北京:中国农业出版社. (Kong X S, Yi X F. 2012. Experiment principle and technology of plant physiology. Beijing:China Agriculture Press.[in Chinese])(  1) 1)
|
| [8] |
李汉美,何勇.2013. NaCl胁迫对番茄嫁接苗光合作用和叶绿素荧光特性的影响.西北农业学报,22(3):131-134. (Li H M, He Y. 2013. Effects of NaCl stress on photosynthetic and fluorescence parameters in grafted tomato seedlings. Acta Agriculturae Boreali-Occidentalis Sinic, 22(3):131-134[in Chinese]).(  1) 1)
|
| [9] |
李晓娜,张强,陈明昌,等.2005.不同改良剂对苏打碱土磷有效性影响的研究.水土保持学报,19(1):71-74. (Li X N, Zhang Q, Chen M C, et al. 2005. Study on effect of using three soil conditioners to phosphorus validity of soda-alkali soil. Journal of Soil and Water Conservation, 19(1):71-74[in Chinese]).(  1) 1)
|
| [10] |
林世青,张其德,娄世庆,等.1980.叶绿体膜的结构和功能Ⅵ.Mg2+对叶绿体囊状体膜的光能转化和相对量子产量的影响.植物生理学报, 6(4):353-359. (Lin S Q, Zhang Q D, Lou S Q, et al. 1980. Structure and function of chloroplast membrane Ⅵ. Effects of Mg2+ on the conversion of light energy and relative quantum yield of electron transport in thylakoid membranes. Acta Phytophysiologia Sinica, 6(4):353-359.[in Chinese])(  1) 1)
|
| [11] |
苗丽,巩彪,聂文婧,等.2014.外源IAA对NaHCO3胁迫下黄瓜幼苗光合特性和抗氧化系统的影响.植物生理学报,50(6):765-771. (Miao L, Gong B, Nie W J, et al. 2014. Effects of exogenous IAA on photosynthetic characteristics and antioxidative system in Cucumis sativus seedlings under NaHCO3 stress. Plant Physiology Journal, 50(6):765-771.[in Chinese])(  1) 1)
|
| [12] |
沈其荣,朱毅勇,谢学东,等,2000. Ca2+在磷酸盐营养诱导黄瓜幼叶系统抗病中的作用.植物营养与肥料学报, 6(3):280-286. (Shen Q R, Zhu Y Y, Xie X D, et al. 2000. The role of Ca2+ in the systemic resistance of cucumber young leaf induced by phosphate nutrition. Plant Nutrition and Fertilizer Science, 6(3):280-286[in Chinese])(  1) 1)
|
| [13] |
王芳,万书波,孟庆伟,等.2012. Ca2+在植物盐胁迫响应机制中的调控作用.生命科学研究, 16(4):362-367. (Wang F, Wan S B, Meng Q W, et al. 2012. Regulation of Ca2+ in plant response mechanisms under salt stress. Life Science Research, 16(4):362-367.[in Chinese])(  1) 1)
|
| [14] |
王学奎.2006.植物生理生化实验原理和技术.北京:高等教育出版社. (Wang X K. 2006. Experiment principle and technology of plant physiology and biochemistry. Beijing:Higher Education Press.[in Chinese])(  1) 1)
|
| [15] |
颜宏,赵伟,盛艳敏,等.2005.碱胁迫对羊草和向日葵的影响.应用生态学报,16(8):1497-1501. (Yan H, Zhao W, Sheng Y M, et al. 2005. Effects of alkali-stress on Aneurolepidium chinense and Helianthus annuus. Chinese Journal of Applied Ecology, 16(8):1497-1501[in Chinese]).(  1) 1)
|
| [16] |
杨敏生,李艳华,梁海永,等.2003.盐胁迫下白杨无性系苗木体内离子分配及比较.生态学报, 23(2):271-277. (Yang M S, Li Y H, Liang H Y, et al. 2003. Ion distribution and comparison in seedlings of white poplar clones under salt stress. Acta Ecologica Sinica, 23(2):271-277[in Chinese]).(  1) 1)
|
| [17] |
殷立娟,石德成,王萍.1993.盐碱化草地羊草生长的适应性与耐盐渗透调节.植物学报,35(8):619-625. (Yin L J, Shi D C, Wang P. 1993. Growth adaptability and salt tolerance osmoregulation of Aneurolepidium chinense grown on saline grassland. Acta Botanica Sinica, 35(8):619-625[in Chinese]).(  1) 1)
|
| [18] |
应叶青,杜旭华,姜琴.2013.干旱胁迫下毛竹根尖Ca2+分布及外源Ca2+作用机制.林业科学,49(4):141-146. (Ying Y Q, Du X H, Jiang Q. 2013. Distribution of Ca2+ at the tip of Phyllostachys edulis root under drought stress and physiological functions of exogenous Ca2+. Scientia Silvae Sinicae, 49(4):141-146[in Chinese]).(  1) 1)
|
| [19] |
詹亚光,陈全涉,苑盛华,等.1999.盐胁迫下树木的K+和Na+含量变化特点及其耐盐性.东北林业大学学报, 27(1):24-27. (Zhan Y G, Chen Q S, Yuan S H, et al. 1999. K+ and Na+ content change in trees under salt stress and tree salt tolerence. Journal of Northeast Forestry University, 27(1):24-27.[in Chinese])(  1) 1)
|
| [20] |
张赛娜,马旭君,李科文,等.2008.补血草愈伤组织中渗透调节物对NaCl胁迫响应.西北植物学报,28(7):1343-1348. (Zhang S N, Ma X J, Li K W, et al. 2008. Osmoticregulation in two Limonium Mill. callus under NaCl stress. Acta Bot Boreal-Occident Sin,28(7):1343-1348[in Chinese]).(  1) 1)
|
| [21] |
张振华,刘强,宋海星,等.2010. K+,Ca2+和Mg2+对不同水稻(Oryza sativa L.)基因型苗期耐盐性的影响.中国农业科学,43(15):3088-3097. (Zhang Z H, Liu Q, Song H X, et al. 2010. The salinity tolerance of rice (Oryza sativa L.) genotypes as affected by nutrients (K+, Ca2+ and Mg2+) at seedling stage. Scientia Agricultura Sinica, 43(15):3088-3097.[in Chinese])(  1) 1)
|
| [22] |
周芙蓉,王进鑫,杨楠,等.2013.干旱和铅交互作用对侧柏幼苗生长及抗氧化酶活性的影响.林业科学, 49(6):172-177. (Zhou F R, Wang J X, Yang N, et al. 2013. Interaction of drought and Pb on growth and antioxidant enzyme activities of Platycladus orientalis seedlings. Scientia Silvae Sinicae, 49(6):172-177[in Chinese]).(  1) 1)
|
| [23] |
周建,杨立峰,张琳,等.2008.碱胁迫对合欢种子萌发及幼苗生理指标的影响.浙江大学学报:农业与生命科学版, 34(4):401-408. (Zhou J, Yang L F, Zhang L, et al. 2008. Effect of alkaline stress on seed germination and seedling physiological indices of Albizzia julibrissin Durazz. Journal of Zhejiang University:Agriculture & Life Sciences,34(4):401-408[in Chinese]).(  1) 1)
|
| [24] |
邹琦.2000.植物生理学实验指导.北京:中国农业出版社. (Zou Q. 2000. Experiment guidance of plant physiology. Beijing:China Agriculture Press.[in Chinese])(  1) 1)
|
| [25] |
Ashraf M, OLeary J. 1997. Ion distribution in leaves of salt-tolerant and salt-sensitive lines of spring wheat under salt stress. Acta Botanica Neerlandica, 46:207-217.( 1) 1)
|
| [26] |
Bhatti A S. 2006. Ion uptake and distribution in Panicum antidotale Retz under salt stress. Pakistan Journal of Botany, 38:1661-1669.( 1) 1)
|
| [27] |
Demmig-Adams B, Adams W W. 1996. The role of xanthophyll cycle carotenoids in the protection of photosynthesis. Trends in Plant Science, 1(1):21-26.( 1) 1)
|
| [28] |
Gong B, Wen D, VandenLangenberg K, et al. 2013. Comparative effects of NaCl and NaHCO3 stress on photosynthetic parameters, nutrient metabolism, and the antioxidant system in tomato leaves. Scientia Horticulturae, 157:1-12.( 1) 1)
|
| [29] |
Li C, Fang B, Yang C, et al. 2009. Effects of various salt-alkaline mixed stresses on the state of mineral elements in nutrient solutions and the growth of alkali resistant halophyte Chloris virgata. Journal of Plant nutrition, 32:1137-1147.( 1) 1)
|
| [30] |
Munns R, Tester M. 2008. Mechanisms of salinity tolerance. Annu. Rev Plant Biol, 59:651-681.( 1) 1)
|
| [31] |
Nakamura T, Ishitani M, Harinasut P, et al. 1996. Distribution of glycinebetaine in old and young leaf blades of salt-stressed barley plants. Plant and Cell physiology, 37:873-877.( 1) 1)
|
| [32] |
Parida A K, Das A B. 2005. Salt tolerance and salinity effects on plants:a review. Ecotoxicology and Environmental Safety, 60:324-349.( 1) 1)
|
| [33] |
Santos C. 2004. Regulation of chlorophyll biosynthesis and degradation by salt stress in sunflower leaves. Scientia Horticulturae, 103:93-99.( 1) 1)
|
| [34] |
Vera-Estrella R, Barkla B J, García-Ramírez L, et al. 2005. Salt stress in Thellungiella halophila activates Na+ transport mechanisms required for salinity tolerance. Plant Physiology, 139:1507-1517.( 1) 1)
|
| [35] |
Yang C, Jianaer A, Li C, et al. 2008. Comparison of the effects of salt-stress and alkali-stress on photosynthesis and energy storage of an alkali-resistant halophyte Chloris virgata. Photosynthetica, 46:273-278.( 1) 1)
|
| [36] |
Yasar F, Uzal O, Tufenkci S, et al. 2006. Ion accumulation in different organs of green bean genotypes grown under salt stress. Plant Soil and Environment, 52(10):476.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

