文章信息
- 李宾, 李爱宁, 魏强, 王海明, 贺伟
- Li Bin, Li Aining, Wei Qiang, Wang Haiming, He Wei
- 欧美杨细菌性溃疡病菌hrcJ基因的功能分析
- Functional Analysis of hrcJ Gene in Lonsdalea quercina subsp. populi
- 林业科学, 2015, 51(12): 71-78
- Scientia Silvae Sinicae, 2015, 51(12): 71-78.
- DOI: 10.11707/j.1001-7488.20151209
-
文章历史
- 收稿日期:2014-12-29
- 修回日期:2015-10-11
-
作者相关文章
2. 山东省菏泽市林业局, 菏泽 274000
2. Heze Forestry Bureau of Shandong Province Heze 274000
2006年5月在我国河南省濮阳县4年生的中林46杨(Populus × euramericana cv.Zhonglin 46)林地中首次发现欧美杨溃疡病,这是世界上首次报道此病害(郭利民等,2008)。该病主要危害中林46杨 、107杨(P. × euramericana cv. 74/76)等欧美杨枝干,产生大量伤流,耗损树木养分,严重影响树木的健康生长(郭利民等,2012)。本实验室通过科赫假定回接试验、形态学鉴定等方法,确定了欧美杨溃疡病的病原为Lonsdalea quercina subsp. populi( Li et al.,2014),该细菌属于变形菌门(Proteobacteria)肠杆菌目(Enterobacteriales)肠杆菌科(Enterobacteriaceae)。
2012年L. quercina从Brenneria属中分离出来,成为一个新属。尽管如此,L. quercina与Brenneria属中植物病原细菌仍然存在最近的亲缘关系,由它们所致植物病害症状也很相似(杨莉等,2014)。Brenneria属中林木病原细菌有B. alni, B. nigrifluens,B. paradisiaca,B. quercina, B. salicis,B. rubrifaciens,其中,胡桃树皮深层溃疡病病原B. rubrifaciens能产生一种水溶性的红色色素,这与此细菌的毒性有关(Mcclean et al.,2009),但具体机制尚不清楚。Huvenne等(2009)发现B. salicis具有群体感应(quorum-sensing,QS)效应,通过群体密度调控纤维素酶的表达,使柳树细胞壁降解,从而引发柳树水纹病。除此之外,很少有Brenneria属细菌对寄主致病机制的研究。
革兰氏阴性植物病原细菌在非寄主和抗性寄主上引起的过敏反应(hypersensitive response)及寄主植物上的致病性(pathogenicity)是由其hrp基因簇决定的(陈功友等,2002),效应分子通过hrp基因簇编码的Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)分泌转运进入寄主细胞内,对植株造成伤害和诱导寄主植物抗病反应(朱秀秀等,2009)。杨莉等(2014)通过基因组测序明确了L. quercina N-5-1编码T3SS的基因簇由27个基因组成,约23 kb,存在于染色体上,其中hrcC,hrcJ,hrcQ,hrcR,hrcS,hrcT,hrcU,hrcV和hrcN是高度保守的hrc基因,编码产物组成T3SS的针状装置。并获得了菌株N-5-1的结构基因hrcV及其外泌蛋白编码基因hrpW的突变体,突变体在杨树上的致病性显著下降,而互补菌株则与野生菌株致病性基本保持一致,并在敏感烟草植物上丧失了诱导HR反应的能力; 但该菌株的生长速率、生物膜和游动性并没有受到影响(杨莉等,2014)。
在植物病原细菌Xanthomonas oryzae pv. oryzicola和Pseudomonas syringaeae pv. syringae中,hrcJ基因突变体丧失了致病性和在烟草上的HR激发能力(赵文祥等,2010; He et al.,1998)。但hrcJ基因在欧美杨细菌性溃疡病菌Lonsdalea quercina subsp. populi致病性中的作用尚不清楚。为明确L. quercina N-5-1的hrcJ基因在致病过程中的作用,本研究利用同源重组原理(高杜娟等,2011; 汪新等,2011),通过基因插入方式(王薇等,2014),构建了L. quercina N-5-1的hrcJ基因插入突变体。通过比较野生型菌株与hrcJ基因插入突变体菌株部分生物学性状和对欧美杨品种107杨的致病性,阐释其功能,可为揭示病原菌Ⅲ型分泌系统各基因的功能,阐明病原菌的致病机制提供理论依据。
1 材料与方法 1.1 菌株、质粒、培养条件及引物试验所用菌株、质粒及性状见表 1。 L. quercina N-5-1及其衍生菌株用LB培养基30 ℃培养24 h; 大肠杆菌(Escherichia coli)用LB培养基37 ℃培养16 h。所用抗生素终浓度为: 庆大霉素(GmR)50 μg·mL-1、卡纳霉素(KmR)50 μg·mL-1、氯霉素(CmR)20 μg·mL-1、利福平(RifR)20 μg·mL-1。 试验所用引物在北京天一辉远公司合成(表 2)。
|
|
|
|
欧美杨107苗木,采自北京林业大学三顷园苗圃的1年生健康扦插苗,经过组织分离培养未见Lonsdalea quercina subsp. populi等病原微生物。随机选取18株生长状况相同的107杨苗木,在同一部位截取30 cm长的枝段,随机分成3组,每组6个枝段,供接种使用。
1.3 hrcJ基因插入突变载体的构建根据hrcJ基因序列设计引物(表 2),以野生菌株N-5-1基因组为模板,通过PCR扩增得到所需片段,大小为457 bp,用浓度为2%的琼脂糖进行电泳,使用北京天根公司切胶回收试剂盒回收hrcJ基因的PCR产物,用相应的限制性内切酶进行酶切后16 ℃过夜连接到自杀载体pEX18Km上,得到相应的突变载体,并测序检查所构建载体是否正确。
1.4 hrcJ基因插入突变体的获得制备热击感受态DH5α细胞,将已经构建好的插入突变载体热击转化到DH5α感受态细胞得到供体菌; 野生菌株N-5-1为受体菌。
将供体菌、受体菌、Helper菌株取出适量进行三亲杂交(Yang et al.,2014),将供体菌中的突变载体导入野生菌株中,将杂交株涂于含有 Rif和Km的LB平板,30 ℃培养72 h,挑取所得菌落用N-5-1菌株特异性引物Infb238/Infb579(未发表)和自杀载体中SacB基因引物SacB1/SacB2(表 2)做PCR验证,将得到的插入突变体命名为ΔhrcJ。并利用Southern 杂交方法进一步验证突变载体插入的正确性。
1.5 hrcJ基因互补突变体的获得以野生菌株N-5-1基因组为模板,用引物(表 2)通过PCR扩增出相应的互补片段。PCR产物进行0.8%琼脂糖电泳后切胶回收大小正确片段,与穿梭质粒pBBR1MCS-5一并用相应的限制性内切酶酶切后,16 ℃过夜连接,热击转化入DH5α细胞,得到相应的互补菌株,通过三亲杂交(Yang et al.,2014),将正确的互补载体转化到ΔhrcJ中,PCR验证转化子,得到互补菌株,命名为HBhrcJ。
1.6 生长曲线测定将野生菌株N-5-1、ΔhrcJ和HBhrcJ接种于LB液体培养基中过夜培养至稳定期,用新鲜LB液体培养基将各菌株稀释到OD600=0.3,以体积比1∶1 000分别将各菌株接种于100 mL新鲜LB液体培养基中,30 ℃、180 r·min-1摇培,每个菌株3个重复,每隔一段时间测定各菌株在600 nm的吸光值,绘制生长曲线。
1.7 游动性的测定将野生菌株N-5-1、ΔhrcJ和HBhrcJ接种于LB液体培养基中过夜培养至稳定期,分别吸取3 μL滴于含有0.3%琼脂的半固体LB培养基上,无菌风吹干,30 ℃培养24 h,测量各菌株游动晕圈直径,试验重复3次(高杜娟等,2011)。
1.8 生物膜的测定将N-5-1、ΔhrcJ和HBhrcJ接种于LB液体培养基中过夜培养至稳定生长期,以体积比1∶100接种到含有2 mL新鲜LB液体培养基的洁净普通玻璃试管(10 mL)中,30 ℃静置培养48 h,用移液器轻轻吸尽试管中的菌液,无菌水清洗2遍试管,加2 mL 0.1%的结晶紫染色30 min,用移液器轻轻吸尽结晶紫溶液,然后用无菌水轻轻清洗3遍试管,于37 ℃烘干试管,可观察到试管壁上有一圈紫色痕迹即是固液交界处形成的坚固的生物膜。加入2.5 mL 95%的乙醇充分溶解与生物膜结合的结晶紫,取1 mL测量OD570(Yang et al.,2014)。
1.9 烟草过敏反应测试将突变体、互补菌株、野生菌株用LB培养至对数生长期,将各菌株用无菌水稀释到OD600=1.0,用1 mL无菌注射器取50 μL注射到本氏烟草(Nicotiana benthamiana) 叶片中,24 h后检查各个处理的HR反应情况,无菌水为阴性对照,试验重复3次(赵文祥等,2010)。
1.10 致病性反应测试将N-5-1、ΔhrcJ和HBhrcJ接种到含有相应抗生素的LB液体培养基中,30 ℃、180 r·min-1摇床培养24 h后,将菌液浓度稀释到OD600=1.0,分别取100 μL各菌液接种到1年生欧美杨107枝条上,每个菌株接6个枝段,每枝段接1个点,试验重复3次,LB 液体培养基接种为阴性对照。在28 ℃、相对湿度为90%条件下培养8天后观察、记录发病情况。按发病的严重程度,将病情分为4级:Ⅰ级代表值为0,接种伤口无发病症状,木质部无病斑出现; Ⅱ级记为1,接种点树皮变软、凹陷,无明显脓液流出,病斑长度0.1~0.9 cm; Ⅲ级代表值为2,被接种的树皮伤口流出乳白色菌脓,病斑长度1.0~3.0 cm; Ⅳ级记为3,从接种的伤口流出的菌脓变成褐色,病斑长度3.1~5.0 cm。根据病情指数=100×∑(各级病枝数×各级代表值)/(调查总枝数×最高级代表值)计算病情指数,用SPSS软件进行差异显著性分析(Yang et al.,2014)。
2 结果与分析 2.1 hrcJ基因插入突变体的验证 2.1.1 PCR验证随机选取3个转化子。首先,用L. quercina N-5-1特异性引物InfB238/InfB579 PCR扩增(图 1a),可扩增到342 bp片段,确定是欧美杨溃疡病菌; 然后用引物Sac B 1/Sac B 2进行PCR扩增,由于突变株中有自杀载体pEX18Km-hrcJ的插入,因此可以扩增出854 bp条带,而野生型菌株中没有,故扩增不出任何条带(图 1b),确定pEX18Km-hrcJ插入到野生菌株中。
 |
图 1 PCR验证插入突变菌株 Fig. 1 PCR analysis of the mutant a.用引物InfB 238/InfB 579 PCR验证突变体 PCR analysis by primers of InfB 238/InfB 579; M. 100 bp marker; 1,2,3. ΔhrcJ; 4. N-5-1; 5.pEX18Km-hrcJ; 6.H2O.b.用引物Sac B 1/Sac B 2PCR 验证突变体 PCR analysis by primers of Sac B 1/Sac B 2;1,2,3. ΔhrcJ; 4.pEX18Km-hrcJ; 5. N-5-1; 6. H2O; M.100 bp marker. |
为进一步验证pEX18Km-hrcJ是否定点整合入hrcJ基因,设计了2对引物组合进行PCR扩增:一对引物组合的上游引物为hrcJ hb1,下游引物为CXR; 另一对引物组合的上游引物为CXF,下游引物为hrcJ hb2(图 2)。转化子分别用2对引物组合扩增出来的PCR段大小都与预期一致(图 3),表明pEX18Km-hrcJ正确地整合入目的基因,即hrcJ基因由于发生同源交换而实现了插入突变。
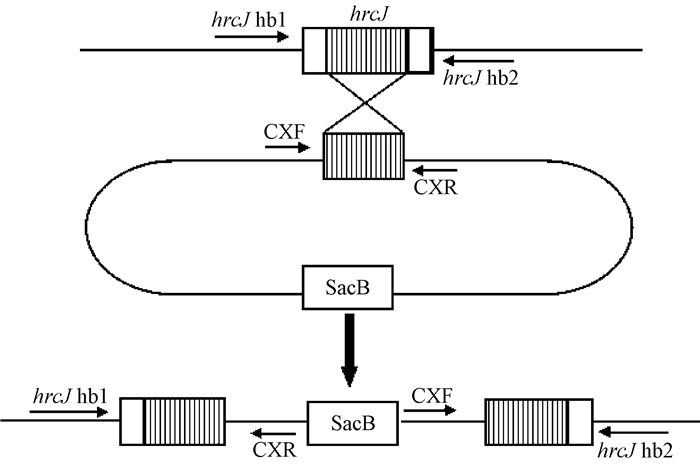 |
图 2 基因插入突变体示意 Fig. 2 Schematic map of the constructions of hrcJ inserted mutants |
 |
图 3 不同引物组合PCR验证自杀载体插入位点 Fig. 3 PCR analysis of the inserted site of the suicide vector a. 用引物hrcJ hb1/CXR PCR验证突变体PCR analysis by primers of hrcJ hb1/CXR;1 ,2,3.ΔhrcJ; 4.N-5-1; 5.pEX18Km-hrcJ; 6.H2O; M.1 kb marker. b. 用引物hrcJ hb2/CXF PCR验证突变体PCR analysis by primers of hrcJ hb2/CXF.1 ,2,3.ΔhrcJ; 4.N-5-1; 5.pEX18Km-hrcJ; 6.H2O; M.1 kb marker. |
提取野生型和突变体DNA,用Hind Ⅲ酶切,以hrcJ基因插入片段为探针进行Southern杂交分析。由于hrcJ基因内部不存在Hind Ⅲ酶切位点,而突变体的基因组中插入的自杀载体pEX18Km上存在Hind Ⅲ酶切位点,所以L. quercina N-5-1 DNA的Hind Ⅲ酶切片段只有1条杂交信号带,片段大小为2 715 bp,而突变体应该有2条杂交信号带,片段大小为1 713和5 845 bp。
杂交结果显示: 条带大小与预期一致(图 4),进一步表明pEX18Km-hrcJ已成功插入到L. quercina N-5-1的hrcJ基因位点。
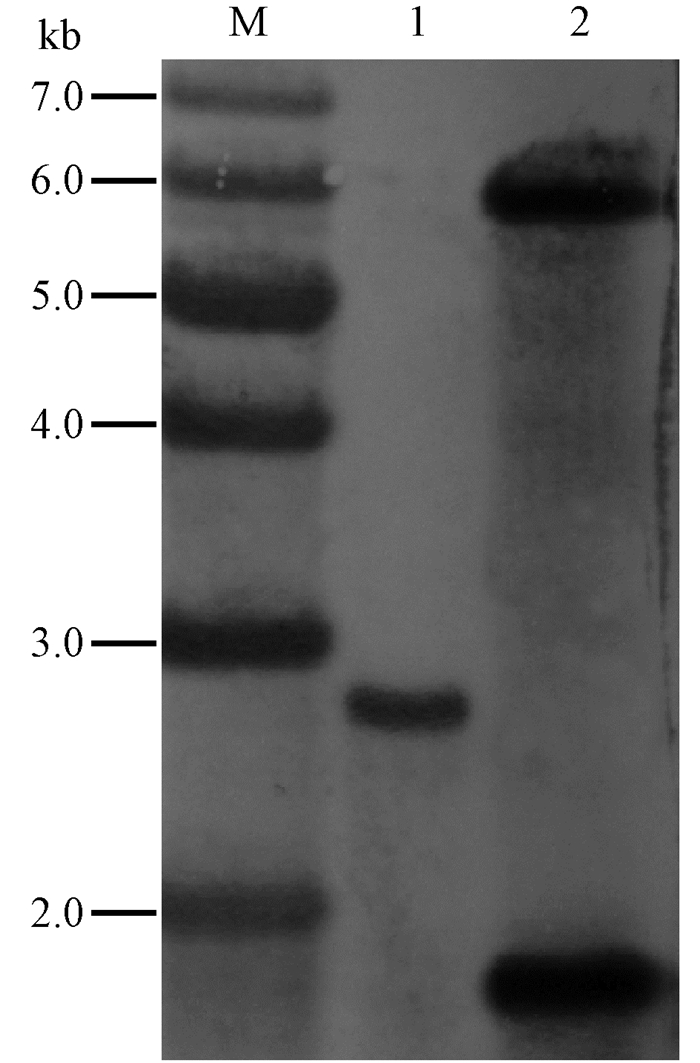 |
图 4 Southern blot验证突变体 Fig. 4 Southern blot analysis of the mutant M.1 kb marker;1.N-5-1;2.ΔhrcJ. |
挑取转化子,用引物InfB238/InfB579、引物SacB1/SacB2和pBBR1MCS-5多克隆位点上下游引物MCS 1/MCS 2(表 2)进行PCR验证。分别可扩增到342,854和2 182 bp片段,大小与预期一致(图 5),即hrcJ基因互补菌株构建正确。
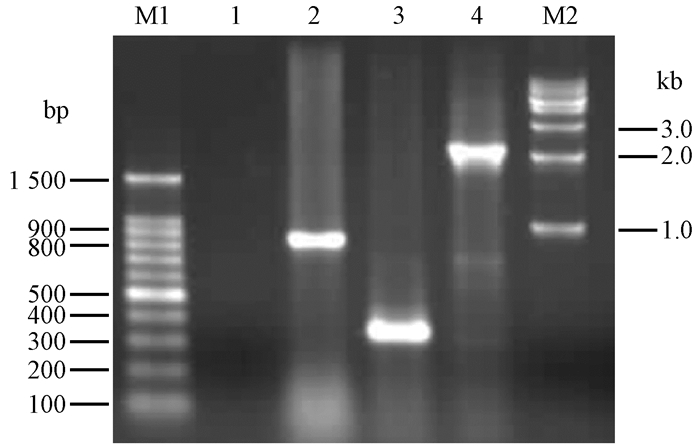 |
图 5 PCR验证互补菌株 Fig. 5 PCR analysis of the complementation M1.1 kb marker;1. H2O; 2.引物InfB 238/InfB 579 PCR验证 PCR analysis by primers of InfB 238/InfB 579; 3.引物Sac B1/Sac B2 PCR验证 PCR analysis by primers of Sac B1/Sac B2; 4.引物MCS 1/MCS 2 PCR验证 PCR analysis by primers of MCS 1/MCS 2; M2. DL2000 marker. |
以横坐标为时间,纵坐标为活菌数的对数(OD600值),可绘制出一条生长曲线。结果显示: 野生型菌株N-5-1、ΔhrcJ和HBhrcJ生长曲线无明显差异,在液体LB培养基中均可正常生长(图 6),说明hrcJ基因突变并未影响L. quercina N-5-1的生长。
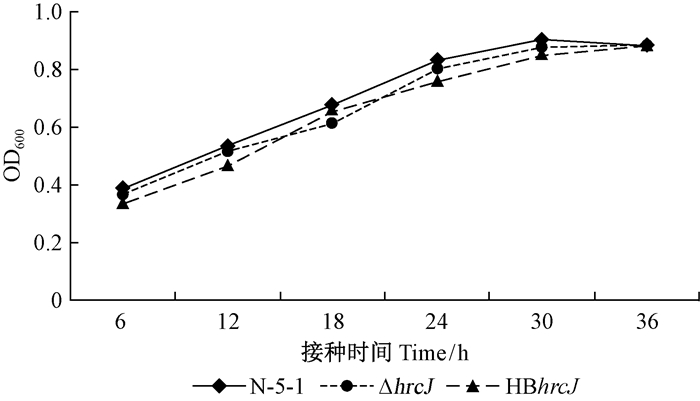 |
图 6 突变体生长能力测定 Fig. 6 Growth test of the mutants |
生物膜是微生物在遇到外界不良环境时,附着在固体表面包裹在胞外多糖内形成的一种复杂多层的类似于膜的结构(Larsen et al.,2002)。通过结晶紫染色,可以在试管壁上观察到紫色环状的生物膜形成。本研究发现ΔhrcJ、HBhrcJ、野生菌株N-5-1均可形成生物膜(图 7a),并且3种菌株的OD570值相近(图 7b),说明L. quercina N-5-1的hrcJ基因在其生物膜形成过程中并不重要。
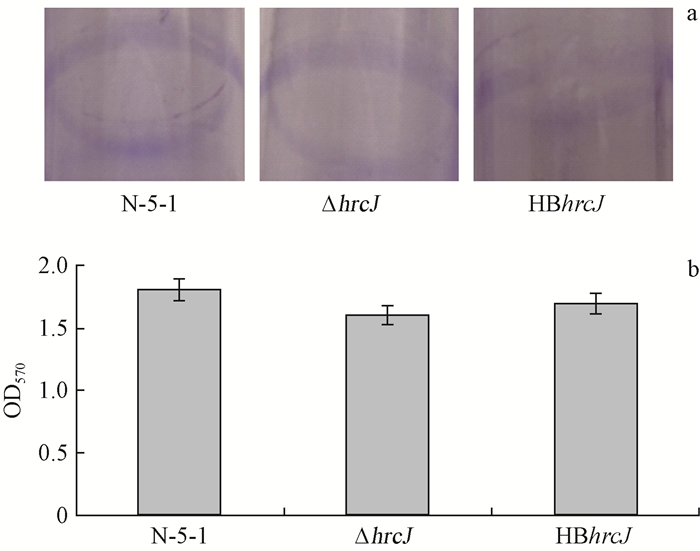 |
图 7 hrcJ基因突变体对生物膜形成的影响 Fig. 7 Effect of the hrcJ mutants on biofilm formation a.各菌株在试管壁上形成的生物膜Biofilm of strains on the burets; b. 各菌株在试管壁上形成生物膜的OD570值OD570 of biofilm of strains on the burets. |
细菌的运动可以分为涌动性和游动性,分别与细菌的纤毛和鞭毛有关,极生鞭毛有助于对细菌生物膜的形成和定殖能力(Bahar et al.,2009)。在含0.3%琼脂的LB半固体培养基上检测细菌的游动性,2天后发现ΔhrcJ的游动晕圈为野生型N-5-1的80%,HBhrcJ的游动晕圈大小与野生型接近(图 8),没有显著差别,结果表明,hrcJ基因可能间接地与鞭毛运动有关,从而导致细菌运动能力下降。
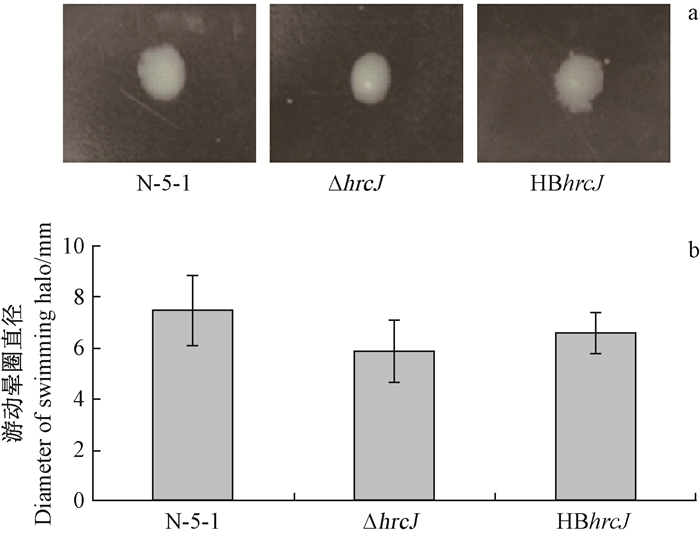 |
图 8 hrcJ基因突变体的游动能力测定 Fig. 8 Motility assay of hrcJ mutants a. 各菌株在半固体培养基中的菌落The haloes of strains on semi-solid medium;b. 菌株的游动晕圈直径Diameter of swimming halo. |
在同一片本氏烟草叶片上接种hrcJ突变体ΔhrcJ、HBhrcJ、野生菌株N-5-1和无菌水阴性对照,对其引发HR反应能力进行检测。结果如图 9,ΔhrcJ基本丧失了在本氏烟草上引起HR反应的能力,而互补菌株和野生菌株则均能在此叶片上引起HR反应。这表明hrcJ基因直接影响N-5-1在本氏烟草上激发HR反应的能力。
 |
图 9 hrcJ突变体过敏反应检测 Fig. 9 The hypersensitivity response of strains |
野生型菌株N-5-1、ΔhrcJ和HBhrcJ接种1年生欧美杨107枝条,8天后观察发病情况(图 10A ),可以看到接种野生菌株和互补菌株的枝条伤口流出大量乳白色黏稠状脓液,伤口周围树皮软腐、凹陷,而接种ΔhrcJ的杨树枝条有少量脓液流出,周围树皮组织没有明显的腐烂。ΔhrcJ的致病性比野生菌株N-5-1和HBhrcJ明显下降,HBhrcJ致病性能部分恢复到野生型水平,病情指数分别为31.1,84.4和66.7(图 10B )。突变体的致病性与野生菌株和互补菌株相比,达到极显著差异。
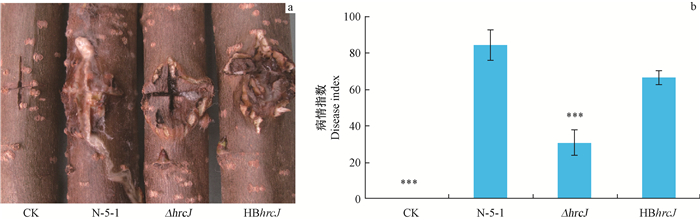 |
图 10 菌株致病性测定 Fig. 10 Pathogenicity assay on poplar branches with strains a. 杨树枝条接种野生菌株N-5-1、ΔhrcJ和HBhrcJ后的症状,接种LB液体培养基为阴性对照。The symptoms on the poplar branches inoculated with wild type strain of L. quercina N-5-1, hrcJ inserted mutant ΔhrcJ,complemented mutant HBhrcJ,and the control LB medium.b. 杨树枝条接种野生菌株N-5-1、ΔhrcJ和HBhrcJ后的病情指数,接种LB液体培养基为阴性对照。The disease index of poplar branches inoculated with N-5-1,ΔhrcJ,HBhrcJ and control(LB medium).试验重复3次,误差线代表标准差,***(P<0.001)表示采用SPSS软件的差异显著性分析结果。Experiments were performed in triplicate,and error bars indicate st and ard deviations. ***(P<0.001)indicate statistically significant differences between wild type N-5-1 and its derivatives. |
本研究利用自杀载体pEX18Km成功地获得了L. quercina N-5-1的hrcJ基因插入突变体。对致病性、生物膜和游动性生物学测定,明确了hrcJ基因的功能,建立了一套适用于L. quercina N-5-1的基因定点插入突变体系,为欧美杨细菌性溃疡病病菌的致病基因研究提供了一种方法。
hrcJ基因在L. quercina N-5-1对107杨的致病过程中起着重要作用。类似的情况也出现在水稻条斑病菌(Xanthomonas oryzae pv.oryzicola)的作用中,该菌hrcJ突变体丧失了在烟草上的HR激发能力和对水稻(Oryza sativa)的致病性(赵文祥等,2010)。L. quercina N-5-1 hrcJ基因突变并未影响病原菌的生长和生物膜的形成,但运动能力比野生菌株有所减弱,表明该基因与病菌某些生长形状的关系较小。
hrcJ基因在植物病原细菌中高度保守(Alfano et al.,2004),水稻条斑病菌中hrcJ基因是hrp基因簇hrp转录单元的第3个基因,与其他植物病原细菌的hrcJ基因具有高度同源性(Zou et al.,2006)。水稻条斑病菌的HrcJ蛋白与HrcC和HrcV蛋白互作,参与T3SS的形成,从而决定病菌在非寄主上的HR和在寄主上的致病性(赵文祥等,2010)。丁香假单胞菌(Pseudomonas syringaease pv. syringae)的相关研究结果显示,HrcJ蛋白位于细菌的内外膜之间(Büttner et al.,2002; Deng et al.,1998),是一种脂蛋白,可能与线粒体外膜和内膜形成有关(He et al.,1998)。笔者研究表明欧美杨细菌性溃疡病菌hrcJ基因与其对107杨的致病性有关,这为了解该病菌的致病机制,寻找和开发新型药物靶标及制定防控策略提供了依据。但L. quercina N-5-1中hrcJ基因的调控、hrcJ蛋白在致病性中的作用,以及如何参与T3SS装置的形成等还有待进一步研究。
4 结 论hrcJ基因决定L. quercina N-5-1在寄主107杨上的致病性和非寄主烟草上激发HR; 能调控病原菌的游动,并未影响病原菌生长和生物膜形成。
| [1] |
陈功友,王金生.2002.植物病原细菌致病性决定因子.植物病理学报, 32(1):1-7. (Chen G Y, Wang J S. 2002. Determinants of pathogenicity in plant pathogenic bacteria. Acta Phytopathologica Sinica, 32(1):1-7[in Chinese]).(  1) 1)
|
| [2] |
高杜娟,韩振华,王敏杰,等.2011.瓜类细菌性果斑病菌hpaP基因的功能分析.农业生物技术学报, 19(4):746-752. (Gao D J, Han Z H, Wang M J, et al. 2011. Function analysis of the hpaP gene in Acidovorax citrulli. Jouranl of Agicultural Biotechonogy, 19(4):746-752[in Chinese]).(  2) 2)
|
| [3] |
郭利民,张鸣放,王洪轩.2008.濮阳市发现杨树新病害.河南林业科技,28(3):36-36. (Guo L M, Zang F M,Wang H X. 2008. A new poplar disease was discovered in Puyang province of China.Journal of Henan Forestry Science and Technology,28(3):36-36[in Chinese]).(  1) 1)
|
| [4] |
郭利民,常聚普,贺伟,等.2012.欧美杨溃疡病田间发生规律研究初报.林业实用技术,(10):38-40. (Guo L M, Chang J P, He wei, et al. 2012. Preliminary study on occurrence regularity of poplar bacterial canker. Practical Forestry Technology, 10:38-40[in Chinese]).(  1) 1)
|
| [5] |
王薇,胡丹丹,李槿年,等. 2014.拟态弧菌OmpU蛋白的黏附功能及所介导的致病作用.水产学报, 38(5):731-740. (Wang W, Hu D D, Li J N, et al. 2014. The adhesion function and pathogenic effect of OmpU protein of Vibrio mimicus. Journal of Fisheries of China, 38(5):731-740[in Chinese]).(  1) 1)
|
| [6] |
汪新,王卫,钱国良,等.2011.瓜类细菌性果斑病菌过敏性反应和致病性(hrp)基因簇部分基因的克隆及功能分析.农业生物技术学报,19(1):36-44. (Wang X, Wang W, Qian G L, et al. 2011.Cloning and functional analysis of Acidovorax avenae subsp. citrulli partial hypersensitive response and pathogenicity (hrp) gene cluster. Journal of Agricultural Biotechnology, 19(1):36-44[in Chinese]).(  1) 1)
|
| [7] |
杨莉,张力群,贺伟,等. 2014.Ⅲ型分泌系统是欧美杨溃疡病菌Lonsdalea quercina重要的致病因子.植物病理学报,44(5):512-520. (Yang L, Zang L Q, He W, et al. 2014. Type Ⅲ secretion system is an essential pathogenic factor in poplar canker pathogen Lonsdalea quercina. Acta Phytopathologica Sinica, 44(5):512-520[in Chinese]).(  3) 3)
|
| [8] |
赵文祥,韩阳春,崔一平,等.2010.Ⅲ型分泌装置蛋白hrcJ决定条斑病菌在植物上的过敏反应和致病性的研究.中国农业科学,43(1):72-79. (Zhao W X, Han Y C, Cui Y P, et al. 2010. hrcJ is involved in type-Ⅲ apparatus formation of Xanthomonas oryzae pv. oryzicola for hypersensitive response in nonhost tobacco and pathogenicity in Rice.Scientia Agricultura Sinica, 43(1):72-79[in Chinese]).(  4) 4)
|
| [9] |
朱秀秀,高必达,赵廷昌,等.2009.植物病原细菌Ⅲ型分泌系统及Pseudomonas syringaeae pv. tomato的信号分子分泌研究进展.湖南农业科学, (2):19-22. (Zhu X X, Gao B D, Zhao T C,et al. 2009. Plant pathogenic bacteria Ⅲ secretion system and research progress of signaling molecules secrete of Pseudomonas syringaeae pv. tomato. Hunan Agricultural Sciences,(2):19-22[in Chinese]).(  1) 1)
|
| [10] |
邹丽芳,周丹,刘之洋,等.2012.水稻黄单胞菌致病相关基因插入突变体系的建立.植物病理学报,42(2):176-185. (Zou L F, Zhou D, Liu Z Y, et al.2012. Insertion mutagenesis in pathogenicity-associated genes of Xanthomonas oryzae. Acta Phytopathologica Sinica, 42(2):176-185[in Chinese]). |
| [11] |
Alfano J R, Collmer A. 2004. Type Ⅲ secretion system effector proteins:double agents in bacterial disease and plant defense. Annu Rev Phytopathol, 42:385-414.( 1) 1)
|
| [12] |
Bahar O, Goffer T, Burdman S.2009.Type IV pili are required for virulence, twitching motility, and biofilm formation of Acidovorax avenae subsp.citrulli. Molecular Plant-Microbe Interactions, 22(8):909-920.( 1) 1)
|
| [13] |
Büttner D, Nennstiel D, Klüsener B, et al. 2002.Functional analysis of hrpF, a putative type Ⅲ translocon protein from Xanthomonas campestris pv. vesicatoria. Journal of Bacteriology, 184(9):2389-2398.( 1) 1)
|
| [14] |
Deng W L, Preston G, Collmer A, et al. 1998.Characterization of the hrpC and hrpRS operons of Pseudomonas syringaeae pathovars syringae, tomato, and glycinea and analysis of the ability of hrpF, hrpG, hrcC, hrpT, and hrpV mutants to eicit the hypersensitive response and disease in plants. Journal of Bacteriology, 180(17):4523-4531.( 1) 1)
|
| [15] |
He S Y. 1998.Type Ⅲ protein secretion systems in plant and animal pathogenic bacteria. Annual Review of Phytopathology, 36(1):363-392.( 2) 2)
|
| [16] |
Hoang T T, Karkhoff-Schweizer R A R, Kutchma A J, et al. 1998.A broad-host-range Flp-FRT recombination system for site-specific excision of chromosomally-located DNA sequences:Application for isolation of unmarked Pseudomonas aeruginosa mutants. Gene, 212(1):77-86.( 1) 1)
|
| [17] |
Huvenne H, Messens E, Maes M. 2009.Willow wood sap promotes the density-dependent pathogenesis of Brenneria salicis. Environmental Microbiology, 11(6):1463-1472.( 1) 1)
|
| [18] |
Kessler B, de Lorenzo V, Timmis K N. 1992. A general system to integrate lacZ fusions into the chromosomes of gram-negative eubacteria:regulation of the Pm promoter of the TOL plasmid studied with all controlling elements in monocopy. Molecular and General Genetics MGG, 233(1/2):293-301.( 1) 1)
|
| [19] |
Kovach M E, Elzer P H, Hill D S, et al.1995.Four new derivatives of the broad-host-range cloning vector pBBR1MCS, carrying different antibiotic-resistance cassettes. Gene, 166(1):175-176.( 1) 1)
|
| [20] |
Larsen R A, Wilson M M, Guss A M, et al. 2002.Genetic analysis of pigment biosynthesis in Xanthobacter autotrophicus Py2 using a new, highly efficient transposon mutagenesis system that is functional in a wide variety of bacteria. Archives of Microbiology,178(3):193-201.( 1) 1)
|
| [21] |
Mcclean A E, Kluepfel D A. 2009. Genetic loci involved in rubrifacine production in the walnut pathogen Brenneria rubrifaciens. Phytopathology,99(2):145-151.( 1) 1)
|
| [22] |
Yang L, Xu B, He W, et al. 2014.The HrpW protein of Lonsdalea quercina N-5-1 has pectate lyase activity and is required for full bacterial virulence. Journal of Basic Microbiology, 54(10):1126-1135.( 4) 4)
|
| [23] |
Zou L, Wang X, Xiang Y, et al. 2006.Elucidation of the hrp clusters of Xanthomonas oryzae pv. oryzicola that control the hypersensitive response in nonhost tobacco and pathogenicity in susceptible host rice.Applied and Environmental Microbiology, 72(9):6212-6224.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

