文章信息
- 李学琳, 孔祥波, 张苏芳, 王鸿斌, 张真, 杨茂发
- Li Xuelin, Kong Xiangbo, Zhang Sufang, Wang Hongbin, Zhang Zhen, Yang Maofa
- 4类昆虫信息化学物质在不同缓释载体上的释放速率
- Researches on the Release Rates of Four Types of Insect Semiochemicals from Four Dispenser Types
- 林业科学, 2015, 51(12): 63-70
- Scientia Silvae Sinicae, 2015, 51(12): 63-70.
- DOI: 10.11707/j.1001-7488.20151208
-
文章历史
- 收稿日期:2015-03-14
- 修回日期:2015-10-20
-
作者相关文章
2. 中国林业科学研究院森林生态环境与保护研究所 国家林业局森林保护学重点实验室 北京 100091
2. Key Laboratory of Forest Protection of State Forestry Administration Research Institute of Forest Ecology, Environment and Protection, CAF Beijing 100091
利用昆虫信息化学物质进行害虫种群监测和防治正日益受到农林科学工作者和生产者的重视,目前也取得了很大的成功。但是由于昆虫信息化学物质在缓释载体中的释放模式受环境条件影响较大,导致其在生产应用中还存在诸多不足之处,所以在制作昆虫仿生诱芯剂型时,需要特别考虑选择适宜的缓释载体来维持信息化学物质的释放速率,保护活性成分免受载体及环境的降解,避免影响诱集效果,以发挥信息化学物质最大的生物功能。目前,昆虫信息化学物质缓释载体主要有固体型和液体喷雾型2种。固体型载体[橡胶塞(Jordan et al.,2013)、聚乙烯管(Bruce et al.,2011)、聚乙烯袋(Torr et al.,1997)和空心纤维(Knight,2003)]在生产中应用得最广泛,而可降解的微乳液组成的液体喷雾型载体[微胶囊和石蜡载体(De Vlieger,2001)等]在生产中应用较少。信息化学物质缓释载体本身的物理特性对其释放量会产生很大的影响。例如,橡胶载体中交联剂硫的存在会对昆虫性信息素的氧化和异构化产生较大的影响(Brown et al.,1986),从而影响其释放量和生物活性。聚乙烯管一般可作为一些小分子量挥发物的缓释载体,而聚氯乙烯塑料膜一般可作为要求大释放量的信息化学物质的缓释载体。例如,聚氯乙烯塑料膜用于小蠹虫聚集信息素的缓释载体,能满足每天毫克数量级的释放要求(Evenden et al.,2010)。因此,要提高昆虫信息化学物质的林间诱捕效果和延长持效期,就需要对其缓释载体展开深入研究。
释放速率和缓释载体的使用是密切相关的。测定昆虫信息化学物质释放速率的方法有很多,如残留测定法(Tomaszewska et al.,2005)、动态顶空吸附法(Giordano et al.,2014)和固相微萃取法(Bertelli et al.,2008)等。动态顶空吸附法是目前应用最广的一种方法,能够收集活体植物或其他生物释放的挥发性气味,并可以对微量化合物进行定性定量分析,测定的结果能够较真实地反映被测生物释放的信息素化学组成及其比例。该方法用到的吸附剂种类也较多,如Super Q(Meagher,2002)、Tenax(Cross,1980)、Porapak Q(Cross et al.,1976)和聚氨酯泡沫(Tomaszewska,2005)等,且吸附剂的选择是根据信息化学物质的性质来决定的;另外,松毛虫和小蠹虫是目前危害针叶林的主要害虫,发生面积广,危害严重。 因此,本文以松毛虫典型的性信息素成分顺5,反7-十二碳二烯醛[落叶松毛虫(Dendrolimus superans)主要的性信息素成分]和顺5,反7-十二碳二烯醇[赤松毛虫(D.spectabilis)、油松毛虫(D.tabulaeformis)和马尾松毛虫(D.punctatus)主要的性信息素成分],以及常见的小蠹虫聚集信息素成分和作为小蠹虫益它素(或者聚集信息素合成前体或者聚集信息素增效剂)的寄主植物挥发物作为研究对象,采用Porapak Q吸附剂动态顶空吸附法收集上述信息化学物质在4种缓释载体上的释放量,研究不同类型的缓释载体对这些信息化学物质的释放规律,以此指导仿生诱芯的配制,提高林间松毛虫和小蠹虫的种群监测和防控效果。
1 材料与方法 1.1 信息素成分、缓释载体和吸附剂供测试的4种缓释载体及信息化学物质:1)聚氯乙烯塑料膜缓释载体(bubble cap,Contech Enterprises,Delta,BC,Canada)。成分为S-(-)-小蠹烯醇(+3/-97,每个诱芯40 mg)、R-(+)-小蠹烯醇(+97/-03,每个诱芯40 mg)、S-(+)-小蠹二烯醇(+97/-03,每个诱芯40 mg)和R-(-)-小蠹二烯醇 +3/-97,每个诱芯40 mg)。2)聚乙烯塑料纸缓释载体(PE pouch,Contech Enterprises,Delta,BC,Canada)。成分为反式马鞭烯醇(每个诱芯40 mg)和顺式马鞭烯醇(+17/-83,每个诱芯40 mg)。 3)聚乙烯塑料瓶缓释载体(PE bottle,15 mL,Contech Enterprises,Delta,BC,Canada),瓶口用塑料薄膜垫紧,盖紧瓶盖以防成分从瓶口挥发。成分为S-(-)-α-蒎烯(每个诱芯10 g)和R-(+)-α-蒎烯(每个诱芯10 g)。(4)聚乙烯管缓释载体 [PE tube #730,1 mL,32 mm(long)× 8 mm(OD)×6 mm(ID),Kartel Company,Italy]。成分为顺5,反 7-十二碳二烯醛(90%,每个诱芯5 mg)和顺5,反 7-十二碳二烯醇(92%,每个诱芯5 mg),这2种成分购自荷兰Chemtech B.V.公司; 聚乙烯管缓释载体中分别加入 顺5,反7-十二碳二烯醛和顺5,反7-十二碳二烯醇后,一部分诱芯用酒精灯封口以防成分从管口挥发(封口),另一部分诱芯用聚乙烯管自带瓶盖封口(未封口)。吸附剂Porapak Q(50~80目)购自CNW Technologies公司,按每采样管150 mg填装到玻璃采样管中[Chrompack,0.6 mm(diameter)×160 mm(long)],使用前在200 ℃高温条件下氮气保护老化2 h,然后用铝箔纸和Parafilm膜封口,以备下次使用。
1.2 缓释载体中信息化学物质的动态顶空采集将测试的诱芯分为4组,第1组含有反式马鞭烯醇、S-(-)-小蠹烯醇、R-(-)-小蠹二烯醇、顺5,反7-十二碳二烯醛(封口)和顺5,反7-十二碳二烯醇(封口); 第2组含有顺式马鞭草烯醇、R-(+)-小蠹烯醇、S-(+)-小蠹烯醇、顺5,反7-十二碳二烯醛(未封口)和顺5,反7-十二碳二烯醇(未封口); 第3组含有S-(-)-α-蒎烯; 第4组含有R-(+)-α-蒎烯。每个成分在指定缓释载体上重复4次。在室内温度24~26 ℃,相对湿度50%~80%的条件下,空气发生器(HGA-5L,北京江龙)产生的2.4 L·min-1气流分别经8个振兴玻璃转子流量计(型号: L2B-6WB,流速300 mL·min-1)持续吹扫8个三角瓶中的不同诱芯载体。在进行信息化学物质动态顶空收集时,大气采样仪(QC-1型,北京市劳动保护科学研究所)进气口端以特氟隆管连接采样管,然后以100 mL·min-1的气体流速收集三角瓶中不同缓释载体诱芯挥发的成分,采样10 min。采完样后立即用色谱纯的正己烷(4 mL)淋洗采样管,1周1次动态顶空采样。
1.3 气相色谱分析采用7890A气相色谱仪进行样品分析,其配有7683B series自动进样器、火焰离子化检测器(FID)和DB-5MS非极性毛细管色谱柱(30 m×0.25 mm× 0.25 μm,J&W Scientific)。分析条件: 炉温升温程序60 ℃保持1 min,以6 ℃·min-1升温至220 ℃,保持10 min。进样器温度220 ℃,柱头压力15 psi,隔垫吹扫流量2.6 mL·min-1,不分流进样模式(保持0.75 min),分流出口吹扫流量45 mL·min-1,载气节省20 mL·min-1; 色谱柱流速1.38 mL·min-1,检测器温度220 ℃,H2流量40 mL·min-1; 空气流量400 mL·min-1; 尾吹气流量41.915 mL·min-1。用Agilent Chemstation软件进行数据采集分析。通过色谱保留时间定性,采用诱芯中相应成分标准品外标法定量。
1.4 数据分析图中数据均以平均数表示。数据经log(x+1)转化后进行单因素方差分析(ANOVA),若方差齐性差异显著,进行Duncan多重比较; 若方差齐性不显著,进行Tamhane多重比较,分析不同处理平均数间的差异显著性(SPSS 17.0)。对比数据用独立样本T检验进行显著性检验。
2 结果与分析 2.1 落叶松八齿小蠹聚集信息素成分及类似物在聚氯乙烯塑料膜缓释载体中的释放速率小蠹烯醇和小蠹二烯醇已经被鉴定为是齿小蠹属昆虫的主要聚集信息素成分(Vité et al.,1972)。落叶松八齿小蠹主要聚集信息素成分是S-(-)-小蠹烯醇和S-(+)-小蠹二烯醇,其在种群监测和大量诱捕防控小蠹虫危害方面发挥着重要作用(Chen et al.,2015)。用DB-5MS毛细管色谱柱分析S-(-)-小蠹烯醇、R-(+)-小蠹烯醇、S-(+)-小蠹二烯醇和R-(-)-小蠹二烯醇4种成分在聚氯乙烯塑料膜缓释载体(bubble cap)中不同时间的释放速率(图 1)。小蠹烯醇和小蠹二烯醇在bubble cap缓释载体中的释放模式基本相同,即在第2天初次测试时释放量较高,然后释放速率持续下降直到第15天,从第15~36天释放速率迅速上升,并在第36天达到最大释放量,然后又逐渐下降到低释放速率状态。在测试周期内,小蠹烯醇的释放速率高于小蠹二烯醇(第36天,S-(+)-小蠹二烯醇的释放速率大于R-(+)-小蠹烯醇除外)。4种聚集信息素成分及类似物的释放速率在第8天(F(3,12)=1.396,P=0.2925)、36天(F(3,12)=0.394,P=0.759)和43天(F(3,12)=0.820,P=0.508)差异不显著,在第2天(F(3,12)=9.493,P =0.002)、22天(F(3,12)=7.998,P=0.03)和29天(F(3,12)=58.174,P < 0.01)差异显著。
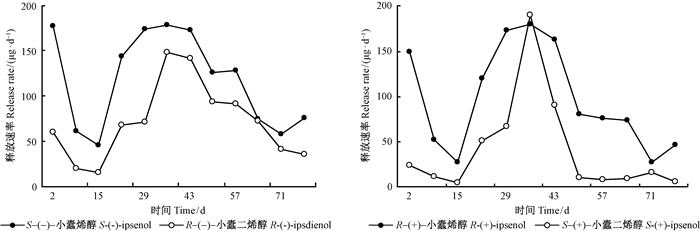 |
图 1 小蠹烯醇和小蠹二烯醇在聚氯乙烯塑料膜缓释载体中78天的释放速率动态 Fig. 1 Dynamic release rates of ipsenol and ipsdienol in bubble cap dispensers during the period of 78 d |
落叶松毛虫在东北地区严重危害落叶松,其性信息素成分 顺5,反7-十二碳二烯醛和顺5,反7-十二碳二烯醇已被鉴定并作为种群监测的有效手段在生产上发挥重要作用(Kong et al.,2007)。对未封口的聚乙烯管缓释载体(PE tube),顺5,反7-十二碳二烯醛和顺5,反7-十二碳二烯醇性信息素成分在其上的释放模式基本相同(图 2)。第2~15天是性信息素成分缓慢释放的初始阶段,从16天开始释放速率一直上升,第22天(顺5,反7-十二碳二烯醇)或43天(顺5,反7-十二碳二烯醛)达到最大释放量,然后又缓慢下降到低释放速率状态。释放高峰期内顺5,反7-十二碳二烯醛的释放速率高于顺5,反7-十二碳二烯醇。经过独立样本T检验分析,在第36天(t=4.150,df=6,P =0.006)和43天(t=12.076,df=6,P<0.01),顺5,反7-十二碳二烯醛的释放速率显著高于顺5,反7-十二碳二烯醇。对性信息素成分每7天的平均释放速率进行独立样本T检验分析,顺5,反7-十二碳二烯醇和顺5,反7-十二碳二烯醛释放速率差异不显著。对相同性信息素成分在不同时间的释放速率分析,顺5,反7-十二碳二烯醛(F(11,36)=8.080,P < 0.001)或顺5,反7-十二碳二烯醇(F(11,36)=15.628,P< 0.001)的释放速率在12个分析时间段间差异极显著,如顺5,反7-十二碳二烯醛在第22,29,36和43天的释放速率显著高于其他测试时间,其平均释放速率(μg·d-1)分别为: 13.16 ± 6.63,15.26 ± 4.52,15.01 ± 2.41和22.44 ± 0.69。对于封口的聚乙烯管载体,顺5,反7-十二碳二烯醇和顺5,反7-十二碳二烯醛一直处于零释放状态,说明这2种成分不能穿透聚乙烯管1 mm厚的管壁对外释放,其只能通过未密封的聚乙烯管口释放。
 |
图 2 顺5,反7-十二碳二烯醇和顺5,反7-十二碳二烯醛成分在聚乙烯管缓释载体中78天的释放速率动态 Fig. 2 Dynamic release rates of Z5,E7-12:OH and Z5,E7-12:Ald in polyethylene tube dispensers during the period of 78 days |
寄主挥发性萜烯化合物可以作为小蠹虫的益它素或者聚集信息素的增效剂发挥作用(Erbilgin et al.,2007; Gallego et al.,2008)。S-(-)-α-蒎烯和R-(+)-α-蒎烯在聚乙烯塑料瓶缓释载体(PE bottle)中的释放模式略有不同(图 3)。S-(-)-α-蒎烯在第2~8天释放速率逐步升高,第8~15天逐渐下降,在第15天后又迅速上升,第22天达到最大释放量,而后迅速下降到第43天并维持在低释放速率状态。R-(+)-α-蒎烯在第2~15天释放速率逐渐下降,从第15~29天释放速率又迅速升高并达到最大值,然后释放速率逐渐下降到43后维持在低释放速率状态。经独立样本T检验分析,第15天(t=13.772,df=5.890,P < 0.01)和第29天(t=9.182,df=3.041,P < 0.01)S-(-)-α-蒎烯和R-(+)-α-蒎烯的释放速率差异显著。对不同时间的释放速率分别进行方差分析,S-(-)-α-蒎烯(F(11,36)=11.124,P < 0.001)和R-(+)-α-蒎烯(F(11,36)=41.220,P< 0.001)的释放速率在12个分析时间段间差异极显著,如R-(+)-α-蒎烯经多重比较分析(Duncan,α=0.05)发现第2,22,29,36天释放速率显著高于其他测试时间,其平均释放速率分别为: 11 098.47 ± 793.65,13 605.99 ± 2 681.09,16 693.49 ± 1 087.61和(13 082.14 ± 40.26)μg·d-1。对S-(-)-α-蒎烯和R-(+)-α-蒎烯挥发物每7天的平均释放速率进行独立样本T检验分析发现S-(-)-α-蒎烯释放速率与R-(+)-α-蒎烯的释放速率差异不显著(t=0.265,df=22,P=0.793)。
 |
图 3 S-(-)-α-蒎烯和R-(+)-α-蒎烯在聚乙烯塑料瓶缓释载体中78天的释放速率动态 Fig. 3 Dynamic release rates of S-(-)-α-pinene and R-(+)-α-pinene in PE bottle dispensers during the period of 78 d |
顺式马鞭草烯醇是云杉八齿小蠹(Ips typographus)的主要聚集信息素成分(Bakke et al.,1977),而反式马鞭草烯醇能抑制西松大小蠹(Dendroctonus brevicomis)雌虫对聚集信息素的反应,其在降低西松大小蠹种内个体对栖息场所竞争方面发挥重要作用(Byers,1983)。 反式马鞭草烯醇和顺式马鞭草烯醇在聚乙烯塑料纸缓释载体(PE pouch)上的释放模式相似(图 4),第2~15天是信息素成分平稳的低释放速率期,从第16天开始释放速率迅速上升,第36天(反式马鞭草烯醇)或43天(顺式马鞭草烯醇)达到最大释放量,然后释放速率逐渐下降到低释放速率状态。在释放周期内反式马鞭草烯醇的释放速率快于顺式马鞭草烯醇 。经独立样本T检验分析,第15天(t=3.674,df=6,P=0.011)、22天(t=4.435,df=6,P=0.004)、29天(t=4.956,df=6,P=0.003)、36天(t=2.680,df=6,P=0.037)和50天(t=4.025,df=6,P=0.007)反式马鞭草烯醇的释放速率都显著高于顺式马鞭草烯醇; 第43天(t=0.375,df =4.602,P =0.726)反式马鞭草烯醇和顺式马鞭草烯醇的释放速率差异不显著。在进行Tamhane多重比较分析时发现反式马鞭草烯醇在第15天释放速率显著低于第64天(P =0.024); 第36天释放速率最大为(391.56 ± 68.04)μg·d-1。对于顺式马鞭烯醇,第43天的释放速率是(321.56 ± 22.79)μg·d-1,显著大于其他释放时间(P < 0.05)。对反式马鞭草烯醇和顺式马鞭草烯醇信息素成分每7天的平均释放速率进行独立样本T检验分析发现,反式马鞭草烯醇与顺式马鞭草烯醇信息素的释放速率差异不显著(t=2.038,df=22,P=0.054)。
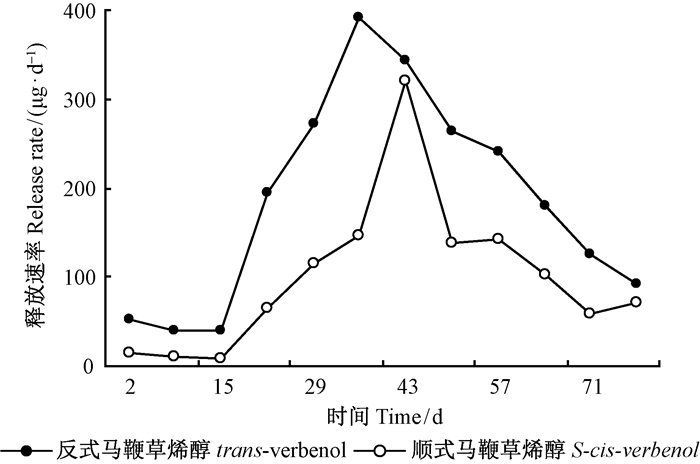 |
图 4 顺式马鞭草烯醇和反式马鞭草烯醇在聚乙烯塑料纸缓释载体中78天的释放速率动态 Fig. 4 Dynamic release rates of trans-verbenol and S-cis-verbenol in PE pouch dispensers during the period of 78 d |
不同昆虫信息素成分在同一缓释载体中的释放速率差异很大。例如,对于聚乙烯类昆虫信息素缓释载体,(+/-)-α-蒎烯的释放速率约为2 g·d-1(20 ℃),乙醇的释放约为300 mg·d-1(20 ℃)(Teale et al.,2011);但是聚乙烯缓释载体的厚度、长度、是否开口以及开口孔径的大小等因素都直接影响到α-蒎烯和乙醇的释放速率(Gallego et al.,2008); 所以针对不同的信息素成分,林间应用时为了获得较准确的释放速率,都需要做大量的前期释放速率测试分析工作,以确定合适的林间使用剂型。本试验在25 ℃室内条件下,测得小蠹烯醇类聚集信息素成分在聚氯乙烯塑料膜缓释载体(Bubble cap)中的释放速率是0.05~0.2 mg·d-1,小蠹二烯醇释放速率为0.005~0.15 mg·d-1。然而Contech Enterprises公司提供的测试结果为在20 ℃室内测试条件下,小蠹烯醇的释放速率是0.4 mg·d-1,小蠹二烯醇的释放速率是0.2 mg·d-1(Contech Enterprises Inc.,Delta,BC,Canada)。通常规律应该是温度越高,信息素的释放速率越快,这里出现相反的结果可能是由于测试方法不同或者是室内的其他控制条件(如风速变化)不同造成的。另外,在24 ℃室内条件下,小蠹烯醇在铝袋缓释载体(Aluminium Pouch)中的释放速率是0.13 mg·d-1,小蠹二烯醇的释放速率是1.2 mg·d-1(Etxebeste et al.,2012)。但是,在野外最低温度8.05 ℃、最高温度20.7 ℃、平均温度14.4 ℃的条件下,采用信息素残留法测试的小蠹二烯醇在铝袋缓释载体中的释放速率是0.64 mg·d-1,小蠹烯醇的释放速率是0.61 mg·d-1(Etxebeste et al.,2012)。在24 ℃测试条件下,顺式马鞭烯醇在铝袋中的释放速率是0.3 mg·d-1,在聚乙烯塑料纸缓释载体中最大释放速率是0.32 mg·d-1。需要强调的是铝袋缓释载体对信息化学物质的释放机制与其他塑料膜式缓释载体完全不同,因为信息化合物不能穿透铝膜释放,而是通过铝袋开口释放的。也说明相同的昆虫信息素成分在不同释放载体中的释放速率差异很大,这与释放速率分析方法、测试条件和释放载体本身特性都有直接关系。在今后的研究中可以将小蠹烯醇和小蠹二烯醇等成分按一定比例添加到聚氯乙烯塑料膜、聚乙烯或者铝袋等缓释载体中进行释放,然后室内或者林间测试其真实的释放比例,以模拟小蠹虫聚集信息素真实的释放状态,更好地对小蠹虫种群进行监测和防治。
根据昆虫信息素的化学性质选择适宜的缓释载体尤为重要。例如,松毛虫性信息素成分含有共轭双键并具有醇醛酯官能团,不易采用异构化速率较快的天然橡胶和释放速率较快的硅橡胶做缓释载体(Brown et al.,1986)。顺5,反7-十二碳二烯醇在聚乙烯管缓释载体(未封口)上81天的释放速率在(0.30~9.09)μg·d-1之间(刘奎伟等,2012),本试验测试的顺5,反7-十二碳二烯醇在聚乙烯管缓释载体(未封口)中78天的释放速率维持在(0.12~12.43)μg·d-1之间,这说明相同信息素成分在同种载体上的释放特性相同,按同种分析方法测试,结论相近。顺5,反7-十二碳二烯醛性信息素成分在聚乙烯管缓释载体上的释放速率是(0.65~22.44)μg·d-1,说明在相同缓释载体中不同性信息素成分的化学性质是影响释放速率的关键因素。另外,Bradley等(1995)指出信息素成分在聚乙烯管载体中的释放速率会呈对数下降,本试验测试的松毛虫性信息素成分没有表现出这一规律。表明信息素成分的释放受多方面因素的影响,不能保证其释放速率的高低有固定的趋势。Compton等(1997)认为,刚配制的聚乙烯管诱芯需要2天的时间来穿透管壁,所以其释放速率是先慢后快,亦有研究者认为信息素挥发的气味可从管(瓶)壁内的微小孔中按一定量释放出来,调节壁的厚度可改变其引诱剂的释放量(Hodges et al.,2004)。本研究对封口和未封口的聚乙烯管载体进行松毛虫性信息素释放比较研究,发现未封口的聚乙烯管载体中的信息素能释放出来,而用酒精灯封口的聚乙烯管载体在78天的测试时间内没有释放出性信息素成分。由此可见,松毛虫性信息素成分是从密封不严的管口进行释放的,而不是穿透管壁进行释放。这一研究结论需要用其他性信息素成分再进行对比研究进行确认。
α-蒎烯在微球载体中,初始阶段释放速率增加快,后期由于芯材物质大量外涌释放,堵住了壁材的小孔,所以释放缓慢(Wang et al.,2012)。本试验测试的S-(-)-α-蒎烯和R-(+)-α-蒎烯在聚乙烯塑料瓶缓释载体中前期释放不稳定,但43天后都处于平稳的低释放状态,与α-蒎烯在微球载体中的释放有类似的原因。本文S-(-)-α-蒎烯和R-(+)-α-蒎烯在塑料瓶上高峰期的释放速率在11~16 mg·d-1之间,R-(+)-α-蒎烯释放速率前期低于S-(-)-α-蒎烯,后期高于S-(-)-α-蒎烯,说明α-蒎烯在长时间释放条件下可能产生了异构化现象。关于萜烯类物质对小蠹虫聚集信息素的增效或抑制作用已被广泛的报道。低浓度释放的α-蒎烯对聚集信息素的引诱力没有影响,而其高浓度释放则起显著的增效作用(Erbilgin et al.,2007)。所以应考虑在制备小蠹虫聚集信息素诱芯时加入适量的α-蒎烯,以增加诱捕效果。另外,小蠹虫可以利用寄主树木分泌的萜烯类物质作为信息素或合成信息素的前体。例如,类加州十齿小蠹(Ips paraconfusus)能将寄主树木分泌的α-蒎烯转化为顺式马鞭草烯醇,西松大小蠹能够利用寄主树木分泌的α-蒎烯合成反式马鞭草烯醇(Hendry et al.,1980; Byers,1982),所以对马鞭草烯醇和α-蒎烯在不同释放载体上释放速率的研究显得非常必要,能否选择出一种缓释载体直接将α-蒎烯转化为马鞭草烯醇聚集信息素来引诱小蠹虫,成为今后的研究方向。
3.2 结 论本研究中4类昆虫信息化学物质的10种化学成分在不同缓释载体上78天后仍能释放(封口的聚乙管载体除外),达到了一定的缓释功能,理论上这4种缓释载体的持效期都能达到80天以上,基本能够满足生产上昆虫诱芯持效期的要求。同种信息化学物质在同种载体上不同时间的释放波动可能会影响多组分信息化学物质构建的化学通信信号的稳定性,表现出测试的缓释载体在使用过程中具有一定的局限性。本文研究结论可为生产上信息素缓释载体的选择提供一定的参考,并为种群监测和害虫防控提供重要的技术支持。
| [1] |
刘奎伟,孔祥波,张真,等. 2012.共轭二烯性信息素在2种载体上的释放速率和异构化效果.林业科学, 48(7):72-78. (Liu K W, Kong X B, Zhang Z, et al. 2012. Release rates and isomerization effects of conjugated dienes sex pheromone from two types of dispensers. Scientia Silvae Sinicae, 48(7):72-78[in Chinese]).(  1) 1)
|
| [2] |
Bakke A, Froyen P, Skattebol L. 1977. Field response to a new pheromonal compound isolated from Ips typographus. Naturwissenschaften, 64(2):98-99.( 1) 1)
|
| [3] |
Bertelli D, Papotti G, Lolli M, et al. 2008. Development of an HS-SPME-GC method to determine the methyl anthranilate in Citrus honeys. Food Chemistry, 108(1):297-303.( 1) 1)
|
| [4] |
Bradley S J, Suckling D M, McNaughton K G, et al. 1995. A temperature-dependent model for predicting release rates of pheromone from a polyethylene tubing dispenser. Journal of Chemical Ecology, 21(6):745-760.( 1) 1)
|
| [5] |
Brown D F, Mcdonough L M. 1986. Insect sex pheromones:Formulations to increase the stability of conjugated dienes. Journal of Economic Entomology, 79(4):922-927.( 2) 2)
|
| [6] |
Bruce T J, Martin J L, Smart L E, et al. 2011. Development of semiochemical attractants for monitoring bean seed beetle, Bruchus rufimanus. Pest Management Science, 67(10):1303-1308.( 1) 1)
|
| [7] |
Byers J. 1982. Male specific conversion of the host plant compound, myrcene, to the pheromone, (+)-ipsdienol, in the bark beetle, Dendroctonus brevicomis. Journal of Chemical Ecology, 8(2):363-371.( 1) 1)
|
| [8] |
Byers J. 1983. Bark beetle conversion of a plant compound to a sex-specific inhibitor of pheromone attraction. Science, 220:624-626.( 1) 1)
|
| [9] |
Chen D F, Li Y J, Zhang Q H, et al. 2015. Population divergence of aggregation pheromone responses in Ips subelongatus in northeastern China. Insect Science, DOI 10.1111/1744-7917.12221( 1) 1)
|
| [10] |
Compton J A, Floyd S, Acquaye K, et al. 1997. Comparison of three types of pheromone-baited flight trap for the larger grain borer, Prostephanus truncatus (Horn). International Journal of Tropical Insect Science, 17(2):205-211.( 1) 1)
|
| [11] |
Cross J H, Byler R C, Cassidy R F, et al. 1976. Porapak-Q collection of pheromone components and isolation of (Z)-and (E)-14-methyl-8-hexadecenal, sex pheromone components, from the females of four species of Trogoderma (Coleoptera:Dermestidae). Journal of Chemical Ecology, 2(4):457-468.( 1) 1)
|
| [12] |
Cross J H. 1980. A vapor collection and thermal desorption method to measure semiochemical release rates from controlled release formulations. Journal of Chemical Ecology, 6(4):781-787.( 1) 1)
|
| [13] |
De Vlieger J J. 2001. Development of a sprayable slow-release formulation for the sex pheromone of the Mediterranean corn borer, Sesamia nonagroides. The Environmentalist, 28(1):45-48.( 1) 1)
|
| [14] |
Erbilgin N, Krokene P, Kvamme T, et al. 2007. A host monoterpene influences Ips typographus (Coleoptera:Curculionidae, Scolytinae) responses to its aggregation pheromone. Agricultural and Forest Entomology, 9:135-140.( 2) 2)
|
| [15] |
Etxebeste I, Álvarez G, Pérez G, et al. 2012. Field response of the six-toothed pine bark beetle, Ips sexdentatus (Col.:Curculionidae, Scolytinae), to pheromonal blend candidates. Journal of Applied Entomology, 136(6):431-444.( 2) 2)
|
| [16] |
Evenden M, Gries R. 2010. Assessment of commercially available pheromone lures for monitoring diamondback moth (Lepidoptera:Plutellidae) in Canola. Journal of Economic Entomology, 103(3):654-661.( 1) 1)
|
| [17] |
Gallego D, Galián J, Diez J J, et al. 2008. Kairomonal responses of Tomicus destruens (Col., Scolytidae) to host volatiles α-pinene and ethanol. Journal of Applied Entomology, 132(8):654-662.( 2) 2)
|
| [18] |
Giordano B C, Lubrano A L, Field C R, et al. 2014. Dynamic headspace generation and quantitation of triacetone triperoxide vapor. Journal of Chromatography A, 28(1331):38-43.( 1) 1)
|
| [19] |
Hendry L B, Piatek B, Browne L E, et al. 1980. In vivo conversion of a labelled host plant chemical to pheromones of the bark beetle Ips paraconfusus. Nature, 284(5755):485.( 1) 1)
|
| [20] |
Hodges R J, Addo S, Farman D I, et al. 2004. Optimising pheromone lures and trapping methodology for Prostephanus truncatus (Horn) (Coleoptera:Bostrichidae). Journal of Stored Products Research, 40(4):439-449.( 1) 1)
|
| [21] |
Jordan T A, Zhang A, Pfeiffer D G. 2013. Blend chemistry and field attraction of commercial sex pheromone lures to grape berry moth (Lepidoptera:Tortricidae), and a nontarget tortricid in vineyards. Environmental Entomology, 42(3):558-563.( 1) 1)
|
| [22] |
Knight A L. 2003. Testing an attracticide hollow fibre formulation for control of codling moth, Cydia pomonella (Lepidoptera:Tortricidae). Journal of the Entomological Society of British Columbia, 100:71-78.( 1) 1)
|
| [23] |
Kong X B, Zhao C H, Wang R. 2007. Sex pheromone of the larch caterpillar moth, Dendrolimus superans, from northeastern China. Entomologia Experimentalis et Applicata, 124:37-44.( 1) 1)
|
| [24] |
Meagher R L J. 2002. Trapping noctuid moths with synthetic floral volatile lures. Entomologia Experimentalis et Applicata, 103(3):219-226.( 1) 1)
|
| [25] |
Teale S A, Wickham J D, Zhang F, et al. 2011. A male-produced aggregation pheromone of Monochamus alternatus (Coleoptera:Cerambycidae), a major vector of pine wood nematode. Journal of Economic Entomology, 104(5):1592-1598.( 1) 1)
|
| [26] |
Tomaszewska E, Hebert V R, Brunner J F, et al. 2005. Evaluation of pheromone release from commercial mating disruption dispensers. Journal of Agricultural and Food Chemistry, 53(7):2399-2405.( 2) 2)
|
| [27] |
Torr S J, Hall D R, Phelps R J, et al. 1997. Methods for dispensing odour attractants for tsetse flies (Diptera:Glossinidae). Bulletin of Entomological Research, 87(3):299-311.( 1) 1)
|
| [28] |
Vité J P, Bakke A, Renwick J A A. 1972. Pheromones in Ips (Coleoptera:Scolytidae)-occurrence and production. Canadian Entomologist, 104(12):1967-1975.( 1) 1)
|
| [29] |
Wang D, Chi D F. 2012. Morphology and release profile of microcapsules encapsulated alpha-pinene by complex Coacervation. Advanced Materials Research, 602-604:1285-1288.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

