文章信息
- 林英华, 贾旭东, 徐演鹏, 李慧仁, 刘学爽, 徐永波, 韦昌雷, 刘三章, 王立中
- Lin Yinghua, Jia Xudong, Xu Yanpeng, Li Huiren, Liu Xueshuang, Xu Yongbo, Wei Changlei, Liu Sanzhang, Wang Lizhong
- 大兴安岭典型森林沼泽类型地表土壤动物群落与生态位分析
- Ground-Dwelling Soil Animal Community and Niche Analysis of A Typical Forest Swamp in Daxing'anling Mountains
- 林业科学, 2015, 51(12): 53-62
- Scientia Silvae Sinicae, 2015, 51(12): 53-62.
- DOI: 10.11707/j.1001-7488.20151207
-
文章历史
- 收稿日期:2014-05-22
- 修回日期:2014-10-08
-
作者相关文章
2. 东北林业大学野生动物资源学院 哈尔滨 150040;
3. 大兴安岭林业集团公司农林科学研究院 加格达奇 165000
2. College of Wildlife Resource, Northeast Forestry University Harbin 150040;
3. Research Institute of Agriculture and Forestry of Daxing'anling Forestry Group Jiagedaqi 165000
大兴安岭是我国最大的森林沼泽分布区,也是我国寒温带沼泽发育较为典型、类型较为齐全的地区(何瑞霞等,2009)。但大兴安岭森林沼泽结构组成相对简单,生态系统比较脆弱,对外界变化极为敏感,一旦遭受破坏将改变大兴安岭受极端环境胁迫的生态系统,尤其是改变地下生态系统与极端环境之间稳定的适应性关系且不可逆转(王增如等,2012)。土壤动物是地下生态系统的关键组成部分和生态系统演化的重要驱动因子(Huhta,2007),在地上生物生长和土壤中有效养分的转换过程中发挥着重要作用(Haase et al., 2008),自然因素与人为活动干扰导致的土壤生物多样性下降(张雪萍等,2006; Krab et al., 2013)对生态系统功能的直接影响,已引起了学者的关注(Hooper et al., 2012),因此,开展大兴安岭森林沼泽土壤动物群落特征研究,了解其组成与功能多样性,对于森林沼泽生态系统保护与恢复具有重要意义。
本研究以大兴安岭东部黑龙江南瓮河国家级自然保护区为研究区域,选择未受到干扰的典型森林沼泽,即兴安落叶松(Larix gmelinii)-狭叶杜香(Ledum palustre)-藓类沼泽、兴安落叶松-兴安杜鹃(Rhododendron dauricum)-藓类沼泽、兴安落叶松+白桦(Betula platyphylla)-苔草(Carex)沼泽,以及研究区内2006年受不同程度火干扰的森林沼泽,即重度火干扰的中营养沼泽和中度火干扰的富营养沼泽类型,通过对其地表土壤动物群落进行调查,运用生态位理论分析大兴安岭森林沼泽演替与火干扰下地表主要土壤动物类群生态位宽度、生态位重叠与可利用资源变化,探讨地表土壤动物群落与环境因子变化的相互关系,为进一步揭示森林沼泽地表土壤动物的生态学功能提供依据。
1 研究区域概况与研究方法 1.1 研究区域概况试验地点位于黑龙江南瓮河国家级自然保护区(125°07′55″—125°50′05″E,51°05′07″—51°39′24″N)内。该保护区处大兴安岭支脉伊勒呼里山的南麓,为嫩江源头,属低山丘陵地貌,海拔在500~800 m之间。寒温带大陆性季风气候,夏季温暖而短暂,冬季严寒且漫长。年平均气温-3.0 ℃,年平均温度≥10 ℃的积温为1 400~1 600 ℃。年降水量在500 mm左右,80%以上集中在7—8月。年积雪时间200天以上,雪深达30~40 cm。全年无霜期90~100天。地带性土壤为棕色针叶林土。地带性植被是寒温带针叶林,树种组成以兴安落叶松为单种优势种。
1.2 典型植被类型选择与样品采集所选植被类型包括 兴安落叶松-狭叶杜香-藓类沼泽(A,简称落叶松-杜香)、兴安落叶松-兴安杜鹃-藓类沼泽(B,简称落叶松-杜鹃)、兴安落叶松+白桦-苔草沼泽(C,简称落叶松+白桦),分别属于贫营养(高位)沼泽、中营养(中位)沼泽、富营养(低位)沼泽,是研究区域森林沼泽发育的3个重要类型,同时选取研究区域内2006年经过重度火烧的兴安落叶松-兴安杜鹃(D)和中度火烧的兴安落叶松+白桦(E)2种典型干扰类型(《中国湿地植被》(中国湿地植被编写委员会,1999)),共计5种类型(表 1)。
|
|
选择地形条件基本一致、林龄基本一致的上述各森林沼泽类型,每种类型分别设定3块样地,除 A类沼泽样地面积为20 m×20 m外,其他样地面积均为30 m×30 m。
2012年8月下旬、2013年8月下旬分别采用陷阱法采集地表土壤动物。在每个样地中心10 m×10 m 区域内,将装有稀酒精溶液(浓度为30%)的一次性塑料杯沿对角线埋在地下,杯口与地面齐平,48 h后取样。每个样地放置5个陷阱,2年共计150个陷阱。 将每个样地的5个陷阱合并为一个样品以统计该样地地表土壤动物数量。土壤动物标本鉴定除了线虫纲(Nematoda)、石蜈蚣目(Lithobiomorpha)、蜱螨目(Acarina)以外,均鉴定到科(尹文英等,1998); 体型大小依据其食物分解过程中的作用进行划分(Swift et al., 1979)。 一般地,土壤动物个体数量占全部捕获量10%以上的为优势类群,介于1%~10%之间的为常见类群,介于 0.1%~1%的为稀有类群,0.1%以下的为极稀有类群;本文将优势类群和常见类群统归为主要类群,稀有类群和极稀有类群统归为其他类群。
1.3 数据分析群落多样性指数采用Shannon-Wiener多样性指数(H′)、Pielou均匀性指数(Js)、 Simpson优势度指数(C):$H' = - \sum\limits_{i = 1}^s {{P_i}\ln } {P_i},{J_s} = H'/\ln S,C = \sum {{P_i}^2} $ ,式中,Pi为第i个种的个体数ni占群落总个体数N的比率,S为类群数。
群落相似性采用Jaccard指数(q): $q = \frac{c}{{a + b - c}}$ 。 式中,a,b分别为群落A、群落B的类群数,c为2个群落中共有的类群数。
生态位宽度和多种群生态位重叠指数分别采用Shannon-Wiener多样性指数为基础的生态宽度指数(孙儒泳,2001)和Petraitis 普通生态位重叠指数,分别是: ${\rm{B}}{{\rm{L}}_i} = \frac{{\lg \sum {{N_{ij}} -(1/\sum {{N_{ij}}\lg {N_{ij}}})} }}{{\lg r}},O = \exp \left\{ {\sum\limits_{i = 1}^s {\sum\limits_{j = 1}^r {\left[ {{n_{ij}}(\ln {c_j} - \ln {P_{ij}})} \right]/N} } } \right\}$。式中,Pij 为 i种对第j个资源的利用占它对全部资源利用的频度,ci=tj/N,tj 为第j个群落中所有种之和,r为资源位数,即样方数。
为降低各变量之间的异质性,将各变量进行 ln(x+1)转化并进行方差齐性检验后,采用双因素方差分析方法分析年份与植被类型对土壤动物群落的影响,LSD检验法对各类型地表土壤动物群落差异显著性进行多重比较; 采用典型判断分析方法分析沼泽不同发育阶段与火干扰后地表主要土壤动物群落间的差异,标准化统计量Wilk’s λ检验判断分析函数的显著性; 根据标准化判断函数得分确定主要土壤动物群落的作用; 采用Bayes 判别函数验证典型判断分析结果的正确率。以上分析通过SPSS18.00完成。
2 结果与分析 2.1 地表土壤动物群落组成2012年8月下旬与2013年8月下旬,2次共采集到地表土壤动物67类11 007只,未鉴定16只,隶属8纲18目3亚目62科(表 2),其中大型土壤动物52类,优势类群是蚁科(Formicidae),常见类群包括石蜈蚣目(Lithobiomorpha)、小蕈甲科(Mycetophagidae)、花萤科(Cantharidae)幼虫、逍遥蛛科(Philodromidae)、蛱蝶科(Nymphalidae)幼虫、蟹形蛛科(Thomisidae)、卵形蛛科(Oonopidae)、蛞蝓科(Limacidae)、长奇盲蛛科(Phalangiidae)、漏斗蛛科(Agelenidae)、步甲科(Carabidae)、隐翅甲科(Staphylinidae)、蛭马陆科(Hirudisomatidae)13类,稀有与极稀有类群占大型土壤动物总数的10.59%; 中小型土壤动物15类,优势类是疣跳科(Neanuridae),常见类群包括棘跳科(Onychiuridae)、甲螨亚目(Oribatida)、等节跳科(Isotomidae)、长角跳科(Entomobryidae),稀有与极稀有类群占中小型土壤动物总数的2.33%。
|
|
研究区域土壤动物营养功能群范围较广,其中植食性动物占有相对较大的比例(40.91%),其次是捕食性(30.30%),尸食性所占的比例最少(1.19%)。
从分布来看,除石蜈蚣目、小蕈甲科、逍遥蛛科、花萤科幼虫、蛱蝶科幼虫、蟹形蛛科外,其他优势类群和常见类群均分布在4种以上的植被类型中,因此可以认为这些优势类群和常见类群是大兴安岭沼泽湿地地表土壤动物中最重要的类群,在森林沼泽生态系统中发挥着重要作用。
2.2 地表土壤动物群落分布与多样性调查数据显示,不同沼泽类型中地表土壤动物个体总数与类群总数大小依次是 E>C>A>D>B与C>E>B>A>D(表 1),其中,大型土壤动物个体数与类群数大小依次是C>E>B>A>D与C>E>D>A>B,中小型土壤动物个体数与类群数大小依次是 E>C>A>D>B与B>C>D>E>A。这说明地表土壤动物分布与植被类型有关,但不同植被类型地表土壤动物个体数与类群差异不显著(P>0.05)。
研究时段内地表土壤动物群落分布变化趋势不一致,其中,2012年地表土壤动物个体数与类群数分别是 E>A>B>C>D与B>C>E>A>D,2013年则分别是B>C>D>E=A与E>A>D>B>C。相对而言,研究时段中小型土壤动物类群数与大型土壤动物类群数年季间变化较小,小型土壤动物个体数则变化较大(图 1),但不同植被类型之间没有显著的差异,仅大型土壤动物个体数与类群数以及中小型土壤动物类群数年季间之间存在显著 差异(P<0.01)(图 1)。
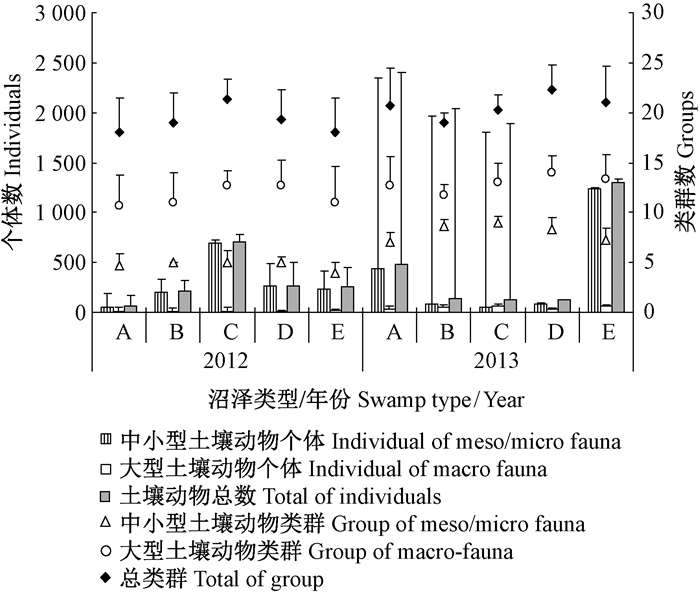 |
图 1 典型森林沼泽类型地表土壤动物个体数与类群数变化 Fig. 1 Dynamics of the numbers of individuals and groups of soil animal in typical forest |
群落多样性分析显示,地表土壤动物群落多样性指数年际间均存在显著差异(P=0.05),且沼泽类型A地表土壤动物群落明显与类型D,B和C不同,2012年与2013年地表土壤动物群落多样性指数变化趋势相反,并且沼泽类型D,E中地表土壤动物群落多样性与均匀性明显低于 类型A,B,C,辛普森指数则明显高于前3种沼泽类型(表 1,图 2)。
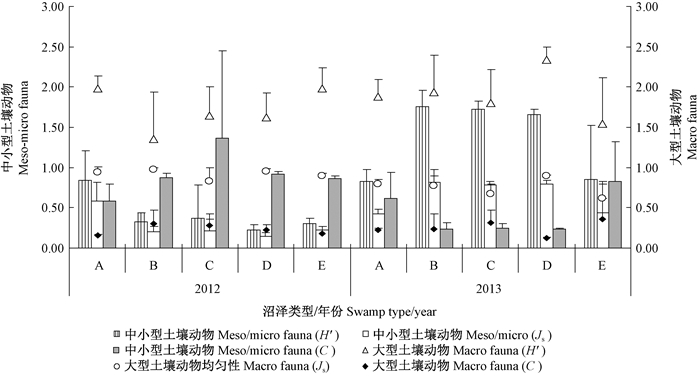 |
图 2 典型森林沼泽类型土壤动物群落多样性指数 Fig. 2 Diversity and evenness of the soil animal community in typical forest swamps |
研究时段内不同类型沼泽地表大型土壤动物群落相似性均低于地表中小型土壤动物群落的相似性(表 3)。其中:沼泽类型D与E、沼泽类型A、B、C间的 Jaccard指数(q)、中小型土壤动物Jaccard指数(q)均在0.500以上,相似度偏高。大型土壤动物只有沼泽类型A和D 之间的Jaccard指数(q)在0.500以上; 沼泽类型B与D、C与E地表中小型土壤动物群落组成变化较小,而地表大型土壤动物群落变化较大,因而相似性较低。
|
|
地表土壤动物生态位宽度变动范围是0.00~1.00之间,即土壤动物对研究区域资源的利用存在明显的差异 (P<0.01),而不同沼泽类型之间地表土壤动物生态位宽度没有明显的差异(P>0.05)。地表土壤动物优势类群,如疣跳科生态位宽度较大,但其分布不均匀; 在沼泽类型中A,B,C中,即火干扰前,同一物种的生态位宽度相差较大,如沼泽类型B中的蚂蚁生态位宽度明显低于其他沼泽类型; 在沼泽类型中D,E中,即火干扰后,同一物种的生态位变化趋势不一致,如蛞蝓、卵形蛛科等受火干扰后,生态位宽度增加,而石蜈蚣、蛭马陆等生态位宽度则降低(表 4)。
|
|
普通生态位重叠指数大小依次是B(0.820)>A(0.809)>D(0.793)>C(0.691)>E(0.657)(表 4),表明B(落叶松-杜鹃)中地表土壤动物可共同利用的资源最多,而E(落叶松-白桦火烧)中地表土壤动物可共同利用资源最少,地表土壤动物优势种优势作用明显,强烈排斥其他物种利用相似资源。火干扰前后地表主要土壤动物类群总普通生态位重叠指数分别为0.308和0.174,明显小于其他各沼泽类型,表明火干扰后地表土壤动物群落对森林沼泽的各物种利用资源要比火干扰前高。同一沼泽类型火干扰前后地表主要土壤动物类群 普通 生态位 重叠指数下降,其中中度火干扰后E(落叶松-白桦)地表土壤动物主要类群普通生态位重叠指数下降0.34,重度火干扰后D(落叶松-杜鹃)地表土壤动物主要类群普通生态位重叠指数下降0.27,表明重火干扰后地表土壤动物群落对森林沼泽的各物种利用资源要比中度火干扰减少。
2.4 环境因子对地表主要土壤动物群落影响数据分析显示,在19种主要地表土壤动物类群中,除逍遥蛛科、等节跳科、长角跳科外,其他16类土壤动物类群年季间或不同沼泽类型之间差异显著(P<0.05),因此对这16种地表土壤动物类群进行典型判断分析。
典型判别分析显示,地表土壤动物群落出现明显分离(图 3a,Wilk’s λ=0.000 0,P=0.000 0)。判别函数第1轴和第2轴分别解释了所有变量的66.0%和28.5%,8类主要地表土壤动物作为表征地表主要土壤动物类群总体变化的类群被筛选出来,其判断分析得分见图 3b。判别函数第1轴主要是把3种沼泽类型中的地表土壤动物类群分开,尤其是沼泽类型C与D分开,并且类型C沿判别函数第1轴负方向转移,因而导致地表土壤动物类群中与第1判断函数轴DF1正向密切相关的蛞蝓科、蟹形蛛科种群数量下降,但增加了与第1判断函数轴DF1反向密切相关的了蛱蝶科幼虫的种群数量,其他主要地表土壤动物类群,如漏斗蛛科、小蕈甲科也沿着第1轴出现分离,其种群数量也出现下降,甲螨亚目则增加(表 1)。判别函数第2轴主要是把干扰与未受干扰地表土壤动物群落分开,尤其是类型A与类型D,类型D沿判别函数第2轴负方向转移,因而导致地表土壤动物类群中与第2判断函数轴DF2正向密切相关小蕈甲科增加,虽然判别分析并没有作出判断,但受火干扰后的沼泽类型D、E导致地表长奇盲蛛科数量明显减少(表 1)。
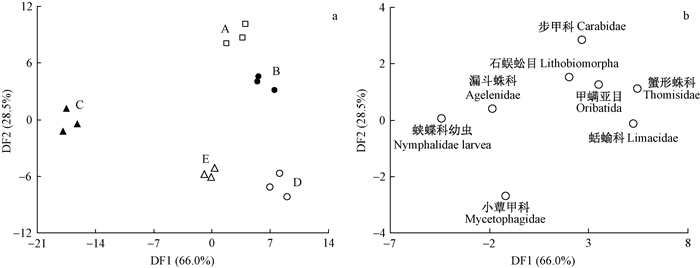 |
图 3 地表土壤动物群落典型判别分析(a)和得分(b) Fig. 3 The plot of canonical discrminant functions analysis(a) and its discriminant scores(b) for ground dwelling soil animal community |
采用Bayes 判别函数对地表主要土壤动物类群分类进行预测,数据显示,5种沼泽类型地表土壤动物群落内验证错判率均为0,综合判断率100.0%; 经交叉验证后,5种沼泽类型地表土壤动物群落的交互验证错判率分别为0,100.0%,0,33.3%和66.7%,综合判断率是60.0%,说明典型分析判断准确率相对较高且稳定,但其中沼泽类型B,E判断准确率较低,因此判断分析对沼泽类型B,E不理想。
3 讨 论地表土壤动物群落结构主要受环境因子如凋落物厚度、海拔、植被盖度以及气候等影响而呈现出个体分布不均衡、群落组成差异性较大的现象(林英华等,2009)。本研究中,2013年由于降雨量偏多,地表湿度偏大,使得一些气管系统不发达的土壤动物,如弹尾类的疣跳科、棘跳科、等节跳科、疣跳科、长角跳科以及蜱螨类的中气亚目、后气亚目等,少数底栖性或两栖性动物幼虫,如鳞翅目幼虫、双翅目幼虫,以及一些喜湿性(需要高湿度或具有饱和状态湿空气的土壤)土壤动物幼虫数量偏高。多样性分析显示,疣跳科和蚁科因个体数量在某一沼泽类型偏多且分布不均匀而呈现较明显的优势现象,使其群落多样指数偏低,如研究区域的样地B。虽然土壤动物群落Shannon-Wiener指数与Pielou 指数变化趋势相似,且存在显著的相关关系(P<0.05),但中小型土壤动物呈明显的负相关关系(r=-0.92),而大型土壤动物呈明显的正相关关系(r=0.60),表明研究区域地表土壤动物群落组成相对简单,且在一定的尺度上,Pielou指数对研究区域地表土壤动物群落的Shannon-Wiener多样性指数的校正能获得较为一致的结果。
地上生物群落演替过程中,土壤生态系统,尤其是土壤生物对环境的适应性一直是生态学家关注的热点问题之一(Frouz et al., 2008,John et al., 2012)。大兴安岭地区森林沼泽因受冷湿气候和森林沼泽本身发育的影响,地表土壤动物通过其生态位宽度变化反映其对环境资源利用状态,如富营养沼泽类型(C),即森林沼泽发育初期,以疣跳科、长角跳科、蛱蝶科幼虫、逍遥蛛科为主的地表土壤动物生态位宽度指数较大,能利用现有资源谱的大部分生物资源;随着地表生物的变化,棘跳科、长奇盲蛛科、隐翅甲科、步甲科、等节跳科、卵形蛛科因资源谱中存在可利用生物资源增多而迁入中营养沼泽类型(B)中,漏斗蛛科、小蕈甲科、蛭马陆科因地表生物中可利用资源谱的变化而迁出;当沼泽演替到贫营养沼泽(沼泽类型A)时,仅有甲螨亚目、花萤科幼虫迁入,蟹形蛛科、蛞蝓科和蛱蝶科幼虫等迁出,地表土壤动物群落组成出现一定的差异性(图 3),在这个过程中,地表土壤动物组成也因生态位宽度,即可利用资源谱的变化而变化,一些生态位宽度较大的种群则因生态位重叠出现生态学特征相似的现象,但随着森林沼泽的发育,地表土壤动物生态相似性减弱,如中小型土壤动物甲螨亚目、疣跳科、等节跳科、长角跳科、棘跳科彼此间的生态位重叠指数在这3个发育期分别介于0.58~0.99、0.78~0.98和0.22~0.55之间,而大型土壤动物则相反,生态位重叠指数随着沼泽演替变化幅度增加,分别在0.00~0.57,0.00~1.00和0.00~1.00之间,中小型与大型土壤动物之间生态位重叠指数与中小型土壤动物生态位重叠指数相似。采用多种群生态位重叠指数,即普通生态位重叠指数分析显示,森林沼泽演替过程中,不同森林沼泽群落的地表土壤动物普通生态位重叠值均较高,而大兴安岭典型森林沼泽群落普通生态位重叠值明显小于其他各群落,仅为0.174,反映出森林沼泽演替过程中地表土壤动物各物种利用资源共性差,随着时间推移地表土壤动物群落可能将朝着有利于充分利用资源的方向发展(Zaitsev et al., 2006; Talley et al.,1999),导致其个体数量增加,如甲螨亚目、蛱蝶科幼虫,同时,一些地表土壤动物类群个体也因环境的改变而呈现下降,如漏斗蛛科、小蕈甲科等(图 3)。
火干扰导致地表土壤动物群落发生改变(Buddle et al., 2006)。中轻度火烧对群落影响小且随着火后恢复过程中土壤湿度增加(孙家宝等,2010),湿生中小型土壤动物和一些大型土壤动物幼虫增加,因此中轻度火烧迹地地表土壤动物种类和数量呈增加趋势;但在重度火烧迹地,由于林地环境的急剧变化,土壤动物迁移能力相对较弱,使地表土壤动物个体数与类群数均减少,但与未受干扰的同一类型森林沼泽相比,火干扰均可导致土壤动物个体数与类群数发生改变(Kim et al., 2008),进而引起地表土壤动物群落组成的变化,本研究结果显示,不同程度的火干扰影响不一致,其中适度火干扰虽有益于地表土壤动物群落,尤其是中小型土壤动物群落(García-Domínguez et al., 2010),但经常性的火灾将导致一些敏感动物种,尤其是一些狭生态位物种因没有可利用生物资源而消失(Vasconcelos et al., 2009)。在本研究中,火干扰后地表土壤动物主要类群生态位宽度指数变化趋势不一致(表 4),如重度火干扰后,仅蛞蝓科、隐翅甲科、逍遥蛛科和石蜈蚣目生态位宽度指数增加,其他地表土壤动物生态位宽度指数均下降,且土壤动物普通生态位重叠指数下降,反映了重度火烧使资源谱中可利用资源增加。但受中度火干扰后,地表主要土壤动物,如蚁科、隐翅甲等7个类群生态位宽度指数部分增大,部分土壤动物,如蛱蝶科幼虫等3个类群可利用资源消失,普通生态位重叠指数由0.691下降0.657,表明重度火烧后地表土壤动物对各物种可利用资源的共性降低,并将随着时间推移,地表土壤动物群落也将向有利于充分利用资源的方向发展;但在这个过程中,地表土壤动物群落的变化将受研究区域气候、沼泽环境的变化影响。
典型判别分析共解释总变量的94.5%,并且内验证与交互验综合判断率均在50.0%以上,反映出典型分析判断较为理想;但在分析中,沼泽类型B,E判断准确率较低,这可能与B,E中地表土壤动物主要类群分布不均匀和生态位改变较大有关。
陷阱法适于研究对比相似栖息生境的土壤动物(Melbourne,1999)。受土壤动物特别是中小型土壤动物具有种类多、分布广、活动范围小、迁移能力弱、对环境变化敏感等特征的影响,所采集到的地表土壤动物与其丰度和活动范围以及活动密度相关,但 Darren 等(2001)的研究证实,在陷阱间距为1,5,10 m时,采集到地表无脊椎动物的丰度和组成并没有差别,只是在间距较大时能够捕获相对较多的甲虫,这与本研究地表土壤动物群落中甲虫的数量与种类偏多相一致。受研究区域内环境因子的影响,本研究陷阱时间仅放置48 h,这是否影响土壤动物多样性与生态位特征有待于今后进一步验证。
| [1] |
何瑞霞,金会军,吕兰芝,等. 2009.东北北部冻土退化与寒区生态环境变化.冰川冻土,31(3):525-532. (He R X, Jin H J, Lü L Z,et al.2009. Recent changes of permafrost and cold regions environments in the northern part of northeastern China.Journal of Glaciology and Geocryology, 31(3):525-532[in Chinese]).(  1) 1)
|
| [2] |
林英华,孙家宝,张夫道.2009.我国重要森林群落凋落层土壤动物群落生态特征.生态学报,29(6):2938-2944. (Lin Y H,Sun J B,Zhang F D. 2009.Characteristics of soil fauna community in forest floor at different climate zone,China. Acta Ecologica Sinica,29(6):2938-2944[in Chinese]).(  1) 1)
|
| [3] |
孙家宝,胡海清.2010.大兴安岭兴安落叶松林火烧迹地群落演替状况.东北林业大学学报,38(5):30-33. (Sun J B,Hu H Q.2010. Community succession of burned forestland of Larix gmelinii in Great Xing'an Mountains. Journal of Northeast Forestry University, 38(5):30-33[in Chinese]).(  1) 1)
|
| [4] |
王增如,杨国靖,何晓波,等.2012.物种多样性和生物量分布规律对冻土活动层埋深变化的响应.草业学报,21(1):10-17. (Wang Z R,Yang G J,He X B,et al.2012. Response of distribution patterns of plant species diversity and biomass to permafrost changes. Acta Prataculturae Sinica, 21(1):10-17[in Chinese]).(  1) 1)
|
| [5] |
尹文英.1998.中国土壤动物检索图鉴.北京:科学出版社. (Yin W Y.1998.Pictorial Keys to Soil Animal of China.Beijing:Science Press.[in Chinese])(  1) 1)
|
| [6] |
张雪萍,张武,曹会聪.2006.大兴安岭不同冻土带土壤动物生态地理分布.土壤学报,43(6):996-1003. (Zhang X P, Zhang W,Cao H C. 2006.Geo-ecology of soil fauna in different tundras in Daxing'anling mountains.Acta Pedologica Sinica, 43(6):996-1003[in Chinese]).(  1) 1)
|
| [7] |
Buddle C M, Langor D W, Pohl G R, et al. 2006.Arthropod responses to harvesting and wildfire implications for emulation of natural disturbance in forest management. Biological Conservation,128:346-357.( 1) 1)
|
| [8] |
Darren F W, Tim R N, Alan L Y. 2001.Effects of pitfall trap spacing on the abundance, richness and composition of invertebrate catches.Journal of Insect Conservation,(5):47-53.( 1) 1)
|
| [9] |
Frouz J, Prach K, Pižl V, et al. 2008.Interactions between soil development, vegetation and soil fauna during spontaneous succession in post mining sites. European Journal of Soil Biology, 44:109-121.( 1) 1)
|
| [10] |
García-Domínguez C, Arévalo J R, Calvo L.2010.Short-term effects of low-intensity prescribed fire on ground-dwelling invertebrates in a Canarian pine forest. Forest Systems, 19:112-120.( 1) 1)
|
| [11] |
Haase J, Brandl R, Scheu S,et al.2008. Above and belowground interactions are mediated by nutrient availability. Ecology, 89:3072-3081.( 1) 1)
|
| [12] |
Hooper D U, Adair E C, Cardinale B J, et al.2012. A global synthesis reveals biodiversity loss as a major driver of ecosystem change. Nature, 486:105-109.( 1) 1)
|
| [13] |
Huhta V. 2007.The role of soil fauna in ecosystems:A historical review.Pedobiologia, 50:489-495.( 1) 1)
|
| [14] |
John M G St, Bellingham P J, Walker L R, et al. 2012.Loss of a dominant nitrogen-fixing shrub in primary succession:Consequences for plant and below-ground communities. Journal of Ecology,100:1074-1084.( 1) 1)
|
| [15] |
Kim J W, Jung C.2008. Abundance of soil microarthropods associated with forest fire severity in Samcheok, Korea. Journal of Asia-Pacific Entomology,11:77-81.( 1) 1)
|
| [16] |
Krab E J, Van Schrojenstein Lantman I M, Cornelissen J H C, et al.2013.How extreme is an extreme climatic event to a subarctic peatland springtail community? Soil Biology & Biochemistry, 59:16-24.( 1) 1)
|
| [17] |
Melbourne B A.1999.Bias in the effect of habitat structure on pitfall traps:An experimental evaluation. Australian Journal of Ecology,24:228-239.( 1) 1)
|
| [18] |
Swift M J, Heal O W, Anderson J M. 1979.Decomposition in Terrestrial Ecosystems. Univ Calif Press,Berkeley.( 1) 1)
|
| [19] |
Talley T S,Levin L A. 1999.Macrofaunal succession and community structure in Salicornia marshes of southern California. Estuarine, Coastal and Shelf Science, 49:713-731.( 1) 1)
|
| [20] |
Vasconcelos H L, Pacheco R, Silva R C, et al. 2009.Dynamics of the leaf-litter arthropod fauna following fire in a neotropical woodland savanna. PloS One, 11:e7762.( 1) 1)
|
| [21] |
Zaitsev A S, Wolters V, Waldhardt R, et al.2006. Long-term succession of oribatid mites after conversion of croplands to grasslands. Applied Soil Ecology,34:230-239.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51
