文章信息
- 高芬, 李静虹, 王俊宏, 王梦亮
- Gao Fen, Li Jinghong, Wang Junhong, Wang Mengliang
- 赞皇枣黑腐病菌拮抗链霉菌的室内多重筛选及发酵条件优化
- Screening in vitro of Antagonistic Streptomyces against the Black Rot Disease (Alternaria tenuissima) of Zanhuang Jujube Fruit and Optimization of Fermentation Conditions
- 林业科学, 2015, 51(12): 132-140
- Scientia Silvae Sinicae, 2015, 51(12): 132-140.
- DOI: 10.11707/j.1001-7488.20151216
-
文章历史
- 收稿日期:2014-03-03
- 修回日期:2014-09-04
-
作者相关文章
枣(Ziziphus jujuba)营养成分非常丰富,除了含有大量果糖、葡萄糖外,还含有一定量的低聚糖和多糖、丰富的维生素C、环磷酸腺苷和环磷酸鸟苷、黄酮、三萜酸、多酚、蛋白质、氨基酸、矿质元素,以及维生素A、B1、B2、E、F和P等(王蓉珍等,2012)。枣性温、味甘,具有益气补血、健脾和胃、袪风等功效,既是备受人们喜爱的干果,也是我国传统的中药材(张采等,2011)。赞皇枣(Z.jujuba ‘Zanhuang’)又名金丝大枣,是我国700多个枣树品种中唯一的自然三倍体品种,果实具有个大、核小、肉厚、皮薄等特点,每100 g鲜枣中维生素C含量高达383~597 mg,被称为“活维生素丸”(及华等,2004)。2003年3月被中国经济林协会评为“中国名优果品”(曹清国等,2003)。
我国是大枣的主产区,产量约占世界总产量的90%以上,集中分布在河北、山西、山东、陕西、河南、以及新疆等地。黑腐病(又名缩果病、褐斑病、铁皮病、黑点病等)是枣果实上发生最重、危害最大的病害之一,也是近年来赞皇枣上发生日趋严重的病害。其病症表现为:果实病部稍有凹陷或皱折,进而整个病果呈暗红色;发病后期果实干缩成灰黑色或黑色,易脱落,味苦,不能食用(孙兆军,2009)。在我国北方等地,一般年份病果率为20%~30%,流行年份可达50%以上,最严重时可使枣果绝收(李志清等,1997)。目前大多采用化学药剂防治该病害,但是化学农药毒性大、残留高、污染严重,且枣果作为鲜食品种,化学农药直接喷施于枣果表面,无疑会对果实造成严重污染和农药残留。生物农药具有污染小、对人畜毒性低、环境兼容性好、病原和害虫不易产生抗性等优点,对生产绿色或有机枣果具有重大的现实意义。农用抗生素作为生物农药的重要组成部分,是世界各国研究的热点领域,许多抗生素如井冈霉素、稻瘟菌素、多氧霉素等已在农业生产中广泛应用,实际应用效果良好(邱德文,2013)。放线菌的次级代谢产物极其丰富,其中抗生素占目前所发现的抗生素种类的一半以上,其中,绝大部分的化合物来自于链霉菌属(Streptomyces)(Berdy et al.,2005)。因此,从拮抗链霉菌中筛选开发农用抗生素是微生物杀菌剂研发的一个重点。
目前,有关枣黑腐病的生物防治报道较少,仅有陈贻金等(1989)通过农抗链霉素、卡那霉素、土霉素的混合使用来防治黑腐病以及李志清等(2005)将中生菌素、农抗120与甲基托布津等交替使用进行黑腐病防治,且上述研究使用的农用抗生素自20世纪60年代以来就在生产上广泛使用(崔增杰等,2010),因病原菌抗性引起防效降低等问题多有发生,亟待开发新的、针对枣黑腐病的农用抗生素来满足生产需要。
对于枣黑腐病病原的报道,从不同地区、不同枣品种上分离鉴定的结果多有差异,如:于占晶等(2010)从壶瓶枣(Z.jujuba ‘Huping’)褐斑病分离到的致病菌为细交链格孢(Alternaria alternata),徐祥彬等(2009)在壶瓶枣缩果病上分离到的致病菌有细交链格孢、Irpex lacteus、Penicillium expansum、Cladosporium tenuissimum,吴玉柱等(2005)、王军等(2007)认为冬枣黑斑病由细极链格孢(A. tenuissima)单独侵染引起,宗淑萍等(2006)在冬枣上分离到的致病菌有Coniothyrium fucsidulum、Phoma pomirum以及细交链格孢。笔者从山西省石楼县赞皇枣黑腐病果中分离获得的主要病原菌,经鉴定为细极链格孢菌 。本研究即以此病原菌为靶标,对从特殊生境土壤中分离并经过初步筛选、鉴定的10株拮抗链霉菌,通过琼脂块法、牛津杯法分别测定供试菌株活体和发酵液活性,同时结合菌丝生长抑制试验进行多重筛选,获得对黑腐病菌具有良好抑制作用的拮抗菌菌株,并对其发酵培养基配方和条件进行优化,以期为田间试验的进行和生防制剂的开发奠定基础。
1 材料与方法 1.1 试验材料供试病原菌细极链格孢菌,由本实验室从山西省石楼县赞皇枣黑腐病果中分离并鉴定。
1.2 土壤样品的采集在河北、山西、辽宁、吉林等地,采用随机取样的方法从深山、原始森林、10年以上枣树种植园等地的土壤表层约5~10 cm深处取土样200 g,分别装入塑料袋并记录采集地,样品共计10份。
1.3 链霉菌的分离与纯化分离培养基:高氏合成1号琼脂培养基。分离及纯化方法:稀释分离法(张成玲等,2008)。将获得的菌株纯化3次,转接斜面备用。
1.4 拮抗链霉菌的多重筛选1)病原菌培养孢子悬液制备:将靶标菌接入PDA斜面活化168 h后,制备孢子悬浮液(10×15倍下,30~40个/视野),置4 ℃冰箱备用。
菌块制备:在制备好的PDA平板上加入孢子悬液0.2 mL,玻璃棒涂布均匀,28 ℃恒温培养72 h,待靶标菌长满全皿后,用无菌打孔器(直径7 mm)制备菌块,待用。
2)拮抗菌培养孢子悬液制备:将待测链霉菌接入高氏麦麸培养基斜面活化96 h(28 ℃)后,制成终浓度为1.5×107~2×108cfu·mL-1的菌悬液,置4 ℃冰箱备用。
菌块制备:在制备好的高氏麦麸培养基平板上加入孢子悬液0.2mL,玻璃棒涂布均匀,28 ℃恒温培养96h后,用无菌打孔器(直径7 mm)制备菌块,待用。
无菌发酵滤液制备:基础发酵培养基[淀粉4.7%,花生粉2.2%,酵母粉0.2%,(NH4)2SO4 0.27%,CaCO30.27%,NaCl 0.27%,pH(7.0~7.2)]。将链霉菌孢子悬液按4%的比例(V/V)接种至 50 mL的液体培养基中(250 mL三角瓶),180 r·min-1摇床振荡培养72 h(30 ℃)后,6 000 r·min-1离心10 min,取上清液,用细菌过滤器除去菌体(0.22 μm),得无菌发酵滤液,置4 ℃冰箱备用。
3 )拮抗链霉菌的活体筛选采用琼脂块法(高芬等,2007)测定备选菌株活体的抑菌效果:将靶标病原菌孢子悬液加入熔融态PDA培养基(300 μL/70 mL PDA,20 mL/皿,9 cm平皿),制成混菌平板。凝固后,等距离放置制备好的链霉菌菌块3块,28 ℃恒温培养72 h后,十字交叉法测量抑菌圈直径。
4)拮抗链霉菌摇瓶发酵筛选用牛津杯法(高芬等,2007)测定备选菌株发酵液的抑菌活性:混菌平板的制备同3)。在制备好的平板中等距离放入无菌牛津杯,牛津杯无菌发酵滤液加样量为200 μL,28 ℃培养72 h后,十字交叉法测量抑菌圈直径。
5)无菌发酵滤液抑制菌丝生长法筛选用含药平板法(沈光斌等,2002)测定备选菌株发酵液对菌丝生长的抑制效果:把无菌发酵滤液按比例加入熔融态的PDA培养基中,使其最终稀释倍数分别为10,20,40,80,160倍,并按20 mL/皿制备平板。然后将靶标菌菌块接入平板中央,分别在72,120,168 h时测量菌落直径,并计算对菌丝生长的相对抑制率。计算采用龚明福(2011)、赵磊等(2012)的方法:相对抑制率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100。
上述试验均设无菌水为对照,3次重复。
1.5 拮抗链霉菌培养条件的优化1)发酵培养基碳、氮源优化碳源优化:以高氏麦麸培养基为基础,将其中的淀粉(B)依次换为麦芽糖(D)、糊精(F)、高粱粉(A)、乳糖(E)、玉米粉(C)。按1.4 2)的方法制备无菌发酵滤液,牛津杯法进行生物测定,确定最佳碳源。
有机氮源优化:确定最适碳源培养基基础上,将培养基中的花生粉(G)依次换为蛋白胨(L)、大豆粉(J)、玉米粉(H)、酵母粉(K)、牛肉膏(I)。方法同碳源优化,确定最佳有机氮源。
无机氮源优化:在确定最适碳源和有机氮源的基础上,将培养基中的(NH4)2SO4(P)依次换为NH4NO3(M)、NH4Cl(Q)、KNO3(O)、NaNO3(N)。同碳源优化确定最佳无机氮源。
2)二次回归正交旋转组合设计发酵培养基采用二次回归正交旋转组合设计,选择培养基中主要组分:碳源 (X1)、有机氮源(X2)、无机氮源(X3)、NaCl(X4)、CaCO3(X5)为5个考察因素,每个因素设5个水平,采用DPS软件设计5因素5水平正交回归旋转试验组合,共进行36组试验(童成立等,2000;王惠等,2006;任丹等,2011),确定最佳发酵培养基。
优化前后培养基的效价对比:将优化前后的培养基同时发酵,按照1.4 2)的方法制备无菌发酵滤液,牛津杯法生物测定,明确培养基优化后的效果。
3)发酵条件优化拮抗菌接种量:以优化后的培养基为发酵培养基,分别以2%,3%,4%,5%,6%的比例(V/V)进行接种,孢子液制备、无菌发酵滤液制备均同1.4 2)生物测定同1.4 4)确定最佳接菌量。初始pH:在上述条件确定的基础上,将培养基初始pH分别调至5.0,6.0,7.0,8.0,9.0,同上试验,确定最佳初始pH。装液量:在上述条件确定的基础上,装液量分别为20,30,40,50,60 mL(250 mL三角瓶),同上试验,确定最佳通气量。发酵温度:在上述条件确定的基础上,分别于20,24,28,32,36 ℃下发酵,同上试验,确定最佳发酵温度。发酵时间:在上述条件确定的基础上,分别发酵培养24,36,48,60,72 h,同上试验,确定最佳发酵时间。
以上试验均设3次重复,所有结果采用DPS统计软件进行分析。
2 结果与分析 2.1 链霉菌的分离与纯化从采集到的10份土样中,共分离到形态特征各有差异的链霉菌菌株32株。经3次纯化,得到形态、大小、颜色均一致的菌株后,保存在高氏合成一号斜面上作为原始菌株。经初始拮抗筛选和鉴定后,将具有抑制真菌效果的10株链霉菌作为筛选目标。供试链霉菌编号为: AC01,AC02,AC03,AC04,AC05,AC06,AC07,AC08,AC09,AC10。
2.2 拮抗链霉菌的多重筛选10株链霉菌的活体筛选结果表明:菌株AC03、AC04、AC07有明显拮抗效果,抑菌圈直径分别为(32.09±1.45)mm,(15.75±1.34)mm和(18.33±0.78)mm,远大于其他备筛菌株。上述3株菌的无菌发酵滤液活性测定表明:菌株AC03、AC07抑菌圈直径分别为(20.94±0.92)mm和(23.44±1.63)mm,显著高于菌株AC04的抑菌圈直径(14.5±0.71)mm(图 1),且二者之间无显著差异(P=0.05),因此选取菌株AC03,AC07进入下步筛选。
 |
图 1 链霉菌菌株AC03,AC04和AC07的无菌发酵滤液对靶标菌的抑制作用 Fig. 1 The inhibition effect of bacteria-free filtrate of the Streptomyces strain AC03, AC04 and AC07 to Alternaria tenuissima |
病菌菌丝生长抑制试验结果表明:相同时间下,随着稀释倍数的增加,2株链霉菌的无菌发酵滤液抑菌活性均随之下降,且AC03抑菌活性的下降速度明显比AC07快(图 2);除稀释倍数为10倍、培养时间为72 h之外,其他稀释倍数对应的任何培养时间下,AC07的抑菌活性均明显高于AC03。当同为培养168h且稀释160倍时,AC03无菌发酵滤液的抑制率仅为3%,而AC07的发酵液抑制率仍达20%。以上结果说明:菌株AC07代谢产生的拮抗物质抑菌效果、持效性均优于AC03。
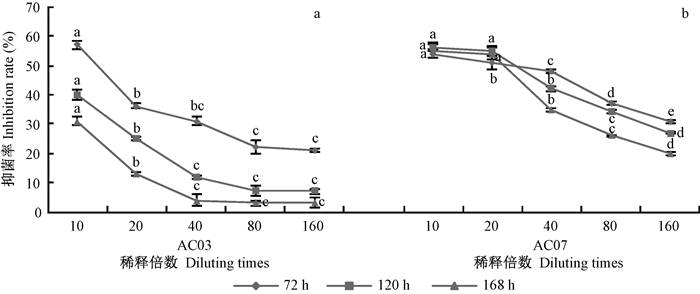 |
图 2 链霉菌AC03(a)和AC07(b)无菌发酵滤液对病原菌菌丝生长的抑制作用
Fig. 2 The inhibition effect of bacteria-free filtrate of the Streptomyces strain AC03(a) and AC07(b) to mycelia growth of Alternaria tenuissima
不同小写字母表示差异显著(P=0.05)。 The value followed by different letters is significantly different (P=0.05). |
1)发酵培养基碳、氮源优化 供试6种碳源中,以麦芽糖为碳源时发酵液的抑菌效果相对最高,因此选用麦芽糖作为碳源。供试6种有机氮源中,以大豆粉、酵母粉和花生粉为有机氮源进行发酵,发酵液的抑菌效果均较好,但从实际应用和发酵成本考虑,宜选用大豆粉作为有机氮源。在供试5种无机氮源中,以NaNO3和(NH4)2SO4为无机氮源进行发酵,发酵液的抑菌效果较好,且二者之间无显著差异(P=0.05),但以(NH4)2SO4为无机氮源的抑菌效果较佳,故选用(NH4)2SO4作为无机氮源(图 3)。
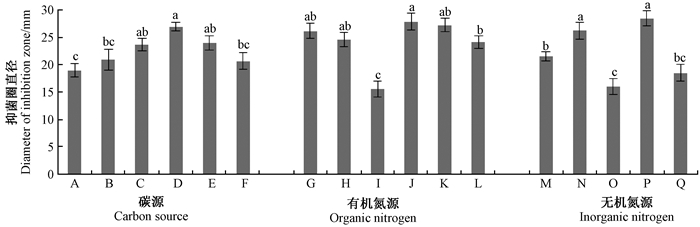 |
图 3 不同碳、氮源对链霉菌菌株AC07发酵液中抗菌物质的影响 Fig. 3 Effect of carbon sources and nitrogen sources on antifungal substance from the Streptomyces strain AC07 A-F分别表示高粱粉、淀粉、玉米粉、麦芽糖、乳糖、糊精The symbols (A-F) are to indicate sorghum flour, starch, corn flour, maltose, lactose and dextrin; G-L分别表示花生粉、玉米粉、牛肉膏、大豆粉、酵母粉、蛋白胨The symbols (G-L) are to indicate peanut powder, corn flour, beef extract, soybean meal, yeast powder and peptone; M-Q分别表示NH4NO3,NaNO3,KNO3,(NH4)2SO4,NH4Cl。 The symbols (M-Q) are to indicate NH4NO3,NaNO3,KNO3,(NH4)2SO4,NH4Cl. 不同小写字母表示差异显著(P=0.05)。The value followed by different letters is significantly different (P=0.05). |
2)二次回归正交旋转组合设计发酵培养基采用DPS数据处理系统对二次回归旋转组合试验的数据进行拟合,根据表 1结果,计算各项回归系数,以这些回归系数建立抑菌圈直径与5因素的数学回归模型,得到回归方程: Y=21.105 00- 1.453 33 X3-2.345 00X22-1.203 75 X32-1.188 75 X42+1.821 25X1X2-2.398 75X1X3-1.992 50 X2X4。
|
|
由表 2可知,回归方程的失拟性检验F1=0.736 41<F0.05(6,9)=3.37不显著,P=0.6284>0.05,可以认为所选定的二次回归模型是适当的;回归方程的显著性检验F2=2.352 49>F0.05(20,15)=2.33,P=0.037 7<0.05,说明方程与试验数据的配合是可行的,可用来建立模型(张晓娜等,2008),故认为仅就各试验因素而言,方程回归结果是可靠的。最终获得的优化后培养基配方为:麦芽糖5.7%,大豆粉2.7%,(NH4)2SO4 0.17%,CaCO3 0.22%,NaCl0.17%,酵母粉0.2%。
|
|
3)发酵培养基优化前后效价对比通过优化前后的培养基效价对比试验,测得优化后培养基发酵液的抑菌圈直径为(31.25±1.36)mm,经方差分析表明,其抑菌圈直径显著高于原始培养基的抑菌圈直径(26.13±0.31)mm(P=0.05),且抑菌活性提高了16.2%(图 4),表明优化后的发酵培养基更利于菌株AC07代谢产生抗菌物质。
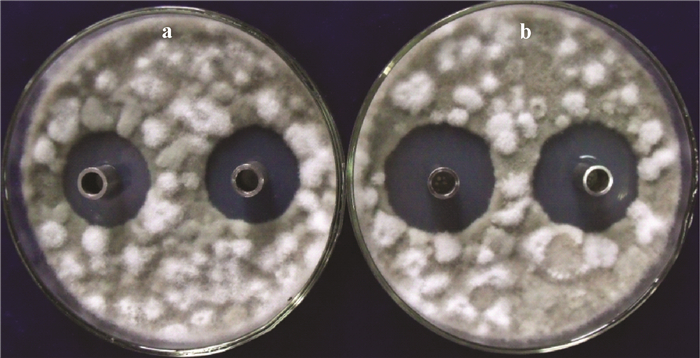 |
图 4 链霉菌菌株AC07发酵培养基优化前(a)后(b)效价对比 Fig. 4 Comparison of effects of the strain AC07 fermentation broth before(a) and after (b)medium optimization |
4)发酵条件优化接菌量:在接种量占发酵液总体积1%~6%的范围内,菌株AC07发酵液的抑菌活性在接种量为2%时抑菌活性最高(图 5a),且在0.05水平上与其他处理具有显著差异。可见,在一定量的发酵培养基中,接种量的多少与抑菌活性物质的产量相关,菌量太小不能充分利用发酵培养基的营养成分,菌量过多则导致营养成分不足,使抑菌活性物质的产量受到影响。本试验中,当接种量控制在2%时可使菌量和发酵培养基中的营养成分达到最大平衡,获得较好的发酵效果。
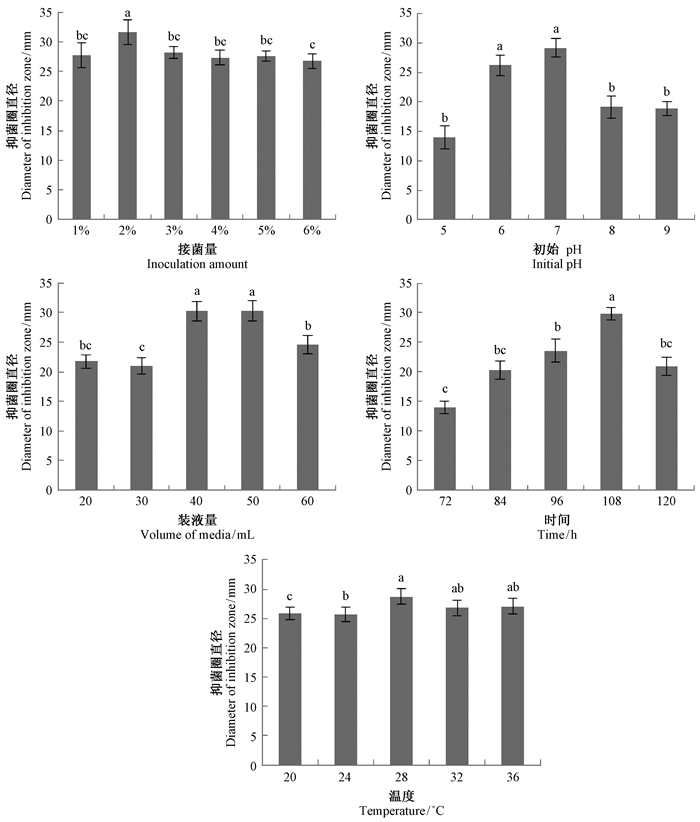 |
图 5 不同发酵条件对链霉菌AC07发酵后抗菌物质的影响
Fig. 5 Effect of different fermentation conditions on antifungal substance from the Streptomyces strain AC07
不同小写字母表示差异显著(P=0.05)。 The value followed by different letters is significantly different(P=0.05). |
初始pH:在不同初始pH条件下,菌株AC07发酵液的抑菌活性随着pH的升高而上升,当pH=7时达到最高,此后开始下降。初始pH在6.0~7.0的范围内,对发酵液的抑菌活性影响不大,但以pH7.0时为最佳,说明初始pH中性有利于抗菌物质的产生(图 5b)。
装液量:菌株AC07发酵液的抑菌活性随装液量增加而上升,当装液量为40或50 mL时抑菌活性最高,此后又开始下降。可见,装液量为40或50 mL时均可达到良好发酵效果,且两处理间无显著差异。考虑到发酵成本的因素,选择装液量40 mL进行后续试验(图 5c)。
发酵时间:菌株AC07发酵液的抑菌活性随发酵时间的延长而增加,当发酵时间为108 h时抑菌活性达到最高,随后抑菌活性开始下降,可见108 h是其发酵的最佳时间,超过这个时间,可能菌株的生长进入了衰退阶段,反而使得抗生素的产量大幅降低(图 5d)。
温度:发酵温度在20~28 ℃之间时,发酵液的抑菌活性缓慢上升,28 ℃时达到最高(图 5e),随后在28~36 ℃间,发酵液的抑菌活性基本保持在相同的水平,各处理间无显著差异,可见28~36 ℃都可视为合适的发酵温度,并以28 ℃为佳。
综上所述,AC07摇瓶发酵的最佳条件为:种子液浓度1.5×107~2×108 cfu·mL-1时,接种量2%(V/V),装液量40 mL/ 250 mL三角瓶,原始pH7.0,发酵温度28 ℃,发酵时间108 h。
3 讨 论由于生物农药的残留普遍较低,正常使用都低于最高残留限量,符合生产绿色食品的标准,特别是可以生产出AA级绿色食品,对生产无公害绿色食品可起到关键的作用(郑春江等,2009)。而农用抗生素是我国生物农药产业主体,农用抗生素具有以下特点:活性高;效果好;对环境安全、易被其他生物或自然因素所分解破坏且不易积累;生产原料大多数为农副产品,来源广、可再生;各类品种生产工艺相似、设备相同,建一个工厂就可生产多个品种,且生产过程中废弃物可再利用,对生产环境的污染少(林壁润,2000)。近年来我国农用抗生素事业在较短的时期内取得了迅速的发展,已成为我国植物保护工作上的一项重要措施(施跃峰,2000),但针对枣果实病害,特别是危害严重的黑腐病开发专用农用抗生素尚未见报道。
目前,防治链格孢属真菌病害的农用抗生素主要为多氧霉素,但自多氧霉素抗性菌株发现以来(Nishimura et al.,1976; Hwang et al.,1986; Gafuret al.,1998;黄思良,2001; Tanaka et al.,2002),该抗生素的应用受到了很大的限制。由于针对链格孢属真菌引起的植物病害一直缺少更为有效的农抗品种出现,因此,本研究通过室内多重筛选发现链霉菌菌株AC07的活体和无菌发酵滤液对枣黑腐病菌(A. tenuissima)具有良好的抑菌效果,且其抑菌物质很可能是抗生素类物质(曾文兵等,2004; Boudjella et al.,2006;金燕华等,2006),不仅为开发针对枣黑腐病的专用农用抗生素具有重要的实际意义,而且对弥补我国防治链格孢属真菌病害农抗品种欠缺的现状,也有较大的价值。但是,本试验所获得的抗生素是否为一种新型抗生素,还必须通过对其活性成分进行分离纯化及结构鉴定来进一步研究和确证。
另外,抗生素要进入实际的生产应用,还必须考察其稳定性以及田间应用效果。本研究在获得目标拮抗菌的基础上,对其发酵条件进行优化,提高目标代谢物的产量,不仅可为下一步的田间试验奠定基础,还可为进行抑菌机制、活性成分结构鉴定等后续研究提供保障。
| [1] |
曹清国,吕爱文. 2003.开发三倍体大枣资源再创赞皇枣业辉煌.中国林业, (18):28. (Cao G Q. 2003. Development of triploid Zanhuang jujube. Forestry of China, (18):28[in Chinese]).(  1) 1)
|
| [2] |
陈贻金,陈谟林,朱林元. 1989.枣缩果病及其防治技术研究.林业科技通讯, (8):3-7. (Chen Y J, Chen M L, Zhu L Y. 1989. Jujube fruit shrink disease and its control techniques. Forest Science and Technology, (8):3-7[in Chinese]).(  1) 1)
|
| [3] |
崔增杰,张克诚,折改梅,等. 2010.抗真菌农用抗生素有效成分研究进展.中国农学通报, (5):413-418. (Cui Z J, Zhang K C, She G M, et al. 2010. Progress on the research of active components in antifungal agricultural antibiotics. Chinese Agricultural Science Bulletin, (5):413-418[in Chinese]).(  1) 1)
|
| [4] |
Dekker J,徐义宽. 1985.农用抗生素抗性发展.农药译丛, (6):12-17. (Dekker J,Xu Y K. 1985. Development of resistance to agricultural antibiotics. Translated Collections of Pesticide, (6):12-17[in Chinese]). |
| [5] |
高芬,穆凌霄,魏颖颖,等. 2007.烟草赤星病菌拮抗链霉菌的多重筛选及发酵液理化性质.华北农学报, (6):171-175. (Gao F, Mu L X, Wei Y Y, et al. 2007. Screening of antagonistic microorganism against Alternaria alternata and the physical and chemical properties of the fermented broth. Acta Agriculturae Boreali-sinica, (6):171-175[in Chinese]).(  2) 2)
|
| [6] |
龚明福,韩松,李超,等. 2011.苦豆子根瘤内生细菌分离及其对棉花枯萎病的生物防治效果测定.微生物学通报, (6):865-870. (Gong M F, Han S, Li C, et al. 2011. Isolation of endophytic bacteria from nodule of Sophora alopecuroides and effect of biological control against Fusarium wilt. Microbiology China, (6):865-870[in Chinese]).(  1) 1)
|
| [7] |
黄思良. 2001.对细交链孢菌在培养基上抗多氧霉素B与异菌脲变异体的分离及其特性鉴定.植物病理学报, 31(3):280-285. (Huang S L. 2001. Isolation and characterization of polyoxin B and iprodione resistant mutants of Alternaria alternata. Acta Phytopathologica Sinica, 31(3):280-285[in Chinese]).(  1) 1)
|
| [8] |
及华,关军锋,窦世娟,等. 2004.采后赞皇大枣不同包装处理的生理生化性状差异.果树学报, (6):540-543. (Ji H, Guan J F, Dou S J, et al. 2004. Physiological and biochemical changes of zanhuangdazao jujube cultivar fruit packed with different materials in storage. Journal of Fruit Science, (6):540-543[in Chinese]).(  1) 1)
|
| [9] |
金燕华,裘娟萍,何景昌. 2006.壮观链霉菌产生抗生素的多样性.中国医药工业杂志, (12):849-855. (Jin Y H,Qiu J P, He J C, et al. 2006. Diversity of antibiotics from Streptomyces spectabilis. Chinese Journal of Pharmaceuticals, (12):849-855[in Chinese]).(  1) 1)
|
| [10] |
李志清,常聚普,乔趁峰,等. 1997.枣黑腐病发病规律研究.果树科学, 14(4):252-256. (Li Z Q, Chang J P, Qiao C F, et al. 1997. Study on the regularity of the outbreak of black-rotted disease of jujube. Journal of Fruit Science, 14(4):252-256[in Chinese]).(  1) 1)
|
| [11] |
李志清,张兆欣,田国忠,等. 2005.枣黑腐病田间药剂防治技术研究.中国森林病虫, (5):3-6. (Li Z Q, Zhang Z X, Tian G Z, et al. 2005. Pesticide control techniques against jujube black rot in the field. Forest Pest and Disease, (5):3-6[in Chinese]).(  1) 1)
|
| [12] |
林壁润. 2000.农抗2507发酵条件优化和应用机理研究.广州:华南理工大学硕士学位论文. (Lin B R. 2000. Study on lmproved ferment technique of agricultural antibiotie 2507 and its application mode. Guangzhou:MS thesis of South China Univesriyt of Technoolgy[in Chinese]).(  1) 1)
|
| [13] |
邱德文. 2013.生物农药研究进展与未来展望.植物保护, (5):81-89. (Qiu D W. 2013. Research progress and prospect of bio-pesticides. Plant Protection, (5):81-89[in Chinese]).(  1) 1)
|
| [14] |
任丹,辜运富,张小平,等. 2011.二次回归正交旋转组合设计在紫芝液体发酵培养条件优化中的应用.西南农业学报, (2):681-686. (Ren D, Gu Y F, Zhang X P, et al. 2011. Optimization of liquid fermentation conditions of Ganoderma sinensis through Quadratic orthogonal rotation combination design. Southwest China Journal of Agricultural Sciences, (2):681-686[in Chinese]).(  1) 1)
|
| [15] |
沈光斌,周明国. 2002.水稻白叶枯病菌对噻枯唑的抗药性监测.植物保护, (1):9-11. (Shen G B, Zhou M G. 2002. Resistance monitoring of Xanthomonas oryzae pv.oxyzae to saikuzuo. Plant Protection, (1):9-11[in Chinese]).(  1) 1)
|
| [16] |
施跃峰. 2000.微生物杀虫剂研究进展.植物保护, 26(5):24-32. (Shi Y F. 2000. Advances in research on microbial insecticides. Plant Protection, 26(5):32-24[in Chinese]).(  1) 1)
|
| [17] |
孙兆军. 2009.枣黑腐病的发病症状及防治措施.烟台果树, (1):54-55. (Sun Z J. 2009. Symptoms and control measures of jujube black rot. Yantai Fruits, (1):54-55[in Chinese]).(  1) 1)
|
| [18] |
童成立,贺喜全,盛良学. 2000.农业试验中正交旋转回归设计分析模型.计算机与农业, (10):16-20. (Tong C L, He X Q, Sheng L X. 2000. Analysis model of quadratic orthogonal rotation regression design in agriculture experiments. Computer and Agriculture, (10):16-20[in Chinese]).(  1) 1)
|
| [19] |
王惠,吴兆亮,童应凯,等. 2006.应用二次回归正交旋转组合设计优化黄霉素发酵培养基.食品研究与开发, (6):19-22. (Wang H, Wu Z L, Tong Y K, et al. 2006. Optimization of the flavomycin fermentation medium by the design of rotation-regression-or thogonal combination. Food Research and Development, (6):19-22[in Chinese]).(  1) 1)
|
| [20] |
王军,辛玉成. 2007.冬枣黑斑病病原的分离与鉴定.青岛农业大学学报:自然科学版, (1):21-23. (Wang J, Xin Y C. 2007. Isolation and identification of the pathogen causing black spot disease in Dongzao fruits.Journal of Laiyang Agricultural University (Natural Science), (1):21-23[in Chinese]).(  1) 1)
|
| [21] |
王蓉珍,赵子青,林勤保,等. 2012.大枣功效成分检测的研究进展.食品工业科技, (4):423-426. (Wang R Z, Zhao Z Q, Lin Q B, et al. 2012. Research progress on function component detection of jujube date. Science and Technonlogy of Food Industry, (4):423-426[in Chinese]).(  1) 1)
|
| [22] |
吴玉柱,季延平,刘会香,等. 2005.冬枣黑斑病病原菌的鉴定.中国森林病虫, (2):1-3. (Wu Y Z, Ji Y P, Liu H X, et al. 2005. Identification of pathogenic fungus of black patch in "Dongzao" jujube. Forest Pest and Disease, (2):1-3[in Chinese]).(  1) 1)
|
| [23] |
徐祥彬,赖童飞,景云飞,等.2009.山西壶瓶枣缩果病病原菌分离和鉴定.植物病理学报, (3):225-230. (Xu X B, Lai T F, Jing Y F, et al. 2009. Isolation and identification of the pathogens of jujube (Zizyphus jujuba cv. Huping) fruit shrink disease in Shanxi. Acta Phytopathologica Sinica, (3):225-230[in Chinese]).(  1) 1)
|
| [24] |
于占晶,侯晓杰,崔建州,等. 2010.壶瓶枣褐斑病病原菌的鉴定.植物病理学报, (1):7-13. (Yu Z J, Hou X J, Cui J Z, et al. 2010. Identification of the pathogen causing brown spot of Ziziphus jujuba Mill. cv. Hupingzao. Acta Phytopathologica Sinica, (1):7-13[in Chinese]).(  1) 1)
|
| [25] |
曾文兵,王锦,段学辉. 2004.从链霉菌中发现新抗生素的趋势分析.江西科学, (4):293-296. (Zeng W B, Wang J, Duan X H. 2004. Analysis on the trends of finding new antibiotics form the genus Streptomyces. Jianxi Science, (4):293-296[in Chinese]).(  1) 1)
|
| [26] |
张采,李佳,张永清. 2011.大枣化学成分研究概况.中国现代中药, (11):49-51. (Zhang C, Li J, Zhang Y Q. 2011. Survey of research on chemical constitutes in jujube. Modern Chinese Medicine, (11):49-51[in Chinese]).(  1) 1)
|
| [27] |
张成玲,赵永强,于晓庆,等. 2008.姜瘟病菌拮抗链霉菌的筛选与鉴定.植物病理学报, (4):414-419. (Zhang C L, Zhao Y Q, Yu X Q, et al. 2008. Screening and identification of antagonistic Actinomyces strains against Ralstonia solanacearum. Acta Phytopathologica Sinica, (4):414-419[in Chinese]).(  1) 1)
|
| [28] |
张晓娜,周素梅,王世平. 2008.二次回归正交旋转组合设计对麦麸中阿拉伯木聚糖酶解工艺的优化.食品科学, (1):141-145. (Zhang X N, Zhou S M, Wang S P. 2008. Optimizing enzymatic hydrolysis conditions of arabinoxylan in wheat bran through quadratic orthogonal rotation combination design.Food Science, (1):141-145[in Chinese]).(  1) 1)
|
| [29] |
赵磊,杜娟,卜春亚,等. 2012.瑞香狼毒活性物质对草莓灰霉病菌的抑制作用.植物病理学报, (4):411-417. (Zhao L, Du J, Bu C Y, et al. 2012. Antifungal activity of extracts of Stellera chamaejasme against Botrytis cinerea. Acta Phytopathologica Sinica, (4):411-417[in Chinese]).(  1) 1)
|
| [30] |
郑春江,朱瑞玮. 2009.生物农药在绿色食品中的地位和作用.农业科技通讯, (1):22-24. (Zheng C J, Zhu R W. 2009. The role of biopesticides in green food production. Bulletin of Agricultural Science and Technology, (1):22-24[in Chinese]).(  1) 1)
|
| [31] |
宗淑萍,杨文香,刘大群,等. 2006.冬枣黑点病病原鉴定.华北农学报, (5):105-107. (Zong S P, Yang W X, Liu D Q, et al. 2010. Identification of the pathogen of dongzao jujube black-spot disease. Acta Agriculturae Boreali-Sinica, (5):105-107[in Chinese]).(  1) 1)
|
| [32] |
Berdy J. 2005. Bioactive micrpbial metabolites. The Journal of Antibiotics, 58(1):1-26.( 1) 1)
|
| [33] |
Boudjella H. 2006. Taxonomy and chemical characterization of antibiotics of Streptosporangium Sg 10 isolated from a Saharan soil. Microbiological Research, 161(4):288-298.( 1) 1)
|
| [34] |
Gafur A, Tanaka C, Shimizu K, et al. 1998. Genetic analysis of Cochliobolus heterostrophus polyoxin-resistant mutants. Mycoscience, 39:155-159.( 1) 1)
|
| [35] |
Hwang B K, Yun J H. 1986. Variability in sensitivity to polyoxin B of isolates of Alternaria marl and decreased fitness of polyoxin-resistant isolates. J Phytopathol, 115:305-312.( 1) 1)
|
| [36] |
Nishimura S, Kohmoto K, Udagawa H. 1976. Tolerance to polyoxin in Alternaria kikuchiana Tannaka, causing black spot disease of Japanese pear. Review of Plant Protection Research, 9:47-57( 1) 1)
|
| [37] |
Tanaka C, Miyagawa H, Kuwahara Y, et al. 2002. Accumulation of anthraquinones in the reddish brown-colored polyoxin resistant mutants of Cochliobolus heterostrophus. Mycoscience, 43:317-320.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

