文章信息
- 杨建伟, 杜瑞卿, 沙文沛, 余明玉, 高宛莉, 张征田
- Yang Jianwei, Du Ruiqing, Sha Wenpei, Yu Mingyu, Gao Wanli, Zhang Zhengtian
- 土壤Pb含量对杨树幼苗生理生长影响的综合因素分析
- Comprehensive Factor Analysis about the Impact of Soil Pb Content on Seedling Growth of Populus canadensis
- 林业科学, 2015, 51(11): 128-136
- Scientia Silvae Sinicae, 2015, 51(11): 128-136.
- DOI: 10.11707/j.1001-7488.20151117
-
文章历史
- 收稿日期:2014-01-06
- 修回日期:2014-12-24
-
作者相关文章
2. 南阳师范学院成人教育学院 南阳 473061;
3. 南阳师范学院农业工程学院 南阳 473061
2. College of Adult Education, Nanyang Normal University Nanyang 473061;
3. College of Agricultural Engineering, Nanyang Normal University Nanyang 473061
土壤重金属污染是严重的生态环境问题之一。目前对于土壤重金属污染有很多修复方法,植物修复以其成本低、处理设施简单、对环境扰动小、利于土壤生态系统修复、有美学价值、适合大规模应用等优点而成为具有广阔前景的修复技术(Lonardo et al., 2011;韦朝阳等,2001;张东为等,2008; Jensen,2009)。木本植物修复重金属污染土壤具有生物量大、生长周期长,根系、茎、枝、叶面积较大,吸收积累重金属能力强,不参与食物链循环等优越性(林晓倩等,2013;Pulford et al., 2003;Giuseppe et al., 2013)。但Pb胁迫对木本植物的生理和生长可能会造成一定影响,需对此进行深入研究。
杨树(Populus)是世界上分布最广、栽培最多的树种,具有易种植、生长快、耐性强、生物量大等特点,因而有重要的生态和经济价值(刘艳丽等,2012;王新等,2007;李金花等,2012)。Lonardo等(2011)、Zacchini等(2009)、 Gu等(2007)和Tlustoš等(2006)的研究表明,杨树根系深、生物量大、蒸腾速率高,能够在根、茎、叶中富集大量重金属,但相关研究主要限于Zn,Cu,As。杨树是Cd的超富集植物,也是Zn的有效富集植物,Cd在杨树根、叶中的最高含量分别为9 962和514.08 mg·kg-1,Zn在杨树叶片中的最高含量约为2 120 mg·kg-1,目前对杨树富集Pb的方面报道还较少。余国营等(1996)研究发现,Pb在杨树体内的分配表现为叶>根(或根皮);Hu等(2013)等报道Pb主要富集在杨树根部,Pb浓度达到41.62 mg·kg-1。以上报道往往仅从一两个方面对数据进行直观分析,或对单个指标的一般分析,缺少影响因素分析。为了进一步提高分析的全面性、综合性和因果性,本文综合应用了方差分析、综合相关分析、矢量综合相关分析等方法,结合聚类分析和判别分析,多角度、多层次地分析Pb对杨树生长生理指标的胁迫,可反映土壤Pb含量对杨树幼苗的生理生长的影响,揭示生理和生长指标之间的复杂关系。本研究将明确适合杨树生长又能有效吸收Pb的土壤Pb浓度阈值,分析杨树幼苗各部分的Pb富集作用及转移系数,为利用杨树进行环境修复提供一定的科学数据参考。
1 材料与方法 1.1 试验材料与处理2月下旬在南阳市白河岸边剪取3周龄加拿大杨(Populus canadensis)10 cm长枝条(粗端直径0.8~1 cm),扦插于南阳师范学院花房温室沙堆内,4月上旬将15 cm高的扦插成活苗取出,用自来水、纯净水多次冲洗后,作为试验材料。
Pb胁迫处理:在高约50 cm、直径30 cm的塑料桶中,装入10 kg干土(黄棕壤土,pH值6.5,Pb本底含量45 mg·kg-1,取自南阳市郊的农田土壤),根据干土质量,依据土壤环境质量标准GB 15615—l995,结合当地重金属高度污染区的实际情况(张征田等,2009),按照大跨度、多梯度、高污染的原则,设置5个Pb胁迫处理,向土壤中添加纯Pb2+[用Pb(CH3COOH)2·3H2O配制,AR],分别设置为:45 mg·kg-1(CK)(1组,即对照组,仅含土壤本底Pb)、545 mg·kg-1(2组,添加Pb 500 mg·kg-1)、1 045 mg·kg-1(3组,添加Pb 1 000 mg·kg-1)、2 045 mg·kg-1(4组,添加Pb 2 000 mg·kg-1)、3 045 mg·kg-1(5组,添加Pb 3 000 mg·kg-1)。将上述5个处理的土壤(即4个试验组)静置1周后,植入杨树幼苗,每桶5株,待植株成活后每桶保留3株并移到室外(当地杨树苗圃密度为50~70株·m-2,保留3株相当于密度为42株·m-2,稍低于苗圃密度,有利于幼苗生长)。试验桶放置于南阳师范学院花房院内。晴天接受自然光照,雨天移至遮雨棚内避雨,每周补充纯净水1次,使土壤湿度基本保持适宜(70%~80%)下。每个处理重复3次(3桶)。栽植50天后测定各项生理指标。
1.2 测定指标及方法测定的生长指标包括杨树幼苗的生物量和株高,生理指标包括叶绿素含量(mg·g-1)、净光合速率(Pn)(μmol·s-1m-2)以及过氧化物酶(POD)活力(U·g-1)、超氧化物歧化酶(SOD)活力(U·g-1min-1)、过氧化氢酶(CAT)活力(mgH2O2·g-1min-1)和丙二醛(MDA)含量(μmol·g-1)。
叶绿素含量、Pn反映杨树幼苗的生理状态,数值越大表示生长越好,本文称为正生理指标。SOD、POD、CAT和MDA反映受胁迫程度,数值越高表明苗木受胁迫越严重,本文称为负生理指标。
1)生物量及株高的测定 生物量的测定:于当年9月下旬起苗后,将根、茎、叶分别用自来水冲洗后,再用蒸馏水冲洗3遍,沥去水分,在120 ℃条件下烘至恒质量,各部分干质量的和即为单株生物量,每桶以3株平均值作每样本(每桶)的测量值,3桶的值为每处理组的3个样本观察值。以下各指标与此相同。植株高度测量:杨树幼苗植株采收后,即时直尺测量,求3株平均值。
2)叶绿素含量和Pn的测定 叶绿素含量测定用浸提法(刘萍等,2009)。Pn测定用TPS-1便携式光合仪(英国PP syetems 公司),幼苗于Pb污染土壤中生长50天后,每天上午10:00左右测定中上部未受害的正常叶片的Pn,连续测定3天,每处理重复测定5个叶片,求平均值。
3)生理指标的测定 幼苗于Pb污染土壤中生长50天后,每株中部采集1~2个叶片,进行生理指标测定(刘萍等,2009;张志良等,2003):CAT活性采用高锰酸滴定法测定,POD活性采用愈创木酚法测定,SOD活性采用淡蓝四唑(NBT)光还原法测定,MDA含量采用硫代巴比妥酸(TBA)法测定。
4)Pb含量测定 起苗后将杨树根、茎、叶分别用自来水冲洗后,再用蒸馏水冲洗3遍,沥去水分,120 ℃下烘至恒质量。将烘干后的植物磨碎,过筛(筛孔为1.4 mm),然后每种样品称取0.2 g,加HNO3-H2O2(4:1)消化、定容、保存。用原子吸收分光光度计(美国AAS-400型原子吸收分光光度计)测定样品中Pb含量。
1.3 统计处理1)方差分析 对每个观察指标在不同组别上进行方差分析,并进行LSD多重比较。
2)综合相关分析和矢量综合相关分析 在相同试验条件下(即同一试验组内)的2个指标组间进行相关分析,即综合相关分析,具体方法见文献(杜瑞卿等,2009)。在多个试验组上2个指标组间进行相关分析,即矢量综合相关分析。本文为5个试验组。矢量综合相关分析过程如下。
对每个试验组的每个指标组进行主成分分析,取其前3个主成分。
对负生理指标组(X1,X2, X3,X4分别表示POD活力、SOD活力、CAT活力和MDA含量),有:
| $\begin{array}{l}{F_{i1}} = {a_{i11}}{X_1} + {a_{i12}}{X_2} + {a_{i13}}{X_3} + {a_{i14}}{X_4} + {b_1}, \\{F_{i2}} = {a_{i21}}{X_1} + {a_{i22}}{X_2} + {a_{i23}}{X_3} + {a_{i24}}{X_4} + {b_2}, \\{F_{i3}} = {a_{i31}}{X_1} + {a_{i32}}{X_2} + {a_{i33}}{X_3} + {a_{i34}}{X_4} + {b_3}.\end{array}$ | (1) |
式中,i=1, 2, 3, 4, 5, 表示试验组别编号,下同。
将Fi1,Fi2,Fi3按方差贡献率比例合成一个矢量Fi,并求和:
| $F = \sum\limits_{i = 1}^5 {{F_i}} $ | (2) |
对于正生理指标组(X5,X6,分别表示叶绿素含量、净光合速率(Pn)),有:
| $\begin{array}{l}{D_{i1}} = {h_{i11}}{X_5} + {h_{i12}}{X_6} + {g_1}, \\{D_{i2}} = {h_{i21}}{X_5} + {h_{i22}}{X_6} + {g_2}, \\{D_{i3}} = {h_{i31}}{X_5} + {h_{i32}}{X_6} + {g_3}.\end{array}$ | (3) |
将Di1、Di2、Di3按方差贡献率比例合成一个矢量Di,并求和:
| $D = \sum\limits_{i = 1}^5 {{D_i}} $ | (4) |
对于生长指标组(X7,X8分别表示生物量和株高),有:
| $\begin{array}{l}{G_{i1}} = {k_{i11}}{X_7} + {k_{i12}}{X_8} + {m_1}, \\{G_{i2}} = {k_{i21}}{X_7} + {k_{i22}}{X_8} + {m_2}, \\{G_{i3}} = {k_{i31}}{X_7} + {k_{i32}}{X_8} + {m_3}.\end{array}$ | (5) |
将Gi1,Gi2,Gi3按方差贡献率比例合成一个矢量Gi,并求和:
| $G = \sum\limits_{i = 1}^5 {{G_i}} $ | (6) |
Fi,Di,Gi两两组成同一试验组内的综合相关系数,F,D,G两两组成所有试验组上的矢量综合相关系数。
3)聚类分析和判别分析 依据杨树幼苗8个生理生长指标,对5个试验组进行判别分析,分析5个试验组在8个生理生长指标上的综合差异及试验组设置的意义。
依据杨树幼苗8个生理生长指标,对5个试验组先聚类,再进行判别分析,将5个试验组按土壤Pb含量分为低含量组、中含量组和高含量组,分析高含量组的界限。
4)转移系数(transfer coefficient,TF)TF=G/Cs,式中,G为植物中Pb含量(mg·kg-1),Cs为土壤中Pb含量(mg·kg-1)。
利用统计软件SPSS 17.0和编程软件MATLAB 7.0进行上述分析运算。
2 结果与分析 2.1 Pb胁迫对杨树幼苗生长指标的影响从图 1a,b可看出,随着土壤Pb含量升高,杨树幼苗生物量和株高呈下降趋势,特别是当土壤Pb含量大于1 045 mg·kg-1后,2个指标下降显著。与对照组相比,在Pb含量为2 045和3 045 mg·kg-1时,植株高度分别下降了8.5%和37.9%,生物量分别下降了22.2%和32.3%。
 |
图 1 各试验组杨树幼苗的株高、生物量
Fig. 1 Plant height, biomass of poplar seedlings in each experimental group
图中不同试验组间含有相同字母的表示无显著差异,否则为有显著差异。下同。 The average number compared to the same row, the same letters indicate no significant difference,and vice versa. The same below. |
方差分析表明,生长指标在各组间有极显著差异(P<0.000 1)。株高各组间相互比较(LSD)(图 1a)结果表明,除组1和组2间及组2和组3间无显著差异外,其他各组间都有显著差异。生物量各组间相互比较(LSD比较)(图 1b)结果表明,除组2和组3间无显著差异外,其他各组间都有显著差异。
结果表明,土壤Pb含量低于1 045 mg·kg-1时,Pb含量增加引起杨树生长减少,但减幅较缓,相邻组间无显著差异;但Pb含量等于高于1 045 mg·kg-1时,杨树生长受到显著影响,并随着土壤Pb含量的大幅升高,杨树幼苗生长受到极为显著的抑制。
2.2 Pb胁迫对杨树幼苗生理活动的影响从图 2a,b可看出,随着土壤Pb含量升高,杨树幼苗叶片叶绿素含量和Pn均呈下降趋势,与对照相比,Pb含量在545,1 045,2 045,3 045 mg·kg-1时,叶绿素含量分别下降了7.83%,22.23%,36.33%,40.25%,Pn分别下降了4.98%,6.20%,32.86%,57.23%。
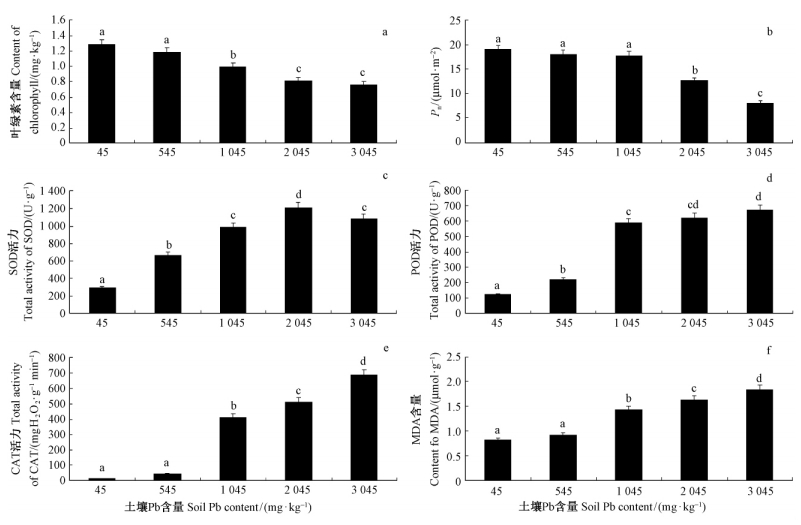 |
图 2 各试验组杨树幼苗的叶绿素含量、Pn及SOD,POD,CAT活力和MDA含量 Fig. 2 Chloyophyll content,Pn, activity of SOD,POD,CAT and MDA content in different groups |
保护酶SOD、POD、CAT活力与植物的抗性强弱有密切关系。从图 5—8可看出,随着土壤Pb含量的升高,杨树幼苗保护酶SOD、POD、CAT活性和MDA呈上升趋势。其中,在Pb含量为2 045 mg·kg-1时,SOD活性达到最高点,是对照的4.11倍;在Pb含量为3 045 mg·kg-1时,POD、CAT活性、MDA含量达到最高,分别是对照的5.4,56,2.24倍,说明在土壤Pb含量达1 045 mg·kg-1以上时,细胞膜系统受到了严重伤害。
方差分析表明,叶绿素含量、Pn、SOD、POD、CAT、MDA在试验组间存在极显著差异(P<0.000 1)。各组间的相互比较(LSD)(图 2a)结果表明:对于叶绿素含量(图 2a),除组1和组2之间及组4和组5之间无显著差异外,其他各组间都有显著差异;对于Pn(图 2b),除组1、组2和组3间无显著差异外,其他各组间都有显著差异;对于SOD(图 2c),除组3和组5之间无显著差异外,其他各组间都有显著差异;POD(图 2d),除组3和组4之间、组4和组5之间无显著差异外,其他各组间都有显著差异;对于CAT(图 2e),除组1和组2之间无显著差异外,其他各组间都有显著差异;对于MDA(图 2f),除组1和组2之间无显著差异外,其他各组间都有显著差异。
生长指标组与正生理指标组的多重比较结果基本相同,说明杨树幼苗的生长指标与正生理指标在各试验组上的变化基本一致。
2.3 生长指标与生理指标间的直接相关分析和综合相关分析一般相关分析均指2个指标间的直接相关分析。杨树幼苗的生长指标、正生理指标、负生理指标各指标之间的直接相关系数在各试验组上绝大部分没有显著性,而且变化没有规律或趋势,无实际意义,所以文中省略。所有试验组指标的直接相关系数见表 1,2。
|
|
|
|
表 1和表 2表明,生长指标与正生理指标之间呈极显著正相关,与负生理指标之间呈显著或极显著负相关,说明随着土壤Pb含量的增大,杨树幼苗叶片叶绿素含量和Pn显著下降,SOD等保护酶和MDA含量显著增加,幼苗生长减弱,生物量和株高减小。
表 3表明,在土壤Pb 含量不高于1 045 mg·kg-1时,生长指标组与正生理指标组存在显著的综合相关系数;土壤Pb含量从545 mg·kg-1到2 045 mg·kg-1时,生长指标组与负生理指标组存在显著的综合负相关系数。综合相关系数的生物学意义与直接相关系数变化一致。
|
|
直接相关和综合相关分析结果与方差分析结果在生物学意义上具有一致性,说明杨树幼苗正生理指标能促进幼苗的生长,负生理指标能抑制幼苗的生长。
2.4 试验组判别分析依据杨树幼苗生理生长的8个指标,对5个试验组进行判别,结果表明,各指标在5个试验组间均有极显著差异(P<0.001),判别函数具有极显著性(P<0.01),各组正确判别率为100%,各组间距离较远,界限清楚(图 3a)。这说明5个试验组的设置是有意义的,杨树幼苗生理生长指标在各组间存在综合的显著差异。
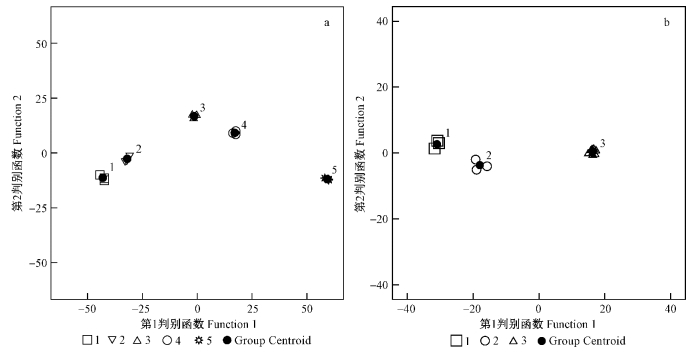 |
图 3 杨树幼苗8个生理生长指标在5个试验组(a)和3个类别上(b)的的判别分析 Fig. 3 Eight physiological growth indices in discriminant analysis of 5 groups and 3 categories for poplar seedlings |
依据杨树幼苗生理生长8个指标,对5个试验组进行聚类,再判别分析,结果表明,5个试验组依Pb含量可分为3大类别,即低(组1,即对照组)、中(组2)、高(组3,组4和组5)3类,各指标在3个类别间均有显著或极显著差异(P<0.05或P<0.01),判别函数极显著(P<0.01),各类别正确判别率为100%,各类别间距离较远,界限清楚(图 3b)。
2.5 杨树幼苗体内Pb的富集Pb在杨树幼苗体内富集情况见表 4。
|
|
从表 4可以看出,随着土壤Pb含量的升高,杨树幼苗的根、茎、叶对Pb的吸收量也随之升高,特别是当Pb浓度等于高于1 045 mg·kg-1时,根对Pb的吸收均远高于茎、叶对Pb的吸收。根是Pb最主要的吸收部位,叶片对Pb的吸收量在各种Pb浓度下均为最低。在各试验组中,根的转移系数也大于茎、叶的转移系数,也充分说明根是Pb最主要的吸收部位。除对照组外,土壤Pb含量为1 045 mg·kg-1时转移系数最大,吸收量是对照组的3.57倍,在本研究中有重要的临界值意义。
3 结论与讨论 3.1 讨论重金属离子Cd2+、Pb2+等均可使植物的叶绿素含量明显降低,叶绿体超微结构改变(李大辉等,1999),出现叶绿体收缩或类囊体膨胀、基粒垛叠结构解体、基质减少,质体小球大量增多等现象(李荣春,2000)。重金属离子直接干扰叶绿素的生物合成,引起了叶绿素酶活性的升高,从而使叶绿素降解加快,叶绿素含量明显降低(邱永祥等,2006)。叶绿素含量降低可能是引起光合速率下降的原因之一,此外,Pd等重金属离子可替代叶绿素的中心Mg离子,从而破坏光合作用,也是其中的重要机制之一(谷绪环等,2008;万雪琴等,2008)。本研究也表明,随着土壤Pb含量升高,幼苗叶绿素含量、Pn逐渐降低,特别是当土壤Pb含量等于高于1 045 mg·kg-1时,二者减小幅度较大。
在正常情况下,细胞内自由基的产生和清除处于动态平衡状态,自由基水平很低,不会伤害细胞。在逆境胁迫下,植物细胞中活性氧的积累,将会导致细胞膜系统损伤和细胞伤害乃至死亡(贾夏等,2012)。氧自由基的清除剂可分为酶促和非酶促2大类,其中酶促系统主要有SOD、POD和CAT等。植物体内SOD、POD和CAT协同构成抗氧化保护酶系统,可以消除在逆境条件下植物体内增加的O2-、-OH等自由基,解除或减轻植物受伤害程度。其中,SOD是植物体通过催化O2-转化为O2和H2O2,POD和CAT将H2O2转化为O2和H2O,以消除自由基的危害(周芙蓉等,2013),此种Pb胁迫下植物体内SOD、POD和CAT含量增多的现象,是一种植物抗胁迫自我保护机制。本研究证实,随着土壤Pb含量升高,杨树幼苗体内3大保护酶SOD、POD、CAT活性均呈上升趋势,尤其在Pb含量达1 045 mg·kg-1以上时,细胞膜系统受到了严重伤害。
植物组织在遭受氧化胁迫下,自由基作用于脂质发生过氧化反应,氧化终产物为MDA。MDA会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性,其含量高低是反映细胞质膜过氧化程度的一个重要指标(孙文越等,2001)。本研究发现,当土壤Pb含量等于高于1 045 mg·kg-1时,杨树幼苗的MDA含量显著增高,提示胁迫伤害加重,这与周芙蓉(2013)的研究结果基本相同。
本研究表明,根是吸收Pb的最主要部位,除对照组外,土壤Pb含量为1 045 mg·kg-1时转移系数最大,吸收量是对照组的3.57倍,这与林晓倩等(2013)的研究结果很相似。土壤Pb含量<1 045 mg·kg-1时,杨树幼苗保护酶系统指标值在各试验组存在差异,具有很强的响应保护能力,从而保护了杨树幼苗进行正常的生理生长活动,受Pb影响较小。但是当土壤Pb含量≥1 045 mg·kg时,杨树幼苗自身抵抗Pb胁迫的保护应急能力开始下降,不能有效保护杨树幼苗正常的生理和生长活动,使得生长指标值和正生理指标值在各试验组上出现了显著差异。这与秦普丰等(2000)、谷绪环等(2008)的研究结果很相似。
依据杨树幼苗8个生理和生长指标对5个试验组的判别分析表明,各试验组间有显著差别,试验组的设置是有意义的。同样,依据上述指标,对5个试验组的聚类和判别分析表明,当土壤Pb含量≥1 045 mg·kg-1时为高含量组,高含量组各组杨树幼苗的生理和生长指标变化具有共同特征(具有同类性)。
3.2 结论随着土壤Pb浓度的升高,杨树幼苗的生物量、株高、叶绿素含量、Pn随之降低,但SOD、POD、CAT和MDA则随之升高。土壤Pb含量为1 045 mg·kg-1具有重要的临界值意义:当土壤Pb<1 045 mg·kg-1时,杨树幼苗可通过自身的抗胁迫响应能力基本能保持正常生长,并保持较高的转移系数;当土壤Pb≥1 045 mg·kg-1,杨树幼苗会受到严重胁迫,不能很好生长,同时也不能保持较高的转移系数。根是吸收Pb最主要的部位。
杨树幼苗生长变化受到生理变化的显著影响:生长指标组(生物量和株高)与正生理指标组(叶绿素含量、净光合速率Pn)呈显著或极显著正相关,与负生理指标组(SOD、POD、CAT和MDA)呈显著或极显著负相关。正生理指标与负生理指标间呈显著负相关。叶绿素含量、Pn高表示生理旺盛,利于生长,SOD、POD、CAT和MDA高表示受胁迫严重,生长受到抑制。
方差分析、综合相关分析、判别分析等多种统计方法的有机结合,能从不同方面,不同层次很好地揭示杨树幼苗生长与生理指标的内在复杂关系以及生长、生理指标与土壤Pb浓度的复杂关系。
| [1] |
杜瑞卿,武福华,王庆林,等.2009.松突圆蚧数量、环境因子及马尾松受危害程度三者间的相关性分析.昆虫学报,52(5):544-550. (Du R Q,Wu F H,Wang Q L,et al.2009.Correlation analysis of population size of Hemiberlesia pitysophila(Homoptera:Diaspididae),environmental factors and the hazard degree of masson pine. Acta Entomologica Sinica,52(5):544-550[in Chinese]).(  1) 1)
|
| [2] |
谷绪环,金春文,王永章,等.2008.重金属Pb与Cd对苹果幼苗叶绿素含量和光合特性的影响.安徽农业科学,36(24):10328-10331. (Gu X H,Jin C W,WangY Z E, et al.2008.Effects of heavy metal Pb and Cd on chlorophyll contents and photosynthetic characteristics in different apple seedlings.Journal of Anhui Agri Sci,36(24):10328-10331[in Chinese]).(  2) 2)
|
| [3] |
贾夏,周春娟,董岁明.2012.低含量Pb2+对Cd2+污染下冬小麦幼苗根系过氧化物同工酶的影响.西北农林科技大学学报:自然科学版,40(2):157-162. (Jia X,Zhou C J,Dong S M.2012.Effects of the low dose of Pb2+ on the response of isozymes of POD of winter wheat seedlings roots to Cd2+ stress. Journal of Northwest A&F University:Nat Sci Ed, 40(2):157-162[in Chinese]).(  1) 1)
|
| [4] |
李金花,何燕,段建平,等.2012.107杨对土壤重金属的吸收和富集.林业科学研究,25(1):65-70.( 1) 1)
|
| [5] |
Li J H,He Y,Duan J P, et al.2012.Absorption and accumulation of heavy metal from soil by leaves of Populus×euramericana cv.'Neva'plantation.Forest Research, 25(1):65-70.[in Chinese])( 1) 1)
|
| [6] |
李大辉,施国新.1999.Cd2+或Hg2+水污染对菱体细胞的细胞核及叶片超微结构的影响.植物资源与环境,8(2):43-48. (Li D H,Shi G X.1999.Effects of Cd2+ or Hg2+ water pollution on the ultrastructure of nuclei and chloroplasts in somatic cells of Trapa bicornis Osbeck. Journal of Plant Resources and Environment, 8(2):43-48[in Chinese]).(  1) 1)
|
| [7] |
李荣春.2000.Cd、Pb及其复合污染对烤烟叶片生理化信细胞亚显微结构的影响.植物生态学报,24(2):238-242. (Li R C.2000.Effects of cadmium and lead on physiological and ultra-structural features in tobacco leaves. Aeta Phytoecologica Siniea,24(2):238-242[in Chinese]).(  1) 1)
|
| [8] |
林晓倩,张健,杨万勤,等.2013.3种土壤类型下铅胁迫对巨桉幼苗的影响.林业科学,49(1):1-6. (Lin X Q,Zhang J,Yang W Q, et al.2013.Effects of Pb stress on Eucalyptus grandis seedlings in three types of soil. Scientia Silvae Sinicae, 49(1):1-6[in Chinese]).(  2) 2)
|
| [9] |
刘萍,李明军.2009.植物生理学实验技术.北京:科学出版社,41-42;125-127. (Liu P,Li M J.2009. Experimental Technology of Plant Physiology.Beijing:Science Press, 41-42;125-127.[in Chinese])(  2) 2)
|
| [10] |
刘艳丽,吴凤霞,徐莹,等.2012.杨树修复重金属污染土壤的研究进展.林业科学, 48(9):139-144. (Liu Y L,Wu F X,Xu Y, et al.2012.Research progress in the remediation of heavy metal contaminated soils with Populus.Scientia Silvae Sinicae, 48(9):139-144[in Chinese]).(  1) 1)
|
| [11] |
秦普丰,铁柏清,周细红,等.2000.铅与镉对棉花和水稻萌发及生长的影响.湖南农业大学报,26(3):205-207. (Qin P F,Tie B Q, Zhou X H, et al.2000. Effects of cadmium and lead in soil on the germination and growth of rice and cotton.Journal of Hunan Agricultural University, 26(3):205-207[in Chinese]).(  1) 1)
|
| [12] |
邱永祥,蔡南通,吴秋云,等.2006.铅对叶菜用甘薯根系生长及植株光合作用的影响.浙江农业学报,18(6):429-432. (Qiu Y X, Cai N T, Wu Q Y, et al.2006. Effects of Pb on root growth and plant photosynthesis of sweetpotato. Acta Agriculturae Zhejiangensis,18(6):429-432[in Chinese]).(  1) 1)
|
| [13] |
孙文越,王辉,黄久常.2001.外源甜菜碱对干旱胁迫下小麦幼苗膜脂过氧化作用的影响.西北植物学报,21(3):487-491. (Sun W Y,Wang H, Huang J C.2001.The effect of external betaine on membrane lipidperoxidation of wheat seedling under water stress. Acta Botanica Boreali-occidentalia Sinica,21(3):487-491[in Chinese]).(  1) 1)
|
| [14] |
万雪琴,张帆,夏新莉,等.2008.镉处理对杨树光合作用及叶绿素荧光参数的影响.林业科学,44(6):73-78. (Wan X Q, Zhang F, Xia X L, et al.2008. Effects of cadmium on photosynthesis and chlorophyll fluorescence parameters of solution-cultured poplar plants. Scientia Silvae Sinicae, 44(6):73-78[in Chinese]).(  1) 1)
|
| [15] |
王新,贾永锋.2007.杨树、落叶松对土壤重金属的吸收及修复研究.生态环境,16(2):432-436. (Wang X,Jia Y F.2007.Study on absorption and remediation by poplar and larch in the soil contaminated with heavy metals.Ecology and Environment, 16(2):432-436[in Chinese]).(  1) 1)
|
| [16] |
韦朝阳,陈同斌.2001.重金属超富集植物及植物修复技术研究进展.生态学报,21(7):1196-1203. (Wei C Y,Chen T B.2001.Hyperaccumulators and phytoremediation of heavy metal contaminated soil:a review of studies in China and abroad. Acta Ecologica Sinica,21(7):1196-1203[in Chinese]).(  1) 1)
|
| [17] |
余国营,吴燕玉,王新.1996.杨树落叶前后重金属元素内外迁移循环规律研究.应用生态学报,7(2):201-206. (Yu G Y, Wu Y Y,Wang X.1996.Transferring and cycling of heavy metals in and out of poplar tree before and after its leaf fallen. Chinese Journal of Applied Ecology, 7(2):201-206[in Chinese]).(  1) 1)
|
| [18] |
张东为,崔建国,戈素芬,等.2008.土壤镉污染对不同品种杨树生长状况的影响.水土保持通报,28(3):59-63. (Zhang D W, Cui J G, Ge S F, et al.2008. Effect of Cd contamination in soil on growth of poplar of different varieties.Bulletin of Soil and Water Conservation,28(3):59-63[in Chinese]).(  1) 1)
|
| [19] |
张征田,夏敏,彭宇,等.2009.河南南阳不同生境土壤重金属含量及其对拟水狼蛛生物学特性的影响.昆虫学报,52(9):994-999. (Zhang Z T, Xia M, Peng Y, et al.2009. Heavy metal levels in soil and their effects on biological characteristics of Pirata subpiraticus (Araneae:Lycosidae) in different habitats in Nanyang,Henan.Acta Entomologica Sinica, 52(9):994-999[in Chinese]).(  1) 1)
|
| [20] |
张志良,瞿伟菁.2003.植物生理学实验指导.北京:高等教育出版社,123-124;268-269;274-276. (Zhang Z L,Qu W J.2003. Experimental guide of plant physiology.Beijing:Higher Education Press, 123-124;268-269;274-276.[in Chinese])(  1) 1)
|
| [21] |
周芙蓉,王进鑫,杨楠,等.2013.干旱和铅交互作用对侧柏幼苗生长及抗氧化酶活性的影响.林业科学,49(6):172-177. (Zhou F R,Wang J X,Yang N, et al.2013.Interaction of drought and Pb on growth and antioxidant enzyme activities of Platycladus orientalis seedlings. Scientia Silvae Sinicae,49(6):172-177[in Chinese]).(  2) 2)
|
| [22] |
Giuseppe B,Giuseppe L C,Attilio T,et al.2013.Heavy metal content in ash of energy crops growing in sewage-contaminated natural wetlands:Potential applications in agriculture and forestry.Science of the Total Environment, 50(8):452-453;349-354.( 1) 1)
|
| [23] |
Gu J G,Qi L W,Jiang W S,et al.2007.Cadmium accumulation and its effects on growth and gas exchange in four populus cultivars.Acta Biologica Cracoviensia(Series Botanica),49(2):7-14.( 1) 1)
|
| [24] |
Hu Y H, Nan Z R, Su J Q, et al.2013.Heavy metal accumulation by poplar in calcareous soil with various degrees of multi-metal contamination:Implications for phytoextraction and phytostabilization. Environ Sci Pollut Res,20:7194-7203.( 1) 1)
|
| [25] |
Jensen J K,Holm P E,Nejrup J,et al.2009.The potential of willow for remediation of heavy metal polluted calcareous urban soils.Environmental Pollution,157:931-937.( 1) 1)
|
| [26] |
Lonardo S D,Capuana M, Arnetoli M,et al.2011. Exploring the metal phytoremediation potential of three Populus alba L. clones using an in vitro screening. Environmental Science and Pollution Research,18(1):82-90.( 2) 2)
|
| [27] |
Pulford I D,Watson C.2003.Phytoremediation of heavy metal-contaminated land by trees-a review. Environment International,29:529-540.( 1) 1)
|
| [28] | Tlustoš P,Pavlíková D,Száková J,et al.2006.Exploitation of fast growing trees in metal remediation//Mackova M,Dowling D, Macek T.Phytoremediation Rhizoremediation.Germany:Springer,83-102. |
| [29] |
Zacchini M,Pietrini F,Scarascia M G,et al.2009.Metal tolerance,accumulation and translocation in poplar and willow clones treated with cadmium in hydroponics.Water Air and Soil Pollution,197(1-4):23-34.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

