文章信息
- 赵力, 李慧琪, 朱耿平, 蔡波, 李敏, 刘强
- Zhao Li, Li Huiqi, Zhu Gengping, Cai Bo, Li Min, Liu Qiang
- 入侵害虫椰子木蛾(鳞翅目:木蛾科)在我国的潜在分布
- Potential Geographical Distribution of the Introduced Opisina arenosella (Lepidoptera: Xylorictidae) in China
- 林业科学, 2015, 51(10): 93-100
- Scientia Silvae Sinicae, 2015, 51(10): 93-100.
- DOI: 10.11707/j.1001-7488.20151012
-
文章历史
- 收稿日期:2014-12-03
- 修回日期:2015-08-18
-
作者相关文章
2. 天津师范大学生命科学学院 天津 300387;
3. 海南出入境检验检疫局热带植物隔离检疫中心 海口 570311
2. College of Life Sciences, Tianjin Normal University Tianjin 300387;
3. Post-Entry Quarantine Station for Tropical Plant, Hainan Entry-Exit Inspection and Quarantine Bureau Haikou 570311
椰子木蛾(Opisina arenosella)(异名Nephantis serinopa),中文别名椰子织蛾、椰蛀蛾,隶属于鳞翅目(Lepidoptera)木蛾科(Xyloryctidae)椰木蛾属(Opisina),原产于印度南部和斯里兰卡, 1923年传入孟加拉国和缅甸(Howard et al., 2001)。近年来,该物种迅速在东南亚建立种群,相继在泰国、马来西亚、印度尼西亚和新加坡等地发现(吕宝乾,2013; He et al., 2013; 阎伟等,2015)。在印度和斯里兰卡,椰子木蛾是椰子(Cocos nucifera)的主要害虫(Howard et al., 2001; Lever,1969),其幼虫在椰子叶片背面取食,并藏匿于虫粪和吐丝结成的虫道中。与椰心叶甲(Brontispa longissima)取食未展开的心叶不同,椰子木蛾通常从低部位的老叶开始危害,并逐渐向其他叶片扩张。严重时,除顶端少数叶片外的整个树冠均被侵害(Manjanath,1985)。
2013年8月,我国海南省兴隆首次发现椰子木蛾疫情。随后经调查,海南省9个市县、广东中山市及顺德市和广西防城港等多个地区发现椰子木蛾(中华人民共和国国家林业局,2013),局部地区已形成种群。风险分析表明,该种主要入侵南亚和东南亚的热带、亚热带的棕榈科植物种植区,其入侵范围有不断扩大的趋势,在我国属于高度危险性有害生物(阎伟等,2013),常见的寄主植物有: 椰子、糖棕(Borassus flabellifer)、董棕(Caryota urens)、贝叶棕(Corypha umbraculifera)、丝葵(Washingtonia filifera)、海枣(Phoenix dactylifera)、蒲葵(Livistona chinensis)、王棕(Roystonea regia)和大蕉(Musa sapientum)等(Howard et al., 2001; Robinson et al., 2001; 李后魂等,2014)。2014年3月,国家林业局发布公告将椰子木蛾列入全国林业危险性有害生物。由于椰子木蛾入侵我国的时间尚短,国内关于该物种的研究较少。吕宝乾等(2013)综述了国外椰子木蛾的研究情况,并综合分析其入侵我国的风险和后果;阎伟等(2013)对其在我国及海南省的风险性进行了定性和定量分析。此外,自疫情公布以来,陆永跃等(2013)、李后魂等(2014)对其鉴别特征进行了综述,后者还对椰子木蛾的分类地位进行澄清。
对新发现入侵害虫进行潜在分布区的预测是实施监测和控制其扩散蔓延的重要前提和基础。近年来,生态位模型被越来越多地运用在入侵种的潜在分布分析中(朱耿平等,2013)。阎伟等(2015)基于CLIMEX生态位模型首次对椰子木蛾在中国的适生区进行了预测。然而,与CIMEX相比,基于Maxent和GARP等相关性生态位模型(朱耿平等,2013)进行潜在分布模拟更具有优越性(Elith et al., 2006; Phillips et al., 2006)。基于相关性方案的生态位模型就椰子木蛾在我国的生态空间和潜在分布尚未有系统性的研究。生态位保守性是生态位模型运行的重要前提,本研究基于文献资料,首先探讨椰子木蛾入侵过程中的生态位保守型,然后结合其寄主植物椰子在我国的种植区域,利用相关性生态位模型对椰子木蛾在我国的生态空间和潜在分布进行模拟分析,以期为椰子木蛾的风险分析和预防治理提供参考。
1 材料与方法 1.1 分布点和环境变量椰子木蛾的物种分布点主要源于文献记载(李后魂等,2014; Anantanarayanan,1934; Bhanu et al., 2009; Fernando et al., 1997; Gupta et al., 2002; Kanagaratnam et al., 1985; Kumar et al., 2007; Landge et al., 2009; Mohan et al., 2010; Muhammad et al., 2012; Muralimohan et al., 2008a; 2008b; 2008c; Muralimohan et al., 2013;Ramkumar et al., 2006)(图 2)。一些分布记录缺少地理坐标,需要在Google earth中进行转换。这些物种分布点涵盖了椰子木蛾的分布范围,可以对其生态需求和潜在分布进行分析。采样偏差是由于人们在某些地理空间上过度采样,造成物种分布点在生态空间上的重复,进而会影响生态位模型模拟的结果(朱耿平等,2014),作者删除了栅格内重复的物种分布点,来降低采样偏差对生态位模型模拟的影响。环境变量的选择主要参考椰子木蛾生长发育的限制因子。在相对较大的尺度下(分辨率为5 min,相当于9.3 km),本研究选取了最具有生物学意义的7个气候变量(表 1),即年平均气温(BIO1)、昼夜温差月平均值(BIO2)、最热月份最高气温(BIO5)、最冷月份的最低气温(BIO6)、年降水量(BIO12)、最湿月份的湿度(BIO13)、最干月份的湿度(BIO14)。环境变量数据源于Worldclim中心(Hijmans et al., 2005)。
|
|
主成分分析可以降低空间环境变量的维度,分析各环境变量对椰子木蛾地理分布的限制作用,并对各地理种群所占有的生态空间进行比较。本研究采用Broennimann等(2012)所提供的程序来比较椰子木蛾在本土以及我国的气候空间,该程序采用核密度(kernel density)来拟合物种分布点及其所在地理区域所关联的环境变量在主成分第一和第二主成分上的载荷,使用Schoener’ D值来计算生态位的相似性,D值介于0(不重叠)至1(完全重叠)之间(Warren et al., 2008),同时使用生态位稳定度(niche stability)、生态位扩张度(niche expansion)和生态位空缺度(niche unfilling)来量化生态位在各地理种群间的相似程度。研究采用pca_env功能来比较物种分布点及其所在地理区域所关联环境变量在主成分第一和第二主成分上的差别,并采用生态位等价性(niche equivalency)和生态位相似性(niche similarity)测试来探讨椰子木蛾的生态位保守性,前者是比较地理种群间的生态位相似性,后者是测试这种相似性是否由于各地理种群所处的生态空间所差异造成(Warren et al., 2010)。
1.3 生态位模型构建本研究同时采用了Maxent和GARP 2种生态位模型来分析椰子木蛾的潜在分布。Maxent和GARP模型与其他模型软件相比,具有所需样本少和受样本偏差影响小等诸多优点(Pearson et al., 2007; Wisz et al., 2008)。采用75%的物种分布点来构建模型,25%用于模型的检验和校正。本研究采用了Maxent的系统默认值,在模型输出上采用了逻辑(logistic)的形式,Maxent逻辑运算结果应用于可能性大小的输出,适合结果展示(Phillips et al., 2006)。在GARP算法中,GARP随机创建100个重复,基于默认设置,即收敛界限为0.01和最大迭代次数为1 000,并采用Anderson等(2003)的方法选取最佳模型,即在100个重复中选取20个最低遗漏率(omission error)的重复,同时保留中间10个重复,以避免较大的记录错率(commission error),在ArcGIS中对选取的最佳模型(共10个)进行加和叠加,最后得到范围值为0~10的栅格图,即椰子木蛾的预测分布图。
在模拟入侵物种分布时,生态位模型包括将模型构建于物种本土分布地,然后将其转移并投射至另一地理区域,来模拟入侵物种的潜在分布(朱耿平等,2014)。本次研究采用2种方案来构建模型,一种方案是基于椰子木蛾的本土分布范围(印度南部和斯里兰卡)构建模型,然后将其转移至入侵地来评价模型的转移能力和椰子木蛾的潜在分布; 另外一种方案是同时基于椰子木蛾的本土和入侵地的分布来构建模型。在模拟的检验上,采用独立物种分布点的遗漏率和卡方测验评价模型。首先将模型输出的可能性预测转换成二维式预测(即分布/不分布),采用了容忍10%遗漏率的阈值(10% training presence threshold),10%遗漏率的阈值可以相对保守地推测物种的生态需求和潜在分布,然后对基于此阈值成功预测的物种分布点和随机分布相比较进行卡方测验,这种模型评价方案被广泛应用于物种分布范围模拟(Peterson et al., 2011)。
2 结果 2.1 主成分分析主成分分析通过降低空间环境变量的空间维度来比较和分析不同地理种群所占有的生态空间(图 1)。主成分的前2种成分(即PC-1和PC-2)可以解释与物种分布点有关的所有环境变量变化的72.88%(表 1),其中PC-1轴与年降雨量(BIO12)有密切的关系,可以解释所有环境变量变化的45.46%,而PC-2与年平均气温(BIO1)有关,可解释环境变量变化的27.42%(表 1)。与印度本土和斯里兰卡本土种群所占有的生态空间相比,椰子木蛾在中国生态空间的分布沿着PC-1和PC-2轴的方向转移,这种转移表明椰子木蛾在我国所占有的气候生态空间和其本土的气候空间是有差别(图 1)。生态位等价性和相似性测试显示,这种差异是由于本土种群和入侵种群所在的地理空间差异造成的,说明椰子木蛾在入侵过程中其生态位是保守的(图 1)。
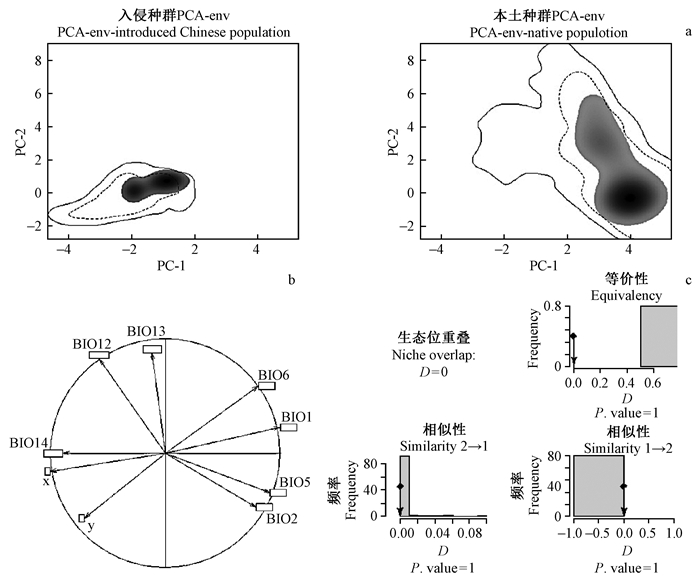 |
图 1 我国椰子木蛾种群和其本土种群的生态空间比较 Fig. 1 Comparisons of the ecological dimensions of the native and introduced Chinese populations a.中国种群和本土种群在第一和第二主成分上的空间分布 The niche of the species along the two first axes of the PCA in the introduced Chinese (left) and native (right) populations; b.气候变量在第一和第二主成分上的贡献 The contribution of climatic variables along the two axes of the PCA; c.生态位等价性和相似性测试,箭头代表真实Schoener’ D,柱状图代表D值的随机分布。The observed niche overlap D between the two ranges (line with a arrow) and simulated niche overlaps (grey bars) on which tests of niche equivalency and niche similarities are calculated (low right panel). |
基于本土范围构建生态位模型,Maxent和GARP软件均能较好地模拟椰子木蛾在入侵地的潜在分布(P<0.05)。基于本土的Maxent模型显示,椰子木蛾在印度西南部大部分区域,以及中部东侧沿海地区的适应性较高(图 2),将Maxent模型投射并转移到入侵地及我国南部后,发现椰子木蛾在东南亚地区具有较大适宜区域,在我国的潜在分布空间集中在广东、广西、福建沿海地区以及海南的大部分地区,广西中部和南部也具有较大的分布可能性。与Maxent相比,GARP在印度本土范围及东南亚的模拟的结果相对自由一些,在我国的模拟相对保守一些,GARP模型显示椰子木蛾在我国的潜在分布空间集中在广东和广西沿海地区以及海南的大部分地区(图 2)。
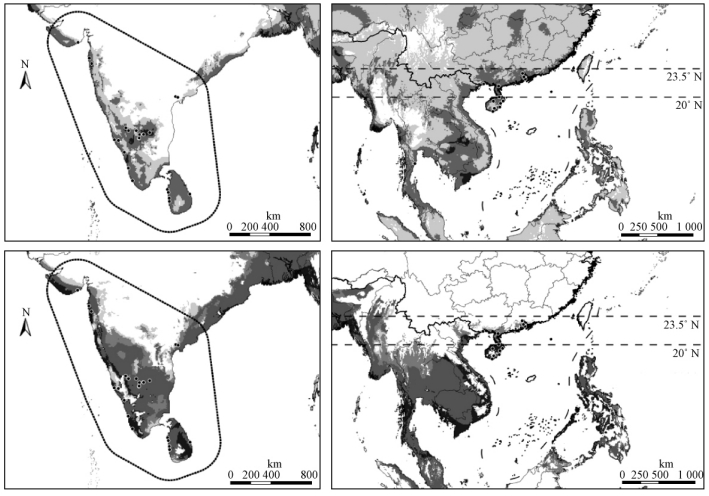 |
图 2 基于椰子木蛾本土范围的Maxent模型(上)和GAPP模型(下)
Fig. 2 Niche model prediction of O. arenosella based on the native area using Maxent (up) and GARP(below)
生态位模型构建于椰子木蛾分布地(左侧),然后将其投射并转移到入侵地(右侧),图中的黑点代表椰子木蛾的分布点,其中,左图中的黑点用于模型的构建,不规则区域为模型的构建区。右图中的黑点用于模型的检验,椰子主要分布在赤道与20° N之间的地区,在20°—23.5° N之间也有分布,深浅色分别代表适生性的高低。 Niche model was calibrated in the native area (left panel) and transferred onto the introduced southern China (right panel), light to dark indicate the low-to-high suitability. The black dots in the left and right panel are occurrence data of O. arenosella. In left panel, black dots indicate the point used to fit niche model in circled areas, whereas the dots in right panel indicate the testing points. The Cocos nucifera were mainly distributed in areas between 0° N and 20° N, but also was planted between 20°N and 23.5° N. |
基于本土和入侵地构建生态位模型,Maxent和GARP软件均能较好地模拟椰子木蛾的潜在分布(P<0.05),但二者的模拟结果差异较大(图 3)。与Maxent相比,GARP所模拟的区域范围较大,主要体现在本土的印度南部地区,以及入侵地孟加拉国、缅甸、泰国等东南亚国家和地区,GARP显示这些地区具有较大的分布可能性,而Maxent在这些地区的预测则相对保守。在我国,海南省的大部分区域、广东和广西的南部、福建东南部的部分区域、台湾的西部等地区均得到了Maxent和GARP的支持,表明椰子木蛾在这些地区具有较大的潜在分布可能性。
 |
图 3 基于椰子木蛾本土和入侵地的Maxent(上)和GARP(下)模型
Fig. 3 Niche model predictions of O. arenosella based on native and introduced areas using Maxent (up panel) and GARP (down panel)
图版中的黑点用于模型的构建,椰子主要分布在赤道与20° N之间的地区,在20°—23.5° N之间也有分布,深浅色分别代表适生性的高低。 Light to dark indicate the low-to-high suitability, black dots indicate points used to fit niche model, the Cocos nucifera was mainly distributed in areas between 0° N and 20° N, but also was planted between 20° N to 23.5° N. |
与椰子木蛾的本土分布地印度和斯里兰卡相比,其在我国的地理分布纬度较高。主成分分析表明椰子木蛾在我国所占有的生态空间和其本土种群的生态空间是有差别的,这种差别主要是现实生态位(realized niche)的差别(Peterson et al., 2011),由椰子木蛾本土种群和入侵种群所在的地理空间本身的差异造成(图 1)。椰子木蛾具有生态空间广、生理耐受性强的入侵特性,在入侵过程中其生态位保守(图 1),这种保守性是生态位模型的重要前提。主成分分析表明,影响椰子木蛾地理分布的重要环境因子是年降雨量、年平均气温以及最干月份的湿度。研究发现,椰子木蛾在高于34 ℃时产卵及存活率较低,在高于38 ℃时不能完成世代的发育(Muralimohan et al., 2013)。在印度,椰子木蛾全年均可繁殖,没有滞育期,由于热带地区气候因素的高异质性,不同气候条件下的椰子木蛾种群数量不同(Ramkumar et al., 2001)。Howard等(2001)认为,椰子木蛾种群与干燥的气候条件关系最紧密,当气温、日照时间以及降雨量增加时,椰子木蛾种群减少(NIIR Board of Consultants & Engineers,2006)。
3.2 模型差别的分析阎伟等(2015)基于CLIMEX软件对椰子木蛾在中国的适生区进行了预测,其结果显示椰子木蛾在适生范围几乎覆盖长江以南大部分区域。CLIMEX软件是基于物种的生理耐受性来推测物种的潜在分布,这种试验机制性的生态位模型与相关性方案的模型相比,不能很好地权衡分布(presence)与不分布(absence),容易产生过度预测(overpredict)的结果。与CLIMEX的结果相比较(阎伟等,2015),基于Maxent和GARP的相关性方案模型的结果相对保守(图 2,3)。Maxent和GARP的生态位模型的差别亦较大,但二者在我国的预测比较一致。Maxent和GARP的预测差异主要在印度南部、斯里兰卡和东南亚地区,这主要是由于二者算法的不同造成的。Maxent基于最大熵值原理来推测物种的生态需求和模拟物种的分布,运算时随着环境变量的录入及迭代次数的增加,熵值增加。在GARP算法中,最优模型的选取以最小遗漏率为标准,而Maxent在遗漏率和记录错率之间能够很好地权衡。
基于本土的模型与同时基于本土和入侵地的模型均能够成功地预测椰子木蛾在我国的潜在分布,但二者在东南亚及菲律宾地区的预测差别较大,这主要是由于模型的构建区域造成的。经典生态位模型构建方案包括模型构建于物种本土分布地,然后将其转移并投射至另一地理区域,模拟入侵物种的潜在分布,这种模型构建方案具有独特优势,这是由于本土分布的物种,其种群一般处于平衡状态。在平衡状态的种群基础上构建生态位模型,其转移能力较高(朱耿平等,2014),但这种模型构建方案有时会需要采取措施来处理超出本土生态空间范围的环境变量(Fitzpatrick et al., 2009)。基于本土和入侵地的模型虽能够克服地理种群间的生态空间不一致性问题,但其模型是构建在入侵种群的非平衡状态基础上,模型的转移能力有时不能够确保(朱耿平等,2014)。
3.3 潜在分布在相对较大的尺度下,昆虫的分布主要受气候因素的影响,而在相对较小的尺度下一般受物种间相互作用的影响比较大(Hortal et al., 2010)。生态位模型可以确定某物种的适宜生态空间,但是未考虑到物种之间的相互作用以及扩散能力(Peterson et al., 2011)。入侵物种能够在其本土范围之外建立种群,与该种物种的种群状态、丰富度、天敌以及人类活动等多种因素相关(Zhu et al., 2012),生态位模型中所显示物种分布可能性虽然高,但是这并不代表该物种在这个地区就有实际分布,在较小的尺度下,椰子木蛾的分布更易受棕榈科寄主植物的影响。生态位模型输出结果与该木蛾在我国的地理分布相符,可为其风险分析提供参考,经调查,海南省万宁市、三亚市、儋州市、保亭县、琼海市、文昌市、海口市,广东省珠海市、湛江市遂溪县、中山市、佛山市顺德区,广西省防城港市港口区、东兴市发现椰子木蛾(中华人民共和国国家林业局,2013)。
从适生性角度看,椰子木蛾在我国的潜在分布集中在广东、广西、福建沿海地区以及海南的大部分地区,广西中部和南部也具有较大的分布可能性,这些沿海地区贸易频繁,容易助长入侵物种的扩散。Maxent和GARP生态位模型均显示出在20° N以南以及20°—23.5° N之间具有较大的潜在分布的可能性,这同时是椰子的分布范围。在北半球,椰子主要分布在赤道20°N以内的地区,在20°—23.5° N之间也有分布(张慧坚,2002),椰子木蛾的其他寄主(棕榈科植物)也多在该地区分布,这种分布格局及人类活动为椰子木蛾的扩散创造了条件。我国与东盟国家贸易频繁,给椰子木蛾入侵我国提供了途径,在上述适宜地区扩散的可能性较大。因此,开展虫情调查,采取应对措施可有效防止椰子木蛾在适宜地区的进一步扩散,同时应对来自椰子木蛾疫区的棕榈植物及繁殖材料进行严格检疫,以防止椰子木蛾的二次入侵。
| [1] |
李后魂,尹艾荟,蔡 波,等. 2014. 重要入侵害虫--椰子木蛾的分类地位和形态特征研究. 应用昆虫学报,51 (1) : 283-291. (Li H H,Yin A H,Cai B,et al. 2014. Taxonomic status and morphology of the invasive alien species Opisina areanosella Walker (Lepidoptera: Xyloryctidae). Chinese Journal of Applied Entomology, 51 (1) : 283-291[in Chinese]).(  3) 3)
|
| [2] |
陆永跃,王 敏. 2013. 椰子织蛾的形态特征识别. 环境昆虫学报,35 (6) : 838-842. (Lu Y Y,Wang M. 2013. Morphology of the coconut caterpillar Opisina arenoseua Walker. Journal of Environmental Entomology,35 (6) : 838-842[in Chinese]).(  1) 1)
|
| [3] |
吕宝乾,严 珍,金启安,等. 2013. 警惕椰子织蛾Opisina arenosella Walker(鳞翅目: 织蛾科)传入中国.生物安全学报,22 (1) : 17-22. (Lü B Q,Yan Z,Jin Q A,et al. 2013.Exotic pest alert: Opisina arenosella (Lepidoptera: Oecophoridae). Journal of Biosafety,22 (1) : 17-22[in Chinese]).(  2) 2)
|
| [4] |
阎 伟,刘 丽,李朝续,等.2015.椰子木蛾在中国的适生区预测.应用昆虫学报,52(2):454-450. (Yan W, Liu L, Li C, et al. 2015. Prediction of suitable habitat for the coconut black-headed caterpillar, Poisina arenosella (Walker) in China. Chinese Journal of Applied Entomology, 52(2): 454-460[in Chinese]).(  4) 4)
|
| [5] |
张慧坚. 2002. 世界与中国的椰子业. 热带农业科学,22 (3) : 41-45. (Zhang H J. 2002. The coconut industry in China and the world. Chinese Journal of Tropical Argicultural,22 (3) : 41-45[in Chinese]).(  1) 1)
|
| [6] |
中华人民共和国国家林业局. 2013.林业有害生物警示通报. 警示通报[2014] 1号. (The State Forestry Administration of the People's Republic of China. 2013. The warning bulletin of the forestry harmful biology. The Warming Bulletin[2014] No.1.[in Chinese])(  2) 2)
|
| [7] |
朱耿平,刘国卿,卜文俊,等. 2013. 生态位模型的基本原理及其在生物多样性保护中的应用. 生物多样性,21 (1) : 90-98. (Zhu G P,Liu G Q,Bu W J, et al. 2013. Ecological niche modeling and its applications in biodiversity conservation. Biodiversity Science,21 (1) : 90-98[in Chinese]).(  2) 2)
|
| [8] |
朱耿平,刘 强,高玉葆. 2014. 提高生态位模型转移能力来模拟入侵物种的潜在分布. 生物多样性,22 (2) : 223-230. (Zhu G P,Liu Q,Gao Y B. 2014. Improving ecological niche model transferability to predict the potential distribution of invasive exotic species. Biodiversity Science,22 (2) : 223-230[in Chinese]).(  4) 4)
|
| [9] |
Anantanarayanan K P. 1934. On the bionomics of a Eulophid (Trichospilus pupivora,Ferr.) a natural enemy of the Coconut Caterpiliar (Nephantis serinopa Meyr.) in South India. Bulletin of Entomological Research,25 (1) : 55-61.( 1) 1)
|
| [10] |
Anderson R P,Lew D,Peterson A T. 2003. Evaluating predictive models of species' distributions: criteria for selecting optimal models. Ecological Modelling,162 (3) : 211-232.( 1) 1)
|
| [11] |
Bhanu K R M,Hall D R,Mathew T,et al. 2009. Female sex pheromone of coconut black headed caterpillar,Opisina arenosella Walker (Lepidoptera: Oecophoridae). 25th Annual Meeting. International Society of Chemical Ecology,Neuchatel,August 23-27,160.( 1) 1)
|
| [12] |
Broennimann O, Fitzpatrick M C, Bearman P B, et al. 2012. Measuring ecological niche overlap from occurrence and spatial environmental data.Global Ecology and Biogeography, 21(4):481-497.( 1) 1)
|
| [13] |
Elith J H,Graham C P,Anderson R,et al. 2006. Novel methods improve prediction of species' distributions from occurrence data. Ecography, 29 : 129-151.( 1) 1)
|
| [14] |
Fitzpatrick M C,Hargrove W W. 2009. The projection of species distribution models and the problem of non-analog climate. Biodiversity and Conservation,18 (8) : 2255-2261.( 1) 1)
|
| [15] |
Fernando L C P,Chandrasirl K A S. 1997. More evidence on the attraction of males to the female sex pheromone of Opisina arenosetta Walker. Cocos,12: 79-81.( 1) 1)
|
| [16] |
Gupta A,Gopal M. 2002. Aflatoxin production by Aspergillus flavus isolates pathogenic to coconut insect pests. World Journal of Microbiology & Biotechnology,18: 325-331.( 1) 1)
|
| [17] |
He L S,Mohd A,Gloria O,et al. 2013. Chemical control of Opisina arenosella, black headed caterpillars at the East Coast Park, Singapore. Agri-Food & Veterinary Authority of Singapore.( 1) 1)
|
| [18] |
Hijmans R J,Cameron S E,Parra J L,et al. 2005. Very high resolution interpolated global terrestrial climate surfaces. International Journal of Climatology,25 (15) : 1965-1978.( 1) 1)
|
| [19] |
Howard F W,Moore D,Giblin-Davis R M,et al. 2001. Insects on palms. New York: CABI Publishing,1-400.( 1) 1)
|
| [20] |
Hortal J,Roura-Pascual N,Sanders N J,et al. 2010. Understanding (insect) species distributions across spatial scales. Ecography,33 (1) : 51-53.( 1) 1)
|
| [21] |
Kanagarathnam P,Pinto J L J G. 1985. Effect of Monocrotophos on the leaf eating caterpillar Opisina arenosella Walker,when injected into the trunk of the coconut palm. Cocos,3: 9-15.( 1) 1)
|
| [22] |
Kumar N R,Janakiraman T N,Thiagarajan H,et al. 2007. Automated motion tracking of insects using invariant moments in image sequence. Information Technology Journal,16 (8): 1264-1269.( 1) 1)
|
| [23] |
Landge S A,Wankhede S M,Gangurde S M. 2009. Comparative biology of Bracon hebetor Say on Corcyra cephalonica stainton and Opisina arenosella Walker. International Journal of Plant Protection,2 (2): 278-280.( 1) 1)
|
| [24] |
Lever R J. 1969. Pests of the coconut palm. Rome: Food and Agriculture Organization of the United Nations,1-190.( 1) 1)
|
| [25] |
Manjanath T M. 1985. Coconut black-headed caterpillar on banana and coconut. Plant Protection Bulletin,33 (2) : 71-72.( 1) 1)
|
| [26] |
Mohan C,Radhakrishnan Nair C P,Nampoothiri C K,et al. 2010. Leaf-eating caterpillar (Opisina arenosella)-induced yield loss in coconut palm. International Journal of Tropical Insect Science, 30 (3): 132-137.( 1) 1)
|
| [27] |
Muhammad B P P,Thomas S K. 2012. Indian Treepie Dendrocitta vagabunda parvula (Latham, 1790) (Passeriformes: Corvidae) as a natural enemy of the pests of coconut and areca palm plantations. J Biopest,5 (Supplementary): 205- 208.( 1) 1)
|
| [28] |
Muralimohan K,Srinivasa Y B. 2008a. Occurrence of protandry in an aseasonal multivoltine moth: implications for body-size evolution. Current Science,94 (4): 513-518.( 1) 1)
|
| [29] |
Muralimohan K,Srinivasa Y B. 2008b. Passive interplay between resource dynamics and resource consumption may determine the spatio-temporal distribution of a leaf-feeding insect in the canopy of a palm. Current Science,94 (7): 876-882.( 1) 1)
|
| [30] |
Muralimohan K,Ramkumar,Srinivasa Y B. 2008c. Natural parasitization and biological control: case of the coconut caterpillar. Current Science,95 (10): 1478-1482.( 1) 1)
|
| [31] |
Muralimohan K,Srinivasa Y B,Sreekanth P N. 2013. Effect of temperature on developmental biology of Opisina arenosella(Walker). Current Biotica,7 (3) : 228-232.( 2) 2)
|
| [32] |
NIIR Board of Consultants & Engineers. 2006. The complete book on coconut & coconut products(cultivation and processing). New Delhi: Asia Pacific Business Press Inc.( 3) 3)
|
| [33] |
Peterson A T, Soberón J, Pearson R G,et al. 2011. Ecological niches and geographical distributions. New Jersey: Princeton University Press.( 1) 1)
|
| [34] |
Pearson R G,Raxworthy C J,Nakamura M,et al. 2007. Predicting species distributions from small numbers of occurrence records: a test case using cryptic geckos in Madagascar. Journal of Biogeography,34 (1) : 102-117.( 1) 1)
|
| [35] |
Phillips S J,Anderson R P,Schapire R E. 2006. Maximum entropy modeling of species geographic distributions. Ecological Modelling,190 (3/4) : 231-259.( 2) 2)
|
| [36] |
Ramkumar,Muralimohan K,Kiranmayi L,et al. 2001. Discrete generation cycles in the tropical moth Opisina arenosella. Current Science,91 (6) : 811-816.( 1) 1)
|
| [37] |
Robinson G S,Ackery P R,Kitching I J,et al. 2001. Hostplants of the moth and butterfly caterpillars of the Oriental region. Kuala Lumpur: Southdene Sdn Bhd,1-744.( 1) 1)
|
| [38] |
Warren D L, Glor R E, Turelli M. 2008. Environmental niche equivalency versus conservatism:quantitative approaches to niche evolution.Evolution,62(11):2868-2883.( 1) 1)
|
| [39] | Warrer D L, Glor R E, Turelli M. 2010. ENMTools:a toolbox for comparative studies of environmental niche models. Ecography, 33(3), 607-611. |
| [40] |
Wisz M S,Hijmans R J,Li J,et al. 2008. Effects of sample size on the performance of species distribution models. Diversity and Distribution,14 (5) : 763-773.( 1) 1)
|
| [41] |
Zhu G P, Bu W J, Gao Y B, et al. 2012. Potential geographic distribution of brown marmorated stink bug invasion (Halyomorpha halys). PLoS ONE, 7 (2) : e31246.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

