文章信息
- 王磊, 宿红艳, 顾亮, 常志远, 陈娜
- Wang Lei, Su Hongyan, Gu Liang, Chang Zhiyuan, Chen Na
- 毛果杨中与PtMKK4互作的PtMPKs的筛选及验证
- Screening and Verification of PtMPKs Interacting with PtMKK4 of Populus trichocarpa
- 林业科学, 2015, 51(10): 60-66
- Scientia Silvae Sinicae, 2015, 51(10): 60-66.
- DOI: 10.11707/j.1001-7488.20151008
-
文章历史
- 收稿日期:2015-01-03
- 修回日期:2015-03-17
-
作者相关文章
2. 鲁东大学农学院 烟台 264025;
3. 烟台市农业科学研究院果树研究所 烟台 265500
2. College of Agriculture, Ludong University Yantai 264025;
3. Fruit Institute, Yantai Academy of Agricultural Sciences Yantai 265500
逆境信号的快速传递是植物感知并主动应对外界环境变化的主要策略之一,蛋白质可逆磷酸化在信号从外界传递到胞内引起细胞响应的信号转导网络中发挥重要作用,因此,促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)级联途径备受关注(Xiong et al., 2002; Rasmussen et al., 2012; Samajová et al., 2013)。该途径在真核生物中高度保守,由3种蛋白激酶组成: MAPKKK(MAP kinase kinase kinase),MAPKK(MAP kinase kinase)和MAPK,各组分之间以逐级磷酸化的方式构成信号放大途径,特异感受上游刺激,将信号放大并向下传递给靶蛋白。在这一过程中,MAPKK激酶位于MAPK级联途径的关键环节,MAPKK通过整合不同MAPKKK接受的多种信号,并将这些信号传递给下游MAPK(Morris,2001; Rodriguez et al., 2010)。
植物MAPK级联途径在生物及非生物胁迫信号传递过程中发挥重要作用。目前,相关研究成果主要来自于拟南芥(Arabidopsis thaliala)、水稻(Oryza sativa)、番茄(Solanum lycopersicum)、玉米(Zea mays)、蒺藜苜蓿(Medicago truncatula)、烟草(Nicotiana tabacum)等草本植物(Colcombet et al., 2008; Rao et al., 2010)。这些研究表明,MAPK级联途径中的成员能被高渗、高盐、低温、干旱、机械损伤及病原体侵染等多种生物和非生物胁迫激活,继而引发一系列下游事件的发生,如防御基因的表达、过敏性反应等,从而参与调控植物对这些胁迫的耐受性(Zhang et al., 2001; Kim et al., 2004; Xie et al.,2012; Xu et al., 2014)。但目前关于多年生林木MAPK的研究非常有限。
杨树(Populus)是林木研究的模式生物,同时也是我国重要的经济树种,目前关于杨树MAPK信号途径的报道甚少。毛果杨(P.trichocarpa)是首个已破译全基因组序列的树种,其高效的遗传转化体系有利于获得转基因植株,丰富的数据库资源为对转基因植株开展更深入的分子生物学分析提供了必要的平台。Nicole等(2006)曾对毛果杨中的PtMKKs(P. trichocarpa MAPKKs)和PtMPKs(P. trichocarpa MAPKs)的结构特征、染色体定位和组织器官表达模式进行了分析,但关于PtMPKs和PtMKKs功能的研究尚未见报道。在前期研究中,本课题组采用实时定量PCR(quantitative real-time RT-PCR,qRT-PCR)技术分析了毛果杨的11个PtMKKs对干旱、高盐、氧化等胁迫以及脱落酸(abscisic acid,ABA)、茉莉酸(jasmonic acid,JA)和水杨酸(salicylic acid,SA)等胁迫相关信号分子的响应情况,其中PtMKK4表达水平在多种胁迫及信号分子处理之后均发生变化。过量表达PtMKK4可提高转基因杨树的耐旱性,表明PtMKK4在杨树干旱信号转导中发挥重要作用(Wang et al.,2014)。在此基础上,本研究利用酵母双杂交技术筛选到1个与PtMKK4互作的PtMPK成员PtMPK6-1,并通过双分子荧光互补技术(bimolecular fluorescence complementation,BiFC)进一步验证; 进而,采用半定量PCR技术分析了PtMPK6-1对干旱和高盐胁迫处理的响应模式,为探明PtMKK4在介导毛果杨干旱信号转导过程中激活的靶标奠定基础。
1 材料与方法 1.1 试验材料毛果杨组培苗为本实验室保存。酵母菌株Y2H、酵母双杂交载体pGADT7及pGBKT7,X-α-gal 购自Clontech 公司; 双分子荧光互补载体pSPYNE-35S,pSPYCE-35S 为本实验室保存; pGM-T质粒载体、T4连接酶购自北京天根生化科技有限公司; 限制性内切酶购自Takara公司; 酵母转化试剂盒及各种营养缺陷型培养基购自北京泛基诺科技公司。引物合成和测序由上海生工生物工程公司完成。
1.2 试验方法 1.2.1 PtMPKs基因的获得1)材料处理取在生根培养基上培养2~3周根长至3~4 cm的毛果杨组培苗,分别进行200 mmol·L-1 NaCl,4 ℃,20% PEG模拟干旱等胁迫以及100 μmol·L-1 ABA,100 μmol·L-1 JA,100 μmol·L-1 SA等信号物质处理8 h,液氮迅速冷冻,保存-80 ℃超低温冰箱备用。
2)RNA的提取及反转录各样品总RNA的提取参照RNeasy Plant Mini Kit(QIAGEN)说明书进行。采用cDNA using the PrimeScript First Str and cDNA Synthesis K(Takara)进行反转录,合成cDNA 的第1条链。
3)PtMPKs基因扩增根据在NCBI数据库中搜索到的毛果杨PtMPKs基因ORF两端的序列设计引物,以1.2.1 2)中合成的各种cDNA为模板,进行RT-PCR。扩增体系为25 μL,包括: 10× buffer(含Mg2+)2.5 μL,dNTP(2.5 mmol·L-1)2 μL,上、下游引物(10 μmol·L-1)各1 μL,模板2 μL,Taq 0.25 μL。PCR 扩增的条件为: 94 ℃ 3 min 预变性后,94 ℃ 40 s,52~56 ℃ 40 s,72 ℃ 90 s,扩增35个循环。获得14条PtMPKs基因的相应扩增产物,克隆到pGM-T载体中,进行测序,将所得序列输入NCBI中进行BLAST比对,确定为目的片段。
1.2.2 酵母表达载体的构建1)诱饵表达载体的构建 根据PtMKK4 ORF两端序列设计特异引物,引物5′端加上相应酶切位点(表 1),以本实验室保存的质粒pGM-PtMKK4为模板,进行扩增。将目的片段定向插入pGBKT7载体中,构建的pGBKT7-PtMKK4重组载体经酶切和测序进行验证。
|
|
2)猎物表达载体的构建 根据PtMPKs ORF两端序列设计特异引物,引物5′端加上相应酶切位点(表 1),以获得的质粒pGM-PtMPKs为模板,进行扩增。将目的片段定向插入pGADT7载体中,构建的pGADT7-PtMPKs重组载体,经酶切和测序进行验证。
1.2.3 诱饵蛋白的自身激活及毒性检测按照北京泛基诺酵母转化试剂盒说明书制备Y2H酵母感受态细胞,将载体pGBKT7-PtMKK4和空载体pGBKT7分别转化感受态细胞。将转化的菌体分别涂布于SD/-Trp,SD/-Trp/-His固体培养平板,30 ℃ 培养3~5 天,观察菌落生长情况,检测诱饵蛋白的自身激活。
1.2.4 酵母双杂交筛选与PtMKK4互作的蛋白将质粒pGBKT7-PtMKK4和pGADT7-PtMPKs质粒共转化酵母Y2H感受态细胞,菌液涂布在SD/-Trp-Leu固体平板上,培养3~4天。挑取生长状态良好的酵母单克隆在SD/-Ade/-Trp/-Leu/-His和SD/-Ade/-Trp/-Leu/-His/X-α-gal平板上进行筛选培养3~5天,将筛选到的阳性克隆进行菌落PCR验证。
1.2.5 双分子荧光互补验证PtMKK4与PtMPKs互作双分子荧光检测参考Walter等(2004)方法进行,将PtMKK4和PtMPKs去掉终止子的cDNA 片段分别插入到pSPYNE-35S和pSPYCE-35S载体中,转化农杆菌(Agrobacterium tumefaciens)GV3101,侵染1月龄本生烟(Nicotiana benthamiana)叶片背面,隔2~3 天后取下表皮在共聚焦显微镜下观察荧光。激发光为488 nm,接收波长设为510~540 nm,扫描结果设为绿色。以共注射pSPYNE-35S、pSPYCE-35S烟草叶片作为阴性对照。
1.2.6 PtMPK6-1对干旱和高盐胁迫的响应模式分析利用半定量PCR分析PtMPK6-1在NaCl和PEG处理后表达水平的变化。按照1.2.1 1)对毛果杨组培苗进行200 mmol·L-1 NaCl和20%PEG模拟干旱胁迫处理,分别在处理后1,3,6,12 h取样,液氮迅速冷冻。提取各样品总RNA,并进行反转录。参照Nicole等(2006)设计特异引物PMK6-1-1: 5′-TCCCAACTGTCCACCCGGCAGCTATTG-3′和PMK6-1-2: 5′- CATTGTGACTGGTCAGCTTGA -3′,进行PCR 扩增。以PtCDC基因为扩增内部参照,扩增引物为CDCf: 5′-ATTCCCCAAGTGGCCTTCTAAG-3′和CDCr: 5′-TATTCATGCTCCAAAGCACTCC-3′。PCR 扩增的条件为: 94 ℃ 3 min 预变性后,94 ℃ 20 s,52 ℃ 20 s,72 ℃ 10 s,扩增30个循环,而PtCDC扩增28个循环,最后72 ℃延伸10 min。
2 结果与分析 2.1 PtMPKs基因的扩增分别提取毛果杨雄花序、雌花序以及用NaCl,PEG,ABA,JA,SA,4 ℃低温等分别处理8 h的组培苗的总RNA,并将其反转录成cDNA。以上述制备的各种cDNA为模板,进行PCR扩增,获得了14个PtMPKs的扩增产物,包括: PtMPK1,PtMPK2,PtMPK3-1,PtMPK3-2,PtMPK4,PtMPK6-1,PtMPK7,PtMPK9-1,PtMPK9-2,PtMPK11,PtMPK14,PtMPK16-1,PtMPK17,PtMPK20-1。测序后,将所得到的14条序列与NCBI中的核苷酸序列进行BLAST比对,证实为相应的PtMPKs基因,BLAST后获取的各基因的GenBank登录号见表 2。
|
|
将PtMKK4 ORF全长和质粒pGBKT7经EcoR I和Sal I双酶切后,用T4 DNA连接酶连接过夜,构建重组质粒pGBKT7-PtMKK4,酶切及测序比对后证实成功获得了PtMKK4与BD融合的诱饵表达载体。将pGBKT7-PtMKK4转入酵母感受态细胞中,证实pGBKT7-PtMKK4无自激活活性,可以用于进一步猎物蛋白的筛选。
为了筛选与PtMKK4互作的PtMPKs,进一步构建PtMPKs与AD融合的诱饵表达载体。酶切及测序结果证实14个PtMPKs ORF全长已分别定向插入到pGADT7载体中,所得的重组质粒命名为pGADT7-PtMPKs。将pGBKT7-PtMKK4分别和14个pGADT7-PtMPKs共转化酵母。结果显示(图 1A),共转化pGBKT7-PtMKK4,pGADT7-PtMPKs的酵母菌均可以在SD/-Trp/-Leu正常生长,而仅共转化pGBKT7-PtMKK4,pGADT7-PtMPK6-1的酵母菌可在营养缺陷型筛选培养基SD/-Ade/-Trp/-Leu/-His和SD/-Ade/-Trp/-Leu/-His/X-α-gal中生长,且在SD/-Ade/-Trp/-Leu/-His/X-α-gal生长的菌落显示蓝色,暗示PtMKK4与PtMPK6-1在酵母中存在相互作用。
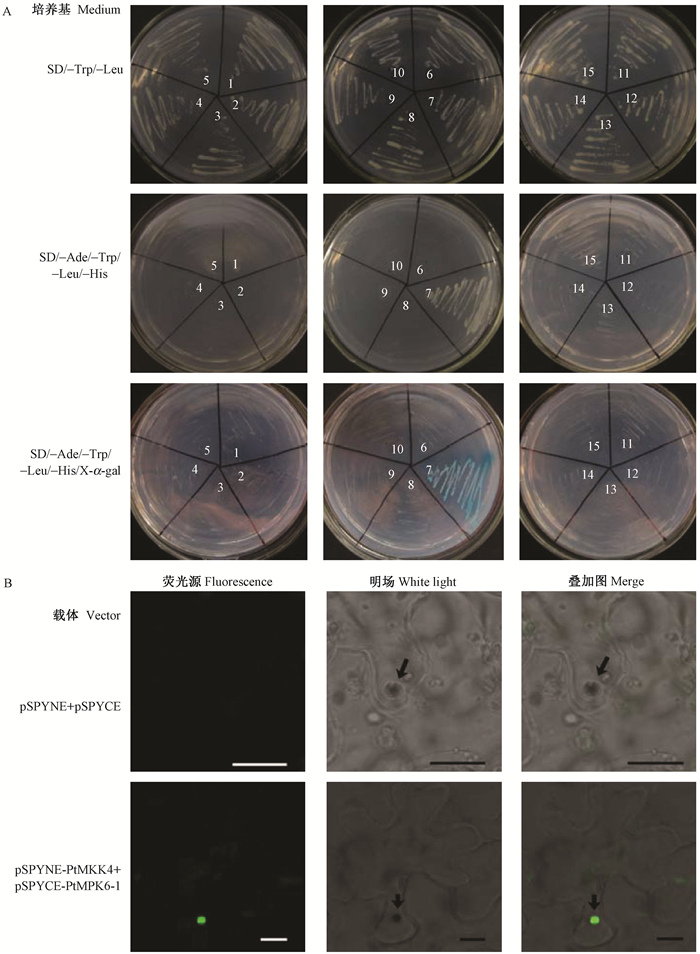 |
图 1 与PtMKK4互作的PtMPKs的筛选与验证
Fig. 1 Screening and verification of PtMPKs interacting with PtMKK4
A: 酵母双杂交筛选与PtMKK4互作的PtMPKs 1:共转化pGBKT7-PtMKK4和pGADT7的酵母菌作为对照; 2-15:共转化pGBKT7-PtMKK4和pGADT7-PtMPKs的酵母菌,pGADT7-PtMPKs依次为pGADT7-PtMPK1, pGADT7-PtMPK2, pGADT7-PtMPK3-1, pGADT7-PtMPK3-2, pGADT7-PtMPK4, pGADT7-PtMPK6-1, pGADT7-PtMPK7, pGADT7-PtMPK9-1, pGADT7-PtMPK9-2, pGADT7-PtMPK11, pGADT7-PtMPK14, pGADT7-PtMPK16-1, pGADT7-PtMPK17, pGADT7-PtMPK20-1。B: BiFC验证PtMKK4和PtMPK6-1之间的互作 箭头所指为细胞核,标尺为25 μm。 A: Screening the PtMPKs interacting with PtMKK4 using the yeast two-hybrid system 1: The yeast co-transformed into pGBKT7-PtMKK4 and pGADT7 plasmids as control; 2-15: The yeast strains co-transformed into pGBKT7-PtMKK4 and pGADT7-PtMPKs plasmids. The pGADT7-PtMPKs plasmids are pGADT7-PtMPK1, pGADT7-PtMPK2, pGADT7-PtMPK3-1, pGADT7-PtMPK3-2, pGADT7-PtMPK4, pGADT7-PtMPK6-1, pGADT7-PtMPK7, pGADT7-PtMPK9-1, pGADT7-PtMPK9-2, pGADT7-PtMPK11, pGADT7-PtMPK14, pGADT7-PtMPK16-1, pGADT7-PtMPK17 and pGADT7-PtMPK20-1 sequentially. B: Verification of the interaction between PtMKK4 and PtMPK6-1 using BiFC The arrows indicate the nucleus. Bar, 25 μm. |
采用BiFC进一步验证PtMKK4与PtMPK6-1之间的相互作用。结果显示,在共聚焦显微镜下共注射pSPYNE-PtMKK4和pSPYCE-PtMPK6-1的烟草表皮细胞中可观察到细胞核中有强荧光信号,细胞质中也有微弱的荧光信号,而共注射pSPYNE和pSPYCE的对照中未检测到荧光信号(图 1B)。
2.4 PtMPK6-1对干旱和高盐的响应模式分析采用半定量PCR技术分析PtMPK6-1基因在干旱和高盐胁迫过程中表达量的变化。结果显示(图 2),200 mmol·L-1 NaCl处理后,PtMPK6-1转录水平呈现上升趋势,6 h时达到最高水平,之后下降。而20%PEG处理1 h后PtMPK6-1迅速上升,之后下降。以上结果表明,PtMPK6-1是干旱和高盐诱导条件下差异表达的基因,暗示其在毛果杨干旱和高盐胁迫适应过程中起作用。
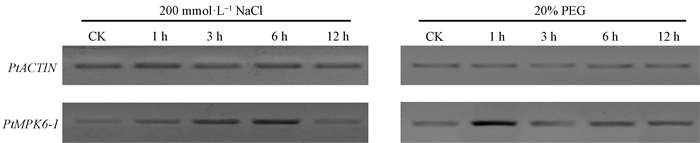 |
图 2 PtMPK6-1表达水平对NaCl和PEG处理的响应模式 Fig. 2 The expression pattern of PtMPK6-1 under NaCl and PEG treatments |
植物MAPK的研究始于20世纪90年代后期,鉴定出的第1条MAPK信号通路是拟南芥中的 AtMEKK1-AtMEK1-AtMPK4通路,能传递干旱和机械损伤信号(Ichimura et al., 1998)。此后,相继在多种植物中进行了MAPK基因的克隆、鉴定以及上下游事件的解析等一系列研究。研究证实,植物MAPK级联途径在生物及非生物胁迫信号传递过程中发挥重要作用(Yang et al., 2010; Xie et al., 2012; Xu et al., 2014)。但迄今关于MAPK调控植物逆境信号转导的作用机制还远未阐述清楚。在今后的研究中进一步分离鉴定MAPK新成员,探明MAPK级联途径各组分之间的互作机制,解析MAPK级联途径的上游和下游分子事件,完善现有的MAPK级联途径模型,将对全面了解植物中这一精细复杂调控方式具有重要意义。
PtMKK4是首个从毛果杨中鉴定出的参与干旱胁迫信号转导的MAPKK,但对于PtMKK4进一步激活的靶标MAPKs尚不明确(Wang et al., 2014)。前人的研究表明,PtMKK4在拟南芥中同源蛋白AtMKK4可激活AtMPKs传递生物及非生物胁迫信号。例如,MKKK1-MKK4/5-MPK3/6途径被一种细菌的鞭毛蛋白flg22激活,最终诱导早期防卫基因的转录(Ichimura et al., 2006; Suarez-Rodriguez et al.,2007)。Kim等(2011)利用凝胶激酶活性检测发现,在NaCl处理条件下野生型拟南芥中的AtMPK3激酶活性高于atmkk4突变体,但低于AtMKK4 过表达转基因植株,表明AtMPK3激酶活性与AtMKK4表达量成正相关,AtMKK4通过激活AtMPK3传递渗透胁迫信号。本研究中,利用酵母双杂交系统筛选到1个与PtMKK4互作的MAPK成员 PtMPK6-1,双分子荧光互补技术进一步验证了PtMKK4与PtMPK6-1存在蛋白互作(图 1)。植物中的MAPKs被划分为A,B,C和D 4个族,PtMPK6-1与之同源的拟南芥的AtMPK6和AtMPK3同属于A族,推测PtMPK6-1可能被PtMKK4激活。进而,半定量PCR结果显示,干旱和高盐胁迫处理均能引起PtMPK6-1表达上调,与PtMKK4的表达变化情况相似,暗示其在干旱和高盐胁迫适应过程中起作用(图 2)。在下一步研究中,将阐明PtMPK6-1的生物学功能及通过凝胶激酶活性检测PtMPK6-1是否可被PtMPKK4激活,最终确定在毛果杨干旱和高盐信号转导途径中PtMPK6-1是否为PtMKK4激活的靶标。
已有的研究表明,MAPKK激酶位于MAPK级联途径的关键环节,MAPKK通过整合不同MAPKKK接受的多种信号,并将这些信号传递给下游不同的MAPK(Morris,2001; Rodriguez et al., 2010)。各条信号传递途径之间不是简单的线性并列关系,而是互相交叉形成复杂的信号传递网络(Jonak et al., 2002; Rasmussen et al., 2012; Samajová et al., 2013)。作者前期研究结果显示,PtMKK4对干旱、高盐、氧化、ABA及SA处理均有响应,暗示PtMKK4在多种非生物胁迫信号转导途径中发挥重要作用。Nicole等(2006)利用生物信息学从毛果杨基因组中搜索到21个PtMPKs成员,但在本研究中,从雄花序、雌花序以及不同处理的毛果杨幼苗中仅分离到14个PtMPKs,推测其余的7个PtMPKs可能在其他特定的组织器官及特定条件下表达,而在以上材料中不表达或表达水平过低。今后,还需进一步分离这7个PtMPKs基因,确定其与PtMKK4是否存在互作关系,为全面认识PtMKK4介导在毛果杨非生物及生物信号转导网络中扮演的角色提供重要资料。
| [1] |
Colcombet J, Hirt H. 2008. Arabidopsis MAPKs: a complex signaling network involved in multiple biological processes. Biochem J, 413(2): 217-226.( 1) 1)
|
| [2] |
Ichimura K, Mizoguchi T, Irie K, et al. 1998. Isolation of ATMEKK1 (a MAP kinase kinase kinase)-interacting proteins and analysis of a MAP kinase cascade in Arabidopsis. Biochem Biophys Res Commun, 253 (2): 532-543.( 1) 1)
|
| [3] |
Ichimura K, Casais C, Peck S C, et al. 2006. MEKK1 is required for MPK4 activation and regulates tissue-specific and temperature-dependent cell death in Arabidopsis. J Biol Chem, 281 (48): 36969-36976.( 1) 1)
|
| [4] |
Jonak C, Okrész L, Bégre L, et al. 2002. Complexity, cross talk and integration of plant MAP kinase signaling. Curr Opin Plant Biol, 5(5): 415-424.( 1) 1)
|
| [5] | Kim C Y, Zhang S. 2004. Activation of a mitogen-activated protein kinase cascade induces WRKY family of transcription factors and defense genes in tobacco. Plant J, 38 (1): 142-151. |
| [6] |
Kim S H, Woo D H, Kim J M, et al. 2011. Arabidopsis MKK4 mediates osmotic-stress response via its regulation of MPK3 activity. Biochem Biophys Res Commun, 412 (1): 150-154.( 1) 1)
|
| [7] |
Morris P C. 2001. MAP kinase signal transduction pathways in plants. New Phytologist, 151: 67-89.( 2) 2)
|
| [8] |
Nicole M C, Hamel L P, Morency M J, et al. 2006. MAP-ping genomic organization and organ-specific expression profiles of poplar MAP kinases and MAP kinase kinases. BMC Genomics, 7: 223.( 3) 3)
|
| [9] |
Rao K P, Richa T, Kumar K, et al. 2010. In silico analysis reveals 75 members of mitogen-activated protein kinase kinase kinase gene family in rice. DNA Res, 17 (3): 139-153.( 1) 1)
|
| [10] |
Rasmussen M W, Roux M, Petersen M, et al. 2012. MAP kinase cascades in Arabidopsis innate immunity. Front Plant Sci, 3: 169.( 2) 2)
|
| [11] |
Rodriguez M C, Petersen M, Mundy J. 2010. Mitogen-activated protein kinase signaling in plants. Annu Rev Plant Biol, 61: 621-649.( 2) 2)
|
| [12] |
Samajová O, Komis G, Samaj J. 2013. Emerging topics in the cell biology of mitogen-activated protein kinases. Trends Plant Sci, 18(3): 140-148.( 2) 2)
|
| [13] | Suarez-Rodriguez M C, Adams-Phillips L, Liu Y, et al. 2007. MEKK1 is required for flg22-induced MPK4 activation in Arabidopsis plants. Plant Physiology, 143 (2): 661-669. |
| [14] |
Wang L, Su H Y, Han L Y, et al. 2014. Differential expression profiles of poplar MAP kinase kinases in response to abiotic stresses and plant hormones, and overexpression of PtMKK4 improves the drought tolerance of poplar. Gene, 545(1): 141-148.( 2) 2)
|
| [15] |
Walter M,Chaban C,Schütze K,et al. 2004. Visualization of protein interactions in living plant cells using bimolecular fluorescence complementation. Plant J, 40(3): 428-438.( 1) 1)
|
| [16] |
Xie G, Kato H, Imai R. 2012. Biochemical identification of the OsMKK6-OsMPK3 signaling pathway for chilling stress tolerance in rice. Biochem J, 443 (1): 95-102.( 2) 2)
|
| [17] |
Xiong L, Schumaker K S, Zhu J K. 2002. Cell signaling during cold, drought, and salt stress. Plant Cell, 14 Suppl: S165-183.( 1) 1)
|
| [18] |
Xu J, Yang K Y, Yoo S J, et al. 2014. Reactive oxygen species in signaling the transcriptional activation of WIPK expression in tobacco. Plant Cell Environ, 37(7):1614-1625.( 2) 2)
|
| [19] |
Yang T, Chaudhuri S, Yang L, et al. 2010. A calcium/calmodulin-regulated member of the receptor-like kinase family confers cold tolerance in plants. J Biol Chem, 285 (10): 7119-7126.( 1) 1)
|
| [20] |
Zhang S, Liu Y. 2001. Activation of salicylic acid-induced protein kinase, a mitogen-activated protein kinase, induces multiple defense responses in tobacoo. Plant Cell, 13 (8): 1877-1889( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

