文章信息
- 任嘉红, 刘辉, 姜楠, 魏玉宏, 张冰, 王莹
- Ren Jiahong, Liu Hui, Jiang Nan, Wei Yuhong, Zhang Bing, Wang Ying
- GFP标记溶磷草木樨中华根瘤菌CHW10B及其定殖
- Sinorhizobium meliloti CHW10B Strain GFP-Labelling and Its Colonization Associated with Taxus chinensis var. mairei
- 林业科学, 2015, 51(1): 74-79
- Scientia Silvae Sinicae, 2015, 51(1): 74-79.
- DOI: 10.11707/j.1001-7488.20150108
-
文章历史
- 收稿日期:2014-04-01
- 修回日期:2014-09-26
-
作者相关文章
2. 安徽师范大学环境科学与工程学院 芜湖 241003
2. College of Environmental Science and Engineering, Anhui Normal University Wuhu 241003
磷(phosphorus)是植物生命活动必需的营养元素之一,在能量代谢、碳水化合物代谢、氮代谢及物质运转过程中起着重要的作用(Khan et al., 2007; El-Azouni,2008; Zaidi et al., 2009)。我国大约有74%的耕地土壤缺磷,而且土壤中95 %的磷为难溶性磷,植物难以吸收,提高植物对土壤中难溶性磷的吸收的研究具有重要的应用价值。在土壤中分布有大量具有溶磷能力的微生物,称为溶磷菌(Chabot et al., 1996; 朱培淼等,2007; Oliveira et al., 2009)。溶磷菌可明显提高土壤中可溶性磷的营养水平,增加植物对磷元素的吸收,从而促进植物的生长(Mehrvarz et al., 2008; Sharma et al., 2007)。但在推广应用过程中,溶磷菌等植物有益菌存在田间效果不稳定的问题(Zaidi et al., 2009)。大量研究表明,有益菌的生理学特征、细胞表面性质以及植物自身特性与土壤结构、土壤温度和土壤 pH等因素的综合作用,决定了有益菌在根部定殖能力的强弱及其作用的大小。近年来,以植物有益菌引入环境为内容的定殖微生态研究逐渐成为人们关注的重点,尤其是现代标记基因技术的建立与发展,为细菌定殖的微生态学研究提供了有效手段。其中,绿色荧光蛋白(green fluorescent protein,GFP)标记系统以荧光性能稳定、检测方便、灵敏度高以及表达不受种属限制等特性,越来越受到重视,并被广泛用于植物根部细菌定殖的研究(吴沛桥等,2009; 彭祎等,2010; Fan et al., 2012; Kelemu et al., 2013)。
南方红豆杉(Taxus chinensis var. mairei)是国家一级保护珍稀植物,也是新型抗癌天然药物紫杉醇(Taxol)的主要来源之一。本实验室从南方红豆杉根际筛选出的高效溶磷草木樨中华根瘤菌(Sinorhizobium meliloti)CHW10B对南方红豆杉具有明显的促生长作用,但对其根际定殖规律并不清楚(任嘉红等,2012)。因此,本研究采用GFP 标记技术,对南方红豆杉植株根际上标记菌进行定期回收检测,明确草木樨中华根瘤菌CHW10B在其根际的定殖动态,为其在生产中应用提供理论依据。
1 材料与方法 1.1 材料 1.1.1 供试菌株、质粒菌株: 高效溶磷草木樨中华根瘤菌CHW10B,由本实验室保存。
质粒: pGFP4412质粒(10.6 kb),带有组成型表达的绿色荧光蛋白标记基因以及新霉素(neomycin,7 μg·mL-1)和氨苄青霉素(ampicilline,100 μg·mL-1)抗性,由中国农业大学陈三凤教授惠赠。
1.1.2 培养基1)溶磷细菌活化、保藏固体培养基(LB): 胰蛋白胨10.0 g、酵母提取物5.0 g、氯化钠10.0 g、琼脂15.0~20.0 g、水1 000 mL,pH 7.0~7.4。2)溶磷细菌种子及培养液体培养基: 配方同LB(不添加琼脂)。3)溶磷能力测定培养基(NBRIP)(Mehta et al., 2001)。
1.1.3 主要试剂和仪器试剂: DNA maker、感受态制备试剂盒、质粒提取试剂盒、酶切产物纯化试剂盒、PCR产物纯化试剂盒、限制性内切酶EcoR I和Hind III及其Buffer均来自大连Takara公司; 新霉素、氨苄青霉素购自Sigma公司; 其余常规试剂均为国产分析纯。所需GFP检测通用引物由华大基因有限公司合成,引物序列为:
GFP-F: CCGTCTAGAATGAGTAAAGGAGAAG;
GFP-R: CGCAAGCTTTTATTTGTATAGTTCAT。
仪器: 蔡司 Imager A.2荧光显微镜、ABI Verti PCR仪、北京六一电泳仪、BioSpectrum凝胶成像仪、核酸蛋白检测仪ND2000、德国Eppendorf Centrifuge 5804R高速低温离心机、岛津 UV2910紫外分光光度计和Millipore超纯水系统。
1.2 方法 1.2.1 草木樨中华根瘤菌CHW10B感受态细胞的制备挑取活化好的单个菌落接种到25.0 mL LB液体培养基中,于30 ℃、180 r·min-1振荡培养18~20 h后,取1 mL接种到50 mL LB培养基中,30 ℃、180 r·min-1振荡培养。按照试剂盒操作步骤制备感受态细胞,完成后置于-80 ℃保存备用。
1.2.2 载体PGFP4412的转化采用修改的反复冻融方法进行CHW10B菌株GFP基因的转化。1)取1~100 ng质粒,加入100 μL冰上冻融的感受态细胞(加前充分混匀);2)冰浴30 min,液氮1 min,37 ℃水浴3 min,冰浴2 min;3)加入890 μL不含抗生素的LB液体培养基,轻轻摇匀,30 ℃、180 r·min-1振荡培养4~6 h;4)5 000 r·min-1离心5 min,弃900 μL上清液后,用枪吹打均匀;5)将上述菌液均匀涂布于含新霉素(7 μg·mL-1)和氨苄青霉素(100 μg·mL-1)的LB固体平板上,30 ℃培养24~36 h,直至长出单菌落。
1.2.3 转化子的筛选及鉴定1)荧光显微镜镜检 挑取1.2.2中长出的单菌落于1 mL含新霉素(7 μg·mL-1)和氨苄青霉素(100 μg·mL-1)的LB液体培养基中,于30 ℃、180 r·min-1摇培16~36 h,取少量菌液制片,在荧光显微镜下观察菌体荧光特性,选择发光较强转化子进行稳定性检测。
2)稳定性检测 将上述发光较强阳性转化子的LB液体培养物,按照1%的接种量接种于50 mL含Amp的LB液体培养基中,30 ℃、180 r·min-1摇培16~18 h(约繁殖10代)后,将500 μL培养物接入新的1瓶50 mL含Amp的LB中,并摇培,如此重复接种和培养9次,约繁殖90代。每次培养均以上一次的培养物作为接种液,同时制片,检测其荧光性。随机选取大约200个菌体观察有无荧光特性,以仍具荧光表型的细菌所占百分比计算转化菌株的质粒遗传稳定性。
3)PCR检测 选取荧光较强的转化子,提取质粒,利用GFP基因特异引物进行PCR扩增后,用2%琼脂糖凝胶电泳检测,观察750 bp处是否有特征条带。将PCR产物送华大基因有限公司纯化测序,并将所得序列与pGFP4412的GFP基因序列用Bioedit软件进行CLUSTAL多序列分析。
4)酶切检测 选取荧光较强的转化子,提取质粒,利用限制性内切酶EcoR I和Hind Ⅲ于37 ℃进行双酶切。酶切产物用0.8%的琼脂糖凝胶电泳检测,观察其是否有特征条带。
1.2.4 标记菌株与原始溶磷菌株的比较1)形态特征的对比 将CHW10B野生菌株与相应的GFP标记菌株分别过夜活化,按1%的接种量接种于50 mL不含抗生素的LB液体培养基中,30 ℃、180 r·min-1摇培16~18 h。利用紫外分析仪(365 nm)照射观察。将上述菌液梯度稀释后,分别涂布于LB平板上,30 ℃培养24~36 h,观察菌落形态特征。同时分别将野生及标记菌株接种到LB斜面,培养16~18 h后,进行革兰氏染色,记录染色结果。
2)标记菌株溶磷能力检测 将溶磷菌株活化后接种于LB液体培养基中,30 ℃摇培18~24 h制成种子液,取0.5 mL种子液接种于含50 mL NBRIP培养液的100 mL三角瓶中,以接0.5 mL LB液体培养基为对照,每处理3个重复,30 ℃、180 r·min-1摇培4天后,4 ℃、12 857g离心10 min,采用钼锑抗比色法测定上清液有效磷含量(鲁如坤,2000)。
1.2.5 南方红豆杉根际的接种试验将CHW10B转化菌株在LB液体培养基中摇培24 h(30 ℃、180 r·min-1)后,10 000 r·min-1离心5 min,弃上清液,加适量无菌水冲洗,离心3次后,用无菌水将菌体浓度调整为105cfu·mL-1作为接种剂备用。取5.0 mL接种剂缓慢接种到南方红豆杉1年生盆栽实生苗根表面。每处理30株苗,同时以接种5.0 mL无菌水为对照; 生物学重复3次。分别于接种后第1,5,10,15,20,25,30和40天取幼苗根际土壤,按照平板稀释涂布法进行土壤菌量的测定(同时取幼苗根际土壤1.0 g于165 ℃烘2 h后称重,计算水分系数)。接种40天后,将幼苗的根系用无菌水冲洗干净,进行徒手切片(纵切); 在载玻片上滴一滴无菌水,将切片铺展其中,盖上盖玻片,用荧光显微镜察GFP标记菌株在根表面及其内部的定殖状况。
2 结果与分析 2.1 GFP标记CHW10B的筛选 2.1.1 GFP转化子的筛选采用反复冻融的转化方法获得的GFP标记菌株可通过抗性进行筛选; 对在含Amp抗生素的平板培养基上生长的转化菌株,利用荧光显微镜进行荧光检测。结果表明: 在蓝光激发下,标记菌株可发出明显的绿色荧光,说明含有绿色荧光蛋白的质粒已经在目标菌株中成功表达; 但是,不同的转化子之间荧光强弱存在明显的差异(图版I-1)。选择CHW10B荧光表达强烈的标记菌株做进一步的研究。
2.1.2 PCR检测提取强荧光转化子的质粒作为模板,利用GFP基因的特异性引物(GFP-F和GFP-R)进行PCR扩增。2%琼脂糖凝胶电泳检测分析,可见有一条大小约为750 bp的特异性片段,这与预期的片段大小一致(图 1)。将PCR产物送测序公司纯化测序后,将测序结果与已知的GFP基因序列进行多序列分析,二者一致,这进一步证实GFP基因已成功标记CHW10B菌株。挑选一个PCR检测过的阳性克隆CHW10B-GFP2做后续试验。
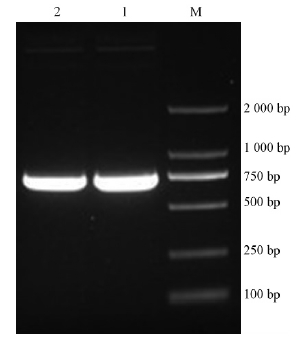 |
图 1 GFP基因PCR电泳检测 Fig. 1 Result of 2% agarose gel eletrophoresis of GFP gene in strain CHW10BM: 2 000 bp DNA marker; 1, 2: 转化子提取质粒The plasmids of CHW10B-GFP. |
由图 2可知,连续培养90代后,GFP基因标记CHW10B-GFP2菌株仍具有很高的遗传稳定性。这说明pGFP4412质粒在CHW10B菌株中遗传稳定性较高,该标记菌株可进一步用于在南方红豆杉根际的定殖规律等相关研究。
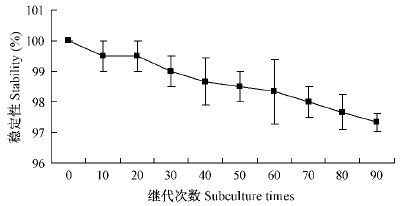 |
图 2 GFP基因标记菌株CHW10B的质粒稳定性检测 Fig. 2 Stability of engineered strain CHW10B-GFP |
EcoR I/Hind III双酶切所提取转化子CHW10B-GFP2的质粒,纯化后的酶切产物经0.8%琼脂糖凝胶电泳检测分析,结果如图 3所示:泳道1在10 600 bp处有一明显条带,符合pGFP4412质粒大小; 泳道2在6 200及4 400 bp处均有明显条带,符合酶切产物预期大小,这进一步证实GFP基因已成功标记于CHW10B菌株。
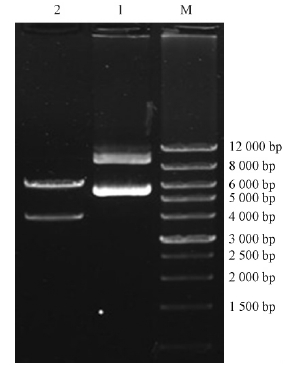 |
图 3 双酶切电泳检测 Fig. 3 Result of 2% agarose gel eletrophoresis of double enzyme cleavage product M: 12 000 bp DNA marker; 1: 转化子提取质粒The plasmids of CHW10B-GFP; 2: 酶切产物The product of double enzyme cleavage. |
分别对菌株CHW10B转化子及野生菌株的细胞形态和菌落特征进行观察。革兰氏染色结果表明转化子及野生菌株均为革兰氏阴性(G-)短杆菌,但二者在LB固体平板上的菌落形态有一定差别(图版I-2)。野生菌株菌落呈圆形、边缘整齐,表面湿润黏稠,为乳白色; 而标记菌株CHW10B-GFP2菌落表面为浅棕色,其他特性一致。
2.2.2 液体培养特征比较采用紫外分析仪在365 nm紫外光下观察菌株的培养特征和菌液的荧光特性。由图版I-3可以看出,标记菌株在紫外灯下可释放出强烈的荧光,这进一步说明已成功将GFP基因导入CHW10B细胞中。
2.2.3 溶磷能力的比较可溶性磷含量测定结果表明,CHW10B野生菌株及其转化子在发酵4天时发酵液中可溶性磷含量分别为656.57和639.12 mg·L-1,说明GFP质粒的进入对菌株CHW10B的溶磷能力影响较小。
2.3 CHW10B菌株在南方红豆杉根际的定殖动态将GFP标记的CHW10B菌悬液接种到南方红豆杉1年生盆栽实生苗根表面,并对根际土壤中GFP标记菌株进行定期回收检测,结果如图 4所示。 检测期间,CHW10B菌株在南方红豆杉根际的数量变化幅度较大,总体呈下降的趋势。接种1天南方红豆杉根际土壤中CHW10B转化菌数为6.08×107cfu·g-1,可见初期细菌能大量存活; 接种5天细菌数量迅速减少; 接种15天后,细菌代谢速率增加、生长繁殖加快,细菌数量明显增多; 25~40天,菌体数量升高后,呈平稳的趋势。分析原因可能是GFP标记菌在根部定殖后,需逐渐适应根围的微环境,细菌存活条件差,故菌体大量死亡,数量大幅度变化,总体呈下降趋势; 经过一段时间的适应,标记菌在宿主根际微生态环境中开始生存和繁殖,数量不再下降,开始上升至平稳趋势。用荧光显微镜对接种40天后南方红豆杉的根部(图版I-4)进行观察,在南方红豆杉根系表面及其内部有大量发绿色荧光的GFP标记细胞存在。这进一步说明CHW10B转化菌株具有迁移性,具备从南方红豆杉根际传输到根内部的能力,并能在南方红豆杉实生苗根部长期稳定地定殖。
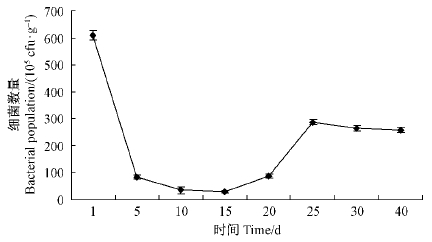 |
图 4 GFP基因标记CHW10B在南方红豆杉根际的数量消长动态 Fig. 4 Population fluctuation of strain CHW10B tagged with GFP gene in taxus’s rhizosphere |
目前研究微生物在植物根际或体内定殖的方法很多,如电镜观察法、免疫胶体金染色法、抗药性标记法、报告基因标记法等。近年来,绿色荧光蛋白(GFP)标记已经被广泛用于细菌在植物根际及植物体的定殖研究中。本研究首先对溶磷菌株草木樨中华根瘤菌CHW10B进行GFP标记,随后研究标记后菌株的存活特性;在确认菌株的稳定性之后,再进行标记菌株在南方红豆杉根际定殖的相关研究。
在研究GFP标记菌株与植物互作前,对标记菌株的生长特性、稳定性等进行检测是非常必要的。为了保证对标记菌株在植物根际及体内的长期定殖动态进行监测,须选择荧光表达强烈且稳定遗传的转化子,这是顺利开展定殖研究的前提和关键。如Leff等(1996)对大肠埃希菌(Escherichia coli)进行GFP标记,结果发现标记菌株所携带的GFP基因几天内便丢失,而GFP标记的Pseudomanas sp. 菌株接种到土壤后13个月却仍能检测到; 有研究还发现GFP标记的清枯雷尔氏菌(Ralstonia solanacearum)与野生菌株相比,标记菌株出现了生长滞后现象(车建美等,2008)。本研究采用修改的反复冻融的转化方法,成功地将含有绿色荧光蛋白基因的质粒pGFP4412转入草木樨中华根瘤菌CHW10B中,通过荧光检测观测到其在蓝光单色光模式下照射时,发出明显绿色荧光;同时pGFP4412质粒在同一菌株不同个体中表达的效果有一定的差异。笔者结合连续传代的方法,最终筛选出了具有强荧光并能稳定遗传的CHW10B标记菌株,而且该菌株与原始菌株相比,对磷素的溶解能力没有降低,证明转入的pGFP4412质粒对目标菌株的生理生化影响不大,不影响其正常生长繁殖,该菌株可以满足南方红豆杉根部定殖相关研究的需要。在前人的研究中,pGFP4412质粒主要用于属芽孢杆菌(Bacillus)的标记(Liu et al., 2006; 杨秀荣等,2013),本研究结果说明该质粒也适用于草木樨中华根瘤菌的GFP标记。
定殖是植物有益菌发挥作用的重要因素。许多室内效果显著的菌株在田间很难达到预期的效果,这是由于菌株不能有效定殖于植物根际或体内。植物根际有益菌产生的预期效果与其在植物体的定殖能力密切相关,有益菌发挥功能的前提条件就是施用后能在环境中存活并有效定殖。本研究表明CHW10B菌株能够在南方红豆杉根际土及根部长期稳定存活,在接种40天后,南方红豆杉根系表面及内部仍有大量GFP标记细胞存在。以上研究结果说明,高效溶磷草木樨中华根瘤菌CHW10B菌株可长期有效且稳定定殖于南方红豆杉根际及根部, 该菌株在生产实践上具有较大的应用潜力。
南方红豆杉与土壤中的有益微生物——丛枝菌根真菌(AMF)能形成共生体(任嘉红等,2008)。因此,应开展溶磷草木樨中华根瘤菌CHW10B菌株与AMF互作研究,可为开发南方红豆杉专用高效复合菌肥,促进南方红豆杉人工林的生长和紫杉醇产业的可持续性发展提供理论依据。
| [1] |
车建美, 蓝江林, 刘波. 2008. 转绿色荧光蛋白基因的清枯雷尔氏菌生物学特性. 中国农业科学, 41(11): 3626-3635. (Che J M, Lan J L, Liu B, et al. 2008. DFP Tagging Ralsonia solanacearum with gfp/luxAB mini-Tn5. Scientia Agriculture Sinica, 41(11): 3626-3635[in Chinese]).(  1) 1)
|
| [2] |
鲁如坤. 2000. 土壤农业化学分析方法.北京: 中国农业科技出版社. (Lu R K. 2000. Soil agricultural chemical analysis method. Beijing: China Agriculture Science and Technology Publishing House.[in Chinese])(  1) 1)
|
| [3] |
彭祎, 谭悠久, 黄永春. 2010. GFP标记的多粘芽孢杆菌114在番茄根际的定殖. 中国生物防治, 26(3): 307-311. (Peng Y, Tang Y J, Huang Y C. 2010. Colonization of gfp tagged Paenibacillus polymyxa strain around tomato roots. Chinese Journal of Biological Control, 26(3): 307-311[in Chinese]).(  1) 1)
|
| [4] |
任嘉红, 张静飞, 刘瑞祥, 等. 2008. 南方红豆杉丛枝菌根(AM)的研究.西北植物学报, 28(7): 1468-1473. (Ren J H, Zhang J F, Liu R X, et al. 2008. Stusy on arbuscular mycorhizae in Taxus chinensis var. mairei. Acta Botanica Boreali-Occidentalia Sinica, 28(7): 1468-1473[in Chinese]).(  1) 1)
|
| [5] |
任嘉红, 刘辉, 吴晓蕙, 等. 2012. 南方红豆杉根际溶无机磷细菌的筛选、鉴定及其促生效果. 微生物学报, 52(3): 295-303. (Ren J H, Liu H, Wu X H, et al. 2012. Screening, identification, and promoting effect of phosphate-solubilizing bacteria in rhizosphere of Taxus chinensis var. mairei. Acta Microbiologica Sinica, 52(3): 295-303[in Chinese]).(  1) 1)
|
| [6] |
吴沛桥, 巴晓革, 胡海, 等. 2009. 绿色荧光蛋白 GFP的研究进展及应用. 生物医学工程研究, 28(1): 83-86. (Wu P Q, Ba X G, Hu H, et al. 2009. Research progress and application of green fluorescent protein. Journal of Biomedical Engineering Reaearch, 28(1): 83-86[in Chinese]).(  1) 1)
|
| [7] |
杨秀荣, 田涛, 孙淑琴, 等. 2013. GFP标记生防细菌B579及其定殖能力检测. 植物病理学报, 43(1): 82-87. (Yang X R, Tian T, Sun S Q, et al. 2013. GFP-expressing Bacillus subtilus B579 sreain and its colonization detection. Acta Phytopathologica Sinica, 43(1): 82-87[in Chinese]).(  1) 1)
|
| [8] |
朱培淼, 杨兴明, 徐阳春, 等. 2007. 高效溶磷细菌的筛选及其对玉米苗期生长的促进作用. 应用生态学报,18(1): 107-112. (Zhu P M, Yang X M, Xu Y C, et al. 2007. High effective phosphate solubilizing bacteria: their isolation and promoting effect on corn seedling growth. Chinese Journal of Applied Ecology, 18(1): 107-112[in Chinese]).(  1) 1)
|
| [9] |
Chabot R,Antoun H,Cescas M P. 1996. Growth promotion of maize and lettuce by phosphate-solubilizing Rizobium legumenosarum biovar. phaseoli. Plant and Soil,184(2): 311-321.( 1) 1)
|
| [10] |
El-Azouni I M. 2008. Effect of phosphate solubilizing fungi on growth and nutrient uptake of soybean(Glycine max L.)plants. Journal of Applied Sciences Research,4(6): 592-598.( 1) 1)
|
| [11] |
Fan B,Borriss R,Bleiss W,et al. 2012. Gram-positive rhizobacterium Bacillus amyloliquefaciens FZB42 colonizes three types of plants in different patterns. The Journal of Microbiology,50(1): 38-44.( 1) 1)
|
| [12] |
Kelemu S,Fory P,Zuleta C,et al. 2013. Detecting bacterial endophytes in tropical grasses of the Brachiaria genus and determining their role in improving plant growth. African Journal of Biotechnology,10(6): 965-976.( 1) 1)
|
| [13] |
Khan M S,Zaidi A,Wani P A. 2007. Role of phosphate-solubilizing microorganisms in sustainable agriculture-A review. Agronomy for Sustainable Development,27: 29-43.( 1) 1)
|
| [14] |
Leff L G,Leff A A. 1996. Use of green fluorescent protein to monitoe survival of genetically engineered bacteria in aquatic enviroments. Applied and Enviromental Microbiology,62(9): 3486-3488.( 1) 1)
|
| [15] |
Liu X,Zhao H, Chen S. 2006. Colonization of maize and rice plants by strain Bacillus megaterium C4. Current Microbiology,52(3): 186-190.( 1) 1)
|
| [16] |
Mehrvarz S,Chaichi M R,Alikhani H A. 2008. Effects of phosphate solubilizing microorganisms and phosphorus chemical fertilizer on yield and yield components of Barely(Hordeum vulgare L.). Agriculture Ecosystems & Environment,(3): 822-828.( 1) 1)
|
| [17] |
Mehta S,Nautiyal C S. 2001. An Efficient method for qualitative screening of phosphate-solubilizing bacteria. Current Microbiology,43: 51-56.( 1) 1)
|
| [18] |
Oliveira C A,Alves V M C,Marriel I E,et al. 2009. Phosphate solubilizing microorganisms isolated from rhizosphere of maize cultivated in an oxisol of the Brazilian Cerrado Biome. Soil Biology and Biochemistry,41: 1782-1787.( 1) 1)
|
| [19] |
Sharma K,Dak G,Agrawal A,et al. 2007. Effect of phosphate solubilizing bacteria on the germination of Cicer arietinum seeds and seedling growth. Journal of Herbal Medicine and Toxicology,(1): 61-63.( 1) 1)
|
| [20] |
Zaidi A,Khan M S,Ahemad M,et al. 2009. Plant growth promotion by phosphate solubilizing bacteria. Acta Microbiologica Et Immunologica Hungarica,56(3): 263-284.( 2) 2)
|
 2015, Vol. 51
2015, Vol. 51

