文章信息
- 郑璐嘉, 黄志群, 何宗明, 王夏怡, 刘桌明, 刘瑞强, 肖好燕
- Zheng Lujia, Huang Zhiqun, He Zongming, Wang Xiayi, Liu Zhuoming, Liu Ruiqiang, Xiao Haoyan
- 林龄、叶龄对亚热带杉木人工林碳氮稳定同位素组成的影响
- Influence of Forest and Foliar Ages on The Composition of Stable Carbon and Nitrogen Isotope of Cunninghamia lanceolata in Subtropic China
- 林业科学, 2015, 51(1): 22-28
- Scientia Silvae Sinicae, 2015, 51(1): 22-28.
- DOI: 10.11707/j.1001-7488.20150103
-
文章历史
- 收稿日期:2014-03-20
- 修回日期:2014-04-27
-
作者相关文章
2. 福建师范大学地理研究所 福州 350007;
3. 湿润亚热带生态地理过程教育部重点实验室 福州 350007;
4. 福建农林大学林学院 福州 350002
2. Institute of Geography, Fujian Normal University Fuzhou 350007;
3. MOE Key Laboratory of Humid Subtropical Eco-Geographical Process Fuzhou 350007;
4. Forestry College, Fujian Agriculture and Forestry University Fuzhou 350002
与工农业快速发展相伴而生的化石燃料燃烧、化肥农药使用加剧等问题导致由大气输入陆地生态系统的氮含量不断增加,2005年全球活性氮排放已达187 Tg N(Galloway et al.,2004)。氮素是植物生长必需的元素,但过量的氮输入将对森林生态系统的一些氮转化过程如氮矿化(Chen et al.,2006)、硝化(Venterea et al.,2004)及氮输出过程如氮挥发(Venterea et al.,2004; Huygens et al.,2007)产生显著影响,从而导致森林生态系统出现氮饱和现象。我国亚热带被认为是受氮沉降影响严重的地区(Mo et al.,2008),许多研究发现氮素不再是限制该地区森林生态系统树种生长的因素,树木生长出现从氮限制到磷限制的转换。氮饱和指的是氮素可利用性超过树木生长的需要(Aber et al.,1989)。同一树种在其生长的不同阶段对氮素的需求不尽相同,速生期阶段的树木对氮素的需求大于幼年和老年时期,因此对于一个地区人工林生态系统氮素等养分状况应从不同生长阶段入手,才能更有针对性地制定施肥措施,以满足树木各生长阶段的需求。
同位素自然丰度法为研究树木生理过程及氮素状况提供了新工具,具有不受时间、空间限制(Robinson,2001; Kahmen et al.,2008)、非侵入性(Fang et al.,2011)以及测量简易等优点。由于植物氮循环和新陈代谢过程都存在同位素分馏的现象,所以该方法能较好地反映树木的动态变化。叶片中碳同位素自然丰度可以用来反映树木新陈代谢和水分利用的效率,而光合作用速率被认为与叶片氮含量呈显著的相关性。同时,许多研究发现叶片δ15N同土壤氮库大小(Gebauer et al.,1991; Emmett et al.,1998)、土壤氮转化速率(Garten et al.,1994; Pardo et al.,2002)以及土壤氮损失(Chen et al.,2006)呈显著正相关关系。研究还发现,叶片δ15N值同叶片15N 富集指数(EF=叶片δ15N-土壤δ15N)可以用来指示森林生态系统的氮饱和程度,叶片δ15N值越高(Templer et al.,2007)或叶片15N 富集指数越接近0(Garten et al.,1994),其所对应的森林生态系统越接近氮饱和状态。当前国内外已开展的相关研究中针对不同树种δ15N的研究较多(Templer et al.,2007; Gubsch et al.,2011),而针对同一树种的研究多考虑的是海拔、地域差异(Kitayama et al.,2001; Sah et al.,2006)或氮沉降(Fang et al.,2011)等环境因素对稳定同位素的影响,针对同一树种不同生长阶段的研究较少。
杉木(Cunninghamia lanceolata)是我国亚热带地区最重要的造林树种之一。据2013年统计数据显示,福建省人工林面积为378万hm2,而其中绝大部分为杉木。因此,本文选用处于不同生长阶段的杉木人工林为研究对象,对比其叶片、土壤等在同位素自然丰度上的差异,以求能从中了解相应林龄杉木人工林的氮饱和程度,从而为营林施肥措施的制定提供科学依据。
1 研究区概况试验地位于福建南平峡阳林场(26°48′ N,117°59′ E),属中亚热带季风气候,年均气温20.0 ℃,年均降水量为1 644 mm,降水主要集中在每年3—8月,10月最少。年平均蒸发量为1 143 mm,年平均相对湿度83%。本研究选取5个不同林龄(3,8,14,21,46年)的杉木人工林为研究对象,各林龄林分相互毗邻,最大距离不超过1 km,林下土壤均为黄红壤。在每个林龄的杉木人工林中随机设立4个小区,每个小区包括16株树龄和形态相近的杉木,5个林龄共设20个小区。各林龄杉木人工林土壤理化性质及林分基本情况见表 1。
|
|
2013年10月,在每个小区中根据平均树高和胸径选取4株标准木,根据不同叶片年龄采集活叶样品。具体取样方法为在每株标准木树冠中部选取朝南方向的活枝,根据叶片年龄将其上的叶片分为当年生(小于1年)、1年生(小于2年但大于1 年)、2年生(小于3年但大于2 年)、3年生(大于3 年)4个部分(林龄为3年的杉木林叶片只分为前3个叶龄),然后将同一个区组4株标准木的样品均匀混合,取混合样带回实验室。在室内将树叶样品放入60 ℃的烘箱中烘干至恒重,利用自动球磨仪将样品磨碎至过0.154 mm筛,制成待测样。利用碳氮元素分析仪(Elemental Analyzer Vario ELIII)测定待测杉叶样品的碳氮含量,利用同位素质谱仪(Thermo scientific MAT253)测定碳、氮稳定同位素比率,并分别用δ13C,δ15N表示,由下式计算得到:
| $${\delta ^{13}}{\rm{C}}\left({{\raise0.5ex\hbox{$\scriptstyle 0$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle {00}$}}} \right){\rm{ = }}\left({{R_{{\rm{sample}}}} - {R_{{\rm{st and ard}}}}} \right)/{R_{{\rm{st and ard}}}} \times 1000,$$ | (1) |
| $${\delta ^{15}}{\rm{N}}\left({{\raise0.5ex\hbox{$\scriptstyle 0$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle {00}$}}} \right){\rm{ = }}\left({{R_{{\rm{sample}}}} - {R_{{\rm{st and ard}}}}} \right)/{R_{{\rm{st and ard}}}} \times 1000,$$ | (2) |
式中:R分别为13C/12C或15N/14N的比值, Rsample为测定样品的R值,Rst and ard为标准物质的R值。
2.2 土壤样品的采集和分析于同一时间在每个区组(8年生的林分除外)内,去除地表凋落物后,避开人为干扰带,用内径为3.7 cm的土钻沿对角线等距离钻取5个点,将取出的土样分为0~5,5~10,10~20,20~40 cm 4个土层,并将同一区组内相同土层的土样混合均匀。随后将土壤样品置于室温下自然风干后,过0.154 mm筛,作为待测样。最后利用同位素质谱仪(Thermo Scientific MAT253)测定土壤样品的δ15N值。叶片15N富集指数(enrichment factors,EF)通过下式计算得到:
| $${\rm{EF = }}{\delta ^{15}}{{\rm{N}}_{{\rm{foliar}}}} - {\delta ^{15}}{{\rm{N}}_{{\rm{soil}}}}。$$ | (3) |
式中:δ15 Nfoliar为当年生的叶片δ15N值; δ15Nsoil为0~5 cm土层土壤δ15N值。
2.3 数据分析数据通过Excel 2003和SPSS 17.0软件进行分析,用Origin 8.0软件作图。采用多重比较方差分析法对比不同林龄或叶龄的杉木叶片碳氮稳定同位素间的差异,显著水平设为α=0.05。利用Pearson相关系数来检验变量之间的相关性。
3 结果与分析 3.1 不同林龄杉木叶片氮稳定同位素及氮素含量差异多重比较方差分析结果显示,不同林龄杉木叶片δ15N值达到了极显著差异(P=0.00),呈现出3年生幼林(1.44‰)显著高于所有林分、处于速生期的14年生杉木林(-1.44‰)显著低于其他所有林分的趋势。虽然其他3个林龄的林分彼此间并不存在显著差异,但总的趋势是 46年生(-0.40‰)>8年生(-0.80‰)>21年生(-0.90‰)(图 1)。而不同叶龄叶片δ15N值在各林龄间均未达到显著差异(P=0.19)。
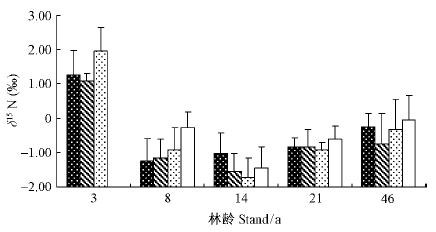 |
图 1 不同林龄、叶龄之间叶片δ15N值的差异
Fig. 1 Differences of foliar δ15N among different stand and foliar ages 当年生叶Current year foliage; 当年生叶Current year foliage; 1年生叶1-year-old foliage; 1年生叶1-year-old foliage; 2年生叶2-year-old foliage; 2年生叶2-year-old foliage; 3年生叶3-year-old foliage;下同。The same below 3年生叶3-year-old foliage;下同。The same below |
不同林龄叶片氮含量达到了极显著差异(P=0.00),呈现出3年生幼林同46年生老林显著高于其他林分的趋势。各林龄叶片氮含量从高到低依次为: 3年生(12.5 g·kg-1)>46年生(11.7 g·kg-1)>8年生(10.9 g·kg-1)>21年生(10.8 g·kg-1)>14年生(10.2 g·kg-1)。而同一林龄不同叶龄的叶片氮含量也具有极显著差异(P=0.00),呈现出随着叶龄增大氮含量逐渐降低的趋势(图 2)。同时,对叶片δ15N值与叶片氮含量的相关分析显示,二者间的相关性达到了显著水平(P=0.027)(图 3)。
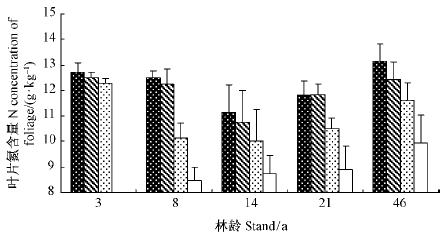 |
图 2 不同林龄、叶龄之间叶片氮含量的差异 Fig. 2 Differences in foliar N concentrations among different stand and foliar ages |
 |
图 3 叶片δ15N值同叶片氮含量之间的关系
Fig. 3 The correlation between foliar δ15N and N concentration◆3年生叶 3-year-old □8年生叶 8-year-old ▲14年生叶 14-year-old ○21年生叶 21-year-old  46年生叶 46-year-old 46年生叶 46-year-old |
多重比较方差分析结果显示,不同林龄杉木叶片δ13C值之间没有显著差异(P=0.828),但3年生和8年生林分的δ13C值相对低于其他林分(图 4)。
 |
图 4 不同林龄、叶龄之间叶片δ13C值的差异 Fig. 4 Differences of foliar δ13C among different stand and foliar ages |
而不同叶龄杉木叶的δ13C值则差异显著,当年生叶的δ13C值显著高于2年生及3年生叶(P=0.01,P=0.009),同时也较高于1年生叶,但二者间的差异并未达到显著水平(P=0.317)。整体来看,本研究中杉木叶片δ13C值与其氮含量之间无显著相关性,但不同叶龄间δ13C值的差异与氮含量的变化规律基本一致,都趋向于随着叶片年龄的增加而逐渐降低(图 4)。
3.3 不同林龄杉木人工林土壤氮稳定同位素及叶片15N富集指数的差异21年生杉木人工林土壤δ15N值(6.99‰)显著低于其他林龄,而另外3个林龄则呈现出3年生(7.91‰)>46年生(7.90‰)>14年生(7.50‰)的趋势,但不同林龄之间的差异并未达到显著水平。而所有林龄土壤的δ15N值均表现出随着土层深度增加而显著增加的趋势(表 2)。另外,各林龄土壤δ15N值均显著高于相应的叶片δ15N值(表 2、图 1)。
|
|
不同林龄间叶片15N富集指数具有显著差异 (P=0.014),呈现出3年生(-4.48‰)与46年生 (-5.99‰) 显著高于14年生(-7.32‰)和21年生(-6.23‰)的趋势,即3年生和46年生杉木人工林的叶片15N富集指数更接近于0(图 5)。
 |
图 5 不同林龄叶片15N富集指数的差异 Fig. 5 Differences in foliar 15N enrichment indices among the plantations with various ages |
国内外许多研究发现,叶片δ15N值与土壤δ15N值可以用来指示土壤的氮饱和程度(Garten,1993; Pardo et al.,2006; 姚凡云等,2012),森林生态系统氮饱和程度越高,其土壤和叶片δ15N值也相应越高。原因是由于氮转化和输出的过程存在氮同位素分馏现象,导致反应的剩余物中15N富集,反应的产物则出现15N贫化的现象。在氮饱和程度高的地区,其氮循环较为开放和活跃(Hobbie et al.,2009; Huang et al.,2013),因此氮的输出量会更高,伴随着较高的氮硝化和硝酸根淋失速率,将导致较多的15N贫化氮离开森林生态系统,而土壤中剩余氮素的15N更加富集。植物吸收了15N富集的氮素将导致叶片δ15N值升高。因此,本研究中3年生和46年生林分较高的叶片和土壤δ15N值说明研究区处于速生期的林分氮素可利用性低于幼林和老林,即使在氮沉降严重的亚热带地区,氮素对处于速生阶段的杉木可能仍是一个限制因素。
同时,也有研究对上述观点进行补充,并提出利用叶片15N富集指数同样可以指示林分氮饱和程度(Michener et al.,2008),他们认为叶片15N富集指数越接近0,则对应林分的氮饱和程度越高。本研究中3年生幼林和46年生老林的叶片15N富集指数显著高于其他3个林分(较接近于0),同样说明本研究区幼林同老林的氮饱和程度高于其他林龄。另外,叶片15N富集指数代表的是叶片δ15N同土壤δ15N间的差值,而树木根系特别是菌根在吸收氮素时发生的同位素分馏现象可能是造成这一差值的主要原因之一,因为菌根真菌在利用土壤中氮素时存在明显的氮同位素分馏现象,这一过程将导致通过菌根固定的氮素出现15N贫化现象并反映在叶片δ15N上。所以叶片δ15N同土壤δ15N间的差值越小(叶片15N富集指数越接近于0),则可能说明菌根真菌对氮素的分馏作用越弱。而有研究认为,森林生态系统氮素可利用性越低,菌根在植物氮素供应中的地位就越重要,进而将导致土壤中的氮素被植物吸收利用的过程中伴有更强烈的氮同位素分馏现象(Högberg,1997; Hobbie et al.,2009),最终导致叶片中δ15N值较低。如果本研究区叶片15N富集指数的差异主要来自菌根的分馏作用,这也从侧面再次支持了笔者的观点,即处于速生期阶段的林分同幼林和老林相比氮素可利用性较低,氮素可能仍是限制其生长的因素。
本研究中,叶片δ15N值同叶片氮含量之间具有显著的相关性,这与许多研究(Vitousek et al.,1989; Jung et al.,1997)相一致。Hobbie等(2008)认为,叶片δ15N值同叶片氮含量之间的相关关系反映了菌根对叶片δ15N值的影响。因为菌根对叶片δ15N值的影响主要通过2个指标来产生作用,一个是菌根为植物固定的氮素的数量,另一个是菌根将氮素传输给植物时对氮同位素的分馏程度。本研究针对所有林龄叶片δ15N值及所对应的叶片氮含量所做的相关分析结果显示,所有林龄这2个指标均符合一致的相关性(P=0.027)(图 3),这说明不同林龄菌根对氮稳定同位素的分馏程度基本相同(Kitayama et al.,2001)。笔者认为如果本研究中叶片δ15N值的差异主要来自菌根的影响,则可能由于不同林龄杉木林的菌根吸收氮素数量上的不同,即源于不同林龄杉木林菌根生物量的差异,这还需开展进一步的研究来验证。
4.2 不同年龄杉木人工林碳稳定性同位素的差异一般认为,植物中碳稳定同位素分馏的机制主要包括热力学分馏和动力学分馏(Farquhar et al.,1989),其中热力学分馏占植物叶片碳稳定同位素分馏的60%以上,影响因素包括光合作用速率、水分利用效率等。由于本试验样地均位于同一区域,故影响动力学分馏的环境因素基本一致,因此导致不同年龄间δ13C值差异的原因可能主要来源热力学分馏过程,即光合作用效率和水分利用率间的差异。影响机制主要是由于光合作用速率增大将加大对CO2的需求,从而促使叶片对13C利用的歧视性降低,进而使得叶片中δ13C值相应降低;水分利用率降低将直接导致叶片气孔导度降低,使得可被叶片吸收的CO2含量降低,叶片在利用CO2时对13C的歧视性也相应降低,进而导致叶片中δ13C值相应升高。
本研究中,不同林龄叶片δ13C值差异没有达到显著水平,但从数值上看,林龄较小的3年生和8年生杉木有较低于其他林龄的趋势。幼年林叶片δ13C值较低的结果与丁访军等(2011)的研究一致,可能的原因之一是林龄较小的2个林分叶片水分利用效率较高。因为叶片水分的供应效率不仅受外界环境影响,同时还与树木输导组织的水分运输阻力有关(Warren et al.,2001)。而Waring等(1994)研究发现树木枝条同水分运输速率间的负相关关系,即树干、枝条等运输水分的组织越长,其水分运输速率越低,从而使得叶片的δ13C值较低。因此,本研究中林龄较小的2个林分δ13C值较低的原因可能与树高有关。较低的树高减少了从地面运输水分到树木冠层的距离,从而保证了在较干旱的季节(采样时间10月为本研究区一年中最干旱的时期),林龄较小的林分的水分利用速率受环境影响较小从而导致较低的叶片δ13C值。
影响叶片δ13C值的因素不仅有水分利用效率还有光合作用速率。本研究中各林龄叶片δ13C值从小到大依次为: 3年生<8年生<46年生<21年生<14年生。如果造成不同林龄杉木δ13C值差异的主要原因是光合作用速率,则可知3,8同46年生杉木林的光合作用速率可能高于其他林龄。而有研究认为,由于氮是光合器官以及一些光合作用酶的主要组成部分,因此叶片氮含量对光合作用速率具有重要的指示作用,叶片氮含量同光合作用速率之间具有显著相关性(Macfarlane et al.,2007)。本研究中3,8同46年生杉木林叶片的氮含量也有显著高于其他林龄的趋势,与叶片δ13C值的差异基本符合,而这也可能意味着这几个林龄的杉木林具有相对较高的氮素供应能力,可从侧面支持本文关于叶片δ15N值的研究结果。
另外本研究同一林龄的杉木中,不同叶龄的叶片间δ13C值间具有显著差异,且呈现出随着叶龄增大而逐渐减小的趋势。而这一趋势与叶片氮含量一致,但二者间并没有显著的相关性。因此,笔者认为,在林龄相同的情况下,树木水分运输能力基本相同,则光合作用对叶片δ13C值的影响起主导作用。由于树木叶片的养分归还作用使得随着叶片年龄的增大,叶片氮含量逐渐降低,氮素的缺乏容易使其叶绿素含量和光合作用酶含量降低,从而导致光合作用速率受到影响而在叶片δ13C值上体现出来。
4.3 结论从不同林龄杉木人工林δ15N值的差异可以看出,即使在氮沉降严重的亚热带地区,氮素对处于速生阶段的杉木可能仍是一个限制因素,今后的试验还需考虑菌根对叶片δ15N值的影响。而造成不同林龄杉木人工林δ13C值差异的原因,需综合考虑水分利用效率和光合作用效率2方面问题。
| [1] |
丁访军, 王兵, 郭浩. 等. 2011. 中亚热带毛竹和杉木的稳定碳同位素组成及其对水分利用效率的指示. 江西农业大学学报, 33(1): 52-57. (Ding F H, Wang B, Guo H,et al. 2011. Composition of stable carbon isotope of Phyllostachys edulis and Cunninghamia lanceolata and their indications for water use efficiency in the middle subtropics. Acta Agriculturae Universitatis Jiangxiensis, 33(1): 52-57[in Chinese]).(  1) 1)
|
| [2] |
姚凡云, 朱彪, 杜恩在. 2012. 15 N自然丰度法在陆地生态系统氮循环研究中的应用. 植物生态学报, 36(4): 346-352. (Yao Y F, Zhu B, Du E Z. 2012. Use of 15N natural abundance in nitrogen cycling of terrestrial ecosystems. Acta Phytoecologica Sinica, 36(4): 346-352[in Chinese]).(  1) 1)
|
| [3] |
Aber J D, Nadelhoffer K J, Steudler P, et al. 1989. Nitrogen saturation in northern forest ecosystems. BioScience, 39(6): 378-286.( 1) 1)
|
| [4] |
Chen Y, Högberg P. 2006. Gross nitrogen mineralization rates still high 14 years after suspension of N input to a N-saturated forest. Soil Biology and Biochemistry, 38(7): 2001-2003.( 2) 2)
|
| [5] |
Cheng S L, Fang H J, Yu G R, et al. 2010. Foliar and soil 15N natural abundances provide field evidence on nitrogen dynamics in temperate and boreal forest ecosystems. Plant and Soil, 337(1/2): 285-297.( 0) 0)
|
| [6] |
Emmett B A, Kjønaas O J, Gundersen P, et al. 1998. Natural abundance of 15N in forests across a nitrogen deposition gradient. Forest Ecology and Management, 101(1): 9-18.( 1) 1)
|
| [7] |
Fang H, Yu G, Cheng S, et al. 2011. Nitrogen-15 signals of leaf-litter-soil continuum as a possible indicator of ecosystem nitrogen saturation by forest succession and N loads. Biogeochemistry, 102(1/3): 251-263.( 2) 2)
|
| [8] |
Farquhar G D, Ehleringer J R, Hubick K T. 1989. Carbon isotope discrimination and photosynthesis. Annual Review of Plant Biology, 40(1): 503-537.( 1) 1)
|
| [9] |
Galloway J N, Dentener F J, Capone D G, et al. 2004. Nitrogen cycles: past, present, and future. Biogeochemistry, 70(2): 153-226.( 1) 1)
|
| [10] |
Garten C T. 1993. Variation in foliar 15N abundance and the availability of soil nitrogen on Walker Branch watershed.Ecology:2098-2113.( 1) 1)
|
| [11] |
Garten C T, Miegroet H V. 1994. Relationships between soil nitrogen dynamics and natural 15N abundance in plant foliage from Great Smoky Mountains National Park. Canadian Journal of Forest Research, 24(8): 1636-1645.( 2) 2)
|
| [12] |
Gebauer G, Schulze E D 1991. Carbon and nitrogen isotope ratios in different compartments of a healthy and a declining Picea abies forest in the Fichtelgebirge,NE Bavaria. Oecologia, 87(2):198-207.( 1) 1)
|
| [13] |
Gubsch M, Roscher C, Gleixner G, et al. 2011. Foliar and soil δ15N values reveal increased nitrogen partitioning among species in diverse grassland communities. Plant, Cell & Environment, 34(6): 895-908.( 1) 1)
|
| [14] |
Hobbie E A, Hobbie J. 2008. Natural abundance of 15N in nitrogen-limited forests and tundra can estimate nitrogen cycling through mycorrhizal fungi: a review. Ecosystems,11(5): 815-830.( 1) 1)
|
| [15] |
Hobbie E, Ouimette A.2009.Controls of nitrogen isotope pattern in soil profiles. Biogeochemistry, 95(2/3):355-371.( 2) 2)
|
| [16] |
Robinson D.2001.δ15N as an integrator of the nitrogen cycle.Trends in Ecology & Evolution,16:153-162.( 1) 1)
|
| [17] |
Högberg P. 1997. 15N natural abundance in soil-plant systems. New Phytol,137(2):179-203.( 1) 1)
|
| [18] |
Huang Z, Wan X, He Z,et al. 2013. Soil microbial biomass, community composition and soil nitrogen cycling in relation to tree species in subtropical China. Soil Biology and Biochemistry,62:68-75( 1) 1)
|
| [19] |
Huygens D, Rütting T, Boeckx P, et al. 2007. Soil nitrogen conservation mechanisms in a pristine south Chilean Nothofagus forest ecosystem. Soil Biology and Biochemistry, 39(10):2448-2458.( 1) 1)
|
| [20] |
Jung K, Gebauer G, Gehre M, et al. 1997. Anthropogenic impacts on natural nitrogen isotope variations in Pinus sylvestris stands in an industrially polluted area. Environmental Pollution, 97(1): 175-181.( 1) 1)
|
| [21] |
Kahmen A, Wanek W, Buchmann N. 2008. Foliar δ15N values characterize soil N cycling and reflect nitrate or ammonium preference of plants along a temperate grassland gradient. Oecologia, 156(4): 861-870.( 1) 1)
|
| [22] |
Kitayama K, Iwamoto K. 2001. Patterns of natural 15N abundance in the leaf-to-soil continuum of tropical rain forests differing in N availability on Mount Kinabalu, Borneo. Plant and Soil, 229(2): 203-212.( 2) 2)
|
| [23] |
Macfarlane C, Arndt S K, Livesley S J, et al. 2007. Estimation of leaf area index in eucalypt forest with vertical foliage, using cover and fullframe fisheye photography. Forest Ecology and Management, 242(2): 756-763.( 1) 1)
|
| [24] |
Michener R, Lajtha K.2008. Stable isotopes in ecology and environmental science, USA:John Wiley & Sons.( 1) 1)
|
| [25] |
Mo J, Zhang W, Zhu W, et al. 2008. Nitrogen addition reduces soil respiration in a mature tropical forest in southern China. Global Change Biology, 14(2): 403-412.( 1) 1)
|
| [26] |
Pardo L, Hemond H, Montoya J, et al. 2002. Response of the natural abundance of 15N in forest soils and foliage to high nitrate loss following clear-cutting. Canadian Journal of Forest Research, 32(7): 1126-1136.( 1) 1)
|
| [27] |
Pardo L, Templer P, Goodale C, et al. 2006. Regional assessment of N saturation using foliar and root δ15N. Biogeochemistry, 80(2): 143-171.( 1) 1)
|
| [28] |
Sah S, Rita H, Ilvesniemi H 2006. 15N natural abundance of foliage and soil across boreal forests of Finland. Biogeochemistry, 80(3): 277-288.( 1) 1)
|
| [29] |
Templer P H, Arthur M A, Lovett G M, et al. 2007. Plant and soil natural abundance δ15N: indicators of relative rates of nitrogen cycling in temperate forest ecosystems. Oecologia, 153(2): 399-406.( 2) 2)
|
| [30] |
Venterea R T, Groffman P M, Verchot L V, et al. 2004. Gross nitrogen process rates in temperate forest soils exhibiting symptoms of nitrogen saturation. Forest Ecology and Management, 196(1): 129-142.( 1) 1)
|
| [31] |
Vitousek P M, Shearer G, Kohl D H. 1989. Foliar 15N natural abundance in Hawaiian rainforest: patterns and possible mechanisms. Oecologia, 78(3): 383-388.( 1) 1)
|
| [32] |
Waring R H, Silvester W B. 1994. Variation in foliar δ13C values within the crowns of Pinus radiata trees. Tree Physiology, 14(11): 1203-1213.( 1) 1)
|
| [33] |
Warren C R, Mcgrath J F, Adams M A. 2001. Water availability and carbon isotope discrimination in conifers. Oecologia, 127(4): 476-486.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

