文章信息
- 王文君, 杨万勤, 谭波, 刘瑞龙, 吴福忠
- Wang Wenjun, Yang Wanqin, Tan Bo, Liu Ruilong, Wu Fuzhong
- 四川盆地亚热带常绿阔叶林不同物候期土壤动物对凋落物氮和磷释放的影响
- Effects of Soil Fauna to Nitrogen and Phosphorus Releases during Litter Decomposition at Different Phenological Stages in the Subtropical Evergreen Broad-Leaved Forest in Sichuan Basin
- 林业科学, 2015, 51(1): 1-11
- Scientia Silvae Sinicae, 2015, 51(1): 1-11.
- DOI: 10.11707/j.1001-7488.20150101
-
文章历史
- 收稿日期:2013-09-13
- 修回日期:2014-12-09
-
作者相关文章
凋落物分解过程中释放的N和P等元素是森林生态系统中植物生长所需营养元素的重要来源(Manzoni et al.,2010; Vitousek et al.,2010)。由于植物不同生长阶段对养分需求存在明显差异,尤其是植物快速生长期对养分的过度需求可能亟需凋落物分解的供给(Wright et al.,2011),因而,弄清植物生长与凋落物分解过程中N和P等养分元素释放的关系具有重要意义(Perez-Moreno et al.,2000; Davidson et al.,2004)。土壤动物是影响凋落物分解的重要生物因子(Wood et al.,2012; Ramanathan et al.,2012; Li et al.,2009),对凋落物养分释放具有举足轻重的作用。然而,植物物候期差异往往伴随着温度等环境因子的变化,且凋落物分解过程中质量的变化也必将影响土壤动物对凋落物养分释放的贡献(Wood et al.,2012; Barantal et al.,2012)。大量凋落物往往形成于秋末冬初植物叶片凋落期,在新鲜凋落物分解之初,土壤动物常利用凋落物中的C作为能量来源,从凋落物以外的外界环境中固定N和P等养分元素以满足其生存生长的需要,因而表现为土壤动物对凋落物N和P的富集效应;随着分解的进行,凋落物中的C持续大量减少,与之相应的是N和P等养分元素的浓度逐渐上升,土壤动物可能明显促进凋落物N和P等养分元素的释放(Berglund et al.,2012)。更为重要的是,植物落叶期后冬季相对较低的温度可能明显限制土壤动物的活动,而展叶期和盛叶期较高的温度可提高土壤动物的活动(Xu et al.,2012),进而促进凋落物N和P等养分元素的释放,贡献于植物生长过程。已有的研究很少关注植物生长的不同物候期凋落物N和P的释放过程,更没有关注不同物候期土壤动物对N和P等养分元素释放的贡献。
四川盆地亚热带常绿阔叶林在全球森林生态系统中占有重要地位,也是人口稠密区人们赖以生存和生活的物质基础(丁圣彦等,2004)。但由于人类的强烈索求,次生林和人工林已成为该区主要的森林类型。这些受到严重人为干扰的系统生态过程非常脆弱,土壤退化严重,缺N少P,凋落物养分释放对于植物生长更为重要,但缺乏深入研究。因此本研究以四川盆地典型人工林树种马尾松(Pinus massoniana)和柳杉(Cryptomeria fortunei)及次生林树种香樟(Cinnamomum camphora)和麻栎(Quercus acutissima)凋落物为研究对象,根据植物物候动态,研究植物不同物候期土壤动物对凋落物N和P释放的作用,以期深入认识四川盆地常绿阔叶林凋落物分解过程及其与植物生长的关系,同时为区域生态系统可持续管理提供理论依据。
1 研究区概况马尾松人工林和香樟次生林位于四川省高县来复镇(104°32′—104°34′ E,28°34—28°36′ N),海拔412~567 m,地处长江上游和四川盆地南缘,属中亚热带湿润季风气候,年均气温18.1 ℃,最高气温(7月)36.8 ℃,最低气温(1月)7.8 ℃,年均降水量1 021 mm。林下灌木主要有梨叶悬钩子(Rubus pirifolius)、枹栎(Quercus serrate)、油樟(Cinnamomum longepaniculatum)、野桐(Mallotus japonicus)、铁仔(Myrsine africana)、茶荚蒾(Viburnum setigerum)和展毛野牡丹(Melastoma normale)等;草本主要有金星蕨(Parathelypteris gl and uligera)、芒(Miscanthus sinensis)、芒萁(Dicranopteris dichotoma)、皱叶狗尾草(Setaria plicata)和淡竹叶(Lophatherum gracile)等。土壤为发育在砂岩上的山地黄壤,土层厚40~60 cm,pH4.3±0.4,总有机碳含量(16.3±1.5)g·kg-1,全氮含量(0.7±0.1)g·kg-1,全磷含量(2.0±0.3)g·kg-1。
柳杉人工林和麻栎次生林位于成都平原与川西北山地接合部的都江堰灵岩山(103°34′-103°36′ E,31°01′-31°01′ N),海拔896~1 320 m,亚热带气候类型,年均气温15.2 ℃,最高气温(7月)31.6 ℃,最低气温(1月)-1.4 ℃,年降水量1 243 mm。林下灌木主要有光叶海桐(Pittosporum glabratum)、胡枝子(Lespedeza bicolor)、针刺悬钩子(Rubus pungens)、野花椒(Zanthoxylum simulans)和十大功劳(Mahonia fortunei);草本主要为扁竹根(Iris japonica)、欧洲蕨(Pteridium aquilinum)、麦冬(Ophiopogon japonicus)、莎草(Cyperus rotundus)和芒萁等。土壤为发育在沙岩上的黄壤,土层厚70~100 cm,pH 4.9±0.3,有机碳含量(19.8±1.2)g·kg-1,全氮含量(1.4±0.2)g·kg-1,全磷含量(0.9±0.1)g·kg-1。
2 研究方法 2.1 样地设置和处理基于背景调查,2011年10月,在样地区域内收集新鲜的马尾松、香樟、柳杉和麻栎凋落物,带回室内自然风干。每个物种准确称取10 g,分别装入不同孔径的凋落物袋(20 cm×20 cm)。凋落物袋由尼龙网缝合而成,贴地面层孔径为0.04 mm,表面层孔径为0.04 mm(基本排除土壤动物)(Zwahlen et al.,2007)和3 mm(基本允许所有土壤动物进入)(Crutsinger et al.,2009)。4种凋落物用凋落物袋各装30袋,共240袋。同时,另取4种凋落物各50 g,用于测定凋落物初始干质量及养分元素含量(表 1)。
|
|
于2011年11月13日凋落物秋季高峰期,在马尾松人工林、香樟次生林、柳杉人工林和麻栎次生林分别选取光照、坡度和坡向等环境条件基本一致的样地各1块,每个样地内随机选取5个5 m×5 m的均质样方,去除样方内土壤表面的植物和凋落物,将凋落物袋平铺于地表。每个样方分别放置0.04和3 mm孔径的凋落物袋各6袋。样品埋设后,分别在各区域内设钮扣式温度传感器连续监测空气温度,1 h记录1次数据。2011年11月初到2012年10月末样地空气温度变化特征如图 1所示。
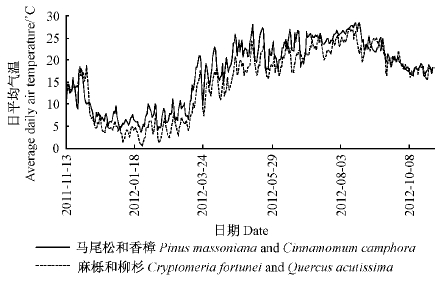 |
图 1 采样期间样地空气温度动态变化 Fig. 1 Dynamic changes of air temperature in the sampling sites during the sampling date |
为探讨凋落物分解与叶片生长过程的相互关系,根据亚热带常绿阔叶林气候带区大部分物种的叶面积指数动态过程(夏传福等,2012)和已有研究资料对物候期进行划定,于2011年12月27日秋末落叶期(leave falling stage,LF)、2012年3月7日萌动期(leave budding stage,LB)、2012年4月27日展叶期(leave exp and ing stage,LE)、2012年6月16日叶片成熟期(leave maturing stage,LM)、2012年8月25日盛叶期(leave graving stage,LG)和2012年10月30日叶衰期(leave senescing stage,LS)分别进行1次采样,采集不同树种2种孔径的分解袋各5袋,所采分解袋分为有土壤动物和移除土壤动物2种,小心去掉泥土,装入透气的收集袋迅速带回实验室,取部分样品在70 ℃烘干至恒重,供养分、质量损失率、木质素和纤维素含量测定用。采用重铬酸钾外加热法测定凋落物全碳含量;采用半微量凯氏定氮法测定全氮含量;采用钼锑钪比色法测定全磷含量;采用改进的Van Soest中性洗涤纤维(NDF)及酸性洗涤纤维(ADF)方法测定木质素含量和纤维素含量(邓仁菊等,2010)。
2.2 数据处理凋落物每阶段的养分释放率Rn、土壤动物对每阶段凋落物养分的贡献率Pfau及各阶段养分的释放速率Vn计算公式(Irmler,2000; Heneghan et al.,1999; Xin et al.,2012)如下:
| $\begin{array}{l} {R_n} = \left({{C_{n - 1}}{M_{n - 1}} - {C_n}{M_n}} \right)/{C_0}{M_0} \times 100\% ;\\ \;\;\;\;\;\;{P_{{\rm{fau}}}} = \left({{R_{{\rm{b}}n}} - {R_{{\rm{s}}n}}} \right)/{R_{{\rm{b}}n}} \times 100\% ;\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;{V_n} = {R_n}/t \times 100\% . \end{array}$ | (1) |
式中:C0为分解初始凋落物养分浓度;Cn-1为前一次凋落物养分浓度;Cn为当次凋落物养分浓度;M0为分解初始凋落物干质量;Mn-1为前一次凋落物残留量;Mn为当次凋落物残留量;Rbn为当次大孔径凋落物袋内凋落物养分的释放率;Rsn为当次小孔径凋落物袋内凋落物养分的释放率;t为当次采样与前一次采样的时间间隔(d)。
数据统计与分析采用SPSS 20.0和Excel完成,采用单变量多因素方差分析(Univariate ANOVA)统计树种、土壤动物和物候期对凋落物N和P浓度、释放率以及释放速率的影响。
3 结果与分析 3.1 凋落物分解过程中N和P浓度凋落物分解试验表明,N浓度在4种凋落物的分解过程中均表现出升高的趋势,去除土壤动物仅在叶片成熟期显著影响N浓度,且在去除土壤动物前后均表现出较大差异外,其他各期差异不显著(图 2)。土壤动物的作用使叶片成熟期马尾松和香樟凋落物N浓度升高,但降低了柳杉和麻栎凋落物N浓度。4种凋落物P浓度在分解过程中以叶片成熟期和盛叶期达到最高值。除土壤动物显著影响叶片成熟期香樟P浓度外,土壤动物对其他3种凋落物分解过程中P浓度无显著影响。
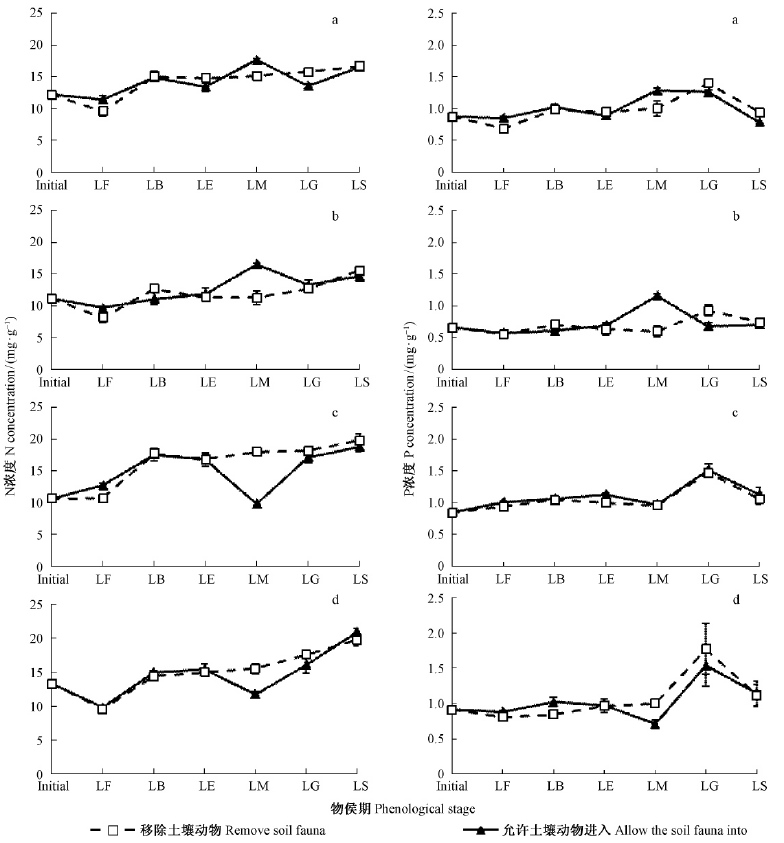 |
图 2 各物候期土壤动物对凋落物分解过程中N和P浓度的影响 Fig. 2 Effects of soil fauna on N and P concentrations during foliar litter decomposition at different phenological stagesInitial:初始值; LF: 秋末落叶期Leave falling stage; LB: 萌动期Leave budding stage; LE: 展叶期Leaf expanding stage; LM: 叶片成熟期Leave maturing stage; LG: 盛叶期Leave graving stage; LS: 叶衰期Leave senescing stage; a: 马尾松 Pinus massoniana; b: 香樟 Cinnamomum camphora; c: 柳杉 Cryptomeria fortunei; d: 麻栎Quercus acutissima. 下同。 The same below. |
凋落物分解过程中,2种孔径凋落物袋中马尾松、香樟和麻栎凋落物N均在秋末落叶期表现为释放,而在萌动期表现为富集,但柳杉凋落物N在2个时期均表现为富集(图 3)。移除土壤动物条件下,4种凋落物N在展叶期表现为释放,但此后释放率持续下降。允许土壤动物进入条件下,马尾松和香樟凋落物N在叶片成熟期表现为明显富集,而盛叶期表现为明显释放;柳杉和麻栎凋落物N却表现为叶片成熟期释放而盛叶期明显富集。土壤动物明显降低了叶片成熟期马尾松和香樟凋落物N释放率以及盛叶期柳杉和麻栎凋落物N释放率,但升高了盛叶期马尾松和香樟凋落物N释放率以及叶片成熟期柳杉和麻栎凋落物N释放率,且土壤动物对其他时期凋落物N释放率无显著影响。
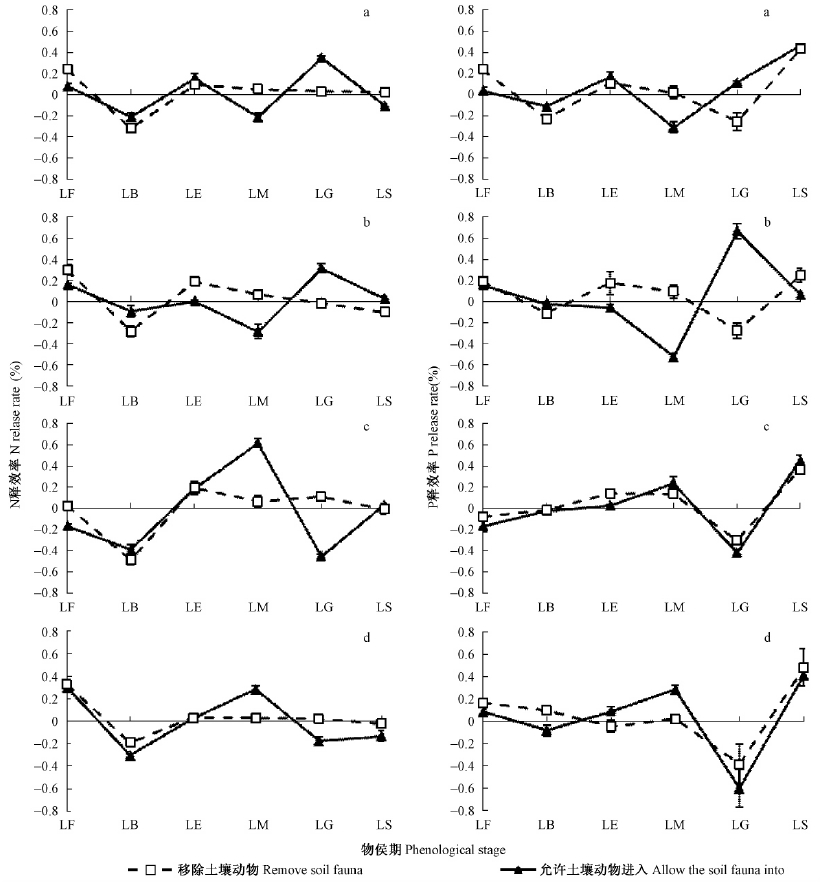 |
图 3 各物候期土壤动物对凋落物分解过程中N和P释放率的影响 Fig. 3 Effects of soil fauna on N and P release rate during foliar litter decomposition at different phenological stages |
凋落物分解过程中,2种孔径凋落物袋中马尾松、香樟和麻栎凋落物P均在秋末落叶期表现为释放,而柳杉却在秋末落叶期表现为富集(图 3)。移除土壤动物条件下,4种凋落物P在展叶期和叶片成熟期表现为释放,盛叶期表现为富集,至叶衰期又均表现为释放。允许土壤动物进入条件下,马尾松和香樟凋落物P在叶片成熟期表现为明显富集,而盛叶期表现为明显释放;柳杉和麻栎凋落物P却表现为叶片成熟期释放而盛叶期明显富集。土壤动物明显降低了叶片成熟期马尾松和香樟凋落物P释放率,升高了盛叶期马尾松和香樟凋落物P释放率,但土壤动物对柳杉和麻栎分解各期凋落物P释放率均无显著影响。
3.3 凋落物分解过程中土壤动物对凋落物N和P释放的贡献率整个凋落物分解期间,土壤动物对马尾松和香樟凋落物N释放的贡献表现为负效应,而对柳杉和麻栎表现为正效应;土壤动物对马尾松凋落物P释放的贡献表现为正效应,而对香樟、柳杉和麻栎表现为负效应。不同物候期土壤动物除对秋末落叶期和萌动期马尾松和香樟凋落物N释放的贡献表现为负效应外,其他各期均表现为正效应;此外,土壤动物对叶片成熟期、盛叶期和叶衰期柳杉和麻栎凋落物N释放的贡献均表现为正效应。土壤动物对秋末落叶期和萌动期马尾松和香樟凋落物P释放的贡献率表现为负效应,而在展叶期、叶片成熟期和盛叶期表现为正相应,麻栎凋落物分解过程也与马尾松和香樟表现出较为相似的变化趋势,除秋末落叶期和叶衰期表现为负效应外,其他时期表现为正效应。不同的是柳杉凋落物在分解过程中,展叶期表现为明显的负效应,其他时期均表现为正效应(图 4)。
 |
图 4 各物候期土壤动物对凋落物分解过程中N和P的贡献率 Fig. 4 Contribution rate of soil fauna to N and P during foliar litter decomposition at different phenological stagesFY:整个第1年 First year. |
凋落物分解过程中,2种孔径凋落物袋中4种凋落物N释放速率均表现为萌动期慢于秋末落叶期和展叶期(图 5)。移除土壤动物条件下,4种凋落物N释放速率在展叶期达到第2个峰值,但此后释放速率持续下降。允许土壤动物进入条件下,马尾松和香樟凋落物N释放速率在叶片成熟期明显慢于盛叶期,而柳杉和麻栎凋落物N释放速率却在叶片成熟期明显快于盛叶期。土壤动物明显减慢了叶片成熟期马尾松和香樟凋落物N释放速率以及盛叶期柳杉和麻栎凋落物N释放速率,但加快了盛叶期马尾松和香樟凋落物N释放速率以及叶片成熟期柳杉和麻栎凋落物N释放速率,且土壤动物对其他时期凋落物N释放速率无显著影响。
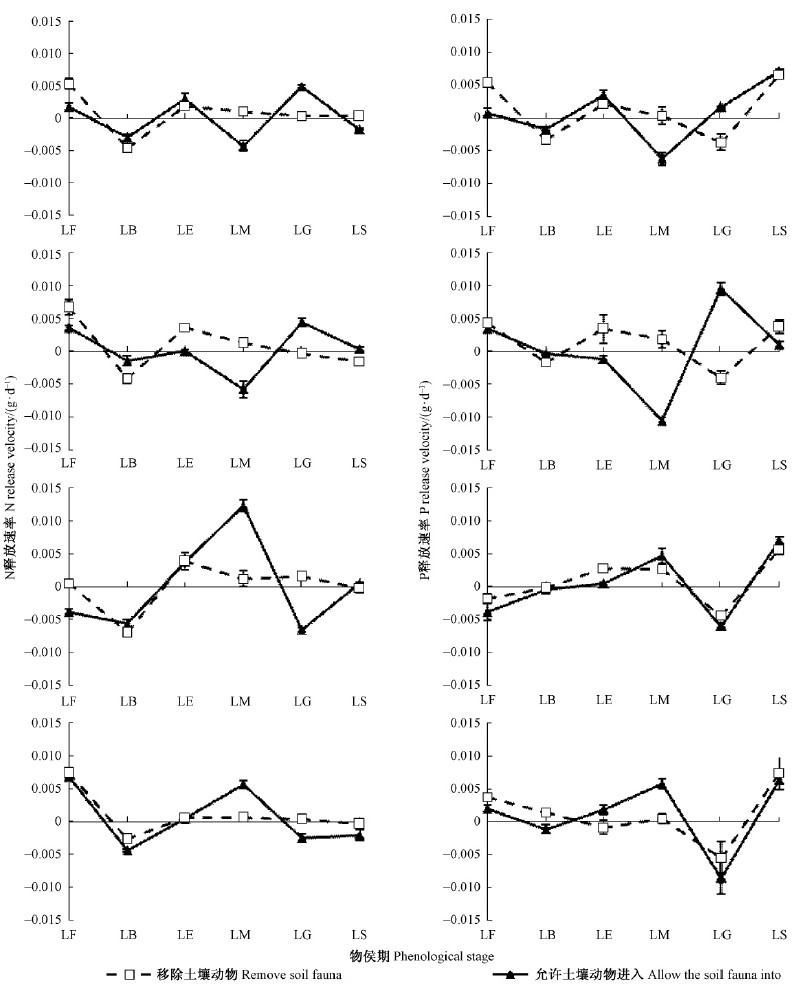 |
图 5 各物候期土壤动物对凋落物分解过程中N和P释放速率的影响 Fig. 5 Effects of soil fauna on N and P release velocity during foliar litter decomposition at different phenological stages |
凋落物分解过程中,2种孔径凋落物袋中马尾松、香樟和麻栎凋落物P释放速率均表现为秋末落叶期快于萌动期,而柳杉却表现为萌动期快于秋末落叶期,但4种凋落物P释放速率均表现为展叶期快于萌动期(图 5)。移除土壤动物条件下,4种凋落物P释放速率均表现为叶衰期快于叶片成熟期,而叶片成熟期又快于盛叶期。允许土壤动物进入条件下,马尾松和香樟凋落物P释放速率在叶片成熟期显著慢于盛叶期和叶衰期,但柳杉和麻栎凋落物P释放速率却在盛叶期显著慢于叶片成熟期和叶衰期。土壤动物明显减慢了叶片成熟期马尾松和香樟P释放速率,却明显加快了盛叶期马尾松和香樟P释放速率,但土壤动物对柳杉和麻栎凋落物P释放速率在凋落物分解的各时期均无显著影响。
3.5 凋落物分解过程中树种、土壤动物和物候期及其交互作用对凋落物N和P浓度、释放率以及释放速率的影响在第1年的凋落物分解过程中,除树种对凋落物的P释放率无显著影响、土壤动物对凋落物的P浓度及P释放率无显著影响外,树种、土壤动物和物候时期对其他各被测指标均表现出显著影响(表 2),其中,树种与土壤动物的交互作用对N和P释放率以及P释放速率无显著影响,但其他交互作用对凋落物N和P浓度、释放率以及释放速率均表现为极显著影响。
|
|
N和P是限制植物生长的主要养分元素(Manzoni et al.,2010; Vitousek et al.,2010; 赵琼等,2010),凋落物分解过程中释放N和P等养分元素供给于植物生长(Wright et al.,2011; 吕瑞恒等,2012)。本研究发现第1年的凋落物分解过程中,秋末落叶期和萌动期土壤动物明显抑制了马尾松和香樟凋落物分解过程中N和P的释放,而在展叶期、叶片成熟期和盛叶期促进了马尾松、香樟和麻栎凋落物分解过程中N和P的释放;并且在秋末落叶期、萌动期和展叶期土壤动物对N和P释放速度并无显著影响,而在植物生长大量消耗养分的叶片成熟期和盛叶期,土壤动物对凋落物N和P释放的作用更为明显。方差分析结果也表明土壤动物对凋落物N和P释放具有显著影响。这些结果充分说明土壤动物作用的凋落物N和P释放可能显著贡献于植物生长,这可能是区域森林生态系统植物生长与凋落物分解之间的耦合机制,可为认识亚热带森林生态系统关键过程提供重要科学依据。
养分元素的浓度因外界环境条件的变化和分解时期而异(林德喜等,2005)。凋落物分解过程中N和P的浓度在4种凋落物中不同物候期表现出较为明显的差异,但同一地区2种凋落物N和P浓度变化规律具有一定相似性,这可能主要是受气候条件的影响。土壤动物对凋落物分解过程中N浓度的作用在叶片成熟期更为显著,其中,在马尾松和香樟凋落物分解过程中土壤动物的作用表现为使凋落物N浓度升高,而在柳杉和麻栎凋落物分解过程中则表现为降低了N浓度,这可能主要和凋落物的初始N浓度(表 1)有关。值得关注的是,直到叶片成熟期土壤动物对凋落物N浓度的影响才更为显著,一方面是由于N主要以有机物形式存在,须经微生物降解后才能大量释放,而微生物受土壤动物影响,尤其是在土壤动物活跃的叶片成熟期,土壤动物对微生物的作用更强烈地影响了N浓度的变化(Hättenschwiler et al.,2005);另一方面,由于叶片成熟期植物进入快速生长阶段,植物生长对养分的过度需求可能亟需凋落物分解供给,而土壤动物在此过程的作用可能相对其他时期更为显著。此外,土壤动物的作用使叶片成熟期柳杉和麻栎凋落物N浓度降低,主要是因为都江堰较宜宾湿度大,适于土壤动物生存和细菌繁殖(Xu et al.,2012),而宜宾地区温度高、湿度相对较低,土壤动物对凋落物质量损失率的贡献相对较小,间接影响了土壤动物作用的N浓度降低。在第1年的凋落物分解过程中,N和P浓度不降反升,这与已有研究凋落物N和P的浓度变化规律较为一致(胡霞等,2012; 邱尔发等,2005),主要是N和P是通过有机物腐解矿化后释放,迁移率较慢,且其释放速率与凋落物质量损失率不同步造成的。
在凋落物分解的不同时期,养分元素的释放与迁移复杂多样,但主要趋势是先富集后释放,这与已有研究结果凋落物分解初期养分富集相一致(Piatek et al.,2009; 2010; Ball et al.,2008),产生这种趋势可能主要是由于受到凋落物质量的影响(Knops et al.,2010)和微生物固持养分、推迟养分的释放(Gulis et al.,2003a; 2003b)以及植物生长季节对养分需求较大(Wright et al.,2011)等原因造成的。1年的凋落物分解过程中,土壤动物明显促进了马尾松和香樟凋落物N的释放,而抑制柳杉和麻栎凋落物N的释放,这可能主要是受环境条件影响造成的。其中,凋落物分解的各时期土壤动物对柳杉凋落物N和P释放贡献的变化规律明显不同于其他树种,可能与柳杉凋落物质量(表 1)以及柳杉中土壤动物的群落组成有关,柳杉凋落物主要以菌食性土壤动物为主(王文君等,2013),菌食性土壤动物直接影响到微生物的生存活动,而微生物对养分的固持和释放起重要作用(Gulis et al.,2003a; 2003b)。此外,在凋落物分解过程中,土壤动物抑制了秋末落叶期和萌动期马尾松和香樟凋落物N和P的释放,却明显促进了叶片成熟期和盛叶期马尾松和香樟凋落物N和P的释放。这可能主要和以下3方面原因有关:1)在秋末落叶期,土壤动物定居凋落物袋需要一段时间,对凋落物N和P的释放作用还不明显,并且秋末落叶期凋落物刚刚进入分解阶段,其养分充足,N和P释放速度快,土壤动物对N和P释放的作用可能会相对较小,另外,秋末落叶期温湿度较低(Xu et al.,2012),不适于土壤动物生长和生存,极大地限制了土壤动物对N和P的贡献;2)萌动期N和P处于富集状态,土壤动物对N和P的富集作用影响相对较小;3)叶片成熟期和盛叶期雨热条件充沛,土壤动物活跃(Xu et al.,2012),土壤动物通过取食、刺激微生物活性(Gulis et al.,2003a; 2003b)等多种途径提高了对凋落物N和P的贡献。此外,叶片成熟期和盛叶期植物进入快速生长阶段,植物生长亟需养分,土壤动物可能会提高对N和P释放的贡献以满足于植物生长。
综上所述,在第1年的植物生长过程中,土壤动物明显影响了亚热带常绿阔叶林生态系统4种典型凋落物N和P的释放特征。其中,土壤动物明显促进了柳杉和麻栎凋落物分解过程N的释放以及马尾松凋落物分解过程中P的释放;但土壤动物抑制了马尾松和香樟凋落物分解过程中N的释放以及香樟、柳杉和麻栎凋落物分解过程中P的释放。相对于其他物候期,秋末落叶期和萌动期土壤动物抑制了马尾松和香樟凋落物分解过程中N和P的释放,而在展叶期、叶片成熟期和盛叶期土壤动物促进了马尾松、香樟和麻栎凋落物分解过程中N和P的释放。这些结果不仅表明土壤动物的作用与凋落物分解过程中N和P释放有密切的联系,同时为理解植物生长不同关键时期生态系统养分循环提供一定的科学依据,也为认识亚热带人工林和次生林生态系统凋落物分解机制提供了基础数据。
| [1] |
邓仁菊, 杨万勤, 张健, 等. 2010. 季节性冻融期间亚高山森林凋落物的质量变化. 生态学报, 30(3): 830-835. (Deng R J, Yang W Q, Zhang J, et al. 2010. Changes in litter quality of subalpine forests during one freeze-thaw season. Acta Ecologica Sinica, 30(3): 830-835[in Chinese]).(  1) 1)
|
| [2] |
丁圣彦, 宋永昌. 2004. 常绿阔叶林植被动态研究进展. 生态学报, 24(8): 1765-1775. (Ding S Y, Song Y C. 2004. Research advances in vegetation dynamic of evergreen broad-leaved forest. Acta Ecologica Sinica, 24(8): 1765-1775[in Chinese]).(  1) 1)
|
| [3] |
胡霞, 吴宁, 吴彦, 等. 2012. 川西高原季节性雪被覆盖对窄叶鲜卑花凋落物分解和养分动态的影响. 应用生态学报, 23(5): 1226-1232. (Hu X, Wu N, Wu Y, et al. 2012. Effects of snow cover on the decomposition and nutrient dynamics of Sibiraea angustata leaf litter in western Sichuan plateau, Southwest China. Chinese Journal of Applied Ecology, 23(5): 1226-1232[in Chinese]).(  1) 1)
|
| [4] |
林德喜, 樊后保. 2005. 马尾松林下补植阔叶树后森林凋落物量, 养分含量及周转时间的变化. 林业科学, 41(6):7-15. (Lin D X, Fan H B. 2005. Changes in amount, nutrient contents and turnover time of forest litter after interplanting hardwood species under masson pine stand. Scientia Silvae Sinicae, 41(6):7-15[in Chinese]).(  1) 1)
|
| [5] |
吕瑞恒, 李国雷, 刘勇, 等. 2012. 不同立地条件下华北落叶松叶凋落物的分解特性. 林业科学, 48(2): 31-37. (Lü R H, Li G L, Liu Y, et al. 2012. Decomposition characteristics of coniferous litter under different site conditions in a Larix principis-rupprechtii plantation. Scientia Silvae Sinicae, 48(2): 31-37[in Chinese]).(  1) 1)
|
| [6] |
邱尔发, 陈卓梅, 郑郁善, 等. 2005. 麻竹山地笋用林凋落物发生, 分解及养分归还动态. 应用生态学报, 16(5): 811-814. (Qiu E F, Cheng Z M, Zheng Y S, et al. 2005. Dynamics of litterfall and its decomposition and nutrient return of shoot-used Dendrocalamus latiflorus in mountainous areas of Fujian Province. Chinese Journal of Applied Ecology, 16(5): 811-814[in Chinese]).(  1) 1)
|
| [7] |
王文君, 杨万勤, 谭波, 等. 2013. 四川盆地亚热带常绿阔叶林不同物候关键时期凋落物分解过程中土壤动物的群落动态. 生态学报, 33(18): 5737-5750. (Wang W J, Yang W Q, Tan B, et al. 2013. The dynamics of soil fauna community during litter decomposition at different phenological stages in the subtropical evergreen broad-leaved forests in Sichuan basin. Acta Ecologica Sinica, 33(18): 5737-5750[in Chinese]).(  1) 1)
|
| [8] |
夏传福, 李静, 柳钦火. 2012. 基于 MODIS叶面积指数的遥感物候产品反演方法. 农业工程学报, 28(19): 103-109. (Xia C F, Li J, Liu Q H. 2012. Vegetation phenology monitoring method using time-series MODIS LAI data. Transactions of the Chinese Society of Agricultural Engineering, 28(19): 103-109[in Chinese]).(  1) 1)
|
| [9] |
赵琼, 刘兴宇, 胡亚林, 等. 2010. 氮添加对兴安落叶松养分分配和再吸收效率的影响. 林业科学, 46(5): 14-19.) Zhao Q, Liu X Y, Hu Y L, et al. 2010. Effects of nitrogen addition on nutrient allocation and nutrient resorption efficiency in Larix gmelinii. Scientia Silvae Sinicae, 46(5): 14-19.[in Chinese])(  1) 1)
|
| [10] |
Ball B A, Bradford M A, Hunter M D. 2008. Nitrogen and phosphorus release from mixed litter layers is lower than predicted from single species decay. Ecosystems, 12(1): 87-100.( 1) 1)
|
| [13] |
Barantal S, Schimann H, Fromin N, et al. 2012. Nutrient and carbon limitation on decomposition in an amazonian moist forest. Ecosystems, 15(7): 1039-1052.( 1) 1)
|
| [13] |
Berglund S L, Ågren G I. 2012. When will litter mixtures decompose faster or slower than individual litters? A model for two litters. Oikos, 121(7): 1112-1120.( 1) 1)
|
| [14] |
Crutsinger G M, Sanders N J, Classen A T. 2009. Comparing intra-and inter-specific effects on litter decomposition in an old-field ecosystem. Basic and Applied Ecology, 10(6): 535-543.( 1) 1)
|
| [15] |
Davidson E A, Reis de Carvalho C J, Vieira I C, et al. 2004. Nitrogen and phosphorus limitation of biomass growth in a tropical secondary forest. Ecological Applications, 14(4): 150-163.( 1) 1)
|
| [16] |
Gulis V, Suberkropp K. 2003a. Leaf litter decomposition and microbial activity in nutrient-enriched and unaltered reaches of a headwater stream. Freshwater biology, 48(1): 123-134.( 3) 3)
|
| [17] |
Gulis V, Suberkropp K. 2003b. Interactions between stream fungi and bacteria associated with decomposing leaf litter at different levels of nutrient availability. Aquatic Microbial Ecology, 30(2): 149-157.( 2) 2)
|
| [18] |
Hättenschwiler S, Tiunov A V, Scheu S. 2005. Biodiversity and litter decomposition in terrestrial ecosystems. Annual Review of Ecology, Evolution, and Systematics, 36(1): 191-218.( 1) 1)
|
| [19] |
Heneghan L, Coleman D, Zou X, et al. 1999. Soil microarthropod contributions to decomposition dynamics: tropical-temperate comparisons of a single substrate. Ecology, 80(6): 1873-1882.( 1) 1)
|
| [20] |
Irmler U. 2000. Changes in the fauna and its contribution to mass loss and N release during leaf litter decomposition in two deciduous forests. Pedobiologia, 44(2): 105-118.( 1) 1)
|
| [21] |
Knops J M, Wedin D A, Naeem S. 2010. The role of litter quality feedbacks in terrestrial nitrogen and phosphorus cycling. Open Ecology Journal, 3: 14-25.( 1) 1)
|
| [22] |
Li J X, Zhang W X, Liao C H, et al. 2009. Responses of earthworms to organic matter at different stages of decomposition. Pedosphere, 19(3): 382-388.( 1) 1)
|
| [23] |
Manzoni S, Trofymow J A, Jackson R B, et al. 2010. Stoichiometric controls on carbon, nitrogen, and phosphorus dynamics in decomposing litter. Ecological Monographs, 80(1): 89-106.( 2) 2)
|
| [24] |
Perez-Moreno J, Read D. 2000. Mobilization and transfer of nutrients from litter to tree seedlings via the vegetative mycelium of ectomycorrhizal plants. New Phytologist, 145(2): 301-309.( 1) 1)
|
| [25] |
Piatek K B, Munasinghe P, Peterjohn W T, et al. 2010. A Decrease in oak litter mass changes nutrient dynamics in the litter layer of a central hardwood forest. Northern Journal of Applied Forestry, 27(3): 97-104.( 1) 1)
|
| [26] |
Piatek K B, Munasinghe P, Peterjohn W T, et al. 2009. Oak contribution to litter nutrient dynamics in an appalachian forest receiving elevated nitrogen and dolomite. Canadian Journal of Forest Research, 39(5): 936-944.( 1) 1)
|
| [27] |
Ramanathan B, Alagesan P. 2012. Isolation, characterization and role of gut bacteria of three different millipede species. Indian Journal of Science Research, 3(2): 55-61.( 1) 1)
|
| [28] |
Vitousek P M, Porder S, Houlton B Z, et al. 2010. Terrestrial phosphorus limitation: mechanisms, implications, and nitrogen-phosphorus interactions. Ecological Applications, 20(1): 5-15.( 2) 2)
|
| [29] |
Wood C T, Schlindwein C C, Soares G L, et al. 2012. Feeding rates of balloniscus sellowii (Crustacea, Isopoda, Oniscidea): the effect of leaf litter decomposition and its relation to the phenolic and flavonoid content. ZooKeys, 176: 231-245.( 2) 2)
|
| [30] |
Wright S J, Yavitt J B, Wurzburger N, et al. 2011. Potassium, phosphorus, or nitrogen limit root allocation, tree growth, or litter production in a lowland tropical forest. Ecology, 92(8): 1616-1625.( 3) 3)
|
| [31] |
Xin W, Yin X, Song B. 2012. Contribution of soil fauna to litter decomposition in Songnen sandy lands in northeastern China. Journal of Arid Environments, 77: 90-95.( 1) 1)
|
| [32] |
Xu G L, Kuster T M, Gunthardt-Goerg M S, et al. 2012. Seasonal exposure to drought and air warming affects soil Collembola and mites. PloS One, 7(8): 1-9.( 4) 4)
|
| [33] |
Zwahlen C, Hilbeck A, Nentwig W. 2007. Field decomposition of transgenic Btmaize residue and the impact on non-target soil invertebrates. Plant and Soil, 300(1/2): 245-257.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

