文章信息
- 刘泽彬, 程瑞梅, 肖文发, 郭泉水, 王娜
- Liu Zebin, Cheng Ruimei, Xiao Wenfa, Guo Quanshui, Wang Na
- 模拟水淹对中华蚊母树生长及光合特性的影响
- Effect of Flooding on Growth, Photosynthesis and Fluorescence Characteristics of Distylium chinense
- 林业科学, 2014, 50(9): 73-81
- Scientia Silvae Sinicae, 2014, 50(9): 73-81.
- DOI: 10.11707/j.1001-7488.20140910
-
文章历史
- 收稿日期:2013-11-14
- 修回日期:2014-01-18
-
作者相关文章
水淹是环境胁迫中一种重要的表现形式,水淹改变了植物的生长环境条件,对植物的形态、生理和代谢等都产生影响(Parolin,2001;Mielke et al.,2003)。如抑制新叶的形成,叶片易发黄或脱落,植物生长缓慢,生物量降低(吴麟等,2012);根系数量减少,根尖变色,根系活力下降(Ahmed et al.,2002;薛艳红等,2007);气孔关闭,光合速率下降,光合产物运输受阻(Gravatt et al., 1998;Mielke et al.,2003);PSⅡ光化学活性和电子传递速率降低(衣英华等,2006);活性氧代谢失衡(Lima et al.,2002);营养元素吸收受阻(Smethurst et al.,2005)等。河岸带植物或耐淹植物能够通过形态和生理调整来适应水淹环境。如有些植物能够形成不定根和肥大的皮孔来获取更多的氧气以弥补水淹造成的氧气供给不足(罗芳丽等,2007;王朝英等,2013);有些植物在水淹过程中气孔能够重新打开,净光合速率逐渐恢复(Kozlowaki et al.,1997);还有的植物能够通过形成复杂的抗氧化酶系来清除活性氧积累对细胞的破坏(Tan et al.,2010)等。这些形态和生理生态的适应机制对于植物抵御水淹环境起到了至关重要的作用。
中华蚊母树(Distylium chinense)为金缕梅科蚊母属常绿灌木,其根系发达,具有较强的耐冲刷、耐浸泡以及耐沙土掩埋等能力(韩官运等,2005)。通过示范区栽植发现,中华蚊母树在三峡库区消落带经历3年的冬蓄水淹后,苗木的保存率能够达到90%。在江水退去后30~40 天,能快速返青,并形成长期的绿化效果,是库区消落带植被恢复的理想树种之一。植株耐淹是由其生理特性决定的,目前对于中华蚊母树耐淹机制的研究主要集中在酶活性(彭秀等,2006)、质膜透性(陈桂芳等,2008)、光合特性(Li et al.,2011)、非结构碳水化合物(秦洪文等,2012)等方面,而关于反季节水淹及间歇性水淹对中华蚊母树生长、光合及荧光特性的影响还未见报道。中华蚊母树在消落带恢复中,为保证航运安全应在消落带高海拔区域(165 m以上区域)种植,而消落带高海拔区域只在秋冬季遭受水淹。因此,本文模拟秋冬季节消落带高海拔区域及库岸洪水线(175 m)附近的水分状况,特别设置了间歇性水淹组(模拟库岸洪水线附近水位波动带来的间歇性水淹),选取2年生中华蚊母树进行盆栽模拟研究。旨在研究: 1)不同水淹形式对中华蚊母树生长、光合及叶绿素荧光特征的影响;2)中华蚊母树对反季节水淹带来的复杂水分环境的生理适应机制。
1 材料与方法 1.1 试验材料及地点2012年8月将生长基本一致的60株2年生中华蚊母树移栽至花盆中,每盆1株。盆高17 cm,盆口直径22 cm。供试土壤为当地砂壤土,每盆土质量3.5 kg。将所有试验植株置于湖北省宜昌市秭归县中国林业科学研究院长江三峡库区森林生态环境定位站试验基地(30°53′ N,110°54′ E,海拔296 m)内进行相同光照和水分条件的管理。试验于2012年10月1日进行,此时植株株高为22.5 cm,基径为5.6 mm。
1.2 试验设计本试验参考Pezeshki等(1997)、Núñez-Elisea等(1999)的试验设计,将试验用苗随机分成4组,分别为对照组(CK)、持续性水淹组(CF)、间歇性水淹组(PF)和全淹组(FF),每组15盆。CK组进行常规水分管理;CF组水面在土壤表面上方5 cm左右;PF组水面在土壤上方5 cm左右,以14天为1个淹水-恢复周期,即7天水淹处理,随后7天将植株移出水池进行恢复生长;FF组水面没过植株20 cm左右。CF和PF组均在长宽高为4 m×4 m×0.45 m的水池中进行,FF组在长宽高为4 m×4 m×0.75 m的水池中进行。由于模拟用水相对清澈,为充分模拟库区消落带水体浑浊带来的低光强环境,本研究在FF组水池上方布设了一层遮阳网,使到达水下植物的光照强度小于10 μmol·m-2s-1(张艳红等,2006;Luo et al.,2011)。试验共持续49天,试验结束后于当日傍晚将所有植株移出水面,次日对各项指标进行取样测定(罗芳丽等,2007;Li et al.,2011)。
1.3 生长指标的测定试验开始前每处理随机选取6株植株对其叶片数量进行计数,并标号,试验结束后对标号的植株叶片数量进行重新计数,以求取每个植株叶片的增加量,每处理6次重复;试验结束后利用卷尺和数显游标卡尺分别对所有植株的株高和基径进行测定,每处理15次重复;同时对植株不定根及皮孔数等形态特征进行记录。
1.4 光合指标的测定选取植株健康成熟功能叶(植株从上到下第3或第4片叶),利用Li-6400 XT便携式光合测定仪测定净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)等气体交换参数。每处理测定3株,每株测定3次,取平均值,共3次重复。测定均在9:00—11:30、60%~70%的相对湿度下完成。测定时控制光合有效辐射为1 000 μmol·m-2s-1(Li et al.,2011),叶室温度设为20 ℃,CO2取自相对稳定的3 m高空,浓度为400~410 μmol·mol-1,同时标记位于叶室内叶片的区域,测定完成后将叶片放入带有坐标纸的夹板上用数码相机获取叶片图像,然后利用AutoCAD 2007 计算标记区域面积,导入叶面积重新计算(刘泽彬等,2013a)。
1.5 光合色素含量的测定采集用于测定光合指标的叶片,利用浸提法(高俊凤等,2008)用GENERAL TU-1221紫外可见分光光度计测定叶绿素a、叶绿素b和类胡萝卜素在A663,A645和A470的吸光度值,并计算其含量,总叶绿素含量=叶绿素a含量+叶绿素b含量,每处理3次重复。
1.6 叶绿素荧光参数的测定叶绿素荧光参数的测量与光合参数的测量同天进行,于0:00—5:30之间利用Li-6400 XT便携式光合测定仪的荧光叶室测定植株叶片的叶绿素荧光参数,每处理选取3个植株进行测定,每个植株测定3次,取平均值,共3次重复。测定时首先对待测植株叶片暗适应2 h(周珺等,2012),然后打开弱光测定初始荧光(F0),再打开一次饱和脉冲光(PFD为6 000 μmol·m-2s-1,频率20 KHz,0.8 s)测定最大荧光Fm。当饱和脉冲光结束后,再打开光化学光(PFD为1 000 μmol·m-2s-1),待荧光基本稳定后测定稳态荧光Fs,然后再打开一次饱和脉冲光测定最大荧光Fm′,关闭光化学光,同时打开远红光照射3 s,测得光下最小荧光F0′。根据Genty等(1989)的方法计算最大光化学效率(Fv/Fm)、光化学猝灭(qP)、非光化学猝灭(qN)、电子传递速率(ETR)等荧光参数。
1.7 统计分析数据统计分析采用Microsoft Excel 2007和SPSS 19.0软件结合进行。使用单因素方差分析(one-way ANOVA)来揭示不同水淹处理对中华蚊母树生长、光合及荧光特征的影响,并运用Duncan 检验法确定每个指标在处理间的差异显著性。利用SigmaPlot 11.0软件进行制图。
2 结果与分析 2.1 生长及形态特征的变化植物的生长及形态特征是对其所处生长环境的综合反映(Tang et al.,1983),植物在面对不同环境条件时往往会做出不同的适应方式,而形态结构的调整就是其中之一。从表 1可以看出,不同水淹形式中华蚊母树株高、基径没有明显影响,但对叶片增加量影响显著。经过49天的水淹,CK植株叶片数量平均增加了16.5片,而CF,PF,FF植株叶片并没有出现增加,均与CK植株差异显著。至水淹49天,CF,PF和FF植株叶片数量分别减少了8.83,6.49和1.00片。水淹促进CF植株不定根的产生,同时在茎基部产生大量特化的皮孔(表 1)。至水淹结束后,CF植株不定根数量平均为4.46个,特化皮孔为41.5个;相反,PF和FF植株并没有生成不定根和特化皮孔,PF植株没有产生不定根和皮孔可能是因为中华蚊母树能够耐受短期的缺氧,无需形成不定根和皮孔来获取更多的氧气;而FF植株没有产生不定根和皮孔可能是由于水中溶氧量很低,即使产生不定根和皮孔也不能增加氧气的吸收(罗芳丽等,2007)。这也表明中华蚊母树在形态结构上对不同形式的水淹有不同的适应策略。
|
|
叶绿素含量是反映叶片光合作用强弱的指标,在光能的吸收、传递和转换中发挥重要作用;类胡萝卜素是光吸收的辅助色素,负责吸收和传递电子,同时还可以吸收过多的光能,避免叶绿素的光氧化(刘泽彬等,2013b)。由表 2可知,持续性和间歇性水淹对中华蚊母树叶片叶绿素a、叶绿素b、总叶绿素以及类胡萝卜素含量的影响基本一致。与CK植株相比,CF,PF植株叶片叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均显著下降。CF植株叶片叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量分别比CK下降了40.0%,36.0%,38.8%和33.0%,PF植株则分别比CK下降了29.8%,27.9%,29.3%和20.0%。这表明持续性水淹及间歇性水淹影响叶绿素的合成或者导致叶绿素的分解,从而影响其净光合速率。相反,FF植株叶片的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均有所增加,但与CK植株差异不显著,这表明全淹并没有影响中华蚊母叶片光合色素的含量。从表 2还可知,叶片叶绿素a/b值在不同水淹形式下并没有明显差异,均约为3:1,这说明水淹条件下中华蚊母树光合反应中心色素与聚光色素之间仍能保持合理的分配比例,以确保光合作用的顺利进行。
|
|
水淹显著降低了CF和PF植株叶片的Pn,但PF植株叶片Pn下降的幅度要小于CF植株,且二者之间差异显著。水淹49天后CF和PF植株叶片Pn分别比CK降低了68.0%和36.1%,可以推测出持续性水淹对Pn的影响要大于间歇性水淹。水淹并没有明显影响FF植株叶片的Pn,水淹结束后FF植株叶片Pn为10.72 μmol·m-2s-1,与CK植株叶片Pn(10.87 μmol·m-2s-1)相当(图 1A),这可能是中华蚊母树对秋冬季水淹的一种适应能力。
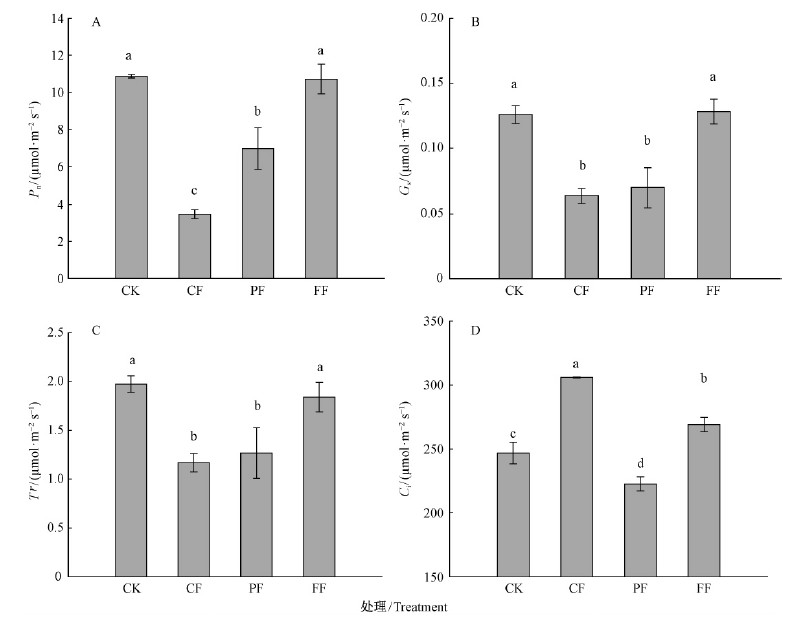 |
图 1 不同水淹形式下中华蚊母树叶片的净光合速率、气孔导度、蒸腾速率和胞间CO2浓度的变化(平均值±标准误)
Fig.1 Changes of Pn,Gs, Tr and Ci of D.chinense under different flooding forms(mean±SE)
不同小写字母表示在0.05水平上差异显著性。Different lower case letters denote the significant difference at the 0.05 level. 下同。The same below. A.净光合速率Pn;B.气孔导度Gs;C.蒸腾速率Tr;D.胞间CO2浓度Ci. |
CF和PF植株叶片Gs均出现了下降,显著低于CK和FF植株,但二者之间差异不显著(图 1B)。至水淹49天,CF和PF植株叶片Gs分别为0.064和0.070 μmol·m-2s-1,分别比CK植株降低了49.6%和44.7%。与对Pn的影响一致,FF植株叶片Gs并没有受到水淹的影响,水淹49天后FF植株叶片Gs仍能保持在CK植株的水平上。不同水淹形式对植株叶片Tr的影响与Gs一致,水淹显著降低了CF和PF植株叶片的Tr,但二者之间差异并不显著,这表明间歇性水淹Gs和Tr并没有像Pn那样在淹水解除后得到明显的恢复。而FF植株Tr并未受到水淹的显著影响(图 1C),说明中华蚊母树Gs和Tr对全淹具有较强的适应性。
植株叶片Ci对不同形式水淹的响应有所不同(图 1D),经过49天的水淹,CF和FF植株叶片Ci都出现显著的增加,CF植株叶片Ci比CK植株增加24.0%,而FF植株叶片Ci比CK植株增加9.0%。与CF和FF植株对水淹的响应不同,PF植株叶片Ci出现了显著下降,与CK植株相比,PF植株叶片Ci下降9.8%。
2.4 叶绿素荧光参数的变化荧光参数Fv/Fm是PSⅡ潜在光化学活性的度量,表明了PSⅡ利用光能的能力,不同水淹形式下植株叶片Fv/Fm表现为: CK>FF>PF>CF,前三者植株叶片Fv/Fm无明显差异,CF植株叶片Fv/Fm显著低于CK及其他处理植株(图 2A),49天水淹后,CK,CF,PF和FF植株叶片Fv/Fm分别为0.789,0.665,0.738和0.786。
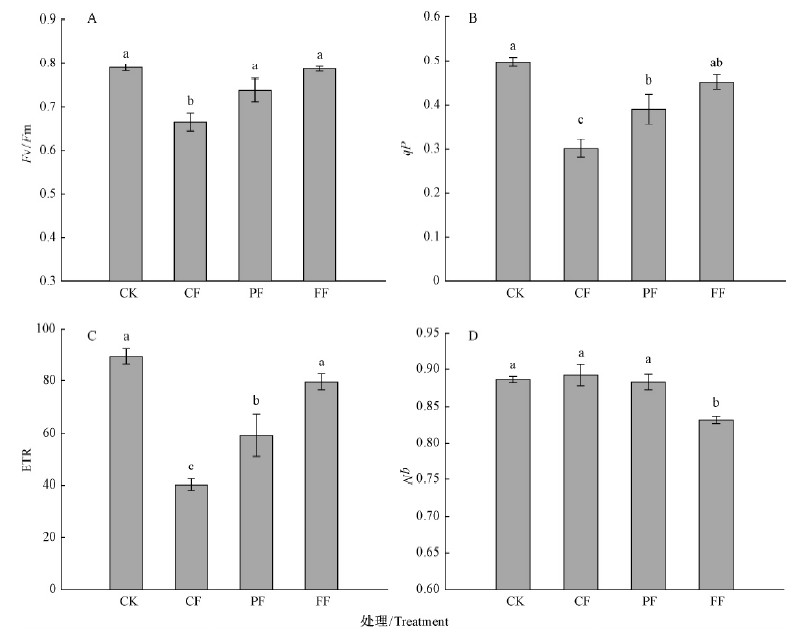 |
图 2 不同水淹形式下中华蚊母树最大光化学效率(A)、光化学猝灭(B)、电子传递速率(C)和非光化学猝灭(D)的变化(平均值±标准误) Fig.2 Changes of Fv/Fm(A), qP(B), ETR(C) and qN (D)of D.chinense under different flooding forms(mean±SE) |
荧光参数qP反映的是PSⅡ原初电子受体QA的氧化还原状态和PSⅡ开放中心的数目,其值越大说明PSⅡ的电子传递活性越大(张守仁,1999;王可玢等,1997)。受水淹影响,CF和PF植株叶片qP都出现显著下降,但PF植株叶片qP下降的幅度要小于CF植株,且二者之间差异显著。至49天水淹后,CF和PF植株叶片qP分别比CK植株降低了39.5%和21.6%;FF植株叶片qP虽有所下降,但与CK差异不显著。49天水淹后,FF植株叶片qP比CK植株降低9.2%(图 2B)。
不同水淹形式对植株叶片ETR的影响与qP类似,淹水显著降低CF和PF植株叶片的ETR,但PF植株叶片ETR显著高于CF。水淹49天后,CF和PF植株叶片ETR比CK植株分别下降55.1%和33.9%;水淹并没有显著降低FF植株叶片的ETR,水淹结束后,FF植株叶片ETR仅比CK植株下降了11.2%,仍维持在较高的水平上(图 2C)。
由此可知,间歇性水淹在水淹解除后可明显促使中华蚊母树Fv/Fm,qP和ETR的恢复,持续性水淹对Fv/Fm,qP和ETR的影响最大,而全淹对Fv/Fm,qP和ETR的影响最小。
荧光参数qN反映的是PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分,是植物光合机构的一种自我保护机制(郭春芳等,2009)。图 2D显示,水淹对CF和PF植株叶片的qN并没有显著影响,但水淹显著降低了FF植株叶片的qN。49天水淹后,FF植株叶片qN为0.832,比CK植株下降了6.1%,这表明CF和PF植株qN并没有对水淹做出积极响应,而FF植株qN的降低或许是对全淹低光量子通量的响应。
3 讨论有些植物能够耐受较长时间的水淹与植物本身形态结构对水淹的积极调整密不可分,如落羽杉(Taxodium distichum)幼苗通过分配更多的光合产物促进茎的生长来有效提高水淹的抵御能力(Eclan et al.,2002);枫杨(Pterocarya stenoptera)幼苗在水淹下通过生长不定根和肥大的皮孔以满足对氧气的获取来适应水淹环境(王朝英等,2013);香附子(Rhizoma cyperi)幼苗通过增加叶面积和基径来捕获更多的光能和氧气以提高耐淹性(刘泽彬等,2013a)。本研究中不同水淹形式的植株株高和基径均未大于CK植株,说明中华蚊母树并不是通过促进茎的伸长及增加基径的方式来应对水淹环境。受水淹影响,CF植株在形态上主要表现为不定根和特化皮孔的生成以及减少叶片数量,PF和FF植株在形态上主要表现为减少叶片数量。不定根和特化皮孔的生成可以增加植株对氧气的获取,叶片数量的减少可以降低植株对物质能量的消耗(刘泽彬等,2013a)。因此,中华蚊母树面对不同水淹环境在形态上的调整均有利于增强植株的耐淹性,对水淹环境具有一定的适应和调节能力。同时,不同植物形态结构对水淹的响应不同,也说明了有些适应性较强的库岸植物在面对水淹环境时各自都具有适应水淹环境的独特方式。
水淹会加速植株叶片光合色素的降解,引起叶绿素含量的降低,从而影响植株叶片的光合作用(陈芳青等,2008)。本试验中,CF和PF植株叶片叶绿素含量均受到水淹的显著影响,但FF植株叶片光合色素含量却并未受到水淹的明显影响,Gardiner等(2001)研究发现,遮荫水淹的宝塔栎(Quercus pagoda)叶片叶绿素含量要高于全光水淹下的叶绿素含量,因此得出水淹条件下低的光量子通量或许可以减弱植株叶绿素的光氧化。由于本试验中全淹环境光量子通量极低,FF植株能够维持较高的光合色素或许与全淹环境下低的光量子通量有关。同时,全淹环境下中华蚊母树能够维持较高的光合色素对于出水后的快速生长具有积极的作用。中华蚊母树在出水后可以及时捕获光能进行光合作用来满足植株生长所需的物质能量,这对其恢复生长极为有利。水淹条件下叶绿素a/b值的变化在不同植物中有所不同,受水淹影响,宜昌黄杨(Buxus ichangensis)叶片叶绿素a/b值会降低(薛艳红等,2007),而湿地松(Pinus ellottii)叶片叶绿素a/b值会升高(周珺等,2012)。本试验中,水淹并没有显著影响中华蚊母树叶片叶绿素a/b值。经过49天的水淹处理后,所有水淹处理植株叶绿素a/b值均维持在3:1。叶绿素a主要结合在光系统反应中心上,而叶绿素b主要结合在捕光色素蛋白复合物上(薛艳红等,2007),不同植物在水淹条件下叶绿素a/b值变化不同可能是由于水淹对不同植物光系统反应中心与捕光色素蛋白复合物的影响程度不同所致。
光合作用是植物生长所需能量的来源,是物质生产的基础,也是受环境胁迫影响明显的过程之一(王瑞等,2012),而Pn下降的程度可以用来检验植物对逆境条件下光合生理生态的响应能力(周珺等,2012)。对水淹敏感的栓皮栎(Quercus variabilis)在水淹处理50天后其Pn下降为对照的9%(衣英华等,2006),而中华蚊母树幼苗水淹49天后Pn为对照的32.0%,表现出对水淹的耐受力。Lavinsky等(2007)研究发现:弱光减轻了水淹下美洲格尼帕树(Genipa Americana)光合机构的破坏,从而使其具有较高的Pn。本试验中全淹环境并没有造成中华蚊母树光合机构的破坏或许与全淹环境下低的光量子强度有关,这与全淹对光合色素的影响一致。适应性较强的库岸带植物能够在水淹解除后迅速恢复其光合生理功能(Conner et al.,1997;Pezeshki,2001;Kodowski,2002)。本研究中,PF植株叶片Pn显著高于CF植株,表明间歇性水淹的植株Pn能够在水淹解除后得到一定的恢复,从而延缓植株Pn下降的速率,使植株Pn在更长时间内维持在较高的水平上,表现出较强的恢复能力。
水淹所引起Pn下降的原因主要有2个方面的因素: 一方面为气孔的关闭导致叶片对CO2的吸收降低,从而对碳的获取减少,光合酶底物减少;另一方面为叶细胞光合能力的下降,使叶肉细胞利用CO2的能力降低,从而使胞间CO2的浓度升高(阎秀峰等,1994;刘泽彬等,2013b)。枫杨在单纯水淹或干旱条件下主要通过非气孔因素(即叶肉细胞利用CO2的能力下降)来限制Pn,而经历水淹-干旱交替胁迫时则是因为气孔限制而导致Pn下降(王振夏等,2012)。本试验中也得出类似结论,CF植株叶片Gs不仅出现了显著下降,其Ci也出现了明显上升,表明持续性水淹下中华蚊母树Pn的下降除与气孔关闭有关外,还与植株叶细胞光合能力的下降有关;而PF植株叶片Gs出现了显著下降的同时Ci也出现了显著下降,这表明间歇性水淹下中华蚊母树Pn的下降主要是由气孔关闭所引起的。目前对于出现这种现象的内在机制尚不清楚,还有待进一步研究。
叶绿素荧光被称为植物光合功能的快速、无损的探针,可以灵敏快速地了解植物光合作用对外界环境胁迫的响应(张守仁,1999;Maxwell et al.,2000),与“表观性”的气体交换参数等相比,叶绿素荧光特性更侧重对植株光合机构“内在性”的揭示(Krause et al., 1991)。本研究显示,荧光参数Fv/Fm,qP和ETR在不同水淹环境的变化均表现为CK>FF>PF>CF,这与“表观性”的净光合速率等气体交换参数对水淹的响应基本一致,说明水淹对中华蚊母树光合机构“内外”表现特性的影响具有一致性。CF植株Fv/Fm,qP和ETR的降低表明中华蚊母树PSⅡ反应中心活性、光能转换效率以及光合电子传递受到了水淹的影响,PF植株Fv/Fm,qP和ETR高于CF植株表明水淹对中华蚊母树光合机构PSⅡ造成的损坏同样可以通过解除水淹后得到修复,而FF植株Fv/Fm,qP和ETR并未受到水淹的明显影响,或许也与全淹环境下低的光量子通量有关。有些适应性强的植物在遭受逆境胁迫时往往能够通过提高热耗散能力对其自身形成保护(Bader et al.,2000),如,互叶白千层(Melaleuca alternifolia)、巴西红厚壳(Calophyllum brasiliense)等耐淹植物在遭受水淹后荧光参数qN会显著增加以抵御过剩光能对光合机构的破坏(Jing et al.,2009;de Oliveira et al.,2010)。本研究中,CF和PF植株叶片qN并没有出现显著增加,水淹49天后均与CK植株差异不显著,暗示持续性水淹和间歇性水淹下植株qN并没有做出相应的调整来耗散掉因光合电子传递活性降低而产生的过多的光能,这或许是持续性水淹和间歇性水淹光合机构出现损伤的原因之一。而FF植株qN显著低于CK及其他处理植株,由于植株长期处于全淹环境中,光照强度较弱,产生过剩光能的几率相对较少,植株qN的降低或许是对全淹弱光环境的适应。
Li等(2011)研究发现夏秋季全淹(8—10月)会造成中华蚊母树光合机构的破坏,而本研究综合光合色素、气体交换参数以及叶绿素荧光参数在全淹环境中的变化,发现中华蚊母树光合机构并没有受到全淹环境的影响,由于不同水淹深度水体的含氧量和水压等因素有所差异,对植物胁迫程度也会有所不同(Tan et al.,2010)。Li等(2011)的试验植株淹没程度要比本试验设置的更深,这可能是造成两者研究结果有所差别的原因,这也暗示了中华蚊母树在浅淹环境下具有较强的适应能力;与此同时,水体温度也会对水淹植物产生重要的影响,有研究发现(van Eck et al.,2005),冬季水淹对酸模(Rumex acetosa)的影响要远小于夏季水淹,冬季水淹几乎不会影响酸模在河漫滩的分布。以往类似研究大部分模拟的是夏季水淹(罗芳丽等,2007),而关于秋冬季水淹对植物影响的研究较少,季节之间水体温度的差异或许也是本研究结果区别于以往其他类似研究的一个原因。此外,有研究发现(Lavinsky et al.,2007),遮荫能够减轻水淹下美洲格尼帕树叶片光合机构的破坏。笔者通过对中华蚊母树半淹处理植株的水上叶片与水下叶片光合特性的比较也发现,其水下叶片的净光合速率以及Fv/Fm等荧光参数均明显高于水上叶片,水下低光强的环境或许减轻了过剩光能对中华蚊母树叶片光合机构的破坏,因此,笔者认为全淹所造成的低光强环境也是全淹植株光合机构未造成损伤的原因之一。三峡库区消落带秋冬季具有水温低、水体浑浊的特点,中华蚊母树的这种适应特性或许对于其在三峡库区消落带上层的生存及恢复生长极为有利。
从本试验的研究结果来看,中华蚊母树对秋冬季节不同水淹形式呈现出不同的适应策略,均表现出一定的可塑性。持续性水淹虽然从光合色素到光合生理再到叶绿素荧光均表现出明显下降的趋势,但试验过程中能够通过形成不定根、特化的皮孔以及减少叶片数量来增加对水淹的抗逆能力;间歇性水淹使植物在解除水淹胁迫后各项生理指标很快得到一定的恢复,减缓了水淹影响的速率,从而使各项生理指标维持在相对较高的水平上,同时通过减少叶片数量等形态调整来减少对光合产物的消耗,增强自身的耐淹能力;而全淹环境下的植株能够维持正常光合色素含量、光合生理特性以及叶绿素荧光特性,体现出极强耐淹能力,同时也为植株出水后迅速恢复生长提供了保障。中华蚊母树这种面对秋冬季节不同水淹环境所体现出来的生理适应机制,或许是其在三峡库区消落带复杂水分环境中存活下来的重要原因。
| [1] |
陈芳青,郭成圆,王传华,等. 2008. 水淹对秋华柳幼苗生理生态特征的影响. 应用生态学报, 19(6): 1229-1233.( 1) 1)
|
| [2] |
陈桂芳,蔡孔瑜,李在军,等. 2008. 淹水对中华蚊母树生长及生理的影响. 西南林学院学报,28(5): 42-44.( 1) 1)
|
| [3] |
郭春芳,孙云,唐玉海,等. 2009. 水分胁迫对茶树叶片叶绿素荧光特性的影响. 中国生态农业学报,17(3): 560-564.( 1) 1)
|
| [4] |
高俊凤. 2008. 植物生理学实验指导. 北京: 高等教育出版社,74-77.( 1) 1)
|
| [5] |
韩官运,侯昆仑,何亨晔,等. 2005. 中华蚊母扦插实验初探. 重庆林业科技,71(2): 22-23.( 1) 1)
|
| [6] |
刘泽彬,程瑞梅,肖文发,等. 2013a. 淹水对三峡库区消落带香附子生长及光合特性的影响. 生态学杂志,32(8): 2015-2022.( 3) 3)
|
| [7] |
刘泽彬,程瑞梅,肖文发,等. 2013b. 水淹胁迫对植物光合生理生态的影响. 世界林业研究,26(3): 33-38.( 2) 2)
|
| [8] |
罗芳丽,曾波,陈婷,等. 2007. 三峡库区岸生植物秋华柳对水淹的光合和生长响应. 植物生态学报, 31(5): 910-918.( 4) 4)
|
| [9] |
彭秀,肖千文,罗韧,等. 2006. 淹水胁迫对中华蚊母树生理生化特性的影响. 四川林业科技,27(2): 17-20.( 1) 1)
|
| [10] |
秦洪文,刘正学,周大祥,等. 2012. 中华蚊母对反季节完全水淹的生理响应. 河南农业科学,41(11): 126-128.( 1) 1)
|
| [11] |
王朝英,李昌晓,张晔. 2013. 水淹对枫杨幼苗光合生理特征的影响. 应用生态学报,24(3): 675-682.( 2) 2)
|
| [12] |
王可玢,许春晖,赵福洪,等. 1997. 水分胁迫对小麦旗叶某些体内叶绿素a荧光参数的影响. 生物物理学报,13(2): 123-128.( 1) 1)
|
| [13] |
王瑞,梁坤伦,周志宇,等. 2012. 不同淹水梯度对紫穗槐的营养生长和生理响应. 草业学报,21(1): 149-155.( 1) 1)
|
| [14] |
王振夏,魏虹,吕茜,等. 2012. 枫杨幼苗对土壤水分"湿-干"交替变化光合及叶绿素荧光的响应. 生态学报,33(3): 888-897.( 1) 1)
|
| [15] |
吴麟,张伟伟,葛晓敏,等. 2012. 植物对淹水胁迫的响应机制研究进展. 世界林业研究,26(6): 27-33.( 1) 1)
|
| [16] |
薛艳红,陈芳清,樊大勇,等. 2007. 宜昌黄杨对夏季淹水的生理生态学响应. 生物多样性,15(5): 542-547.( 3) 3)
|
| [17] |
阎秀峰,孙国峰,李敬兰,等. 1994. 羊草和星星草光合蒸腾日变化的比较研究. 植物研究,14(3): 287-291.( 1) 1)
|
| [18] |
衣英华,樊大勇,谢宗强,等. 2006. 模拟淹水对枫杨和栓皮栎气体交换、叶绿素荧光和水势的影响. 植物生态学报,30(6): 960-968.( 2) 2)
|
| [19] |
张守仁. 1999. 叶绿素荧光动力学参数的意义及讨论. 植物学通报,16(4): 444-448.( 2) 2)
|
| [20] |
张艳红,曾波,付天飞,等. 2006. 长期水淹对秋华柳根部非结构碳水化合物含量的影响. 西南师范大学学报: 自然科学版,31(3): 153-156.( 1) 1)
|
| [21] |
周珺,魏虹,吕茜,等. 2012. 土壤水分对湿地松幼苗光合特征的影响. 生态学杂志,31(1): 30-37.( 3) 3)
|
| [22] |
Ahmed S,Nawata E,Hosokawa M,et al. 2002. Alterations in photosynthesis and some anti-oxidant enzymatic activities of mungbean subjected to waterlogging. Plant Science,163(1): 117-123.( 1) 1)
|
| [23] |
Bader M R,von Caemmerer S,Ruuska S,et al. 2000. Electron flow to oxygen in higher plants and algae: rates and control of direct photoreduction(Mehler reaction)and rabisco oxygenase. Biological Sciences,355(1402): 1433-1446.( 1) 1)
|
| [24] |
Conner W H,Mcleod K W,Mccarron J K. 1997. Flooding and salinity effects on growth and survival of four common forested wetland species. Wetlands Ecology Management,5(2): 99-109.( 1) 1)
|
| [25] |
de Oliveira V C,Joly C A. 2010. Flooding tolerance of Calophyllum brasiliense Camb. (Clusiaceae): morphological,physiological and growth responses. Trees, 24(1): 185-193.(  1) 1)
|
| [26] |
Eclan J M,Pezeshki S R. 2002. Effects of flooding on susceptibility of Taxodium distichum L. seedlings to drought. Photosynthetica,40(2): 177-182.( 1) 1)
|
| [27] |
Gardiner E S,Krauss. 2001. Photosynthetic light response of flooded cherrybark oak(Quercus pagoda)seedlings grown in two light regimes. Tree Physiology. 21(15): 1103-1111.( 1) 1)
|
| [28] |
Genty B,Briantais J M,Barker N R. 1989. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. Biochimica et Biophysica Acta,990(1): 87-92.( 1) 1)
|
| [29] |
Gravatt D A,Kirby C J. 1998. Patterns of photosynthesis and starch allocation in seedlings of four bottomland tree species subjected to flooding. Tree Physiology,18(6): 411-417.( 1) 1)
|
| [30] |
Jing Y X,Li G L,Gu B H,et al. 2009. Leaf gas exchange,chlorophyll fluorescence and growth responses of Melaleuca alternifolia seedlings to flooding and subsequent recovery. Photosynthetica,47(4): 595-601.( 1) 1)
|
| [31] |
Kozlowaki T T. 1997. Responses of woody plants to flooding and salinity.Victoria, Canada: Heron Publishing.( 1) 1)
|
| [32] |
Kodowski T T. 2002. Physiological-ecological impacts of flooding on riparian forest ecosystems. Wetlands,22(3): 550-561.( 1) 1)
|
| [33] |
Krause G H, Weis E. 1991. Chlorophyll fluorescence and photosynthesis: the basics. Annual Review of Plant Physiology and Plant Molecular Biology,42(1): 313-349.( 1) 1)
|
| [34] |
Lavinsky A O,Sant, Ana C D S,Mielke M S,et al. 2007.Effects of light availability and soil flooding on growth and photosynthetic characteristics of Genipa americana L. seedlings. New Forests,34(1): 41-50. ( 2) 2)
|
| [35] |
Li X L,Li N,Yang J,et al. 2011. Morphological and photosynthetic responses of riparian plant Distylium chinense seedlings to simulated autumn and winter ooding in Three Gorges Reservoir Region of the Yangtze River,China. Acta Ecologica Sinica,31(1): 31-39.( 5) 5)
|
| [36] |
Lima A L S,DaMatta F M,Pinheiro H A,et al. 2002. Photochemical responses and oxidative stress in two clones of Coffea canephora under water deficit conditions. Environmental Experimental Botany,47(3): 239-247. ( 1) 1)
|
| [37] |
Luo F L,Nagel K A,Scharr H,et al. 2011. Recovery dynamics of growth, photosynthesis and carbohydrate accumulation after de-submergence:a comparison between two wetland plants shoeing escape and quiescence strategies. Annals of Botany,107(1): 49-63.( 1) 1)
|
| [38] |
Maxwell K,Johnson G N. 2000. Chlorophyll fluorescence:a practical guide. Journal of Experimental Botany,51(345): 659-668.( 1) 1)
|
| [39] |
Mielke M S,de Almeida A F,Gomes F P,et al. 2003. Leaf gas exchange,chorophyll fluorescence and growth responses of Genipa Americana seedlings to soil flooding. Environment and Experimental Botany,50(3): 221-231.( 2) 2)
|
| [40] |
Núñez-Elisea R,Schaffer B,Fisher J B,et al. 1999. Influence of flooding on net CO2 assimilation, growth and stem anatomy of Annona species. Annals of Botany,84(6): 771-780.( 1) 1)
|
| [41] |
Parolin P. 2001. Morphotological and physiological adjustments to waterlogging and drought in seedlings of Amazonian floodplain trees. Oecologia,128(3): 326-335.( 1) 1)
|
| [42] |
Pezeshki S R. 2001. Wetland plant responses to soil flooding. Environment Experimental Botany, 46(3): 299-312.( 1) 1)
|
| [43] |
Pezeshki S R and Anderson P H. 1997. Responses of three bottomland species with different flood tolerance capabilities to various flooding regimes. Wetlands Ecology and Management,4(4):245-256.( 1) 1)
|
| [44] |
Smethurst C F,Garnett T,Shabala S. 2005. Nutritional and chlorophyll fluorescence responses of lucerne(Medicago sativa)to waterlogging and subsequent recovery. Plant and Soil,270(1): 31-45.( 1) 1)
|
| [45] |
Tan S D,Zhu M Y,Zhang Q F. 2010. Physiological responses of bermudagrass(Cynodon dactylon)to submergence. Acta Physiologiae Plantarum,32(1): 133-140.( 2) 2)
|
| [46] |
Tang Z C,Kozlowski T T. 1983. Responses of Pinus banksiana and Pinus resinosa seedlings to flooding. Canadian Journal of Forest Research,13(4): 633-639.( 1) 1)
|
| [47] |
van Eck W H J M, Lenssen J P M, RengelinkR H J,et al. 2005. Water temperature instead of acclimation stage and oxygen concentration determines responses to winter floods. Aquatic Botany,81(3): 253-264.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

