文章信息
- 张于光, 宿秀江, 丛静, 陈展, 卢慧, 刘敏超, 李迪强
- Zhang Yuguang, Su Xiujiang, Cong Jing, Chen Zhan, Lu Hui, Liu Minchao, Li Diqiang
- 神农架土壤微生物群落的海拔梯度变化
- Variation of Soil Microbial Community along Elevation in the Shennongjia Mountain
- 林业科学, 2014, 50(9): 161-166
- Scientia Silvae Sinicae, 2014, 50(9): 161-166.
- DOI: 10.11707/j.1001-7488.20140922
-
文章历史
- 收稿日期:2013-07-16
- 修回日期:2014-08-04
-
作者相关文章
2. 湖南白云山国家级自然保护区管理局 保靖 416500;
3. 中南大学资源加工与生物工程学院 长沙 410083;
4. 五邑大学化学与环境工程学院 江门 529020
2. Hunan Baiyunshan National Nature Reserve Administration Baojing 416500;
3. School of Mineral Processing and Bioengineering, Central South University Changsha 410083;
4. School of Chemical and Environmental Engimeering, Wuyi University Jiangmen 529020
生物多样性的海拔梯度分布格局及其形成机制一直是生物学和生态学理论研究的重要内容之一,也是全面理解生物多样性和生态系统对环境变化响应的重要内容(Wang et al.,2010)。长期以来,对动物和植物进行了大量的相关研究,并提出许多解释其分布格局和形成机制的假说和理论(Renaud et al.,2009)。目前,关于土壤微生物的海拔梯度分布规律的相关研究还很少,在海拔梯度分布格局上,土壤微生物是否与大型生物有着相似的分布规律仍没有得到较好的验证,有待进一步研究探讨(Fierer et al.,2011)。
磷脂脂肪酸(PLFA)是所有活体微生物细胞膜的主要组成成分,在真核生物和细菌的膜中磷脂分别约占50%和98%,不同的微生物有不同的PLFA特征(张秋芳等,2009)。磷脂脂肪酸法是一种快速、可靠并可重现的分析土壤微生物群落结构的方法,可用于表征在数量上占优势的土壤微生物群落,具有较高的准确性、稳定性和敏感性,已广泛应用于微生物生态学和地理学等研究领域(张秋芳等,2009; Wagai et al.,2011; 张地等,2012)。
神农架自然保护区位于我国地势第Ⅱ阶梯的东部边缘,是大巴山脉余脉,被誉为“华中屋脊”,是一个具有全球意义的生物多样性地区。神农架山峰海拔多在1 500 m以上,最高峰神农顶的海拔为3 105.4 m,最低海拔398 m,最大相对高差 2 707.4 m,形成典型的垂直山地生态系统和植被类型(丛静等,2013),为开展海拔梯度对生物多样性和生态系统的影响研究提供理想场所。本研究沿海拔梯度(1 700~2 800 m)选择了4种典型天然森林植被为研究对象,利用PLFA分析技术,研究不同海拔高度土壤微生物群落组成及其主要的环境影响因素,旨在为揭示气候变化对土壤微生物群落结构的影响和预测微生物对气候变化的响应提供科学依据。
1 研究区概况湖北神农架国家级自然保护区是以川金丝猴(Rhinopithecus roxellanae)为主要保护对象的野生动物与森林生态系统类型保护区,位于湖北省西北部(110°03′05″—110°33′50″ E,31°21′20″—31°36′20″ N)(罗璐等,2011)。神农架地区具有亚热带北部湿润季风气候,四季变化鲜明,年平均气温12 ℃,年降水量800~2 500 mm(陈大新等,2000)。随海拔升高,神农架呈现出北亚热带、暖温带和寒温带的气候特征,由于特殊的地理环境和气候条件,孕育和保存了十分丰富的生物资源(沈泽昊等,2004; 李广良等,2012),形成了典型的垂直山地植被带谱,主要包括常绿阔叶林、常绿阔叶-落叶混交林、落叶阔叶林、针叶-落叶阔叶混交林、寒温带针叶林、亚高山灌木林和亚高山草甸7种植被类型(陈大新等,2000)。土壤类型为山地黄棕壤。
2 研究方法 2.1 野外调查和样品采集沿海拔梯度 选择落叶阔叶林(DF)、针叶-落叶阔叶混交林(MF)、寒温带针叶林(CF)和亚高山灌木林(SB)4种典型植被类型。在每种植被类型连续设置12块20 m×20 m样地(表 1),在每块样地进行乔木和灌木调查,其中乔木层调查所有胸高直径(DBH)≥5 cm的植株,记录其种类、DBH、树高、枝下高并估测冠幅; 灌木层调查所有DBH<5 cm的木本植株,记录其种类、平均高度、丛数,并估测其盖度和多度等指标(丛静等,2013)。同时记录样地的海拔、坡度、坡向等环境特征。在每块样地内,通过多点采样采集0~10 cm土层土壤,除去落叶、石砾杂物,过筛后每块样地混合成1份样品,装袋,4 ℃保存。
|
|
土壤微生物磷脂脂肪酸(PLFA)含量的测定方法参考Frostegard等(1996),并进行适当的修改(张地等,2012)。真菌以 18∶2w6,9c和18∶1w9c的和估算,放线菌以10Me18∶0和10Me19∶0的和估算,细菌以其他脂肪酸含量总和估算。革兰氏阴性菌(G+)以14∶0,i15∶0,a15∶0,15∶0,i16∶0,16∶0,i17∶0,a17∶0,17∶0,18∶0等表示,革兰氏阴性菌(G-)以 3-OH14∶0,16∶1w9t,16∶1W7C,16∶1w5c,cy17∶0,18∶1w9t和cy19∶0等表示。
2.3 土壤理化性质测定土壤理化性质测定采用常规方法(鲍士旦,2003),元素分析仪测定土壤有机碳含量; 凯氏定氮法测定全氮含量; pH计测定土壤pH值; 烘干法测定土壤含水量; 碱解扩散法测定速效氮含量。
2.4 数据分析野外植物样方调查数据、PLFA 含量和土壤理化性质数据以Excel软件建库,对数据进行初步整理。采用SPSS17.0软件进行单因素方差分析(one-way ANOVA)比较不同数据组间的差异,用Pearson相关系数评价不同因子间的相关关系。利用R软件和Simaplot 11.0软件,对群落植被进行主成分分析,以群落物种矩阵和样地环境矩阵为基础进行典范对应分析(CCA),分析PLFA含量的分布格局以及与环境因子的相互关系。
3 结果与分析 3.1 植物多样性和土壤理化性质随海拔梯度的变化4种植被类型的植物多样性和土壤理化性质见表 2,其中植物多样性采用香农-威纳(Shannon-Wiener)指数表征。从表 2可以看出,植物Shannon-Wiener指数随海拔降低先增加后减少,且各群落类型间差异均显著的(P < 0.05),以MF的植物Shannon-Wiener指数最高。低海拔的DF土壤有机碳和全氮含量与其他3种植被类型土壤含量有显著差异,而其他3种植被类型土壤有机碳和全氮含量没有显著差异。4种植被类型的土壤pH值和含水量均具有较明显的差异,SB的土壤pH值和含水量均最低,MF具有最高的土壤pH值,DF具有最高的土壤含水量(表 2)。
|
|
4种植被类型土壤中共检测到24种磷脂脂肪酸(表 3),其中 SB中检测出21种,MF中检测出23种,CF和DF中检测出24种。不同植被类型土壤微生物PLFA含量都很丰富,包括各种饱和、不饱和、分支和环状PLFA。 16∶0和18∶1w9t的含量最丰富,而15∶00在SB和MF中均没有检测到,在CF和DF中的含量也较低。4种植被类型的总PLFA含量存在较明显的差异,MF土壤的PLFA含量最高,SB土壤的PLFA含量最低,其中SB与CF和DF均差异显著(P < 0.05),CF和DF的差异不显著。对4种植被类型土壤微生物的PLFA含量进行主成分分析,4种不同植被类型的PLFA具有明显的聚类(图 1),表明4种植被类型土壤中,具有明显不同的微生物群落结构。
|
|
 |
图 1 不同植被土壤微生物PLFAs含量的主成分分析 Fig. 1 Principal components analysis of soil microbial PLFAs content in the different plant types |
通过PLFA分析结果,计算土壤微生物细菌、真菌、革兰氏阳性菌和革兰氏阴性菌的PLFA含量。 MF中真菌、放线菌和细菌PLFA含量最高,而SB中的含量最低。MF土壤的真菌、放线菌和细菌含量与其他3种植被类型土壤均差异显著(P < 0.05)。在4种植被类型土壤中真菌与细菌含量的比例为0.06 ~ 0.11。在所有的植被类型土壤中,革兰氏阳性细菌的PLFA含量高于革兰氏阴性细菌,不同植被类型土壤的革兰氏阴性细菌PLFA含量间均具有显著差异(P <0.05)(表 4)。
|
|
将真菌、细菌、放线菌、革兰氏阳性细菌和革兰氏阴性细菌的PLFA含量与主要的环境因素进行相关性分析。Pearson相关性分析结果见表 5。 土壤的pH值和植物的Shannon-Wiener指数与土壤的真菌、放线菌、细菌、革兰氏阳性细菌和革兰氏阴性细菌PLFA含量均极显著相关(P < 0.01),这表明土壤pH值和植物Shannon-Wiener指数是影响土壤微生物群落结构的重要因素。同时,土壤含水量与细菌、革兰氏阳性细菌和革兰氏阴性细菌PLFA含量均显著相关(P < 0.05),土壤全氮含量和有效氮含量分别与土壤真菌和革兰氏阴性细菌PLFA显著相关(P < 0.05)。
|
|
利用CCA分析不同植被类型的土壤微生物群落和环境因素(图 2)。 土壤pH值具有最长的箭头,因此,pH值可能是影响微生物群落结构最重要的因素。同时,植物 Shanon-Wiener指数、土壤全氮含量和有效氮含量也具有较长的箭头,这表明这些因素对神农架不同海拔植被类型的土壤微生物群落结构也具有重要影响。
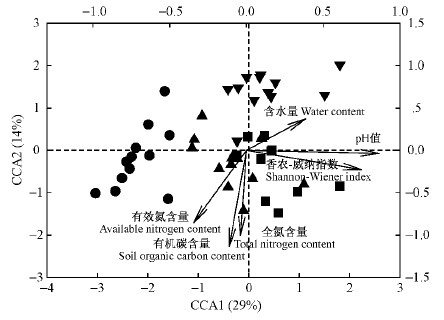 |
图 2 土壤微生物PLFA含量与环境因素的CCA分析 Fig. 2 Canonical correspondence analysis between soil microbial PLFA content and environmental factors |
微生物群落结构沿海拔梯度具有不同的分布格局,有的随着海拔高度的增加而呈现单峰模式(Singh et al.,2012),有的单调递减(Bryant et al.,2008)或递增(Wang et al.,2011)等。张地等(2012)等研究表明,随着海拔升高,辽东栎(Quercus liaotungensis)林土壤微生物各类群PLFA含量均没有显著差异; Djukic等(2010)发现总PLFA含量及细菌PLFA含量并未随海拔升高表现出一致的规律。本研究表明,在海拔1 700~2 800 m 的4种不同植被类型中,土壤微生物总的PLFA含量随着海拔的降低先增加后减少,呈现出“单峰”模式。 同 时,土壤微生物的真菌、细菌、放线菌和革 兰氏阳性细菌与革兰氏阴性细菌的PLFA含量均具有基本一致的变化趋势。而在低海拔的混交林和落叶阔叶林中,真菌/细菌的比例相对较高。这与已有的一些研究具有相似的结果。Wagai等(2011)发现,随着海拔升高,土壤真菌、细菌的PLFA含量下降,真菌/细菌升高; Clark等(2008)研究表明,低海拔时真菌含量最高。这可能是因为随着海拔降低,土壤温度升高造成的,Djukic等(2010)研究表明温度的降低会使真菌的比例下降,细菌的比例上升; Zhang等(2004)的 土壤的增温试验也表明,气温上升显著降低土壤微生物中的细菌含量比重,从而显著提高群落中真菌与细菌的比值 。
本研究中,微生物的PLFAs含量变化趋势与植物Shannon-Wiener指数的变化趋势基本一致,都是随海拔降低而先增加后减少,且两者极显著相关(P <0.01)。因此,对神农架土壤微生物群落结构来说,植物Shannon-Wiener指数是影响微生物海拔分布格局的一个重要因素。王卫霞等(2013)对南亚热带3种人工林土壤微生物群落结构研究表明,林分是显著影响土壤微生物总PLFAs、细菌PLFAs和真菌PLFAs含量的主要因素; 而张地等(2012)在不同海拔的辽东栎林土壤中没有发现微生物各类群PLFA含量的显著差异。海拔梯度变化的显著特征又体现在植被类型的一系列变化,植物可以通过改变其植被类型、碳固定量和营养物质的输入,从而影响其相应的微生物群落,同时也可能改变土壤温度和湿度而影响微生物的群落结构(Waldrop et al.,2004)。树木凋落物作为土壤有机质输入的主要来源是真菌或微生物进行生命活动的物质基础,其质量、数量必然影响林地土壤微生物数量和群落组成(Chapin et al.,2011)。
土壤pH值通常是影响微生物多样性的重要因子之一(Chu et al.,2010; Shen et al.,2013)。 Shen等(2013)对长白山海拔梯度的土壤微生物分布格局研究结果表明,土壤pH值是控制微生物多样性和群落组成的最主要的因子。Xiong等(2012)在研究碱性沉积物中,发现,pH值也是影响微生物群落结构的主要因素。在本研究中,Pearson相关性和CCA分析都表明,土壤pH值是影响土壤微生物群落结构和海拔分布格局的重要因素。因此,土壤pH值对微生物的分布规律存在普遍的影响(Shen et al.,2013)。土壤pH值与微生物多样性和群落结构的紧密关系很大程度上依赖于pH值能够影响土壤其他相关因素的变化(Fierer et al.,2006),但是,也有的研究认为土壤pH值可能是影响土壤微生物多样性的独立的驱动因子,这是因为微生物自身的pH值与周围环境压力的变化有关(Xiong et al.,2012)。
| [1] |
鲍士旦.2003.土壤农化分析.北京: 中国农业出版社.( 1) 1)
|
| [2] |
陈大新, 朱兆泉, 欧阳志云.2000.神农架自然保护区生物多样性特征分析.湖北林业科技, 4: 5-10.( 2) 2)
|
| [3] |
丛静, 尹华群, 卢慧, 等.2013.神农架保护区典型植被的物种多样性和环境解释.林业科学, 49(5): 30-35.( 2) 2)
|
| [4] |
李广良, 薛亚东, 张于光, 等.2012.神农架川金丝猴栖息地森林类型与植物多样性研究.林业科学研究, 25 (3): 308-316.( 1) 1)
|
| [5] |
罗璐, 申国珍, 谢宗强.2011.神农架海拔梯度上4种典型森林的乔木叶片功能性状特征.生态学报, 31(21):6420-6428.( 1) 1)
|
| [6] |
沈泽昊, 胡会峰, 周宇,等.2004.神农架南坡植物群落多样性的海拔梯度格局.生物多样性, 12(1): 99-107.( 1) 1)
|
| [7] |
王卫霞, 史作民, 罗达, 等.2013.南亚热带3种人工林土壤微生物生物量和微生物群落结构特征.应用生态学报, 24(7): 1784-1792.( 1) 1)
|
| [8] |
张地, 张育新, 曲来叶, 等.2012.海拔对辽东栎林地土壤微生物群落的影响.应用生态学报, 23(8): 2041-2048.( 4) 4)
|
| [9] |
张秋芳, 刘波,林营志, 等.2009.土壤微生物群落磷脂脂肪酸PLFA生物标记多样性.生态学报, 29(8): 4128-4137.( 2) 2)
|
| [10] |
Bryant J A, Lammanna C, Morlon H, et al.2008.Microbes on mountainsides: contrasting elevational patterns of bacterial and plant diversity.PNAS, 105 (suppl): 11505-11511.( 1) 1)
|
| [11] |
Chapin III F S, Matson P A, Vitousek P M.2011.Principles of terrestrial ecosystem ecology.London: Springer.( 1) 1)
|
| [12] |
Chu H, Fierere N, Lauber C L, et al.2010.Soil bacterial diversity in the Arctic is not fundamentally different from that found in other biomes.Environmental Microbiology, 12(11): 2998-3006.( 1) 1)
|
| [13] |
Clark J S, Campbell J H, Grizzle H, et al.2008.Soil microbial community response to drought and precipitation variability in the Chihuahuan Desert.Microbial Ecology, 57(2): 248-260.( 1) 1)
|
| [14] |
Djukic I, Zehetner F, Mentler A, et al.2010.Microbial community composition and activity in different Alpine vegetation zones.Soil Biology and Biochemistry, 42(2): 155-161.( 2) 2)
|
| [15] |
Fierer N, Jackson R B.2006.The diversity and biogeography of soil bacterial communities.PNAS, 103(3): 626-631.( 1) 1)
|
| [16] |
Fierer N, McCain C M, Meir P, et al.2011.Microbes do not follow the elevational diversity patterns of plants and animals.Ecology, 92(4): 797-804.( 1) 1)
|
| [17] |
Frostegard A, Baath E.1996.The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil.Biology and Fertility of Soils, 22(1): 59-65.( 1) 1)
|
| [18] |
Renaud P E, Webb T, Bjorgesaeter A, et al.2009.Continental-scale patterns in benthic invertebrate diversity: insights from the MarBEF database.Mar Ecol Prog Ser, 382: 239-252.( 1) 1)
|
| [19] |
Shen C, Xiong J, Zhang H, et al.2013.Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai mountain.Soil Biology & Biochemistry, 57 (2): 204-211.( 2) 2)
|
| [20] |
Singh D, Takahashi K, Adams J M.2012.Elevational patterns in Archaeal diversity on Mt.Fuji.PLOS one, 7(9): e44494.( 1) 1)
|
| [21] |
Wagai R, Kitayama K, Satomura T, et al.2011.Interactive influences of climate and parent material on soil microbial community structure in Bornean tropical forest ecosystems.Ecological Research, 26(3): 627-636.( 2) 2)
|
| [22] |
Waldrop M P, Firestone M K.2004.Microbial community utilization of recalcitrant and simple carbon compounds: impact of oak-woodland plant communities.Oecologia, 138(2): 275-284.( 1) 1)
|
| [23] |
Wang J, Soininen J, Zhang Y, et al.2010.Contrasting patterns in elevational diversity between microorganisms and macroorganisms.Journal of Biogeography, 38: 595-603.( 1) 1)
|
| [24] |
Xiong J, Liu Y, Lin X, et al.2012.Geographic distance and pH drive bacterial distribution in alkaline lake sediments across Tibetan Plateau.Environmental Microbiology, 14(9): 2457-2466.( 2) 2)
|
| [25] |
Zhang W J, Xu Q, Wang X K, et al.2004.Impacts of experimental atmospheric warming on soil microbial community structure in a tall grass prairie.Acta Ecologica Sinica, 24(8): 1746-1751.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50
