文章信息
- 徐洪宇, 张晓茹, 王军辉, 黄晓华, 雷鸣, 董娟娥, 尉芹
- Xu Hongyu, Zhang Xiaoru, Wang Junhui, Huang Xiaohua, Lei Ming, Dong Juan, Wei Qin
- 楸树叶中抗氧化活性成分的分离和鉴定
- Isolation and Identification of Bioactive Compounds with Antioxidant from Catalpa bungei
- 林业科学, 2014, 50(9): 112-117
- Scientia Silvae Sinicae, 2014, 50(9): 112-117.
- DOI: 10.11707/j.1001-7488.20140915
-
文章历史
- 收稿日期:2013-10-11
- 修回日期:2013-11-21
-
作者相关文章
2. 西北农林科技大学生命科学学院 杨凌 712100;
3. 中国林业科学研究院林业所国家林业局 林木培育重点实验室 北京 100091
2. College of Sciences, Northwest A&F University Yangling 712100;
3. Key Laboratory of Tree Breeding and Cultivation of State Forestry Administration Research Institute of Forestry, CAF Beijing 100091
机体氧化反应过程中产生的自由基具有强氧化性,可损害机体的组织和细胞,衰老及多种疾病的产生与自由基有关(Gao et al.,2007)。自由基的减少,不仅要靠自身的清除系统,而且需要外部抗氧化剂的帮助。抗氧化剂,被广泛用于食品、化妆品和药品中(Cuvelier et al.,1996)。目前人工合成抗氧化剂的副作用受到关注(Sun et al.,1997),寻找植物源类抗氧化剂取代合成抗氧化剂已成为全球趋势(Balasundram et al.,2006)。
楸树(Catalpa bungei)系紫葳科(Bignoniaceae)梓属(Catalpa)植物,落叶乔木,主要分布于 22— 42° N,88—123° E,地跨温带草原区、暖温带落叶阔叶林区和亚热带常绿阔叶林区(吴丽华等,2010)。梓属植物中,人们主要研究梓树,报道其主要含有环烯醚萜类和萘醌类化合物(Fujiwara et al.,1998; Kanai et al.,1996; Machida et al.,1998; 2001; 2004; 昝丽霞等,2005)。从梓树中分离的化合物具有抑菌(Cho et al.,2006; Kuk et al.,2002)、抗炎(An et al.,2002; Kim et al.,2004; Pae et al.,2003; Yang et al.,2013)、抗肿瘤(Fujiwara et al.,1998; Munoz-Mingarro et al.,2003; Oh et al.,2010; Suzuki et al.,2006)及抗氧化(Dvorska et al.,2007; Machida et al.,2004)等作用。 预试验发现,楸树叶中含有与梓树叶相似的化学成分,同时对生长在我国甘肃省天水市和河南省洛阳市的楸树叶进行了抗氧化活性筛选,发现生长在甘肃省天水市的楸树无性系C. bungei 6(CA-6)叶的乙酸乙酯萃取相具有较强的抗氧化活性。
本文以CA-6叶粗提物的乙酸乙酯萃取相为研究材料,采用硅胶柱层析及活性追踪法分离具有强清除DPPH自由基能力的组分,利用半制备高效液相色谱对该组分进行分离、纯化,以清除DPPH自由基、还原力及清除ABTS自由基能力作为考察指标,根据理化性质和光谱数据鉴定楸树叶中具有抗氧化活性的化合物,为繁育具强抗氧化活性的楸树植物资源提供基础,为开发高效植物源类抗氧化剂及保健产品提供可利用资源。
1 材料与方法 1.1 试验材料、试剂与仪器2012年10月中旬,于甘肃省天水市(105°41′ E,34°14′ N,海拔1 131 m)采集楸树无性系叶片,样品采集时挑选3株树龄接近的楸树无性系,每株树分别采集一定量的新鲜叶片后混合。采集的叶片在90 ℃下杀青处理20 min,在60 ℃下烘干,粉碎,过20目筛备用。
1,1-二苯基-2-三硝基苦肼(DPPH)、2,2′-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)购自美国Sigma公司;2,6-二叔丁基-4-甲基苯酚(BHT)购自国药集团化学试剂有限公司;铁氰化钾、三氯乙酸、三氯化铁、过硫酸钾均为分析纯。
X26型显微熔点测定仪,北京泰克仪器有限公司生产;HP 5988型四极杆质谱仪,美国HP公司生产;Brucker AM500超导核磁共振仪,TMS内标,美国Brucker公司生产。柱色谱硅胶及薄层层析硅胶为青岛海洋化工厂生产;半制备高效液相色谱仪,意大利Waters公司,制备柱XTerra Prep RP18(7.8×150 mm,10 μm),1525型二元梯度泵,2489型紫外可见检测器。
1.2 提取、分离和纯化采用活性示踪法分离抗氧化活性物质,测试分离过程中不同组分的抗氧化活性,选取活性相对较高的组分进行分离、纯化。具体过程如下: 楸树叶粉100 g,加入1 L 80%的乙醇-水溶液(V/V),在80 ℃下回流提取3次,每次1 h。合并3次提取滤液,45 ℃旋转蒸发浓缩至干,得粗提物浸膏(18.639 g),用500 mL蒸馏水配制成混悬液,依次用500 mL石油醚、乙酸乙酯、正丁醇分别萃取5~8次,将各萃取(余)相分别浓缩至干,得石油醚萃取相(2.438 g)、乙酸乙酯萃取相(4.977 g)、正丁醇萃取相(5.669 g)和水(萃余)相(5.555 g),抗氧化活性最强的乙酸乙酯萃取相经反复硅胶柱层析,以氯仿:甲醇(150:1~5:1)为流动相进行梯度洗脱,TLC分析归类为7个组分(Fr.1-7)。活性较高的Fr.5组分经半制备液相色谱(流动相为甲醇-水55:45,检测波长为254 nm,体积流量为3 mL·min-1,柱温为30 ℃)分离、纯化,得到化合物1(90.49 mg)和化合物2(97.28 mg)。
1.3 抗氧化能力测定 1.3.1 DPPH自由基清除率测定采用Brand williams等(1995)的方法,略做修改。取1 mL样品溶液,加入3 mL 0.2 mmol·L-1的DPPH自由基乙醇溶液,混匀后加入4.0 mL乙醇溶液,室温下避光静置反应30 min后,在波长517 nm下测定吸光值。样品对DPPH自由基的清除率按下式计算: DPPH·(%)=[(AC-AS)/AC]×100,式中AC为空白样品的吸光值,AS为不同浓度样品的吸光值。计算清除率为50%时的样品浓度(IC50),IC50越小,表明清除DPPH自由基的能力越强。
1.3.2 还原力测定采用Oyaizu(1986)的方法。取0.5 mL样品溶液,加入0.5 mL 0.2 mol·L-1磷酸盐缓冲液(pH 6.6)和0.5 mL 1 %铁氰化钾溶液,50 ℃水浴中放置20 min。迅速冷却后,加入0.5 mL 10%三氯乙酸溶液,混匀后3 000 r·min-1离心20 min。取上清液1.0 mL加入1.0 mL蒸馏水和0.2 mL 0.1 %三氯化铁溶液,反应10 min后测定700 nm波长处吸光值。计算IC50值,IC50值为吸光值达到0.5时的样品浓度。
1.3.3 ABTS自由基清除率测定采用Re等(1999)的方法,略做修改。配制ABTS·+储备液: 配制2.45 mmol·L-1过硫酸钾,用过硫酸钾溶解ABTS,配成7 mmol·L-1 ABTS储备液,在室温、避光条件下静置12~16 h。配制ABTS·+测定液: 将ABTS·+储备液用磷酸盐缓冲液(10 mmol·L-1,pH 7.4)稀释,使其吸光度在734 nm波长处达到0.700±0.020。测定: 取4 mL ABTS·+测定液,加入40 μL样品待测液,振荡30 s,静置6 min,测定反应一定时间后734 nm波长处的吸光值。清除率按下式计算: ABTS·+%=[(AC-AS)/AC]×100。计算清除率为50%时的样品浓度(IC50)。
1.4 统计分析使用SPSS 18.0软件对试验数据进行ANVOA统计分析,采用SNK法进行显著性检验(P < 0.05)。每个样品重复测定3次,结果以平均值±标准差表示。
2 结果与讨论 2.1 分离组分的DPPH自由基清除能力硅胶柱层析法是目前广泛使用的一种分离纯化技术。抗氧化活性较高的乙酸乙酯萃取相进行硅胶柱层析,以三氯甲烷-甲醇体系梯度洗脱(150:1~5:1),经TLC检测归类为极性由小到大7个组分(Fr.1-7)。对7个组分清除DPPH自由基能力进行测定,以同浓度的BHT为对照(图 1)。
 |
图 1 7个组分的DPPH自由基清除率 Fig. 1 DPPH radical scavenging activity of 7 subfractions |
DPPH自由基是一种稳定的自由基,被广泛用于评价天然抗氧化剂的体外清除自由基活性(Jao et al.,2002; Matsukawa et al.,1997; Tai et al., 2011)。浓度为0.1 mg·mL-1的7个组分及BHT对DPPH自由基的清除能力差异显著(P < 0.05)。其中Fr.5组分对DPPH自由基的清除能力最强(51.47 %),比同浓度BHT强1.3倍,其次为Fr.7组分(8.59 %),其余组分的清除能力较弱。乙酸乙酯萃取相经硅胶柱层析分离后,具有清除DPPH自由基能力的物质主要集中在40:1~30:1(三氯甲烷:氯仿)的Fr.5组分,其他6个组分所含具有清除DPPH自由基能力的物质较少。以下对活性较强的Fr.5组分进行分离、纯化,寻找其具有抗氧化能力的化合物。
2.2 Fr.5组分分离、纯化及抗氧化能力利用半制备液相色谱对Fr.5组分进行分离、纯化,得到化合物1和化合物2(图 2),对化合物1,2的DPPH自由基清除率、还原力及ABTS自由基清除率进行考察,以BHT为对照,评价化合物1,2的抗氧化活性。
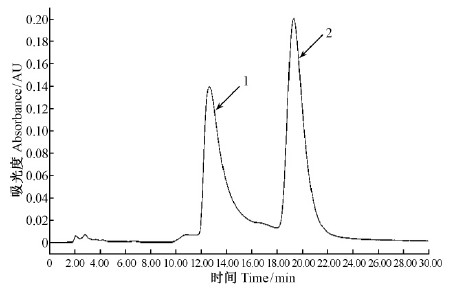 |
图 2 Fr.5组分的半制备液相色谱 Fig. 2 Semi-preparative HPLC chromatogram of Fr.5 component |
质量浓度为0.01~1.0 mg·mL-1的化合物1,2及BHT的DPPH自由基清除率随样品浓度的增大而增强(图 3)。化合物1清除DPPH自由基能力强于BHT,化合物2清除DPPH自由基能力不及BHT。在浓度为0.01~0.1 mg·mL-1时,化合物1的DPPH自由基清除率从23.39 %增大到84.04 %,浓度大于0.1 mg·mL-1时DPPH自由基清除率随样品浓度的增大而增加缓慢,说明化合物1对DPPH自由基的清除率不但存在量效关系,且呈浓度饱和型特征。
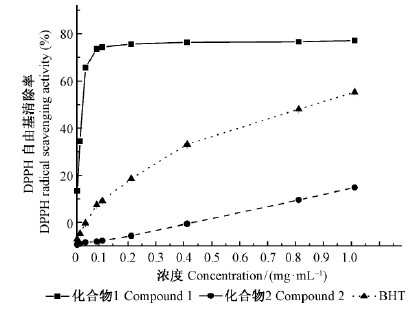 |
图 3 化合物1,2及BHT的DPPH自由基清除率 Fig. 3 DPPH radical scavenging activity of compounds and BHT |
0.01~1.0 mg·mL-1的化合物1,2及BHT对DPPH自由基清除率为50 %时的质量浓度差异较大(表 1)。化合物1的IC50值为23.89 μg·mL-1,其对DPPH自由基清除能力较强,BHT的IC50值是化合物1的22倍,可见化合物1对DPPH自由基清除能力远高于BHT。化合物2的IC50值在1.0 mg·mL-1以上,其清除能力较弱。
|
|
还原力的大小与其抗氧化能力有关,可作为化合物潜在抗氧化能力的标志(Meir et al.,1995; Sun et al.,2010)。在还原力测定中,抗氧化剂的抗氧化活性由其将Fe3+络合物还原为Fe2+络合物的能力表示。
质量浓度在5~400 μg·mL-1时化合物1,2及BHT的还原力存在明显差异(图 4)。化合物1和BHT的还原力存在量效关系,趋势相近,且化合物1的还原力整体强于BHT,其中化合物1的IC50值为29.77 μg·mL-1,而BHT为45.14 μg·mL-1。化合物2质量浓度从5 μg·mL-1增加到400 μg·mL-1时,其在700 nm波长下的吸光值仅从0.005增大到0.054,还原力较弱。化合物1,2虽然是同一组分分离得到且极性接近的2个化合物,但化合物1的还原力明显强于化合物2,主要是因为2个化合物结构的不同,导致还原力有明显的差异。
 |
图 4 化合物1,2及BHT的还原力 Fig. 4 Reducing capacity of compounds and BHT |
ABTS自由基是一种稳定的蓝绿色阳离子自由基,加入的抗氧化物质会与ABTS自由基发生反应使体系逐渐褪色,吸光度值的减少幅度表示抗氧化剂对ABTS自由基的抑制率。ABTS自由基在水及醇溶剂中均有较好的溶解性,可用于水溶性及脂溶性天然产物抗氧化活性的测定,该方法简单快捷,无需复杂的反应步骤及苛刻的反应条件,可测定酸性、中性及弱碱性化合物的自由基清除能力。ABTS法常被用于天然产物抗氧化活性的筛选(Durmaz,2012; Floegel et al.,2011; Wang et al.,2007; Zeng et al.,2011)。
化合物1,2及BHT(质量浓度10~200 μg·mL-1)的ABTS自由基清除率均随质量浓度的增加而增强(图 5)。试验中各质量浓度点处化合物1的ABTS自由基清除率均强于化合物2和BHT,同时化合物1,2的IC50值接近(43.47,48.78 μg·mL-1),而BHT的IC50值(140.30 μg·mL-1)为化合物1,2的3倍左右,即化合物1,2清除ABTS自由基能力强于BHT。
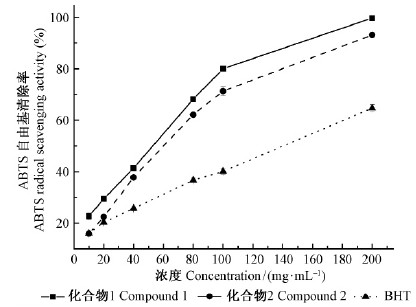 |
图 5 化合物1,2及BHT的ABTS自由基清除 Fig. 5 ABTS radical scavenging activity of compounds and BHT |
以上结果表明,化合物1具有较强的抗氧化活性,而化合物2的抗氧化活性较弱。为了明确2个极性相似化合物抗氧化能力的差异,本文进一步对化合物1,2的结构进行鉴定,分析抗氧化能力差异的原因,明确其抗氧化作用机制。
2.3 化合物结构鉴定化合物1: CAS: 128475-17-2,黄色粉末,mp>300 ℃;1H NMR(400 MHz,DMSO-d6)δ: 12.99(s,1H,H-5),9.84(s,3H,H-7,3′,4′),7.40-7.44(m,2H,H-2′,6′),6.88(d,J=8.0 Hz,1H,H-5′),6.68(s,1H,H-3),6.45(d,J=2.0 Hz,1H,H-8),6.19(d,J=2.0 Hz,1H,H-6);13C NMR(100 MHz,DMSO-d6)δ: 182.1(C-4),164.6(C-7),164.3(C-2),161.9(C-9),157.7(C-5),150.1(C-4′),146.1(C-3′),121.9(C-6′),119.4(C-1′),116.4(C-5′),113.8(C-2′),104.1(C-3),103.3(C-10),99.2(C-6),94.3(C-8);MS(ESI-TRAP),m/z(%): 285.22([M-H]+,100)。波谱数据与文献报道基本一致,故确定化合物1为木犀草素。
化合物2: CAS: 128475-17-2,黄色粉末,mp>300 ℃;1H NMR(400 MHz,DMSO-d6)δ: 12.98(s,1H,H-5),10.60(s,2H,H-7,4′),7.92(d,J=8.8 Hz,2H,H-2′,6′),6.92(d,J=8.8 Hz,2H,H-3′,5′),6.79(s,1H,H-3),6.49(d,J=2.0 Hz,1H,H-8),6.20(d,J=2.0 Hz,1H,H-6);13C NMR(100 MHz,DMSO-d6)δ: 182.2(C-4),164.6(C-2),164.1(C-7),161.9(C-4′),161.6(C-9),157.7(C-5),128.9(C-2′,6′),121.6(C-1′),116.4(C-3′,5′),104.1(C-10),103.3(C-3),99.2(C-6),94.3(C-8);MS(ESI-TRAP),m/z(%): 269.20([M-H]+,100)。波谱数据与文献报道基本一致,故鉴定化合物2为芹菜素。
化合物1,2的结构见图 6,均为黄酮类化合物。黄酮类化合物自身可作为优良供氢体而具有一定的抗氧化能力(Riceevans et al.,1996),但因其羟基的数目、位置不同,其抗氧化能力不同。木犀草素比芹菜素仅多1个羟基,但其抗氧化活性相差较大,这说明酚羟基数目越多,抗氧化活性越强。黄酮类化合物的邻二酚羟基结构可极大地增加其抗氧化活性(Hyun et al.,2010; Riceevans et al.,1996; Yesilada et al.,2000)。木犀草素的3′和4′位上均有羟基,能够形成邻二酚羟基结构,是其具有较好的清除DPPH自由基清除率、还原力和清除ABTS自由基能力的主要原因。木犀草素具有抗菌(Zhu et al.,2004)、抗炎(Chen et al.,2007)、抗癌(Ueda et al.,2003)、抗氧化(Sharma et al.,2007)、预防心血管疾病、降低血压和胆固醇以及降低神经退行性等疾病发生(Lopez-Lazaro,2009)的活性。可见,羟基的数目及是否具有邻二酚羟基结构是黄酮类化合物成为高活性化合物的结构基础。
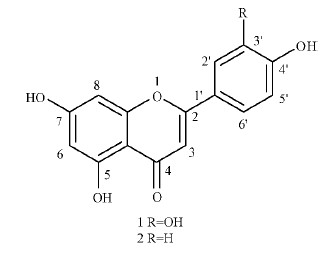 |
图 6 化合物1和2的结构 Fig. 6 Chemical structures of luteolin(1) and apigenin(2) |
本文以在我国广泛种植的楸树叶为原料,通过抗氧化活性追踪法从楸树叶的乙酸乙酯萃取相中首次分离、得到木犀草素和芹菜素2个化合物,其中木犀草素的DPPH自由基清除率、还原力和ABTS自由基清除率显著强于合成抗氧化剂BHT,芹菜素仅对ABTS自由基清除能力强于BHT,抗氧化能力较弱。本试验为提取木犀草素提供了新的植物来源,同时对楸树的开发利用提供了新的途径。
| [1] |
吴丽华, 王军辉, 林娟. 2010. 楸树植物资源的研究概况. 上海交通大学学报:农业科学版, 28(1) : 91-96.( 1) 1)
|
| [2] |
昝丽霞, 赵勇, 孙文基. 2005. 楸树种子中梓醇的分离与含量测定. 中药材, 28(1) : 26-27.( 1) 1)
|
| [3] |
An S J, Pae H O, Oh G S, et al. 2002. Inhibition of tnf-alpha, il-1 beta, and il-6 productions and nf-kappa b activation in lipopolysaccharide-activated raw 264.7 macrophages by catalposide, an iridoid glycoside isolated ftom Catalpa ovata g. Don (bignoniaceae). International Immunopharmacology, 2(8) : 1173-1181.( 1) 1)
|
| [4] |
Balasundram N, Sundram K, Samman S. 2006. Phenolic compounds in plants and agri-industrial by-products: antioxidant activity, occurrence, and potential uses. Food Chemistry, 99(1) : 191-203.( 1) 1)
|
| [5] |
Brandwilliams W, Cuvelier M E, Berset C. 1995. Use of a free-radical method to evaluate antioxidant activity. Food Science and Technology-Lebensmittel-Wissenschaft & Technologie, 28(1) : 25-30.( 1) 1)
|
| [6] |
Chen C Y, Peng W H, Tsai K D, et al. 2007. Luteolin suppresses inflammation-associated gene expression by blocking nf-kappa b and ap-1 activation pathway in mouse alveolar macrophages. Life Sciences, 81: 1602-1614.( 1) 1)
|
| [7] |
Cho J Y, Kim H Y, Choi G J, et al. 2006. Dehydro-alpha-lapachone isolated from catalpa ovata stems: activity against plant pathogenic fungi. Pest Manag Sci, 62(5) : 414-418.( 1) 1)
|
| [8] |
Cuvelier M E, Richard H, Berset C. 1996. Antioxidative activity and phenolic composition of pilot-plant and commercial extracts of sage and rosemary. Journal of the American Oil Chemists Society, 73(5): 645-652.( 1) 1)
|
| [9] |
Durmaz G. 2012. Freeze-dried abts(center dot+) method: a ready-to-use radical powder to assess antioxidant capacity of vegetable oils. Food Chemistry, 133(4) : 1658-1663.( 1) 1)
|
| [10] |
Dvorska M, Zemlicka M, Muselik J, et al. 2007. Antioxidant activity of catalpa bignonioides. Fitoterapia, 78(6): 437-439.( 1) 1)
|
| [11] |
Floegel A, Kim D O, Chung S J, et al. 2011. Comparison of abts/dpph assays to measure antioxidant capacity in popular antioxidant-rich us foods. Journal of Food Composition and Analysis, 24(7) : 1043-1048.( 1) 1)
|
| [12] |
Fujiwara A, Mori T, Iida A, et al. 1998. Antitumor-promoting naphthoquinones from Catalpa ovata. Journal of Natural Products, 61(5) : 629-632.( 2) 2)
|
| [13] |
Gao P, Zhang H F, Dinavahi R, et al. 2007. Hif-dependent antitumorigenic effect of antioxidants in vivo. Cancer Cell, 12(3) : 230-238.( 1) 1)
|
| [14] |
Hyun J, Woo Y, Hwang D S, et al. 2010. Relationships between structures of hydroxyflavones and their antioxidative effects. Bioorganic & Medicinal Chemistry Letters, 20(18) : 5510-5513.( 1) 1)
|
| [15] |
Jao C L, Ko W C. 2002. 1,1-diphenyl-2-picrylhydrazyl (dpph) radical scavenging by protein hydrolyzates from tuna cooking juice. Fisheries Science, 68(2) : 430-435.( 1) 1)
|
| [16] |
Kanai E, Machida K, Kikuchi M. 1996. Studies on the constituents of catalpa species.1. Iridoids from catalpae fructus. Chemical & Pharmaceutical Bulletin, 44(8) : 1607-1609.( 1) 1)
|
| [17] |
Kim S W, Choi SC, Choi E Y, et al. 2004. Catalposide, a compound isolated from catalpa ovata, attenuates induction of intestinal epithelial proinflammatory gene expression and reduces the severity of trinitrobenzene sulfonic acid-induced colitis in mice. Inflammatory Bowel Diseases, 10(5) : 564-572.( 1) 1)
|
| [18] |
Kuk J H, Ma S J, Moon J H, et al. 2002. Antibacterial and antifungal activities of a naphthoquinone derivative isolated from the fruits of Catalpa ovata g. Don. Journal of Microbiology and Biotechnology, 12(5) : 858-863.( 1) 1)
|
| [19] |
Lopez-Lazaro M. 2009. Distribution and biological activities of the flavonoid luteolin. Mini-Reviews in Medicinal Chemistry, 9(1) : 31-59.( 1) 1)
|
| [20] |
Machida K, Ando M, Yaoita Y, et al. 2001. Studies on the constituents of catalpa species. Vi. Monoterpene glycosides from the fallen leaves of Catalpa ovata g. Don. Chemical & Pharmaceutical Bulletin, 49(6) : 732-736.( 1) 1)
|
| [21] |
Machida K, Hishinuma E, Kikuchi M. 2004. Studies on the constituents of catalpa species. Ix. Iridoids from the fallen leaves of Catalpa ovata g. Don. Chemical & Pharmaceutical Bulletin, 52(5) : 618-621.( 2) 2)
|
| [22] |
Machida K, Ogawa M, Kikuchi M. 1998. Studies on the constituents of catalpa species. Ii. Iridoids from Catalpae fructus. Chemical & Pharmaceutical Bulletin, 46(6) : 1056-1057.( 1) 1)
|
| [23] |
Matsukawa R, Dubinsky Z, Kishimoto E, et al. 1997. A comparison of screening methods for antioxidant activity in seaweeds. Journal of Applied Phycology, 9(1) : 29-35.( 1) 1)
|
| [24] |
Meir S, Kanner J, Akiri B, et al. 1995. Determination and involvement of aqueous reducing compounds in oxidative defense systems of various senescing leaves. Journal of Agricultural and Food Chemistry, 43(7) : 1813-1819.( 1) 1)
|
| [25] |
Munoz-Mingarro D, Acero N, Llinares F, et al. 2003. Biological activity of extracts from Catalpa bignonioides walt. (bignoniaceae). Journal of Ethnopharmacology, 87(2/3) : 163-167.( 1) 1)
|
| [26] |
Oh C H, Kim N S, Yang J H, et al. 2010. Effects of isolated compounds from catalpa ovata on the t cell-mediated immune responses and proliferation of leukemic cells. Archives of Pharmacal Research, 33(4) : 545-550.( 1) 1)
|
| [27] |
Oyaizu M. 1986. Studies on products of the browning reaction. Antioxidative activities of browning reaction products prepared from glucosamine. Japanese Journal of Nutrition, 44(6) : 307-315.( 1) 1)
|
| [28] |
Pae H O, Oh G S, Choi B M, et al. 2003. Inhibitory effects of the stem bark of Catalpa ovata g. Don. (bignoniaceae) on the productions of tumor necrosis factor-α and nitric oxide by the lipopolisaccharide-stimulated raw 264.7 macrophages. Journal of Ethnopharmacology, 88(2/3) : 287-291.( 1) 1)
|
| [29] |
Re R, Pellegrini N, Proteggente A, et al. 1999. Antioxidant activity applying an improved abts radical cation decolorization assay. Free Radical Biology and Medicine, 26(9/10) : 1231-1237.( 1) 1)
|
| [30] |
Riceevans C A, Miller N J, Paganga G. 1996. Structure-antioxidant activity relationships of flavonoids and phenolic acids. Free Radical Biology and Medicine, 20(7) : 933-956.( 2) 2)
|
| [31] |
Sharma V, Mishra M, Ghosh S, et al. 2007. Modulation of interleukin-1 beta mediated inflammatory response in human astrocytes by flavonoids: implications in neuroprotection. Brain Research Bulletin, 73(1/3) : 55-63.( 1) 1)
|
| [32] |
Sun B X, Fukuhara M. 1997. Effects of co-administration of butylated hydroxytoluene, butylated hydroxyanisole and flavonoids on the activation of mutagens and drug-metabolizing enzymes in mice. Toxicology, 122(1/2) : 61-72.( 1) 1)
|
| [33] |
Sun J, Jiang Y M, Shi J, et al. 2010. Antioxidant activities and contents of polyphenol oxidase substrates from pericarp tissues of litchi fruit. Food Chemistry, 119(2) : 753-757.( 1) 1)
|
| [34] |
Suzuki R, Yasui Y, Kohno H, et al. 2006. Catalpa seed oil rich in 9t,11t,13c-conjugated linolenic acid suppresses the development of colonic aberrant crypt foci induced by azoxymethane in rats. Oncology Reports, 16(5) : 989-996.( 1) 1)
|
| [35] |
Tai Z G, Cai L, Dai L, et al. 2011. Antioxidant activity and chemical constituents of edible flower of sophora viciifolia. Food Chemistry, 126(4) : 1648-1654.( 1) 1)
|
| [36] |
Ueda H, Yamazaki C, Yamazaki M. 2003. Inhibitory effect of perilla leaf extract and luteolin on mouse skin tumor promotion. Biological & Pharmaceutical Bulletin, 26(4) : 560-563.( 1) 1)
|
| [37] |
Wang S Y, Ballington J R. 2007. Free radical scavenging capacity and antioxidant enzyme activity in deerberry (Vaccinium stamineum l.). Lwt-Food Science and Technology, 40(8) : 1352-1361.( 1) 1)
|
| [38] |
Yang G, Choi C H, Lee K, et al. 2013. Effects of catalpa ovata stem bark on atopic dermatitis-like skin lesions in nc/nga mice. Journal of Ethnopharmacology, 145(2) : 416-423.( 1) 1)
|
| [39] |
Yesilada E, Tsuchiya K, Takaishi Y, et al. 2000. Isolation and characterization of free radical scavenging flavonoid glycosides from the flowers of spartium junceum by activity-guided fractionation. Journal of Ethnopharmacology, 73(3) : 471-478.( 1) 1)
|
| [40] |
Zeng W C, Jia L R, Zhang Y, et al. 2011. Antibrowning and antimicrobial activities of the water-soluble extract from pine needles of Cedrus deodara. Journal of Food Science, 76(2) : 318-323.( 1) 1)
|
| [41] |
Zhu X F, Zhang H X, Lo R. 2004. Phenolic compounds from the leaf extract of artichoke (Cynara scolymus l.) and their antimicrobial activities. Journal of Agricultural and Food Chemistry, 52(24) : 7272-7278.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

