文章信息
- 刘政捷, 林源, 周明兵, 汤定钦
- Liu Zhengjie, Lin Yuan, Zhou Mingbing, Tang Dingqin
- 应用微卫星分子标记估算毛竹的异交率
- Estimation of Outcrossing Rate in Phyllostachys edulis by Microsatellite Polymorphism
- 林业科学, 2014, 50(8): 76-81
- Scientia Silvae Sinicae, 2014, 50(8): 76-81.
- DOI: 10.11707/j.1001-7488.20140811
-
文章历史
- 收稿日期:2013-10-16
- 修回日期:2014-06-05
-
作者相关文章
植物有各种形式的有性和无性繁殖系统。有性繁殖通过父母本间的染色体重组产生不同基因型的子代,有利于维持子代种群的遗传多样性。然而,有性繁殖的配子(种子)是一个脆弱的独立生命幼体,易受环境的影响,往往容易在形成、萌发及以后的成长过程中被淘汰。由根或茎派生出子分株的无性繁殖是有利的,因为这些分株通常连接到母株获得营养物质,更有利于安全成长发育成为独立的成熟生物体(de Kroon et al., 1997)。然而,由于无性繁殖只能产生基因型完全相同的分株,不能在种群中引入新的基因型,因而依赖于营养再生的无性繁殖导致种群遗传组成的均一性。
毛竹(Phyllostachys edulis)具有非常发达的地下鞭系系统,通过地下鞭系横走地下,由其上的笋芽萌发在地上形成秆或分株克隆(萧江华,1983)。在有性繁殖方面,毛竹与多数竹子一样属一稔(monocarpic)植物,需间隔60年以上才能完成开花(Janzen, 1976; Watanabe et al., 1982)。因此,在完成开花结实的60多年间,由种子实现再生罕有发生。种群的发展主要靠无性繁殖,通过地下鞭系系统延伸形成了地下鞭系相连,地上由同一克隆(秆)组成连绵几十米甚至更远的顶极群落。在开花毛竹林后续演替群落中存在着遗传多样的基株(genets),表明了有性繁殖保持毛竹种群的遗传多样性(Isagi et al., 2004)。迄今为止毛竹开花特性的研究报道不多,除大家普遍认可的开花间隔时间长、大面积同时开花等竹子开花特性外(Watanabe et al., 1982; Liao, 1990; Isagi et al., 2004),多是各地出现开花现象的新闻报道,育种上的应用更为罕见。
自20世纪90年代末以来,广西壮族自治区桂林市周边地区连续多年发生零星毛竹林开花,为研究毛竹开花的生物学特性提供了很好的试验材料。本研究采用具有共显性遗传、选择中性、多态性高、在不同的基因组中随机分布、易于被扩增等优点的微卫星(microsatellites)标记技术,分析了从桂林市周边3个县的3株开花毛竹收集得到的半同胞家系子代,以期了解毛竹的交配行为及其对维持其种群遗传多样性的作用,同时为毛竹实生苗选择育种奠定理论基础。
1 材料与方法 1.1 试验材料近几年在广西壮族自治区有小范围毛竹零星开花的报道,主要地点包括荔浦、灵川和灌阳等县。于2011年,在这3个县开花毛竹林现场各选定1株开花毛竹(株间相隔30~100 km),分别收集半同胞种子共3份(表 1)。种子于实验室培养箱内发芽,统计发芽率(国标种检2772-81);培养到3叶期,随机各抽取50株幼苗,应用改良CTAB法(Doyle et al., 1987)提取基因组DNA, 作为模板供PCR扩增。
|
|
本课题组先前已开发了近100个毛竹的微卫星分子标记,分析毛竹2010年混合种批(seedlot)发现有22位点上存在有多态性(Tang et al., 2010; Lin et al., 2014)。本文选用其中8个多态性(多态信息含量polymorphism information content, PIC≥0.36)较高的位点作为分析工具,具体信息见表 2。
PCR反应体系总体积为20 μL, 其中包括10×Buffer 2 μL, MgCl2(25 mmol·L-1)1.2 μL, dNTPs(各dNTP均2.5 mmol·L-1)1.6 μL, Taq聚合酶(5 U·μL-1)0.2 μL, DNA模板1 μL(50 ng·μL-1),上、下游引物(10 μmol·L-1)各0.5 μL。PCR反应程序为: 94 ℃预变5 min;94 ℃45 s、复性45 s(各引物对应退火温度,表 2),72 ℃ 1 min, 35个循环;最后72 ℃延伸10 min后4 ℃保存。在PCR产物中加入变性缓冲液,95 ℃变性5 min后用4%变性聚丙烯酰胺胶(厚度0.4 mm)和1×TBE电泳缓冲液电泳分离。用美国C.B.S.测序胶电泳系统进行电泳,100 W预电泳30 min后上样,60 W恒功率电泳约1.5 h, 用银染法(Panaud et al., 1996)显示微卫星片断,再用相机拍照,记录统计上述3个半同胞家系子代各50个个体在分析位点上的基因型。
1.2.2 数据分析采用基于牛顿拉普森(Newton-Raphson)算法、适用于共显性标记的多位点异交率分析软件MLTR(Ritland ,1986;2002)(版本2.4,http://genetics.forestry.ubc.ca/ritl and /programs.html)对交配系统各个参数进行估计。按软件输入要求列出分析个体及其在各个位点上基因型矩阵,统计遗传多样性等常规参数;采用最大期望法(expectation maximization method),经过100次重复取样(bootstraps)估计试验种群的参数: 单位点(ts,single-locus outcrossing rate)、多位点(tm,multi-locus outcrossing rate)异交率和近交系数(Fis,inbreeding coefficient)等,分析毛竹的交配系统特性。
|
|
选用8个多态性较高(PIC≥0.36)的位点(表 2)作为分析工具,检测3株开花毛竹(相互间隔大于30 km)上收集得到的自由授粉半同胞种子(2011年度)种群的遗传多态性(图 1和表 3)。结果显示: 3个半同胞种群内存有遗传多态性,在8个SSR位点平均有效等位基因数(Ae)为1.54,Shannon指数(I)平均为0.282,多态信息含量(PIC)平均为0.157(均小于0.25),为低度多态基因座,种群遗传多态度整体偏低;3个种群在Nei基因多样性指数(H)、预期杂合度(He)等多态性指标上有差异,其中荔浦种群最小,灵川种群居中,灌阳种群最大。
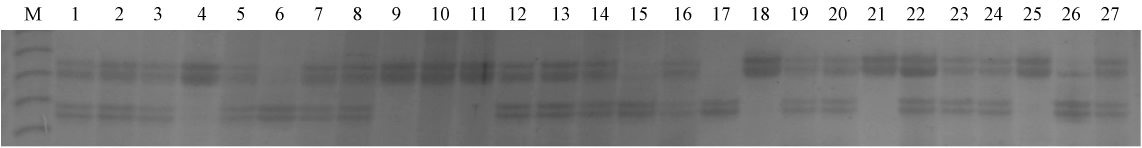
|
图1 毛竹半同胞子代(部分)在PBM069位点上的基因型多态性 Fig.1 Polymorphism of half-sib offsprings(partial)in locus PBM069 M: 10 bp size marker; 1-27: 灵川半同胞子代个体 Half-sib offsprings from Lingchuan. |
|
|
具体分析毛竹半同胞种群在最富有多态性的8个位点中基因型表现(表 4)。从表 4可看出: 3个种群在PBM044,PBM080,PBM095位点上均表现出基因型多态性,荔浦种群在PBM069,PBM075和PBM087位点上未有多态基因型出现,灵川种群在PBM087位点上有特有的多态基因型表现而在PBM075和PBM084位点为单一基因型,灌阳种群在PBM087和PBM091上呈单一基因型表现。这些结果说明,位于3个不同地点的开花植株都能够通过与不同的外源花粉杂合,产生具有不同微卫星基因型特点的遗传上多态的半同胞子代个体。 利用这8个多态微卫星位点来估算毛竹的异交率等相关遗传参数(表 4)。理论上所有子代个体至少含有1个来自母本的等位基因,分析发现在3个位点上共有9个基因型不含有共同等位基因(推测的母本基因型,约为0.25%),剔除这类子代个体数据。毛竹通过地下鞭芽繁育,如地下鞭芽繁育的日本倭竹(Sasa cernua)会出现芽突变(Kitamura et al., 2009),产生微卫星基因型的变化,其突变率可达4.4%(Kitamura et al., 2011)。另外毛竹林的寿命可达近70年,在长寿命植物如深山犬樱(Prunus ssiori)和北美乔柏(Thuja plicata)上发现微卫星位点上产生突变基因型(Nagamitsu et al., 2004; O’Connell et al., 2004)。 3个不同地点开花毛竹的异交率tm(多位点)和ts(单位点)均表现出一定的差异,荔浦和灵川为 0.067左右,灌阳为0.133左右,总体平均值均为0.089;近交系数估算均值为0.181,表明家系子代中的纯合体过剩。本课题组也曾采用同一方法分析了2010年开花的灵川和灌阳的2个子代家系的材料(位于本文所研究的开花材料不远),其分析结果与本文的结果相近。这说明毛竹交配系统主要以自交为主,兼顾有一定比例的异交以确保其种群后代的遗传多样性。
|
|
迄今有关毛竹林种群形成的研究不多,形成机制尚无定论。一般认为毛竹林每间隔67年就会同时开花后大面积死亡,结实的毛竹种子在经历鼠类、鸟类等吞食和萌发早期的高死亡率后,少数种子成苗成秆并通过其地下鞭系系统延伸形成克隆分株而恢复毛竹林种群(Janzen, 1976; Watanabe et al., 1982)。在开花后复兴的毛竹林中发现有多种不同(AFLP)基因型的基株共存,并且具有不同的开花时间,即不同基株的开花年度不同造成整个毛竹林种群的开花可延续几年的现象(Isagi et al., 2004)。本研究的采样地均位于人迹罕至的深山老林,没有人为经营的记载,据采毛竹种子的山民介绍在采种地的周边出现了持续几年的零星毛竹林开花。本文分析了3个独立的半同胞家系的子代材料,结果表明: 在半同胞家系内存在着一定程度的微卫星标记多样性,同一家系子代个体中含有多种基因型的基株。可以据此推测采样的这3片毛竹林种群很有可能按上述的方式演化而来的,同时在开花后复兴的同一片毛竹林中有多个基因型基株存在(Isagi et al., 2004)也是形成同一家系子代个体中含有多种基因型的原因。
在半同胞家系中形成遗传多样子代的直接原因是由于外来花粉的影响,这种影响通过携带着新基因型的外来花粉与母株雌性配子的杂合(异交,outcrossing)产生新基因型的杂合子代,而这种影响的程度取决于异交的程度即异交率(outcrossing rate)。因此通过异交率等参数研究竹子交配系统,不但能了解竹子繁育生物学特性,也能阐明竹子种群的遗传多样性和遗传结构,以制订育种改良策略。目前对竹子的交配系统研究不多,通过野外观察和人工授粉试验研究推测赤竹属(Sasa)竹种以自交亲和性占主导地位(Nishiwaki et al., 1990),南美原产的偏穗竹属(Merostachys)竹种Merostachys riedeliana 的自交率也可达0.99(Guilherme et al., 2001)。本文基于8个多态SSR位点的分析结果也支持上述的推测,估算的毛竹异交率为0.089。这个结果略低于Kitamura等(2011)报道的日本倭竹在6个多态位点估算的异交率0.148。这些初步结果表明: 毛竹与赤竹属、偏穗竹属的竹种一样,是一种以自交为主导的、稍有兼顾异交的、具有较高自交亲和性的物种。同属禾本科(Gramineae)的野生稻(Oryza rufipogon)1年生品种多以自交(tm=0.04)为主,多年生品种则为混合交配(tm=0.55)(Morishima et al., 1990)。
竹子按照其地下鞭系系统的延伸方式可分为散生、丛生和混生3种类型(Das et al., 2008)。毛竹属于散生竹种,与丛生竹 M. riedeliana和混生竹日本倭竹相比,其地下鞭系系统具有更强、更远的延伸能力,因而能够在远离母株(秆)的地方繁殖克隆分株(秆),从而增加竹林种群中同一基因型个体的数量和比例。其结果也就如在野生稻报道的那样: 在小范围内增加了同一克隆个体间的自交概率而降低了异交的概率(Song et al., 2003)。事实上毛竹确实具备一些适合于异交的生物学特性,如开花时其柱头呈三瓣状、伸长超出内稃外露,似乎更容易接受外来的花粉(Liao, 1990);花粉直径在竹类植物中属于较大的,刚竹属(Phyllostachys)的竹种多在50 μm以上(张文燕等,1989),相比较于其他禾本科植物的花粉属于较大的(Shimakura et al., 1973); 在广西壮族自治区桂林市周边的采种地现场以及移栽的开花竹种质资源圃,均能观察到蜜蜂授粉过程,Guilherme等(2001)在M. riedeliana 也报道过这种虫媒授粉现象。此外,毛竹具集群开花(gregarious flowering)特性,在本研究收集供试种子的毛竹林中虽只出现小范围(面积)开花,但开花的分株几乎是整株开花产生了高密度的花粉,也有利于异交的发生(Nishiwaki et al., 1990)。另一方面,毛竹的种子发芽率整体偏低,特别是没有人工防虫处理的荔浦种群只有15.3%(表 1)。Liu等(2005)的研究表明: 普通野生稻种子的萌发与其基因型有关,存在非随机种子萌发的现象。本试验中毛竹种子发芽率与其遗传多样性有一定程度的关联性(r2=0.91***),近交系数估算均值为0.181,表明家系子代中的纯合体过剩。如若出现自交衰退,种子萌发阶段会因对纯合子的自然选择,造成种群中的纯合体下降、杂合体的比例上升(Suso et al., 2008)。偏低的发芽率会加剧这种选择,使得分析材料中的杂合体比例增加而导致其异交率被高估。
本研究首次通过DNA分子标记技术估算了散生竹种的异交率,高效、多态的微卫星标记有利于准确鉴别外来花粉的基因流动,选用相隔大于30 km的3株野生开花植株的家系子代作为分析材料有望克服毛竹克隆生长的弊端。分析结果揭示的毛竹交配系统生物学特性为其种质资源保存策略制定以及遗传育种研究奠定了基础,但准确阐明毛竹的生殖特性还需对分布更为广泛的种群(家系)、更多的子代个体进行分析,并综合各类相关参数。
| [1] |
萧江华. 1983. 材用毛竹林的地下系统结构. 竹类研究, 2(1): 114-119.( 1) 1)
|
| [2] |
张文燕, 马乃训, 陈红星. 1989. 竹类花粉形态及萌发试验. 林业科学研究, 2(1): 67-70.( 1) 1)
|
| [3] |
Das M, Bhattacharya S, Singh P, et al. 2008. Bamboo taxonomy and diversity in the era of molecular markers//Jean-Claude K, Michel D. Advances in botanical research. San Diego, UAS: Academic Press, 225-268.( 1) 1)
|
| [4] |
de Kroon H, van Groenendael J. 1997. The ecology and evolution of clonal plants. Backhuys Publishers, Leiden.( 1) 1)
|
| [5] |
Doyle J J, Doyle J L. 1987. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochem Bull, 19: 11-15.( 1) 1)
|
| [6] |
Guilherme F A G, Ressel K. 2001. Biologia floral e sistema de reproduo de Merostachys riedeliana (Poaceae: Bambusoideae). Revta brasil Bot, So Paulo, 24(2): 205-211 (in Spanish with English abstract).( 2) 2)
|
| [7] |
Isagi Y, Shimada K, Kushima H, et al. 2004. Clonal structure and flowering traits of a bamboo[Phyllostachys pubescens (Mazel) Ohwi] stand grown from a simultaneous flowering as revealed by AFLP analysis. Mol Ecol, 13(7): 2017-2021.( 4) 4)
|
| [8] |
Janzen D H.1976. Why bamboos wait so long to flower. Ann Rev Eco Syst, 7(1): 347-391.( 2) 2)
|
| [9] |
Kitamura K, Kawahara T. 2011. Estimation of outcrossing rates at small-scale flowering sites of the dwarf bamboo species, Sasa cernua. J Plant Res, 124(6): 683-688.( 2) 2)
|
| [10] |
Kitamura K, Saitoh T, Matsuo A, et al. 2009. Development of microsatellite markers for the dwarf bamboo species Sasa cernua and S. kurilensis (Poaceae) in northern Japan. Mol Ecol Resour, 9(6): 1470-1472.( 1) 1)
|
| [11] |
Liao G L. 1990. On the flowering and regeneration of Phyllostachys pubescens. Bamboo J, 8: 21-23.( 2) 2)
|
| [12] |
Lin Y, Wu M D, Zhou M B, et al. 2014. Identification, cross-taxon transferability and application of full-length cDNA SSR markers in Phyllostachys pubescens. SpringerPlus (in press).( 1) 1)
|
| [13] |
Liu G H, Zhou J, Li W, et al. 2005. The seed bank in a subtropical freshwater marsh: implications for wetland restoration. Aquat Bot, 81(1): 1-11.( 1) 1)
|
| [14] |
Morishima K, Barbier P. 1990. Mating system and genetic structure of natural populations in wild rice Oryza rufipogon. Plant Species Biol, 5(1): 31-39.( 1) 1)
|
| [15] |
Nagamitsu T, Ogawa M, Ishida K, et al. 2004. Clonal diversity, genetic structure and mode of recruitment in a Prunus ssiori population established after volcanic eruptions. Plant Ecol, 174(1): 1-10.( 1) 1)
|
| [16] |
Nishiwaki A, Konno Y. 1990. Pollination system in two dwarf bamboo species. Bamboo J, (8): 17-20.( 2) 2)
|
| [17] |
O'Connell L M, Ritland K. 2004. Somatic mutations at microsatellite loci in western red cedar (Thuja plicata: Cupressaceae). J Hered, 95(2): 172-176.( 1) 1)
|
| [18] |
Panaud O, Chen X, McCouch S R. 1996. Development of microsatellite markers and characterization of simple sequence length polymorphism (SSLP) in rice (Oryza sativa L.). Mol Gen Genet, 252(5): 597-607.( 1) 1)
|
| [19] |
Ritland K. 1986. Joint maximum-likelihood-estimation of genetic and mating structure using open-pollinated progenies. Biometrics, 42(1): 25-43.( 1) 1)
|
| [20] |
Ritland K. 2002. Extensions of models for the estimation of mating systems using n independent loci. Heredity, 88(4): 221-228.( 1) 1)
|
| [21] |
Shimakura M, Hakabutsukan Õss. 1973. Palynomorphs of Japanese plants. Special Publications from the Osaka Museum of Natural History, 5:60 (in Japanese with English summary).( 1) 1)
|
| [22] |
Song Z P, Xu X, Wang B, et al. 2003. Genetic diversity in the northernmost Oryza rufipogon populations estimated by SSR markers. Theor Appl Genet, 107(8): 1492-1499.( 1) 1)
|
| [23] |
Suso M J, Moreno M T, Melching A E. 2008. Variation in outcrossing rate and genetic structure on six cultivars of Vicia faba L. as affected by geographic location and year. Plant Breeding, 118(4): 347-350.( 1) 1)
|
| [24] |
Tang D Q, Lu J J, Fang W, et al. 2010. Development, characterization and utilization of GenBank microsatellite markers in Phyllostachys pubescens and related species. Mol Breeding, 25(2): 299-311.( 1) 1)
|
| [25] |
Watanabe M, Ueda K, Manabe I, et al. 1982. Flowering, seeding, germination and flowering periodicity of Phyllostachys pubescens. J Jpn For Soc, 64(3): 107-111.( 3) 3)
|
 2014, Vol. 50
2014, Vol. 50

