文章信息
- 江南, 谭晓风, 张琳, 曾艳玲
- Jiang Nan, Tan Xiaofeng, Zhang Lin, Zeng Yanling
- 基于RNA-Seq的油茶种子α-亚麻酸代谢途径及相关基因分析
- Gene Analysis of α-Linolenic Acid Metabolism of Camellia oleifera Seeds Based on RNA-Seq
- 林业科学, 2014, 50(8): 68-75
- Scientia Silvae Sinicae, 2014, 50(8): 68-75.
- DOI: 10.11707/j.1001-7488.20140810
-
文章历史
- 收稿日期:2013-10-11
- 修回日期:2014-02-24
-
作者相关文章
2. 湖南工业大学 株洲 412008
2. Hunan University of Technology Zhuzhou 412008
油茶(Camellia oleifera)原产我国,是最重要的木本食用油料树种,在南方14个省(市、自治区)均有栽培分布(何方等,2002;谭晓风等,2012),栽培面积接近400万hm2。茶油是优质保健食用植物油,含有90%左右的不饱和脂肪酸(吴小娟等,2006),其中以油酸(80%以上)和亚油酸(约8%)居多,且不含有难以消化的芥酸和山嵛酸。α-亚麻酸(α-linolenic aicd, ALA, C18: △9,12,15)是只能在植物体内合成的三价不饱和脂肪酸,是ω-3多不饱和脂肪酸中唯一的人体必需脂肪酸(Simon et al., 2009)。α-亚麻酸在人体内可转化为二十二碳六烯酸(docosahexaenoic acid, DHA)、二十碳五烯酸(eicosapentaenoic acid, EPA)和二十二碳五烯酸(docosapentaenoic acid, DPA)等(Stark et al., 2008),是构成细胞膜和生物酶的基础物质,具有降血脂、降血压、预防心脑血管疾病、抵抗炎症、增强智力等多方面的作用(SanGiovanni et al., 2005)。近年来α-亚麻酸的研究越来越被重视,但与油酸、亚油酸等不饱和脂肪酸相比,现有α-亚麻酸的研究主要集中在人体α-亚麻酸的生理功能研究及富含α-亚麻酸植物的开发利用等方面(杨静等,2011;李丽萍等,2007;徐爱遐等,2004)。Schilmiller等(2007)和Truman等(2007)在茉莉酸的生物合成及茉莉酸调节拟南芥(Arabidopsis thaliana)的生长发育和应激反应研究中涉及α-亚麻酸的合成及在植物体内的变化过程;KEGG PATHWAY数据库茉莉酸生物合成数据模块中包含有α-亚麻酸代谢通路。不饱和脂肪酸的合成研究表明,植物中α-亚麻酸合成是以磷脂酰胆碱为最初底物,经磷脂酶(PLA)和脂肪酸脱饱和酶(FAD)作用形成亚麻酸(王镜岩等,2002)。这些研究为植物α-亚麻酸代谢途径基因调控研究提供重要参考。本实验室在油茶种子转录组研究中发现,油茶种子油脂合成过程存在α-亚麻酸代谢途径。同时,对不同油茶品种所产油脂样品分析发现,α-亚麻酸在茶油中的含量不高,仅为0.3%~0.4%(胡芳名等,2006)。若能通过分子设计育种,调控油茶种子α-亚麻酸代谢途径,促进α-亚麻酸合成代谢相关基因的超量表达,有可能在一定范围内提高α-亚麻酸在茶油中的含量,对于进一步提高茶油的食用和保健品质具有科学意义和产业开发价值。本文在油茶种子转录组和表达谱数据分析的基础上开展了油茶种子α-亚麻酸代谢途径及其相关基因分析,以期为相关基因的克隆与鉴定,进而为提高α-亚麻酸含量的油茶分子育种奠定基础。
1 材料与方法 1.1 材料采集分别于2009年6月下旬(油茶果实膨大期)和10月中旬(油脂合成高峰期)从湖南省株洲市马家河镇中南林业科技大学油茶种质资源圃采集国家审定油茶品种‘华硕’的果实,果实采摘后立即剥取种子放入液氮中保存,带回实验室将种子置-80 ℃超低温冰箱中保存。
1.2 油茶种仁总RNA提取及RNA浓度和质量检测分别取果实膨大期和油脂合成高峰期的‘华硕’种仁放入不同的研钵中,加入液氮研磨至匀质粉末状,分别装入预冷的1.5 mL离心管中,用Invitrogen公司总RNA提取试剂盒分别提取不同时期种仁样品的总RNA。电泳检测提取RNA的完整性,核酸/蛋白定量分光光度计测定RNA浓度。-80 ℃保存完整性好(28S∶18S大致为2∶1)、OD260/280值在1.9~2.2之间、样品浓度≥200 ng·μL-1的RNA样品备用测序。
1.3 油茶种子转录组数据库构建将上述2个不同时期的RNA样品等比例混合成总量为1 mg左右的混合样品,用干冰保存送至深圳华大基因公司采用Illumina技术进行转录组测序。组装软件SOAP denovo完成对转录组数据组装、拼接和去冗余处理后获得非冗余Unigene序列,构建了油茶种子油脂合成调控过程中的转录组数据库。将Unigene 序列比对到Nr, SwissProt, KEGG和COG等数据库,完成油茶种子油脂合成调控过程转录组数据库基因注释,取e-value< 0.000 01的Unigene视为已知基因(邵奉公,2011)。
1.4 油茶种子表达谱数据库构建将上述2个不同时期的RNA样品各1 mg左右分别用干冰保存,送至深圳华大基因公司采用Solexa技术进行数字化表达谱测序。对2个表达谱数据库进行整理和去杂后,根据已有的转录组数据库进行基因注释。
1.5 油茶种子转录组和表达谱数据库数据分析从华大基因公司下载油茶种子转录组数据和表达谱测序数据,按基因功能对转录组数据中Pathway显著富集的Unigenes进行分类,综合分析油茶种子油脂形成过程中涉及的相关基因,关键基因参与调控代谢途径中的关键节点,以及关键基因的功能、不同时期的表达差异及与油脂形成的关系,在Nr, SwissProt, KEGG和COG等数据库中注释信息不一致的Unigenes序列,选取其中200 bp以上的序列在GenBank中重新进行Blastx同源性比对获取准确基因信息。
1.6 qPCR验证油茶种子油脂合成关键基因在不同时期的表达差异对表达谱数据分析获得的油茶种子关键基因在油茶种子不同时期的表达模式采用qPCR进行验证。根据油茶种子转录组数据库中各基因已知序列信息采用软件Primer Primer5.0设计用于qPCR的引物(表 1),由北京六合华大基因公司合成,各引物均进行PCR检测,并对扩增产物回收测序以验证引物的特异性。按QuantiFast SYBR Green PCR试剂盒(QIAGEN)推荐方法在实时荧光定量PCR仪(BIO-RAD)上完成qPCR过程,采用Bio-Rad CFX Manager软件进行分析。
|
|
油茶果实膨大期和油脂合成高峰期RNA等比例混合样品进行Illumina双末端测序(paired-end sequencing, PE)后,共获得了13 333 334个reads片段,包含1 200 000 060 nt, 其中片段长度大于20个碱基的百分比为96.05%,N值为0,GC%值为46.75%,说明此次转录组测序结果较好,为后续的数据组装提供了很好的原始数据。用组装软件SOAP denovo对转录组数据组装、拼接和去冗余处理后最终获得了69 798个非冗余Unigene片段,序列信息达到24 154 817 nt, 片段大小从159~3 859 nt不等,各Unigene片段长度、数量及其在转录组中所占比例见表 2。 对Unigene进行覆盖度分析发现69 798条Unigene都能够与测序的原始数据reads相对应,同时将Unigene数据库与Scaffold数据库进行比对后,也得到了Unigene序列与Scaffold序列的很好的对应关系,说明Unigene序列确实由Scaffold序列进行拼接获得的去冗余序列。对油茶种子转录组Unigene序列进行蛋白功能注释、Pathway注释、COG功能注释和Gene Ontology(GO)功能注释,共有18 714条Unigene获得基因注释,归并为124个代谢途径,其中涉及α-亚麻酸合成代谢的Unigene序列共112条,与α-亚麻酸代谢密切相关的不饱和脂肪酸合成途径Unigene序列94条,分别占全部注释基因的0.6%和0.5%。
|
|
分别对油茶果实膨大期和油脂合成高峰期RNA进行Solexa单端测序(single-end sequencing, SE),获得油茶种子2个不同时期的表达谱数据库,对数据库进行整理和去杂后,得到油茶果实膨大期高质量测序标签(clean tags)117 123条,油脂合成高峰期clean tags 106 069条;大部分数据能够通过前期构建的转录组数据库得到注释。为了进一步分析2个时期基因表达差异,将基因的表达量标准化,取标准化基因表达量TPM(transcript per million clean tags)值直接用于比较不同样品间的基因表达差异(聂志扬等,2009),并对差异检验的P值进行多重假设检验校正,通过控制FDR(false discovery rate)≤0.001来最终决定P值的域值。本研究中,以FDR≤0.001且存在2倍以上表达差异作为判断基因表达差异显著的阈值。将果实膨大期的表达谱数据库与高峰期的数据库进行比较,发现种类相同且表达上存在差异的基因共有2 716条,其中α-亚麻酸代谢差异表达基因12条,占全部差异表达基因的1.25%。
2.3 油茶种子α-亚麻酸代谢途径及其相关基因综合分析油茶种子转录组数据中α-亚麻酸代谢途径的112条Unigenes序列和不饱和脂肪酸合成途径94条Unigenes序列的基因注释信息,可确定调控α-亚麻酸代谢过程的主要酶基因有12种,分别为磷脂酶A2基因(PLA2)、脂肪氧合酶基因(LOX)、α-双加氧酶基因(DOX)、12-氧代植物二烯酸还原酶基因(OPR)、丙二烯氧化物环化酶基因(AOC)、脂肪酸β-氧化作用多功能蛋白基因(MFPA)、乙酰-CoA酰基转移酶基因(AACT)、脂酰-CoA-氧化酶基因(ACOX)、氢过氧化物裂解酶基因(HPL)、丙二烯氧化物合酶基因(AOS)、△-(12)-脂肪酸脱饱和酶基因(FAD2)、△-(15)-脂肪酸脱饱和酶基因(FAD3),它们编码参与油茶种子α-亚麻酸代谢过程的12种关键酶。转录组α-亚麻酸代谢Pathway分析显示12种酶功能基因分别参与调节α-亚麻酸代谢过程中关键节点的生化反应,是调控α-亚麻酸代谢途径的关键酶功能基因。
为进一步确认12种α-亚麻酸代谢关键酶基因注释的可靠性,将12种基因中200 bp以上的Unigene编码序列在GenBank中重新进行Blastx同源性比对。各基因Unigene序列与其他植物相关已知基因序列的比对信息显示,编码12种关键酶的Unigenes基因序列分别与油橄榄(Olea europaea)、茶树(Camellia sinensis)、欧洲榛子(Corylus avellana)、大豆(Glycine max)、花生(Arachis hypogaea)、蒺藜苜蓿(Medicago truncatula)、陆地棉(Gossypium hirsutum)、烟草(Nicotiana tabacum)等植物相关基因序列比对的基因注释达到较高的期望值,相似性达85%~95%不等。Blastx同源性比对结果可以确认这12种酶基因注释的准确性和可靠性。
2.4 不同时期油茶种子α-亚麻酸代谢关键酶功能基因的表达分析油茶种子果实膨大期和油脂合成高峰期的表达谱数据,发现油茶种子α-亚麻酸代谢中12种关键酶功能基因在油茶种子不同发育时期的表达存在差异,各基因不同时期表达分析详见表 3。本研究中,以TPM 1~5为低丰度表达,TPM 5~10为中丰度表达,TPM>10为高丰度表达。
|
|
表 3数据显示,在油茶种子发育过程中α-亚麻酸代谢的12种关键酶基因存在4种表达模式。脂肪氧合酶基因(LOX)、丙二烯氧化物合酶基因(AOS)和脂酰-CoA-氧化酶基因(ACOX)膨大期没有表达,油脂合成高峰期有表达;丙二烯氧化物环化酶基因(AOC)、12-氧代植物二烯酸还原酶基因(OPR)、乙酰-CoA脂肪酰转移酶基因(AACT)在油茶种子成熟过程不同时期都有表达但表达量差异不大,3种基因在不同时期均表达丰度较低;磷脂酶A2基因(PLA2)、氢过氧化物裂解酶基因(HPL)、△-12脂肪酸脱饱和酶基因(FAD2)和△-15脂肪酸脱饱和酶基因(FAD3)在油茶油脂形成过程的果实膨大期和油脂合成高峰期都有表达,且油脂合成高峰期表达相对于膨大期表达为上调;而α-双加氧酶(DOX)基因和脂肪酸β-氧化作用多功能蛋白基因(MFP)在油茶油脂形成过程的果实膨大期和油脂合成高峰期也都有表达,但油脂合成高峰期表达为下调,如MFP在油脂合成高峰期相对于果实膨大期基因表达下调近4倍。
2.5 qPCR对不同时期油茶种子α-亚麻酸代谢关键酶功能基因表达差异验证对α-亚麻酸代谢12个关键酶基因采用qPCR验证其在油茶果实膨大期和油茶种子油脂合成高峰期的表达情况。利用Primer Premier 5.0设计的α-亚麻酸代谢关键酶功能基因的qPCR引物退火温度为57 ℃,PCR产物130~385 bp, 经琼脂糖凝胶电泳检测和测序,确认各基因引物能有效单一条带扩增,表明设计的引物具有特异性,可用于荧光定量PCR 分析。
以表达稳定的油茶GAPDH基因(rzots0_001325.y1.scf)为内参对照基因(谭晓风等,2008)扩增目的基因,采用Bio-Rad CFX Manager软件,拟定相对表达丰度最高值为1.0,计算α-亚麻酸代谢各关键酶基因在油茶果实膨大期和油茶种子油脂合成高峰期的相对表达量并作柱状图(图 1)。由图 1可知:PLA2,HPL, FAD2和FAD3基因表达规律一致,在油茶种子果实膨大期都有一定表达量,PLA2,HPL, FAD2油脂合成高峰期相对于膨大期表达上调幅度较大,FAD3果实膨大期表达量低,油脂合成高峰期表达上调幅度不如FAD2;AOC, OPR, AACT等基因在油茶种子果实膨大期和油脂合成高峰期表达量较低且差异不大;LOX, AOS和ACOX在果实膨大期表达量极低,在油脂合成高峰期有一定量表达;DOX, MFP果实膨大期表达量较大但在油脂合成高峰期基因表达骤然下降。试验结果显示,α-亚麻酸代谢关键酶基因在油茶果实膨大期和油茶种子油脂合成高峰期的表达模式与油茶种子不同时期表达谱数据分析结果一致。

|
图1 实时荧光定量PCR检测不同时期关键酶基因相对表达量 Fig.1 The relative expression abundance of key enzyme genes in different developmental period by qPCR |
油茶种子转录组数据分析显示Pathway显著性富集分析可以确定α-亚麻酸代谢过程中FAD2,FAD3,LOX, AOS, ACOX, AOC, OPR, AACT, PLA2,HPL, DOX, MFP2具差异表达的12种关键酶功能基因调控α-亚麻酸代谢过程的关键节点的反应,结合油茶种子调控α-亚麻酸代谢的关键酶基因不同时期基因表达差异分析,绘制油茶种子α-亚麻酸代谢过程关键酶功能基因调控途径(图 2)。从图 2中可以看出,油茶种子α-亚麻酸代谢存在α-亚麻酸的合成和形成多种不饱和脂肪酸的物质转化的过程。PLA2,FAD2,FAD3是调控α-亚麻酸合成过程的关键基因,各基因分别调控油茶种子α-亚麻酸合成途径中1个节点的反应。DOX, LOX及FAD是平行调控α-亚麻酸转化为其他不饱和脂肪酸物质的第1步反应中的关键基因,在油茶α-亚麻酸代谢途径中DOX基因调节1个代谢节点的生化反应,LOX参与调控2个代谢节点的生化反应,调控α-亚麻酸生成脂肪酸氢过氧化物过程。HPL和AOS基因在油茶α-亚麻酸代谢过程分别调节2个代谢节点的代谢流量,调控脂肪酸氢过氧化物转化形成多种不饱和脂肪酸。AOC和OPR各调控1个α-亚麻酸代谢节点的生化反应,ACOX, MFP和AACT各调控3个代谢节点的反应,图 2显示这5个基因共同参与调控油茶种子发育过程中α-亚麻酸形成茉莉酸类物质。
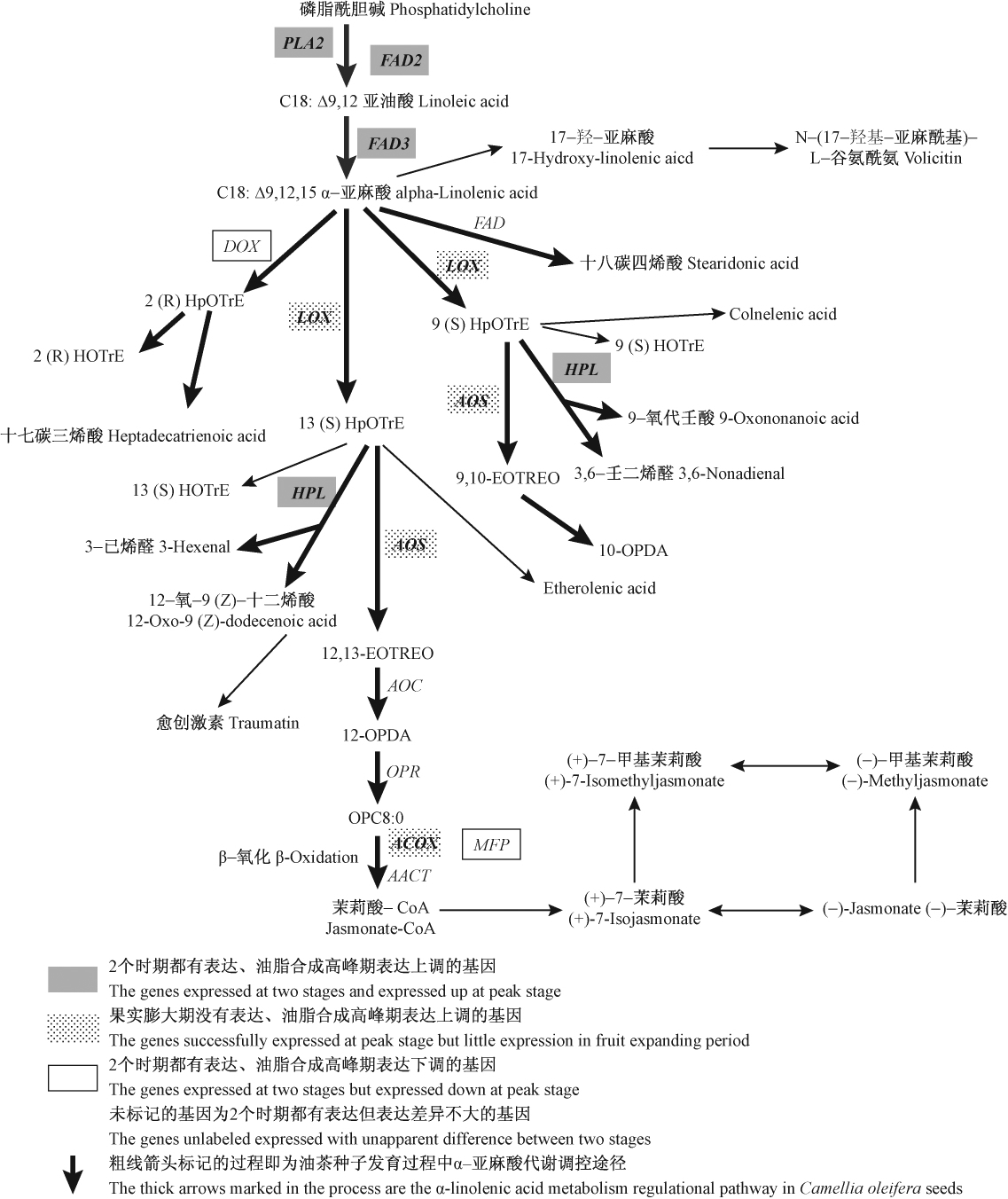
|
图2 油茶种子α-亚麻酸代谢调控途径 Fig.2 The α-linolenic acid metabolism regulational pathway in Camellia oleifera seeds |
油茶种子发育过程中能合成大量不饱和脂肪酸,其中α-亚麻酸是ω-3不饱和脂肪酸中人体必需的不饱和脂肪酸。为开发油茶的优质基因资源,培育提高α-亚麻酸含量的油茶新品种,本研究以油茶果实膨大期和油脂合成高峰期种子为材料构建了油茶种子转录组数据库和不同时期表达谱数据库,并在转录组和表达谱数据分析的基础上对油茶种子α-亚麻酸代谢途径及其相关基因在种子不同时期的表达进行了分析,同时对各关键酶基因参与调控α-亚麻酸代谢过程关键节点的生化反应进行了分析研究。
转录组基因注释过程中KEGG是有关Pathway主要公共数据库(Kanehisa et al., 2008),通过Pathway显著性富集可以确定差异表达基因参与的最主要的生化代谢途径以及信号转导途径(聂志扬等,2009)。油茶种子转录组研究发现基因注释中Pathway显著性富集可以确定α-亚麻酸代谢12种关键酶功能基因,各基因在α-亚麻酸代谢过程中分别调控不同节点的反应进程(图 2)。12种关键酶功能基因中PLA2,FAD2,FAD3等基因是调控油茶种子α-亚麻酸合成的关键酶基因,其他基因调控α-亚麻酸进行物质转化形成多种不饱和脂肪酸的关键步骤。王镜岩等(2002)研究表明植物中的脂肪酸脱饱和酶(FAD)不能直接作用于游离脂肪酸,但可直接对磷脂类的脂肪酸链去饱和。PLA2可调控磷脂酰胆碱形成1-酰基甘油磷酸胆碱(1-Acylglycerophosphocholine),FAD2调控磷脂酰胆碱分子中sn2位上油酸链12和13碳原子之间形成双键生成亚油酸,亚油酸受FAD3调控在15和16碳原子之间进一步形成双键生成α-亚麻酸(王镜岩等,2002),实现油茶种子成熟过程中α-亚麻酸的积累。所以磷脂酰胆碱是α-亚麻酸合成的最初底物,FAD2调控着油茶油脂中油酸和亚油酸的比例,FAD3调控油茶种子α-亚麻酸含量。油茶种子不同时期表达谱数据分析显示PLA2,FAD2在油茶果实膨大期有高丰度表达到油脂合成高峰期表达上调幅度很大,说明油茶种子发育过程中始终有油酸和亚油酸的积累,而FAD3在油茶果实膨大期表达量较低,到油脂合成高峰期表达虽有上调但上调倍数不到2(表 3),这可能是油茶种子α-亚麻酸含量不高的主要原因。目前FAD2和FAD3基因已经分别在油茶、拟南芥、花生、麻疯树(Jatropha curcas)、大豆、油菜(Brassica napus)等植物中发现并克隆出来(谭晓风等,2008;谢金喜等,2007;张皙等,2007;石东乔等,1999;付瑜华等,2012;李晓丹,2007)。α-亚麻酸在茶油成分中含量不高也与α-亚麻酸合成后进行物质转化形成多种不饱和脂肪酸有关。DOX和LOX是调控α-亚麻酸向其他不饱和酸物质转化的关键酶基因,DOX在拟南芥和烟草中研究较多,现已分别克隆得到基因序列(马龙等,2007),可调控α-亚麻酸进行α-氧化形成2(R)-氢过氧化物-十八碳三烯酸[(2R)-(9Z, 12Z, 15Z)-2-hydroxyoct-adecatri-9,12,15-enoic acid],继而进一步形成 2(R)-羟基-十八碳三烯酸[(2R)-(9Z, 12Z, 15Z)-2-hydroxyoctadecatri-9,12,15-enoic acid]或十七碳三烯酸等不饱和脂肪酸(马龙等,2007),图 2清楚显示了这一过程。表达谱数据分析DOX基因在油茶果实膨大期中丰度表达且油脂合成高峰期表达下调,并未随α-亚麻酸的积累表达加强,这有利于油脂合成高峰期α-亚麻酸的积累。LOX广泛存在于需氧生物中(Hartmut et al., 2002),调控α-亚麻酸氧化生成脂肪酸氢过氧化物(Alexander, 1998),LOX表达贯穿于植物生活史的整个过程(Porta et al., 2002)。图 2显示LOX作用形成的脂肪酸氢过氧化物一方面经AOS调控进一步氧化形成环氧-十八碳三烯酸等多种不饱和脂肪酸,这些氧化物的形成不利于油茶优良品质形成,另一方面经HPL调控分解形成断链的醛(C6-或者C9-)和相应的C12-或者C9-脂肪酸,Feussner 等(2002)的研究证明了这一反应过程。HPL在油茶种子发育过程各个时期表达量都较大,这一方面与α-亚麻酸在油脂合成高峰期增加累积代谢加强有关,另一方面也说明脂肪酸氢过氧化物通过其他代谢途径在各个时期均有积累。ACOX和MFP在α-亚麻酸代谢过程中参与调控12-氧代植物二烯酸(12-OPDA)形成茉莉酸和茉莉酸甲酯过程中的三轮β-氧化。有研究资料表明,LOX, AOS, ACOX和MPF是植物体内茉莉酸类物质(jasmonates, JAs)合成途径的关键酶,JAs的合成是以亚麻酸为最初底物开始的一连串酶反应(蒋科技等,2010)。LOX, AOS和ACOX等基因在油茶果实膨大期表达量极低甚至无表达而在油脂合成高峰期有表达,这种前后表达差异表明油茶种子发育初期α-亚麻酸合成量很少或者没有合成,3种基因的表达与α-亚麻酸随种子成熟不断积累呈正相关。现有研究表明ACO, OPR和AACT 3种基因参与调控的反应均为JAs合成过程的后期反应(蒋科技等,2010),在油茶果实膨大期和油脂合成高峰期都有表达,但表达量及表达差异都不大,很明显3个基因的表达都不利于油茶油脂α-亚麻酸的积累。综合以上分析,油茶种子发育过程中α-亚麻酸的合成,主要受PLA2,FAD2及FAD3的调控。LOX是调控α-亚麻酸转化为其他物质的第1步反应中的关键酶基因,在油茶种子成熟期表达高丰度,不利于茶油α-亚麻酸的积累和茶油优良品质的形成。鉴于PLA2,FAD2,FAD3及LOX等基因在油茶种子不同时期的表达模式及其对α-亚麻酸代谢过程的调控功能,通过促进FAD3在油茶种子成熟过程中超量表达和在某时期适当抑制LOX的表达有利于提高茶油中α-亚麻酸含量。目前本实验室已着手进行油茶种子α-亚麻酸代谢过程中关键基因的克隆和功能分析,已克隆LOX, FAD2,AACT(张党权等,2008;张琳等,2011;胡姣等,2010;谭晓风等,2008)等基因并获得基因全长。这些研究将为分子育种培育高α-亚麻酸含量的优质油茶新品种提供理论基础和科学依据。
| [1] |
付瑜华, 陈新, 王文泉. 2012. 麻疯树 FAD3 基因的克隆及亚细胞定位研究. 热带作物学报, 25(11): 2030-2034.( 1) 1)
|
| [2] |
何方, 何柏. 2002. 油茶栽培分布与立地分类的研究. 林业科学, 38(5): 64-72.( 1) 1)
|
| [3] |
胡芳名, 谭晓风, 刘惠民. 2006. 中国主要经济树种栽培与利用. 北京: 中国林业出版社, 370-383.( 1) 1)
|
| [4] |
胡姣, 谭晓风, 张琳, 等. 2010. 油茶种子总RNA提取及Cod8FAD基因的鉴定. 浙江林业科技, 30(2): 17-21.( 1) 1)
|
| [5] |
蒋科技, 皮妍, 侯嵘, 等. 2010. 植物内源茉莉酸类物质的生物合成途径及其生物学意义.植物学报, 45(2): 137-148.( 2) 2)
|
| [6] |
李丽萍, 韩涛. 2007. 富含α-亚麻酸植物资源的开发与利用. 食品科学, 28(11): 614-618.( 1) 1)
|
| [7] |
李晓丹. 2007. 油料作物种子脂肪酸累积模式及相关基因的克隆与序列比较研究.北京: 中国农业科学院博士学位论文.( 1) 1)
|
| [8] |
马龙, 潘克厚, 石娟. 2007. α-双加氧酶及其研究进展. 海洋水产研究, 28(6): 109-116.( 2) 2)
|
| [9] |
聂志扬, 肖飞, 郭健, 等. 2009. DNA测序技术与仪器的发展. 中国医疗器械信息, 15(10): 13-16.( 2) 2)
|
| [10] |
邵奉公. 2011. 油茶种子油脂合成调控的转录组与表达谱研究. 长沙: 中南林业科技大学博士学位论文.( 1) 1)
|
| [11] |
石东乔, 周奕华, 张丽华, 等. 1999. 油菜BcNA1启动子与拟南芥 Fad2 基因的克隆及相关植物表达载体的构建.云南大学学报, 21(S3): 47-48.( 1) 1)
|
| [12] |
谭晓风, 马履一, 李芳东, 等. 2012. 我国木本粮油产业发展战略研究. 经济林研究, 30(1): 1-5.( 1) 1)
|
| [13] |
谭晓风, 陈鸿鹏, 张党权. 2008. 油茶 FAD2 基因全长cDNA的克隆和序列分析. 林业科学, 44(3): 70-75.( 3) 3)
|
| [14] |
王镜岩, 朱圣庚, 徐长发, 等. 2002.生物化学:下册.北京: 高等教育出版社, 265-272.( 3) 3)
|
| [15] |
吴小娟, 李红冰, 逄越, 等. 2006. 山茶和油茶种子中脂肪酸的分析. 大连大学学报, 27(4): 56-58.( 1) 1)
|
| [16] |
谢金喜, 蔡宁波, 石新国, 等. 2007.花生Δ12脂肪酸脱氢酶基因 FAD2 的克隆及反义表达载体的构建. 花生学报, 36(1): 1-6.( 1) 1)
|
| [17] |
徐爱遐, 张博勇, 赵德义.2004. 富含α-亚麻酸植物的研究. 水土保持学报, 18(4): 190-199.( 1) 1)
|
| [18] |
杨静, 常蕊.2011. α-亚麻酸的研究进展.农业工程, 1(1): 72-76.( 1) 1)
|
| [19] |
张皙, 陈存社, 李成伟, 等. 2007. 甘蓝型油菜△12-脂肪酸脱氢酶基因(BnFAD2 )cDNA序列的克隆及其对烟草的转化. 安徽农学通报, 13(11): 30-32.( 1) 1)
|
| [20] |
张党权, 谭晓风, 陈鸿鹏, 等. 2008. 油茶SAD基因的全长cDNA克隆及生物信息学分析. 林业科学, 44(2): 155-159.( 1) 1)
|
| [21] |
张琳, 谭晓风, 胡姣, 等. 2011. 油茶乙酰CoA 酰基转移酶基因cDNA克隆及序列特征分析. 中南林业科技大学学报, 31(8): 108-112.( 1) 1)
|
| [22] |
Alexander G. 1998. Recent developments in biochemistry of the plant lipoxygenase pathway. Prog Lipid Res, 37(5): 317-352.( 1) 1)
|
| [23] |
Feussner I, Wasternack C. 2002. The lipoxygenase pathway. Annu Rev Plant Biol, 53(1): 275-297.( 1) 1)
|
| [24] |
Hartmut K, Astrid B. 2002. Regulation of enzymatic lipid peroxidation: the interplay of peroxidizing and peroxide reducing enzymes. Free Radical Biology & Medicine, 33(2):154-172. ( 1) 1)
|
| [25] |
Kanehisa M, Araki M, Goto S, et al. 2008. KEGG for linking genomes to life and the environment. Nucleic Acids Research, 36(suppl 1): D480-D484.( 1) 1)
|
| [26] |
Porta H, Rocha-Sosa M. 2002. Plant lipoxygenases. Physiological and molecular features. Plant Physiology, 130(1): 15-21.( 1) 1)
|
| [27] |
SanGiovanni J P, Chew E Y. 2005. The role of omega-3 long-chain polyunsaturated fatty acids in health and disease of the retina. Progress in Retina and Eye Research, 24(1): 87-138.( 1) 1)
|
| [28] |
Schilmiller A, Koo A, Howe G. 2007. Functional diversification of acyl-coenzyme A oxidases in jasmonic acid biosynthesis and action. Plant Physiol, 143(2): 812-824.( 1) 1)
|
| [29] |
Simon J, Chen Y H, Bent S. 2009. The relation of α-linolenic acid to the risk of prostate cancera systematic review and meta-analysis. American Journal of Clinical Nutrition, 89(S1): 1558 -1564.( 1) 1)
|
| [30] |
Stark A H, Crawford M A, Reifen R. 2008. Update on alpha-linolenic acid. Nutrition Reviews, 66(6): 326 -332.( 1) 1)
|
| [31] |
Truman W, Bennett M, Kubigsteltig I, et al. 2007. Arabidopsis systemic immunity uses conserved defense signaling pathways and is mediated by jasmonates. Proc Natl Acad Sci USA, 104(3):1075-1080.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

