文章信息
- 曹传旺, 孙丽丽, 问荣荣, 豆晓洁, 王志英
- Cao Chuanwang, Sun Lili, Wen Rongrong, Dou Xiaojie, Wang Zhiying
- 舞毒蛾LdOA1基因克隆分析及对3种杀虫剂胁迫的响应
- Cloning and Analysis of LdOA1in Lymantria dispar and Its Response to the Stress of Three Kinds of Insecticides
- 林业科学, 2014, 50(8): 102-107
- Scientia Silvae Sinicae, 2014, 50(8): 102-107.
- DOI: 10.11707/j.1001-7488.20140815
-
文章历史
- 收稿日期:2013-05-22
- 修回日期:2014-01-31
-
作者相关文章
舞毒蛾(Lymantria dispar)是一种世界性、周期性发生的危害严重的森林食叶害虫,分布广,食性杂,国外报道可取食300多种植物 (Lazareviæ et al., 1998),国内报道可危害杨(Populus)、柳(Salix)、苹果(Malus pumila)、樟子松(Pinus sylvestris var.mongolica)、落叶松(Larix)等500多种植物,几乎全国均有分布,给林业生产造成巨大的经济损失。
目前生产上防控舞毒蛾主要是利用氯氰菊酯、高效氯氰菊酯、溴氰菊酯、氧化乐果、吡虫啉、灭幼脲III号等农药进行化学防治(倪鸣等,2009; 侯雅芹等,2009),但是化学农药容易引起害虫抗药性的形成,并污染环境。随着分子生物学的快速发展,控制害虫新的防治策略是运用分子靶标干预开发新杀虫剂。理想的分子靶标是参与机体至关重要功能的基因产物,通过调节这种靶标的活性来干扰害虫正常的生理过程。在众多膜受体中,G蛋白偶联受体(G protein coupled receptors,GPCRs),也称为7跨膜域受体(seven-transmembrane domain receptors,7TM receptors),是生物体内重要的膜受体,由一个大的跨膜受体蛋白家族组成,通过激活三聚体G蛋白参与各种细胞内信号转导(Hill,2006)。能够链接和激活GPCRs的配体有光敏感化合物、气味、信息激素、激素和神经递质等,这些配体从小分子物质到多肽再到大的蛋白。GPCR对于一个细胞外刺激产生胞内反应,这种特性使这类蛋白在药物研发中具有很高的利用价值。据估计,市场上大约50%的药物直接或间接地利用GPCR信号(Klabunde et al., 2002)。许多昆虫的发育和生理过程都是通过GPCR信号调控的,已有研究报道了光敏感化合物、气味、信息激素、激素和神经递质等对昆虫GPCR功能的影响(Broeck,2001)。眼白化病1型(ocular albinism type 1 protein,OA1)蛋白作为一种黑素小体膜整合性糖蛋白,具有7个跨膜结构,N末端伸向小体膜腔一侧,C末端伸向细胞质侧,在两侧各形成3个环结构,N糖基化位点在小体膜腔一侧的第一个环上(d’Addio et al., 2000; 谷学英等,2009)。这种结构与通常位于细胞膜的G蛋白偶联受体非常相似,并且在OA1蛋白跨膜区和环上都含有许多GPCR的保守性氨基酸,因此认为OA1蛋白是GPCR超家族中的一员。已有研究表明,人和小鼠(Mus musculus)OA1单基因突变导致黑色素生物合成减少或完全缺乏,引起眼白化病,临床表现为眼、皮肤、毛发黑色素缺乏和弱视等(谷学英等,2009)。黑色素是昆虫的主导色素,在昆虫的体色决定过程中发挥着重要作用(Wittkopp et al., 2003)。OA1蛋白可能也参与昆虫体内黑色素的代谢通路,该基因的表达或突变可能引起眼和表皮的白化现象,有关昆虫体内OA1基因的克隆、功能未见报道。本文在分析舞毒蛾转录本文库的基础上,克隆分析了1条舞毒蛾GPCR家族眼白化1型蛋白cDNA全长,并采用实时荧光定量PCR技术分析了溴氰菊酯、甲萘威和氧化乐果处理对该基因表达的影响。
1 材料与方法 1.1 供试昆虫及处理舞毒蛾卵块采自东北林业大学实验林场,孵化幼虫于(25±1)℃、光照14L∶10D、相对湿度75%的条件下用新鲜的人工饲料(来源于中国林业科学院研究森环森保研究所)饲养,取健康、大小一致的舞毒蛾3龄幼虫为试虫。分别用92.8%溴氰菊酯、95.0%甲萘威和82.8%氧化乐果原药均匀加入到人工饲料中,配制成15 mg·L-1浓度毒饵饲喂舞毒蛾3龄幼虫,于6,12,24,48,72 h时间点挑取活泼的幼虫,液氮冷冻后保存于-80 ℃用于实时荧光定量PCR分析,每个处理重复3次,每次重复10头幼虫。
1.2 LdOA1基因克隆与分析随机选用活泼、健康、大小一致舞毒蛾1~6龄幼虫各10头,采用RNeasy Mini动物组织总RNA提取试剂盒(Qiagen)提取RNA,然后将各龄幼虫提取的RNA等比例混匀,20 μg总RNA用于转录组文库构建,建好的测序文库用Illumina HiSeqTM 2000进行测序(深圳华大基因科技有限公司)。测序结果经de novo组装和TGICL软件拼接后共获得23 975个非冗余单一基因(non-redundant unigenes),对这些Unigenes进行BLASTX和BLASTN分析。对测序拼接后的结果用“G Protein Coupled Receptors”作为关键词进行查找,对查找后的序列进行比对拼接,最终获得LdOA1基因进行进一步的分析。设计引物进行PCR,进一步测序确定所获得的LdOA1基因序列。用ORF founder(http://www.ncbi.nlm.nih.gov/gorf.html)程序确定其开放读码框,用ProtParam(http://au.expasy.org/tools/protparam.html)软件计算推导的蛋白质分子质量及理论等电点,利用SignlP3.0 Server(http://www.cbs.dtu.dk/services/SignalP)检测其有无信号肽序列,用NCBI的Conserved Domains程序(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白的保守区。利用Blast 程序(http://www.ncbi.nlm.nih.gov/BLAST/)进行序列同源性搜索,选择与其相似程度高的其他不同昆虫的GPCR蛋白氨基酸序列,用多序列联配程序Clustalx(1.83)进行多序列比对。应用Clustalx(1.83)和MEGA(5.1),采用邻接法(Neighbor-Joining,N-J)构建系统发育树。
1.3 实时荧光定量PCR采用RNeasy Mini动物组织总RNA提取试剂盒(Qiagen)提取对照(非杀虫剂处理)、15 mg·L-1溴氰菊酯、甲萘威和氧化乐果分别处理6,12,24,48和72 h后的舞毒蛾3龄幼虫的总RNA,经DNase I(Promega)消化除去DNA,采用PrimeScriptTM RT reagent Kit(TaKaRa)合成cDNA,将合成cDNA稀释成100 μL,用作实时荧光定量PCR模板。实时荧光定量PCR使用试剂盒SYBR Green Realtime PCR Master Mix(Toyobo)。内参基因为Actin,EF1α和TUB,引物序列见表 1。实时荧光定量PCR反应体系为: 10 μL 2×SYBR premix Ex Taq酶,正向和反向引物(10 μmol·L-1)各1,2 μL稀释后cDNA模板,加去离子水补足20 μL。实时荧光定量PCR反应条件为: 94 ℃预变性30 s,94 ℃变性12 s,60 ℃退火45 s,72 ℃延伸45 s,81 ℃读板1 s,45个循环,每个样品重复3次,用2-△△Ct方法进行基因的相对定量分析(Pfaffl et al., 2002)。
|
|
通过对舞毒蛾幼虫转录组数据的分析,获得了OA1基因的全长cDNA序列,该基因阅读框(ORF)长453 bp,编码150个氨基酸(图 1)。ProtParam预测编码蛋白的分子质量为17.54 kDa,理论等电点(pI)为9.76,此蛋白为一碱性蛋白。该蛋白中相对含量最多的氨基酸是亮氨酸Leu(19个,占总氨基酸数12.7%),其次是丝氨酸Ser(12个,占总氨基酸数8.0%)。信号肽预测结果表明,该基因不含信号肽序列。BlASTP对LdOA1蛋白保守区的预测结果表明,该蛋白属于GPCR家族中眼白化病1型蛋白(图 2)。

|
图1 舞毒蛾LdOA1基因的cDNA及由此推导的氨基酸序列 Fig.1 The cDNA and deduced amino acid sequence of LdOA1 in L. dispar |

|
图2 LdOA1蛋白氨基酸序列保守区预测 Fig.2 Conserved region predication of amino acid sequences of LdOA1 protein in L. dispar |
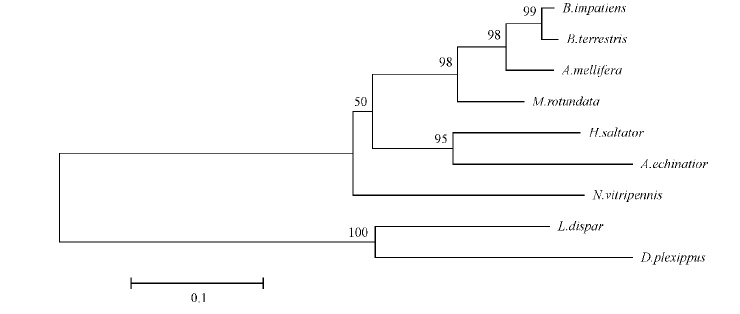
通过BLASTP多序列比对,选择与舞毒蛾LdOA1蛋白序列相似程度高的8种其他昆虫的GPCR蛋白进行多序列比对,结果表明: LdOA1蛋白与其他昆虫GPCR蛋白的氨基酸序列同源性为37.33%~69.33%(图 3)。从构建的9种昆虫的GPCR基因的系统进化树表明,9种昆虫GPCR蛋白分为2类,其中舞毒蛾LdOA1蛋白与帝王蝶GPCR亲缘关系近而聚为一类,其他7种昆虫的亲缘关系较近而聚为另一类(图 4)。

|
图3 9种昆虫GPCR蛋白多序列比对 Fig.3 Multiple sequence alignment of GPCR proteins from 9 insects 印度跳蚁Harpegnathos saltator(EFN82229.1),切叶蚁Acromyrmex echinatior(EGI67170.1),熊蜂Bombus impatiens(XP_003489203.1),欧洲熊蜂Bombus terrestris(XP_003395851.1),苜蓿切叶蜂Megachile rotundata(XP_003707340.1),蜜蜂Apis mellifera(XP_394576.3),金小蜂Nasonia vitripennis(XP_003428050.1),舞毒蛾Lymantria dispar,帝王蝶Danaus plexippus(EHJ67128.1). |
|
图4 9种昆虫GPCR蛋白系统进化树 Fig.4 Phylogenetic analysis of GPCR proteins from 9 insects |
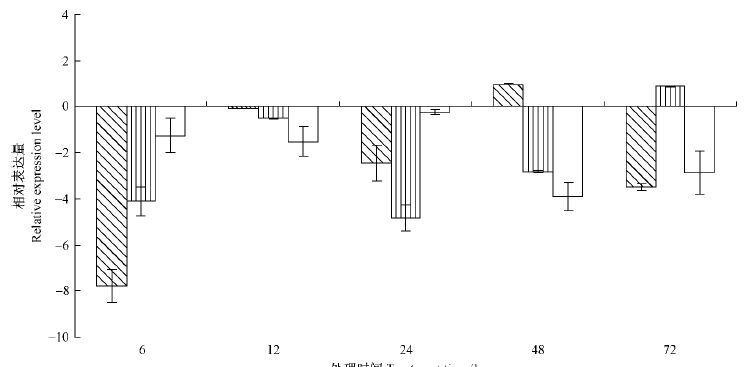
为了研究杀虫剂对LdOA1基因表达的影响,采用实时荧光定量PCR技术分析了溴氰菊酯、甲萘威和氧化乐果不同处理时间舞毒蛾3龄幼虫LdOA1基因表达量的变化情况(图 5)。结果表明,3种杀虫剂处理下舞毒蛾LdOA1基因主要表现为下调表达,尤其是氧化乐果处理后所有研究的时间点基因表达均表现为抑制。但3种杀虫剂处理后,舞毒蛾LdOA1基因表达受抑制程度不同。溴氰菊酯处理早期(6 h)LdOA1基因表达达到最低,仅为对照的0.45%; 甲萘威处理24 h LdOA1基因表达达到最低,为对照的3.54%; 氧化乐果处理48 h LdOA1基因表达达到最低,为对照的6.74%。
|
图5 3种杀虫剂胁迫对舞毒蛾LdOA1基因表达量的影响 Fig.5 Analysis of LdOA1 gene expression in L. dispar under the stress of three kinds of insecticides 表达量进行了log2转化。 The relative expression levels were log2 transformed. |
昆虫果蝇(Drosophila melanogaster)和冈比亚按蚊(Anopheles gambiae)基因组中(Adams et al., 2000; Holt et al., 2002),GPCRs参与了大约1%果蝇和1.6%冈比亚按蚊蛋白质的重要功能(如视力、化学感受途径和激素系统)(Brody et al., 2000; Hill et al, 2002)。在昆虫GPCRs中,神经肽受体、生物胺受体和化学感受受体因参与了昆虫广泛的生理过程而受到关注。胺类在神经系统中起到重要的作用,参与感受信息的传递和组装,控制肌肉的和腺体的活性和一些诸如学习、记忆和行为等的复杂过程。目前,胺类受体是昆虫GPCRs中研究最全面的家族(Zhou et al., 2008)。研究发现,沙漠蝗(Schistocerca gregaria)存在2个章鱼胺受体基因(SgOctαR,SgOctβR),且SgOctαR在中央神经系统中转录水平最高,而SgOctβR在飞行肌中具有最高转录水平(Verlinden et al., 2010)。Mitri等(2009)研究发现,果蝇孤儿GPCRs DmX受体能够通过味觉感知到植物有毒次生物质L-canavanine,使果蝇产生驱避作用从而免受毒害。这些研究主要集中于GPCRs基因参与昆虫神经生理的作用,而有关对化学杀虫剂响应的研究甚少,仅有Hu 等(2007)研究报道,来源于淡色库蚊(Culex pipiens pallens)的GPCRs家族中opsin基因NYD-OP7在溴氰菊酯抗性和敏感品系各发育阶段均有表达,且在蛹和成虫期抗性品系NYD-OP7表达高于敏感,昆虫C6/36细胞系表达NYD-OP7证实该基因参与溴氰菊酯抗性形成。
为了探讨昆虫GPCRs成为杀虫剂新作用靶标的可能性,本文从林果重要害虫舞毒蛾转录组中克隆到GPCR家族中眼白化1型蛋白,进化树分析与帝王蝶GPCR蛋白关系较近,这可能与该昆虫同属鳞翅目有关。OA1蛋白作为一种GPCR蛋白可与G蛋白之间发生特殊的反应,而其突变基因的产物,这种反应能力则降低甚至消失。Schiaffino等(1999)研究表明OA1蛋白可能是黑素小体内某种未知配体的感受器,通过激活位于小体膜细胞质侧的异源三聚体G蛋白,进行信息的传导,从而调节黑素小体的生长与成熟。本项研究中发现舞毒蛾LdOA1基因能够对拟除虫菊酯类溴氰菊酯、氨基甲酸酯类甲萘威和有机磷类氧化乐果杀虫剂作出响应,均被3种杀虫剂抑制,这可能是由于杀虫剂作为配体与膜蛋白舞毒蛾OA1结合,引起OA1结构的改变影响舞毒蛾黑素小体内G蛋白激活而信息传导受阻。但有关农药胁迫是否导致OA1基因突变有待进一步的研究。
| [1] |
谷学英, 刘志强, 刘玲, 等. 2009. 眼皮肤白化病Ⅰ型的基因诊断及产前诊断的意义.中国计划生育学杂志, 161(3): 168-171.( 2) 2)
|
| [2] |
侯雅芹, 南楠, 李镇宇. 2009. 舞毒蛾研究进展.河北林果研究, 24(4): 439-444.( 1) 1)
|
| [3] |
倪鸣, 柴汝松, 张鹏, 等. 2009. 不同药剂对舞毒蛾和春尺蠖的毒力测定. 东北林业大学学报, 37(5): 121-122.( 1) 1)
|
| [4] |
Adams M D, Celniker S E, Holt R A, et al. 2000. The genome sequence of Drosophila melanogaster. Science, 287:2185-2195.( 1) 1)
|
| [5] |
Brody T, Cravchik A. 2000. Drosophila melanogaster G Protein-coupled Receptors. The Journal of Cell Biology, 150: F83-F88. ( 1) 1)
|
| [6] |
Broeck J V. 2001. Insect G protein-coupled receptors and signal transduction. Archives of Insect Biochemistry and Physiology, 48:1-12.( 1) 1)
|
| [7] |
d'Addio M, Pizzigoni A, Bassi M T, et al. 2000. Defective intracellular transport and processing of OA1 is a major cause of ocular albinism type 1. Human Molecular Genetics, 29 (20):3011-3018.( 1) 1)
|
| [8] |
Hill C A, Fox A N, Pitts R J, et al. 2002. G protein-coupled receptors in Anopheles gambiae. Science, 298: 176-178.( 1) 1)
|
| [9] |
Hill S J. 2006. G-protein-coupled receptors: past, present and future. British Journal of Pharmacology, 147: S27-S37.( 1) 1)
|
| [10] |
Holt R A, Subramanian G M, Halpern A, et al. 2002. The Genome sequence of the malaria mosquito Anopheles gambiae. Science, 298:129-149.( 1) 1)
|
| [11] |
Hu X B, Sun Y, Wang W J, et al. 2007. Cloning and characterization of NYD-OP7, a novel deltamethrin resistance associated gene from Culex pipiens pallens. Pesticide Biochemistry and Physiology, 88: 82-91.( 1) 1)
|
| [12] |
Klabunde T, Hessler G. 2002. Drug design strategies for targeting G-protein-coupled receptors. ChemBioChem, 3: 928-944.( 1) 1)
|
| [13] |
Lazareviæ J, Periæ-mataruga V, Ivanovi J, et al. 1998. Host plant effects on the genetic variation and correlations in the individual performance of the gypsy moth. Functional Ecology 12: 141-148.( 1) 1)
|
| [14] |
Mitri C, Soustelle L, Framery B, et al. 2009. Plant insecticide L-canavanine repels Drosophila via the insect orphan GPCR Dmx. PLos Biology, 7(6): e1000147. doi:10.1371/journal.pbio.1000147.( 1) 1)
|
| [15] |
Pfaffl M W, Horgan G W, Dempfle L. 2002. Relative expression software tool (REST) for group-wise comparison and statistical analysis of relative expression results in real-time PCR. Nucleic Acids Research, 30:36.( 1) 1)
|
| [16] |
Schiaffino MV, d'Addio M, Alloni A, et al. 1999. Ocular albinism: evidence for a defect in an intracellular signal transduction system. Nature Genetics, 23(1): 108-112.( 1) 1)
|
| [17] |
Verlinden H, Vleugels R, Marchal E, et al. 2010. The role of octopamine in locusts and other insects. Journal of Insect Physiology, 56:854-867.( 1) 1)
|
| [18] |
Wittkopp P J, Williams B L, Carroll S B, et al. 2003. Drosophila pigmentation evolution: divergent genotypes underlying convergent phenotypes. Proceedings of the National Academy of Sciences of the USA, 100:1808-1813.( 1) 1)
|
| [19] |
Zhou C, Rao Y, Rao Y. 2008. A subset of octopaminergic neurons are important for Drosophila aggression. Nature Neuroscience, 11 (9): 1059-1067.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

