文章信息
- 邱念伟, 周峰, 张士超, 杨东, 刘媛, 宋贤慧, 郑媛
- Qiu Nianwei, Zhou Feng, Zhang Shichao, Yang Dong, Liu Yuan, Song Xianhui, Zheng Yuan
- 人工模拟倒春寒对杨树叶片活力的影响
- Effects of Simulated Cold Spell in Later Spring on Leaf Vigor of Populus tomentosa
- 林业科学, 2014, 50(7): 17-22
- Scientia Silvae Sinicae, 2014, 50(7): 17-22.
- DOI: 10.11707/j.1001-7488.20140703
-
文章历史
- 收稿日期:2013-09-13
- 修回日期:2013-10-22
-
作者相关文章
2. 南京晓庄学院生物化工与环境工程学院 南京 211171
2. School of Biochemical and Environmental Engineering, Nanjing Xiaozhuang University Nanjing 211171
倒春寒是指初春(一般指3月)气温回升较快,而在春季后期(一般指4月或5月)气温较正常年份偏低的天气现象。倒春寒现象时有发生,气温下降剧烈,降幅可达10~15 ℃,最低气温可降低至零下温度(Ma et al.,2013)。如2013年4月19日的强冷空气影响华北、黄淮等地,多地出现降雪天气,最高气温只有5 ℃,最低气温降至0 ℃以下; 4天内最高气温剧降26 ℃。这种天气易造成春季农作物大面积烂秧、死苗,花卉品质受损,果树开花座果率低等农业灾害,尤其是对南方热带亚热带植物危害较大(李勇等,2010),在农业生产上较受重视(Cheng et al.,2013)。倒春寒对林业的危害同样严重,尤其是倒春寒引起的霜冻常导致树木叶芽、花芽死亡(Prozherina et al.,2003);但大部分情况下,倒春寒对植物主要表现为低温冷害,且历时较短。在北方温带、寒温带,树木幼叶的耐冷性相对较强,倒春寒冷害症状肉眼不易觉察(Awaya et al.,2009),相关报道较少,在林业生产上经常被忽视。叶片是光合作用的主要器官,是树木生长的物质基础,探讨倒春寒对树木幼叶活力的影响,有助于评估倒春寒对树木的危害。
杨树(Populus)是我国最为重要的绿化树种和木材树种,在我国北方地区广泛栽种。华北地区的杨树约在4月上旬开始长出新叶,如果温度适宜,叶片很快会发育成熟,杨树叶片从叶芽萌动到叶片完全伸展仅需2周左右(Dickmann et al.,1975)。在这一阶段,倒春寒天气时有发生,剧烈降温可能对杨树的幼叶造成伤害,影响叶片的发育,进而影响杨树在该年度的叶片光合能力和木材蓄积量(Dittmar et al.,2006)。目前,关于低温伤害杨树叶片的报道主要集中在秋冬季的剧烈降温伤害(Wan et al.,2004; 张静波等,2009; 高丹丹等,2009),这与春季倒春寒对幼叶活力的影响显著不同。本文以生产中最为常见的毛白杨(Populus tomentosa)幼叶为试验材料,用人工气候箱模拟倒春寒天气,分析倒春寒冷害对杨树幼叶的伤害及杨树幼叶对倒春寒冷害的适应能力,为杨树或其他树种的倒春寒危害评估及栽培管理提供参考。
1 材料与方法 1.1 材料的选择与处理 1.1.1 试验材料的选择在曲阜师范大学校园内采集生长健壮毛白杨(树龄10年,生长最盛期)下部1年生枝条,采集后迅速将小枝基部插入盛水的水杯中,所有枝条随机采集于同一株杨树。材料采集时间为2013年4月12日,小枝长度约30 cm,每条小枝上30~40片叶。以小枝上的最大叶为试验对象,最大叶片宽度为6~7 cm, 长度为8~9 cm,当天气温15~22 ℃。
1.1.2 试验材料的低温胁迫处理将采集的小枝连同水杯一同放入-5,0,5,10,15,20 ℃的人工气候箱中处理2 h,气候箱湿度60%,光照强度100 μmol·m-2s-1。每个温度处理包括6条小枝。低温处理后立即测定叶片的光合活力、细胞质膜透性和叶绿素含量; 同时摘取幼叶用液氮速冻后,于-30 ℃冰箱冰冻保存,用于测定蛋白质、脯氨酸、可溶性糖及丙二醛含量。
1.2 测定项目与方法 1.2.1 光合速率的测定低温处理后,立即用Ciras-1型光合仪(英国PP System)在人工条件下测定杨树叶片的净光合速率(net photosynthetic rate,Pn)。测定条件为: 大气CO2浓度400 μmol·mol-1,湿度60%,光照强度1 000 μmol·m-2s-1,温度20 ℃。每个温度测定5个重复。
1.2.2 叶绿素荧光动力学参数的测定低温处理后,杨树叶片继续在低温下暗适应30 min,然后在室温20 ℃下立即用便携式植物效率分析仪(Plant Efficiency Analyser,H and y PEA; Hansatech Instrument Ltd.,UK)测定杨树幼叶的荧光动力学参数数量、名称、单位。测定光源的波长为650 nm的红光,光照强度为3 000 μmol·m-2s-1。每个温度处理10个重复。利用专业软件BiolyzerHP3(Hansatech Instrument Ltd.,UK)处理和并解析叶绿素荧光动力学曲线,荧光参数的生理意义如下。Tfm: 暗适应后从照光至到达最大荧光所需的时间; Fv/Fm: 表示PSⅡ(photosystem Ⅱ)最大光化学效率; Sm: 指标准化面积,表示质体醌库大小;(ABS/TRo/ETo/DIo)/RC: 表示单位反应中心吸收的能量/被反应中心捕获的能量/用于电子传递的能量/热耗散的能量;(RC/ABS/TRo/ETo/DIo)/CSo: 表示单位激发态面积反应中心数目/吸收的光量/被反应中心捕获的光量/用于电子传递的能量/热耗散的能量; SFIABS: 结构功能指数(structure and function index of plants); PIABS:表示以吸收光能为基础的性能指数(performance index of plants); DF: 表示光合驱动力(drive force for photosynthesis)。叶绿素荧光动力学参数的解析方法和生理意义参见文献(邱念伟等,2013; Alex and rina et al.,2011)。
1.2.3 杨树幼叶生理生化参数的测定叶绿素的提取与含量测定参照张其德(1985)的方法,用打孔器打取3个叶圆片,然后用10 mL 80%的丙酮提取叶绿素。可溶性蛋白含量用考马斯亮蓝染色法测定,以牛血清白蛋白作为标准蛋白。脯氨酸含量测定参考张殿忠等(1990)的方法。丙二醛含量测定参照赵世杰等(1994)的方法。可溶性糖含量用蒽酮试剂法测定。质膜透性用电导率仪测定,用相对电导率(%)表示质膜透性大小,相对电导率=原电导率/总电导率(张志良等,2003)。上述生理生化参数每个温度处理均做5个重复。
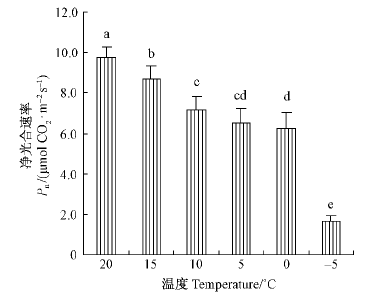
2 结果与分析 2.1 低温处理对杨树幼叶光合功能的影响 2.1.1 低温处理对杨树幼叶净光合速率的影响由于杨树叶片还未完全发育成熟,即使在20 ℃条件下,杨树叶片的光合速率也较低,仅为9.77 μmol CO2 · m-2s-1,至5月中旬毛白杨叶片成熟后,其在饱和光强下的净光合速率可达25 μmol CO2· m-2s-1左右(邱念伟等,2013)。低温处理 后,叶片的光合能力显著下降,15,10,5,0 ℃处理后,叶片的光合速率分别下降至20 ℃时的 89.2%,73.1%,66.5%和63.9%(图 1)。-5 ℃处理则使杨树幼叶的净光合速率急剧下降至对照的17%。
|
图 1 低温处理后杨树幼叶净光合速率的变化 Fig.1 Changes in net photosynthetic rate of young leaves of P. tomentosa plants exposed to low temperature 不同字母数据表示差异显著( P < 0. 05)。下同。Different letters meant significant difference at 0. 05 level. The same below. |
从表 1可看出,与20 ℃相比,低温处理(15,10,5,0,-5 ℃)的杨树幼叶光反应活性逐渐下降,表现为单个反应中心的电子传递效率(ETo/RC)和单位激发态面积的光反应活性(ABS/CSo,TRo/CSo,ETo/CSo)减小,而单位激发态面积的热耗散(DIo/CSo)增加。但零上低温对PSⅡ最大光化学效率(Fv/Fm)以及单个反应中心的能量吸收、捕获和热耗散的比活性(ABS/RC,TRo/RC,DIo/RC)影响较小,只有气温降至-5 ℃时才发生显著变化。杨树幼叶的光反应性能指数[结构功能指数SFIABS、性能指数PIABS、光合驱动力(DF)等]对低温均比较敏感,10 ℃及以下低温对这些性能指数的影响较为显著。10 ℃及以下低温处理后,杨树叶片的质体醌库(Sm)也显著减小,从照光至到达最大荧光所需的时间(Tfm)缩短。以上结果显示,低温处理后杨树幼叶的光反应活力显著下降,-5 ℃则使杨树幼叶光反应活力急剧下降。
|
|
随着处理温度的降低,杨树幼叶的叶绿素和可溶性蛋白含量均逐渐下降。15,10,5,0,-5 ℃处理后,叶片的叶绿素含量分别下降至20 ℃时的 92.9%,89.4%,81.1%,76.6%和71.9%(图 2A)。杨树幼叶蛋白质含量下降的幅度小于叶绿素,15,10,5,0,-5 ℃处理后,叶片的可溶性蛋白含量分别下降至20 ℃时的 99.4%,96.3%,94.7%,90.9%和88.7%(图 2B)。说明低温可能导致这2种物质的合成受阻或降解加快。

|
图 2 低温处理后杨树幼叶叶绿素含量(A)和可溶性蛋白含量(B)的变化 Fig.2 Changes in chlorophyll content and soluble protein content of young leaves of P. tomentosa plants exposed to low temperature |
图 3结果显示,在低温胁迫下,杨树幼叶的丙二醛含量显著增加,15,10,5,0,-5 ℃处理后,丙二醛含量分别上升至20 ℃时的 145.6%,167.5%,177.6%,187.8%和210.8%,膜脂过氧化水平明显升高。

|
图 3 低温处理后杨树幼叶丙二醛含量的变化 Fig.3 Changes in malondialdehyde content of young leaves of P. tomentosa plants exposed to low temperature |
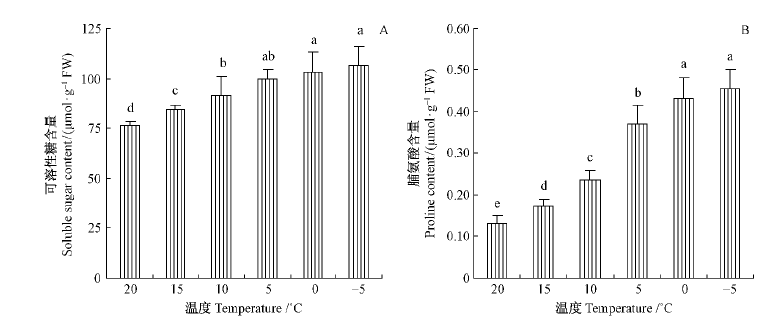
低温处理后,2种渗透保护物质的含量均增加。其中脯氨酸含量的增加幅度显著高于可溶性糖总糖含量,15,10,5,0,-5 ℃处理后,可溶性糖含量分别为20 ℃的1.11,1.2,1.31,1.35和1.39倍(图 4A); 而脯氨酸含量分别为20 ℃时的1.32,1.78,2.82,3.28和3.46倍(图 4B)。可溶总糖的含量显著高于脯氨酸。
|
图 4 低温处理后叶片可溶性糖(A)和脯氨酸(B)含量的变化 Fig.4 Changes in soluble sugar and proline content of young leaves of P. tomentosa plants exposed to low temperature |
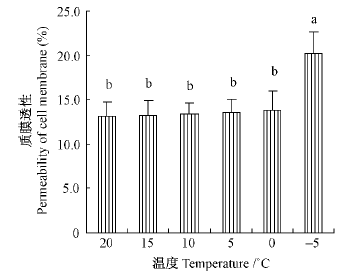
零上低温胁迫处理后,杨树幼叶的质膜透性较为稳定,随着处理温度的增加,质膜透性仅有微小的增大,统计结果(图 5)差异不显著。而-5 ℃则使杨树幼叶质膜透性迅速增大,并出现水渍状伤害。说明杨树幼叶的生物膜在0~15 ℃低温下未受到显著破坏,但不能耐受-5 ℃冷冻低温。
|
图 5 低温处理后杨树幼叶质膜透性的变化 Fig.5 Changes in cell membrane permeability of young leaves of P. tomentosa plants exposed to low temperature |
低温是最为常见的环境胁迫,大量文献从多个方面报道了低温对植物的危害,如生长、细胞结构、原生质体稳定性、水分状况、光合作用、呼吸作用、物质代谢、保护酶系统等(Marta et al.,2006; Dumlao et al.,2012; 王祥军等,2012; 周瑞莲等,2012),但对北方温带、寒温带树木幼叶的倒春寒危害关注较少。温度是植物叶片生长发育的重要条件,倒春寒的剧烈降温可能导致树木的幼叶生长发育缓慢,光合功能下降,影响树木本年度的生长,因此有必要对树木幼叶的倒春寒危害进行评估。
用人工气候箱模拟了-5~15 ℃倒春寒低温,探讨了倒春寒对杨树幼叶活力的影响及杨树幼叶的耐冷性。测定结果显示,-5~15 ℃温度处理使杨树幼叶的净光合速率(图 1)和光反应综合性能指数(SFIABS,PIABS,DF)(表 1)显著下降,叶片光合能力下降可能与杨树幼叶的叶绿素和可溶性蛋白质含量(图 2)下降有关(Usuda et al.,1984; Gratani et al.,1998)。叶绿素含量下降,叶片吸收的光能会减少,在叶绿素荧光参数上表现为单位激发态面积的光反应活性(ABS/CSo,TRo/CSo,ETo/CSo)减小(表 1)。但0~15 ℃低温对单个反应中心的能量吸收、捕获和热耗散的比活性(ABS/RC,TRo/RC,DIo/RC)影响不大,主要影响了单个反应中心用于电子传递的能量比例(ETo/RC),同时参与电子传递的质体醌库(Sm)减小,导致从照光至到达最大荧光所需的时间(Tfm)缩短(Maxwell et al.,2000)。-5 ℃冷冻低温处理对杨树幼叶的上述光合参数影响较大,杨树幼叶的光化学活性剧降。叶片可溶性蛋白含量的下降,说明叶片蛋白质合成能力下降或降解加快,参与光合作用的酶减少,这既会影响光合碳同化,又会影响光合作用光反应。不过本文结果显示杨树幼叶单位激发态面积的反应中心数目(RC/CSo)到0 ℃时才显著低于对照(20 ℃),PSⅡ最大光化学效率(Fv/Fm)在0~15 ℃低温下几乎没有变化,说明0 ℃或0 ℃以下温度才显著影响光合膜蛋白的数量和活性。而0~15 ℃温度处理后杨树幼叶光反应活性的下降主要是因低温导致了光能吸收的减少和电子传递效率的下降,从而影响杨树幼叶的光合能力,杨树幼叶的光反应系统并未受到显著的低温伤害。这一现象与番茄(Lycopersicon esculentum)叶片耐冷性类似(Liu et al.,2012)。0~15 ℃倒春寒模拟温度也未对杨树幼叶造成明显的表观伤害,只是在10 ℃及以下温度时其光合活力受到抑制,说明杨树幼叶具有较强的耐冷性,这种伤害在气温回升后能够很快恢复(Liu et al.,2012)。但杨树幼叶不能承受-5℃低温冻害,叶片上出现水渍状冻伤。
2种渗透保护物质的积累可能与杨树幼叶的耐冷性有关,一是低温处理后杨树幼叶中的可溶糖含量显著增加,且幼叶中的可溶性糖含量高达80~100 μmol·g-1FW(图 4A),显著高于成熟叶片(Sauter et al.,1996)。很多文献证明可溶性糖积累能够显著提高植物的耐冷性(Sauter et al.,1996; Strand et al.,1999; Yannis,2001)。此外,低温处理后杨树幼叶中的脯氨酸含量增加,也有助于增加杨树幼叶的耐冷性(王小华等,2008)。不过脯氨酸的总含量较少,仅0.13~0.43 μmol·g-1FW(图 4B),其耐冷性作用可能小于可溶性糖。有的文献则认为脯氨酸的积累是植物适应逆境过程中的氮代谢产物,在植物抗逆性中的贡献较小(Hayat et al.,2012)。杨树幼叶虽然在低温下通过某些生理生化机制有效保护了其光系统,维护了质膜的稳定性(图 5),但低温处理后杨树幼叶内的丙二醛含量仍然增多,如-5 ℃处理后丙二醛含量比20 ℃时增多1.11倍,说明低温胁迫在杨树幼叶内引起了一定程度的过氧化伤害,因为低温常常引起光抑制而产生活性氧(Liu et al.,2012)。-5 ℃处理的杨树幼叶质膜透性比0 ℃时显著增大,推测可能主要是因冰冻伤害所引起。总的来讲,杨树幼叶对倒春寒天气的适应能力较强,能够安全度过0~15 ℃的倒春寒天气,但不能忍耐-5 ℃冰冻低温,不过-5 ℃低温在自然条件下鲜有发生。
| [1] |
高丹丹, 王洋, 于文喜. 2009. 杨树叶片酚类物质对秋季温度骤降的响应. 东北林业大学学报, 37(5): 4-6.( 1) 1)
|
| [2] |
李勇, 杨晓光, 代姝玮, 等. 2010. 气候变化背景下贵州省倒春寒灾害时空演变特征. 应用生态学报, 21(8): 2099-2108.( 1) 1)
|
| [3] |
邱念伟, 周峰, 王颖, 等. 2013. 松树与杨树叶片叶绿素快相荧光动力学特征比较. 林业科学, 49(3): 136-143.( 2) 2)
|
| [4] |
王祥军, 李维国, 高新生, 等. 2012. 巴西橡胶树响应低温逆境的生理特征及其调控机制. 植物生理学报, 48(4): 318-324.( 1) 1)
|
| [5] |
王小华, 庄南生. 2008. 脯氨酸与植物抗寒性的研究进展. 中国农学通报, 24(11): 398-402.( 1) 1)
|
| [6] |
张殿忠, 汪沛洪, 赵会贤. 1990. 测定小麦叶片游离脯氨酸含最的方法. 植物生理学通讯, 26(4): 62-65.( 1) 1)
|
| [7] |
张静波, 段相军, 王欢, 等. 2009. 气温骤降对杨树叶片总酚、木质素含量的影响. 林业科技, 34(6): 30-31.( 1) 1)
|
| [8] |
张其德. 1985. 测定叶绿素的几种方法. 植物学通报, 3(5): 60-64.( 1) 1)
|
| [9] |
张志良, 瞿伟菁. 2003. 植物生理学实验指导: 3版. 北京:高等教育出版社. 267-269.( 1) 1)
|
| [10] |
赵世杰, 许长成, 邹琦, 等. 1994. 植物组织中丙二醛测定方法的改进. 植物生理学通讯, 30(3): 207-210.( 1) 1)
|
| [11] |
周瑞莲, 赵梅, 王进, 等. 2012. 冬季高温对白三叶越冬和适应春季"倒春寒"的影响. 生态学报, 32(14): 4462-4471.( 1) 1)
|
| [12] |
Alex and rina S, Govindjee. 2011. On the relation between the Kautsky effect (chlorophyll a fluorescence induction) and photosystem II: Basics and applications of the OJIP fluorescence transient. Journal of Photochemistry and Photobiology B: Biology, 104(1/2): 236-257.( 1) 1)
|
| [13] |
Awaya Y, Tanaka K, Kodani E, et al. 2009. Responses of a beech (Fagus crenata Blume) stand to late spring frost damage in Morioka, Japan. Forest Ecology and Management, 257(12): 2359-2369.( 1) 1)
|
| [14] |
Cheng Y X, Huang J F, Han Z L, et al. 2013. Cold damage risk assessment of double cropping rice in Hunan, China. Journal of Integrative Agriculture, 12(2): 352-363.( 1) 1)
|
| [15] |
Dickmann D I, Gordon J C. 1975. Incorporation of C-photosynthate into protein during leaf development in young Populus plants. Plant Physiology, 56(1):23-27.( 1) 1)
|
| [16] |
Dittmar C, Fricke W, Elling W. 2006. Impact of late frost events on radial growth of common beech (Fagus sylvatica L.) in southern Germany. European Journal of Forest Research, 125(3): 249-259.( 1) 1)
|
| [17] |
Dumlao M R, Darehshouri A, Cohu C M, et al. 2012. Low temperature acclimation of photosynthetic capacity and leaf morphology in the context of phloem loading type. Photosynthesis Research, 113(1/3): 181-189.( 1) 1)
|
| [18] |
Gratani L, Pesoli P, Crescente M F. 1998. Relationship between photosynthetic activity and chlorophyll content in an isolated Quercus ilex L. tree during the year. Photosynthetica, 35(3): 445-451.( 1) 1)
|
| [19] |
Hayat S, Hayat Q, Alyemeni M N, et al. 2012. Role of proline under changing environments: A review. Plant Signal and Behavior, 7(11): 1-11.( 1) 1)
|
| [20] |
Liu Y F, Qi M F, Li T L. 2012. Photosynthesis, photoinhibition, and antioxidant system in tomato leaves stressed by low night temperature and their subsequent recovery. Plant Science, 196(1): 8-17.( 2) 2)
|
| [21] |
Ma W J, Yang C X, Chu C, et al. 2013. The impact of the 2008 cold spell on mortality in Shanghai, China. International Journal of Biometeorology, 57(1): 179-184.( 1) 1)
|
| [22] |
Marta H, Carmen A M, Manuel S D. 2006. Frost resistance and biochemical changes during cold acclimation in different annual legumes. Environmental and Experimental Botany,55(3):305-314.( 1) 1)
|
| [23] |
Maxwell K, Johnson G N. 2000. Chlorophyll fluorescence:a practical guide. Journal of Experimental Botany, 51 (345): 659-668.( 1) 1)
|
| [24] |
Prozherina N, Freiwald V, Rousi M, et al. 2003. Interactive effect of springtime frost and elevated ozone on early growth, foliar injuries and leaf structure of birch (Betula pendula). New Phytologist, 159(3): 623-636.( 1) 1)
|
| [25] |
Sauter J J, Wisniewski M, Witt W. 1996. Interrelationships between ultrastructure, sugar levels, and frost hardiness of ray parenchyma cells during frost acclimation and deacclimation in poplar (Populus ×canadensis Moench  2) 2)
|
| [26] |
Strand A, Hurry V, Henkes S, et al. 1999. Acclimation of Arabidopsis leaves developing at low temperatures. Increasing cytoplasmic volume accompanies increased activities of enzymes in the Calvin cycle and in the sucrose-biosynthesis pathway. Plant Physiology, 119(4): 1387-1398.( 1) 1)
|
| [27] |
Usuda H, Ku M S B, Edwards G E. 1984. Rates of photosynthesis relative to activity of photosynthetic enzymes, chlorophyll and soluble protein content among ten C4 species. Australian Journal of Plant Physiology, 11(6): 509-517.( 1) 1)
|
| [28] |
Wan X C, Landhausser S M, Zwiazek J J, et al. 2004. Stomatal conductance and xylem sap properties of aspen (Populus tremuloides) in response to low soil temperature. Physiologia Plantarum,122(1): 79-85.( 1) 1)
|
| [29] |
Yannis G. 2001. A qualitative model for the mechanism of sugar accumulation in cold-stressed plant tissues. Theory in Biosciences, 120(2): 149-165.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

