文章信息
- 于存, 池玉杰
- Yu Cun, Chi Yujie
- 一色齿毛菌产MnP的条件优化及对染料的脱色
- Optimization of Culture Conditions of MnP Produced by Cerrena unicolor and Its Decolorization to 5 Kinds of Dyes
- 林业科学, 2014, 50(7): 121-127
- Scientia Silvae Sinicae, 2014, 50(7): 121-127.
- DOI: 10.11707/j.1001-7488.20140717
-
文章历史
- 收稿日期:2013-07-03
- 修回日期:2013-11-01
-
作者相关文章
锰过氧化物酶(MnP,EC.1.11.1.13)是白腐菌分泌的一种能有效降解木质素的过氧化物酶,具有降解各类芳香族化合物的独特能力,近年来越来越多地被应用于纸浆生物漂白、有机污染物(DDT、多氯联苯、二氯苯胺等)降解、染料脱色等方面(Kirk et al., 1998;Saratale et al., 2011;Janusz et al., 2013)。多数人工合成的染料具有致畸、致突变、致癌的“三致”作用,是纺织工业和染料生产废水中的主要污染物。据统计,2010年我国染料产量75.6万t,居世界之首位,占世界总产量的60%。而每年有1%~10%(15%)的人工合成染料在生产或应用过程中进入水土(Forgacs et al., 2004)。利用细菌、真菌和木质素降解酶进行染料的生物脱色,可克服物理与化学法进行染料脱色的缺点,不但可以杜绝化学漂白剂(氯和二氧化氯)使用造成的污染,而且还可避免二次污染的发生(Modi et al., 2010)。已有一些应用细菌和黄孢原毛平革菌(Phanerochaete chrysosporium)进行偶氮等染料的脱色研究(李慧蓉等,1999;严滨等,2008),但是应用其他白腐菌及其MnP进行染料脱色的研究还较少。不同白腐菌的产酶条件有较大差异,产酶条件的优化是酶学研究和应用的基础。不同的碳氮源及其浓度、Mn2+的浓度、pH、装液量、接种量、培养方式及温度等,都会影响MnP的产量(Patrick et al., 2011; Dos Santos Bazanella et al ., 2013; Hariharans et al ., 2013; Saravanakumar et al., 2013)。考虑到人工合成染料的结构复杂性、白腐菌产酶的多态性和所降解底物的多态性,研究多种白腐菌MnP对染料的脱色是非常必要的,目的是筛选优化组合以尽快使复杂成分的染料获得最大程度的生物消解。本文首先对白腐菌一色齿毛菌(Cerrena unicolor)产MnP的培养基组分及培养条件进行优化,在此基础上,研究优化后的胞外MnP酶液对5种常见染料的脱色能力,为该菌株及其分泌的MnP在染料脱色过程中的应用提供基础。
1 材料与方法 1.1 菌种与培养基一色齿毛菌菌株CB1在PDA斜面上的菌种保存于4 ℃冰箱。试验时将斜面内菌种接种于PDA平板上,29 ℃下活化5天。
低氮天冬酰胺琥珀酸(LNAS)培养基作为产酶基础培养基(Kirk et al., 1978)。
1.2 一色齿毛菌产MnP的条件优化 1.2.1 初始培养方式与MnP活性检测在250 mL三角瓶中加入70 mL LNAS培养基,添加2 g青杨(Populus ussuriensis)木屑,高压灭菌后,加入5 mL 15%除菌后的葡萄糖溶液。接入5个$\phi $=8 mm的PDA平板菌片,在29 ℃下静止培养21天,分别在接菌后3,5,7,9,11,13,15,17,19,21天,取1 mL培养液测定MnP活力,酶活测定方法同闫洪波(2009),每组数据设3个重复,然后绘制MnP活性随时间变化规律的曲线。
1.2.2 碳源和氮源的筛选在初始培养的基础上,明确MnP活性随时间的变化规律后,首先进行碳源和氮源的筛选。将1.2.1初始培养方式中的葡萄糖溶液分别改为果糖、蔗糖、乳糖、可溶性淀粉,静止培养7天检测MnP活性,从中筛选最佳碳源。固定碳源为葡萄糖,去除LNAS培养基中的氮源,然后再分别添加硝酸铵、天冬酰胺、酒石酸铵、蛋白胨、酵母粉作为氮源,静止培养7天后检测MnP活性,从中筛选最佳氮源。
1.2.3 2次正交试验白腐菌MnP的产生受包括碳源浓度、氮源浓度、Mn2+浓度、pH、培养温度、装液量、接种量在内的多个影响因子的调控(尹亮等,2004; 杨晓宽等,2004; 董旭杰等,2004; 崔艳红等,2012)。本研究在碳源和氮源筛选的基础上,选择碳源浓度A(g·L-1)、氮源浓度B(mmol·L-1)、Mn2+的浓度C(mmol·L-1)、接种量D($\phi $=8 mm的PDA平板菌片数)和装液量E(mL)5因素作为第1次正交试验因素,因素水平为4个等级(表 1)。选择各因素水平的原则是把参数的水平区间拉开,尽可能使最佳区域包含在设定的水平区间内。对于碳源和氮源浓度,主要考察不同碳氮比是否有利于产MnP。利用SPASS软件设计出5因素4水平L16(45)的正交表,进行16组不同配方的正交试验。在第1次正交试验优化条件的基础上,选取培养基的pH值F、吐温80加入量G、培养温度H、250 mL摇瓶培养(150 r·min-1)装液量I等4因素,进行3水平9组不同处理的L9(34)第2次正交试验,因素水平表见表 2。根据第1次正交试验配制好优化后的培养基,进行9组不同的处理,其中用1 mol·L-1 NaOH和1 mol·L-1 HCl调节pH分别为3.5,4.5和5.5。以上每组试验都是3个重复静止培养7天后测定酶活。
|
|
|
|
分别以2次正交试验的最佳组合作为产酶培养条件,在接入菌块7天后吸取1 mL培养液测定MnP活力,试验平行进行3次。
1.4 优化后的一色齿毛菌胞外酶液对5种染料的脱色试验选择3种结构类型的5种染料,分别配制50 mg·L-1的溶液,以去离子水为对照,用紫外分光光度计在 300~800 nm区间扫描,得到各自最大吸收峰处的波长值与其对应的吸光值,包括活性黑(偶氮类,λmax=595)、活性红(偶氮类,λmax=539)、刚果红(偶氮类,λmax=501)、中性红(杂环类,λmax=528)和结晶紫(三苯基甲烷类,λmax=584)。根据1.2中优化后的培养条件培养一色齿毛菌7天,共30瓶,将所培养的三角瓶分成2大组,试验组15瓶直接向培养液中分别加入除菌后终浓度为50 mg·L-1的5种染料,对照组15瓶将培养液高压灭菌后再分别加入除菌后终浓度为50 mg·L-1的5种染料,每种染料的试验组和对照组均为3个重复,均摇瓶培养脱色,在加入染料后的0.5 h和1,2,3,4,5,6,7,8,9,10天分别吸取1.5 mL培养液,经12 000 r·min-1离心2 min后取上清液,用紫外分光光度计在最大吸收峰波长处测吸光值,试验组记为At值,对照组记为A0值,取3组数据的平均值。脱色率(rD)的计算公式如下: rD=[(A0-At)/A0]×100%。然后绘制5种染料脱色率随时间的变化曲线。
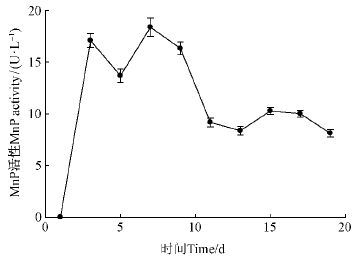
2 结果与分析 2.1 初始培养条件下一色齿毛菌产MnP的活性规律曲线在初始培养条件下,一色齿毛菌产MnP随时间的变化曲线见图 1,3组重复数据的误差线标注其上。由图 1可知,一色齿毛菌在接种3天后,就有MnP分泌且活性较高,5天时呈现出下降,7天时达到最高为18.4 U·L-1,从第9天开始呈现出较迅速的下降,随后从11天开始一直保持在较低的水平。由此确定后续的优化培养试验酶活检测都是 截至7天为止。
|
图1 一色齿毛菌在初始培养条件下MnP活性随时间的变化 Fig.1 The activity curve of MnP produced by C. unicolor under initialized culture condition |
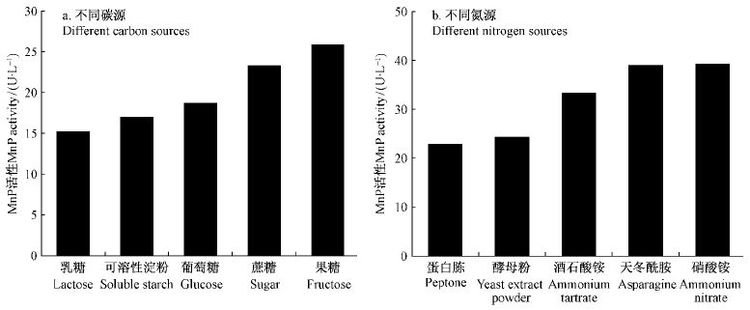
不同碳源、氮源种类及其浓度对白腐菌产MnP的影响不尽相同(吴会广等,2008; 张玉龙等,2011)。本研究初始培养条件下不同碳源和不同氮源种类对MnP活性的影响见图 2。由图 2a可知,以果糖为碳源时,MnP活性最高达到25.81 U·L-1,其次是蔗糖、葡萄糖、可溶性淀粉,乳糖最差。由图 2b可知,以硝酸铵为氮源时,MnP活性最高为39.27 U·L-1,其次为天冬酰胺,最高酶活为39.05 U·L-1,几乎与硝酸铵为氮源时的酶活相同,然后为酒石酸铵、酵母粉,蛋白胨最差。由此确定最佳碳源为果糖、最佳氮源为硝酸铵进行后续的第1次正交试验。
|
图2 不同碳源和不同氮源对MnP活性的影响 Fig.2 Effect of different carbon and nitrogen sources on MnP activity produced by C. unicolor |
第1和第2次正交试验和方差分析结果分别见表 3、表 4和表 5。通过比较第1次正交试验5因素4个不同水平的均值ki,得到每个因素的最大平均值,从而得出产酶组合培养基的最优配方为A1B1C1D4E2,即果糖10 g·L-1、氮源浓度5 mmol·L-1即硝酸铵0.2 g·L-1、Mn2+浓度2.67 mmol·L-1、接种量9片、装液量70 mL。通过极差和方差分析,排列出5因素对MnP活性影响的主次顺序依次为B>A>C>E>D,即氮源浓度对MnP活性影响最大,其次是果糖浓度、Mn2+浓度、装液量和接种量。从第1次正交试验结果可以看出,优化的培养条件是最低的碳源浓度、氮源浓度、Mn2+浓度,较低的装液量及最高的接种量,其中最低的50 mL装液量与较低的70 mL装液量MnP活性均值的差异不是很大。从表 3可以看出,第1次正交试验最高的MnP活性出现在第2组为54.96 U·L-1,是初始培养条件最高酶活的2.98倍。通过比较第2次正交试验4因素3个不同水平的均值ki,得到4因素的最大平均值,从而得出产酶组合培养基的最优配方为F3G1H3I1,即pH5.5、吐温80加入量0、培养温度34 ℃、(150 r·min-1)摇瓶培养、250 mL三角瓶70 mL的装液量。通过极差和方差分析,排列出4个因素影响MnP活性的主次顺序依次为F>I>G>H,即pH对产酶影响最大,其次是装液量、吐温80加入量、培养温度。从第2次正交试验结果可以看出,优化的培养条件是最高的pH和培养温度、不加入吐温80和最低的摇瓶培养装液量。从表 4可以看出,第2次正交试验最高的MnP活性出现在第9组为93.83 U·L-1,是初始培养条件最高酶活的5.1倍。方差分析的显著性结果表明,第1次和第2次正交试验所选取的9个因素对MnP活性的影响均为显著,说明这9个因素对MnP的活性大小都起到很重要的作用。
|
|
|
|
|
|
在第1次正交试验最佳组合,即果糖10 g·L-1、硝酸铵0.2 g·L-1、Mn2+浓度2.67 mmol·L-1、接种量9片、装液量70 mL、29 ℃下培养7 天后,测定MnP活性为55.23 U·L-1,第2次正交试验最佳组合,即在第1次正交试验最佳组合的基础上改变pH5.5、吐温80加入量0、150 r·min-1 摇瓶培养、34 ℃下培养7天后,测定MnP活性为95.47 U·L-1。对比2次正交试验各参数其他水平下所获得的MnP活性,该结果为最高,表明正交试验得当,结果可靠。
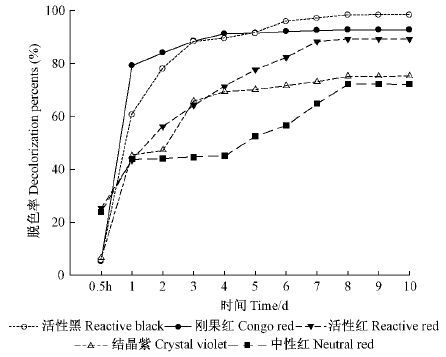
2.5 优化后的一色齿毛菌胞外酶液对5种染料的脱色效果在本项试验中,首先测得了3种结构类型5种染料其50 mg·L-1的水溶液在各自最大吸收峰处的波长值与其对应的吸光值,其中偶氮类的活性黑λmax为595,其对应的吸光值为1.319; 活性红λmax为539,吸光值为0.753; 刚果红λmax为501,吸光值为1.651; 杂环类的中性红λmax为528,吸光值为3.043; 三苯基甲烷类的结晶紫λmax为584,吸光值为2.331。根据优化后的培养条件即果糖10 g·L-1、硝酸铵0.2 g·L-1、Mn2+浓度2.67 mmol·L-1、调整pH为5.5、150 r·min-1摇瓶培养、250 mL三角瓶70 mL装液量、接种$\phi $=8 mm的菌片9片、在34 ℃下进行培养,由于在初始培养条件下一色齿毛菌产MnP的酶活规律曲线表明一色齿毛菌产MnP在7天时活性就会达到最高,以后会下降,因此优化培养也是选择7天时开始进行脱色试验,其胞外酶液对5种染料在不同时间的脱色结果见图 3。由图 3可以看出,经0.5 h脱色后,对活性红、中性红、结晶紫、活性黑和刚果红的脱色率分别达到25.5%,23.9%,6.6%,5.7%和5.13%。在1天内对刚果红的脱色反应最为迅速,1天时的脱色率已达到79.2%; 活性黑次之,脱色率为60.6%; 然后是活性红43.5%、结晶紫45.1%和中性红43.9%。胞外酶液对刚果红的脱色是在4天后脱色能力不再上升,脱色率在达到91.3%时基本保持稳定; 对活性黑是在6天之后脱色率不再上升,此时脱色率达到95.9%; 对活性红、结晶紫和中性红都是在8天之后脱色率不再上升,此时脱色率分别为89.4%,75.2%和72.3%。8天时对活性黑的脱色最为彻底,脱色率已高达98.4%; 对刚果红次之,脱色率为92.8%。
|
图3 MnP活性优化后的胞外酶液对5种染料脱色率随时间的变化 Fig.3 The decolorization percents of extracellular enzyme solution to 5 kinds of dyes |
由于白腐菌对染料的脱色作用是分别来源于菌丝体对染料分子的吸附作用和木质素降解酶系与染料分子发生氧化还原反应的综合结果,因此,试验中对照组A0值的测得是将培养液高压灭菌后再分别加入染料的吸光值,这一部分即是由于菌丝体对染料分子的吸附作用所获得的脱色效果,而与前面的去离子水为对照测得的吸光值不同,从而消除了由于菌丝体的吸附作用所造成的脱色,使脱色率的结果仅来源于胞外酶液的作用。从5种染料在加入到高压灭菌的培养液后测得的吸光值数据来看也可充分证明这一点,这5个吸光值分别是活性黑1.243、活性红0.604、刚果红0.681、中性红1.191和结晶紫的2.267,都比5种染料其50 mg·L-1对应水溶液的吸光值小,这足以说明菌丝体的吸附作用能造成部分脱色效果,但即使这种仅来源于胞外酶液的脱色率也很高。
3 结论与讨论通过在初始条件下培养、最佳碳源和最佳氮源的筛选和2次正交试验对一色齿毛菌产MnP条件的研究,得到以下结论: 较低浓度的碳源与氮源、较低浓度的Mn2+、较低的装液量、较低的底物浓度和较高的接种量对一色齿毛菌产MnP更为有利,较酸化的培养液和加入吐温80不利于MnP的产生,而适当提高培养温度有利于提高MnP活性。 分析碳氮对MnP的影响,可能是由于低浓度的碳氮能刺激一色齿毛菌更快地产生MnP。多数白腐菌产MnP对Mn2+具有依赖性,在一定范围内随Mn2+浓度的增加产酶量增大(Scheel et al., 2000;Nuske et al., 2002),但本研究较低浓度的Mn2+更利于MnP的产生,怀疑是所选择的Mn2+浓度范围偏高。适合的溶氧量有利于MnP的产生,所以本研究中,较低的装液量使溶氧量相对增加,从而更利于MnP的产生。后续试验还需进一步测试更低浓度的碳源、氮源、Mn2+浓度对一色齿毛菌产MnP的影响,以进一步提高MnP的产量。
由于偶氮类染料占合成染料的80%以上,因此本试验选择了3种常见的偶氮染料、1种杂环类染料和1种三苯基甲烷类染料。对5种染料的脱色试验表明: 一色齿毛菌产MnP优化后的胞外酶液对3种结构类型的5种染料都有较大程度的脱色降解能力。一色齿毛菌对3种偶氮类染料活性黑、刚果红和活性红都有较彻底的脱色降解,对三苯甲烷类染料结晶紫和杂环类染料中性红的脱色能力也达到了相当高的程度。因此,在对染料废水进行有效的生物处理方面具有良好的应用前景。
| [1] |
崔艳红,韩庆功,常魁珍,等. 2012. 木质层孔菌产锰过氧化物酶条件的优化及酶学性质研究. 饲料工业,33(12): 55-59.( 1) 1)
|
| [2] |
董旭杰,曹福祥,龙绛雪. 2009. 木质层孔菌产锰过氧化物酶条件的优化. 江西农业学报, 21(3): 94-95.( 1) 1)
|
| [3] |
李慧蓉,李华兵,李文琼,等. 1999. 黄孢原毛平革菌对6种染料的脱色降解. 环境科学研究,12(3): 14-17.( 1) 1)
|
| [4] |
吴会广,蔡宇杰,苑博华,等. 2008. 锰过氧化物酶产生菌的发酵优化及酶学性质研究.食品与机械,24(4):17-21.( 1) 1)
|
| [5] |
严滨,周集体,柳广飞,等. 2008. 偶氮染料生物降解机理的研究. 环境科技,21(5):1-5.( 1) 1)
|
| [6] |
闫洪波. 2009. 偏肿拟栓菌锰过氧化物酶cDNA基因克隆及在毕赤酵母中的表达.哈尔滨: 东北林业大学博士学位论文.( 1) 1)
|
| [7] |
杨晓宽,路福平,杜连祥. 2004. 黄孢原毛平革菌产锰过氧化物酶培养基优化. 天津科技大学学报,19(2): 29-32.( 1) 1)
|
| [8] |
尹亮, 谭龙飞. 2004. 黄孢原毛平革菌生产锰过氧化物酶的发酵条件研究. 生物技术,14(4):40-42.( 1) 1)
|
| [9] |
张玉龙, 池玉杰, 闫洪波. 2011. 偏肿栓菌产锰过氧化物酶条件优化. 林业科学, 47(8):88-94.( 1) 1)
|
| [10] |
Dos Santos Bazanella G C, de Souza D F, Castoldi R,et al. 2013. Production of laccase and manganese peroxidase by Pleurotus pulmonarius in solid-state cultures and application in dye decolorization. Folia Microbiol,58(6):641-647.( 1) 1)
|
| [11] |
Forgacs E,Cserhati T,Oros G. 2004. Removal of synthetic dyes from wastewaters:a review. Environment International,30(7):953-971.( 1) 1)
|
| [12] |
Hariharans S, Nambisan P. 2013. Optimization of lignin peroxidase, manganese peroxidase, and Lca production from Ganoderma lucidum under sollid state fermentation of pineapple leaf. Bioresources, 8(1): 250-271.( 1) 1)
|
| [13] |
Janusz G, Kucharzyk K H, Pawlik A, et al. 2013. Fungal laccase, manganese peroxidase and lignin peroxidase: gene expression and regulation. Enzyme and Microbial Technology, 52(1): 1-12.( 1) 1)
|
| [14] |
Kirk, T K. Cullen D. 1998. Enzymology and molecular genetics of wood degradation by white-rot fungi//Young R A, Akhtar M. Environmentally Friendly Technologies for the Pulp and Paper Industry. John Wiley and Sons, New York, 273-307.( 1) 1)
|
| [15] |
Kirk T K, Schultz E, Connors W J, et al. 1978. Influence of culture parameters on lignin met abolism by Phanerochaete chrysosorium. Archives of microbiology,117(3): 277-285.( 1) 1)
|
| [16] |
Modi H.A, Rajput G, Ambasana C. 2010. Decolorization of water soluble azo dyes by bacterial cultures,isolated from dye house effluent. Bioresource Technology, 101(16): 6580-6583.( 1) 1)
|
| [17] |
Nuske J,Scheibner K,Hofrichter M,et al. 2002. Large scale production of manganese-peroxidase using agaric white-rot fungi.Enzyme and Microbial Technology,30(4): 556-561.( 1) 1)
|
| [18] |
Patrick F, Mtui G, Mshandete A M, et al. 2011. Optimization of laccase and manganese peroxidase production in submerged culture of Pleurotus sajorcaju. African Journal of Biotechnology, 10(50): 10166-10177.( 1) 1)
|
| [19] |
Saratale R G,Saratale G D,Chang J S,et al. 2011. Bacterial decolorization and degradation of azo dyes: a review. J Taiwan Inst Chem Eng, 42(1):138-157.( 1) 1)
|
| [20] |
Saravanakumar T, Palvannan T, Kim D H, et al. 2013. Manganese peroxidase h4 isozyme mediated degradation and detoxification of triarylmethane dye malachite green: optimization of decolorization by response surface methodology. Appl Biochem Biotechnol,171(5):1178-1193.( 1) 1)
|
| [21] |
Scheel T,Hfer M,Ludwig S,et al. 2000. Differential expression of manganese peroxidase and laccase in white-rot fungi in the presence of manganese or aromatic compounds. Appl Microbiol Biotechno1,54(5): 686-691.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

