文章信息
- 周瑞莲, 解卫海, 侯玉平, 王艳芳, 黄清荣
- Zhou Ruilian, Xie Weihai, Hou Yuping, Wang Yanfang, Huang Qingrong
- 东北沙地7种植物高温时段的生理适应对策
- Analysis on the Differences in the Strategy of Physiological Regulation among Psammophytes with Different Family and Genera in Natural Habit of Desert
- 林业科学, 2014, 50(6): 74-81
- Scientia Silvae Sinicae, 2014, 50(6): 74-81.
- DOI: 10.11707/j.1001-7488.20140610
-
文章历史
- 收稿日期:2013-04-12
- 修回日期:2013-12-17
-
作者相关文章
沙生植物抗旱、耐寒、耐热、耐盐碱,已成为未来林木、作物和牧草抗逆育种的重要种质资源,并在环境修复、生态稳定、农业高产稳产和持续发展中起重要作用(赵哈林,2012)。目前对沙漠植物抗逆生理机制研究较多。在人工水分胁迫下差不嘎蒿(Artemisia halodendron)、芦苇(Phragmites communis)、狗尾草(Setaria viridis)叶片抗氧化酶(SOD,POD,CAT)活力随水分胁迫强度增加而增高、细胞膜透性和MDA含量增加(周瑞莲等,1999)。在土壤反复干旱复水处理中, 差不嘎蒿叶片抗氧化酶活力和MDA含量随土壤干旱加剧而增高,随灌水而降低(Luo et al.,2011)。 在自然条件下, 岩黄芪属(Hedysarum)3种植物和油蒿(A. ordosica)在中午干旱时积累渗透调节物并提高抗氧化酶活力(高天明等,2008)。随着水分亏缺程度的增加,黄柳叶片可溶性糖和脯氨酸含量增加,SOD和POD活力增高(崔秀萍,2008)。沙质草原沙漠化过程中扁蓿豆(Melissitus ruthenicus)、羊草(Leymus chinensis)、糙隐子草(Cleistogenes squarrosa)种群优势度增加并与种群抗氧化能力增强呈正相关(朱志梅等,2004)。研究表明:沙生植物抵御恶劣环境的能力与其细胞具有较强的抗氧化和渗透调节能力密切相关。但是也有研究发现,代谢类型不同的C3,C4和CAM植物在水分胁迫下脯氨酸积累模式不同。旱生植物细枝岩黄芪(Hedysarum scoparium),同化枝累积脯氨酸的数量高于中生植物钻天杨(Populus nigra var.italica)和槐树(Sophora japonica)的叶片,而沙生植物梭梭(Haloxylon ammodendron)的同化枝则低于槐树而高于钻天杨(王邦锡,1989),并认为脯氨酸累积在各种生态类型植物中不是普遍反应(王邦锡,1989)。
沙生植物种类较多,涉及的科属繁多,代谢类型多,生物学特性各异。目前对沙生植物抗逆生理机制的研究仅集中在几个具有固沙能力的沙生植物,其研究或是在人工模拟胁迫条件下进行,或是在自然条件下对不同生态型沙生植物逆境生理变化的相异性分析,而对不同科属沙生植物抗逆机制异同性研究鲜有报道。揭示不同科属沙生植物在自然状况下抗逆机制的差异,对未来合理有效地开发沙生植物种质基因具有重要作用,同时深入了解沙生植物在干旱适应中蛋白质组、代谢组方面的信息对了解植物抗旱复杂分子机制非常重要(Zhu et al.,2007;Zhu,2002)。本文选择长期生长在吉林松嫩沙地和内蒙古呼伦贝尔沙地上的7种沙生植物,在夏季研究自然温变状况下其抗氧化酶和渗透调节物含量的日变化,揭示不同科属植物对环境适应的生理差异,为未来沙生植物抗逆基因的合理开发提供理论指导。
1 材料与方法 1.1 研究区自然概况松嫩沙地的研究区设在吉林杜尔伯特县新店林场(43°—47° N,122°—126° E),地处松嫩沙地腹地。该区属中温带半湿润向半干旱气候的过渡带,年均气温3.6~4.4 ℃,无霜期148天,年降水量428 mm,年均风速2.5~4.2 m·s-1。该区沙质草地优势植物种为榆树(Ulmus pumila)、山杏(Prunus armeniaca)、大针茅(Stipa gr and is)、线叶菊(Filifolium sibiricum)和羊草等。
呼伦贝尔沙地的研究区设在内蒙古新巴尔虎左旗北部的嵯岗镇附近(47°05′—53° N,115°13′—126°04′ E)。该区属于温带半干旱大陆性季风气候,冬季严寒而漫长,夏季温和而短促,年均气温-0.4 ℃,无霜期110天左右,年平均降水量268 mm,多大风,年均风速4 m·s-1。该区主要植物有大针茅、克氏针茅(S.krylovii)、羊草、线叶菊、冷蒿(Artemisia frigida)等,沙化草地常见黄柳(Salix gordejevii)和差不嘎蒿等。
1.2 试验样地和试验取材2010年8月初,在呼伦贝尔沙地、松嫩沙地,分别选取差不嘎蒿(菊科Compositae)、小叶锦鸡儿(Caragana microphylla)(豆科Leguminosae)、黄柳(杨柳科Salicaceae)、猪毛菜(Salsola collina)(藜科Chenopodiaceae)、冰草(Agropyron cristatum)(禾本科Gramineae)、扁蓿豆(Melissitus ruthenicus)(豆科)、胡枝子(Lespedeza bicolor)(豆科)7种沙生植物为测定植物。在呼伦贝尔沙地(8月1—3日)、松嫩沙地(8月5—6日)取样。根据天气预报,选择晴好无雨的晴天,在每个试验样地连续取材2天。依据沙漠环境日温差大这一特点(早上16 ℃,中午42 ℃,晚上19 ℃),试验取样分别在早(6: 00,10: 00)、中午(12: 00,14: 00),晚上(18: 00)进行。并在取样的前1天,在试验样地选择健壮、株型中等、株高一致的植株为试验材料并用红色标签标记,每种标记15株。取样时用剪刀从标记植株3/4株高以上部位叶片随机剪下,每次剪少许。并将同种不同标记植株上剪取的叶片混匀、包裹,立刻用液氮固定,带回实验室用于抗氧化物酶活力、渗透调节物质和丙二醛的测定。
1.3 试验方法 1.3.1 酶液提取酶的提取是在4 ℃条件下进行。从液氮固定的材料中随机称取一定量的样叶于预冷研钵中,加入酶提取液(磷酸缓冲液,pH7.8),冰浴上研磨成匀浆,在15 000 r·min-1 4 ℃条件下离心15 min,上清液用于酶的测定。每个处理的酶液提取重复2次。
1.3.2 生理指标测定采用Sundar等(2004)的氯化硝基四氮唑蓝(NBT)光化还原法测定SOD活性; 采用Drazkiewicz(2004)的过氧化氢碘量法测定CAT活性; 采用张志良(2003)的愈创木酚法测定 POD活性、硫代巴比妥酸(TBA)比色法测定丙二醛(MDA)含量、茚三酮法测定游离脯氨酸; 采用张治安(2004)的蒽酮比色法测定可溶性糖含量。每个指标重复5次以上。
1.4 数据处理试验数据采用3个以上重复的平均值±标准误(mean±SE,st and ard error of mean),用SPSS 11.5软件进行数据分析。
2 结果与分析人工模拟控制胁迫处理,较易获得不同胁迫时间和不同胁迫强度下植物材料,并获得相对准确的生理生化测试结果。而在自然条件下,沙生植物叶片抗逆生理指标易受日光强变化、日温变、植物代谢差异的影响。为了排除这些干扰,并在自然条件下获得不同科属植物抗逆生理变化较准确的研究结果,本试验测定2个温带沙地生长的7 种沙生植物叶片膜脂过氧化产物、抗氧化酶活力和渗透调节物含量的日变化。 通过比较日均MDA和渗透调节物含量及抗氧化酶活力大小,以揭示不同科属沙生植物抗逆生理调控机制的差异。
2.1 不同科属沙生植物叶片MDA含量日变化两沙地日间气温变化较大(16~53 ℃)。两沙地7种沙生植物日间叶片MDA含量均表现在早上日出和晚上日落气温较低时较低,在中午气温增高时增加(图 1)。但日间叶片MDA含量除松嫩沙地黄柳和小叶锦鸡儿变化幅度较大外,其他几个日变化相对较小。7个不同科属沙生植物种间MDA含量差异显著(P < 0.05)。按日均叶片MDA含量,可将7种沙生植物分为日均MDA高含量组(扁蓿豆,小叶锦鸡儿)、中含量组(胡枝子、冰草)和低含量组(猪毛菜、黄柳、差不嘎蒿)。其中高含量组均为豆科植物,其叶片MDA含量较中和低含量组分别高57%和1.8倍。两沙地均以扁蓿豆最高,差不嘎蒿较低。呼伦贝尔扁蓿豆叶片日均MDA含量较差不嘎蒿和黄柳高1.7倍和1.9倍;松嫩沙地扁蓿豆叶片日均MDA含量比猪毛菜和差不嘎蒿高2.9倍和3.8倍。两沙地相比,松嫩沙地扁蓿豆、黄柳、小叶锦鸡儿叶片日均MDA含量高于呼伦贝尔沙地,且两者差异显著(P < 0.05)。
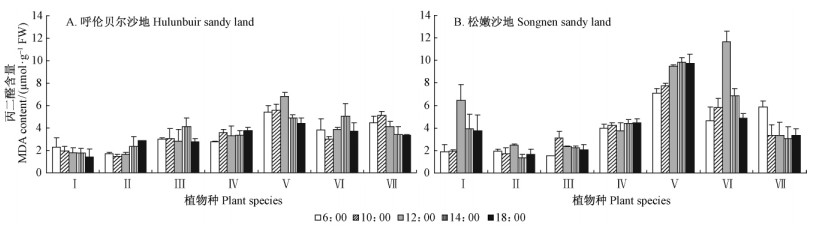 |
图 1 自然条件下呼伦贝尔沙地、松嫩沙地不同科属沙生植物叶片MDA对日温变化的响应 Fig. 1 Comparison of the daily changes in MDA contents in leaves of psammophytes in different families and genera in Hulunbuir sandy land,Songnen sandy land under natural environment Ⅰ黄柳 S. gordejevii Ⅱ差不嘎蒿A.halodendron Ⅲ 猪毛菜S.collina Ⅳ冰草A. cristatum Ⅴ扁蓿豆M. ruthenicus Ⅵ小叶锦鸡儿C. microphylla Ⅶ胡枝子L. bicolor 下同。The same below |
两沙地7种沙生植物日间叶片SOD活力在早晚低温(19 ℃)和中午高温(53 ℃)时较高(图 2)。 但自然状况下不同科属沙生植物叶片日均 SOD 活力差异极为明显(P <0.01)。根据7种沙生植物日均叶片SOD活力,可将其分高活力组(黄柳、胡枝子)、中活力组(扁蓿豆、猪毛菜)和低活力组(冰草、小叶锦鸡儿、差不嘎蒿)。高活力组较中和低活力组高1.7倍和2.2倍。两沙地叶片日均SOD活力均以黄柳最高。呼伦贝尔沙地的黄柳和胡枝子叶片日均SOD活力比活力最低的差不嘎蒿高3.7和3.3倍。松嫩沙地的黄柳和胡枝子叶片日均SOD活力比活力最低的小叶锦鸡儿高2.8和2.7倍。 自然状况下,松嫩沙地 7种沙生植物的叶片日均SOD活力略高于呼伦贝尔沙地,但差异不显著。
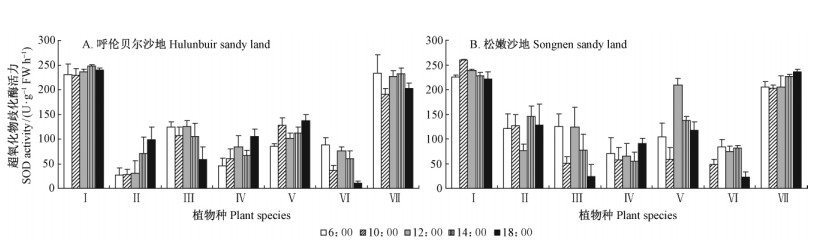 |
图 2 自然条件下呼伦贝尔沙地、松嫩沙地不同科属沙漠植物叶片SOD对日温变化的响应 Fig. 2 Comparison of the daily changes in SOD activity in leaves of psammophytes in different families and genera in Hulunbuir sandy land,Songnen sandy land under natural environment |
自然状况下,沙生植物叶片日POD 活力略有波动,在中午气温高时较大,其中波动幅度较大的是冰草、小叶锦鸡儿和黄柳(图 3)。 7种沙生植物叶片日均POD活力差异显著(P <0.05),甚至极显著(P <0.01)。 按叶片日均POD活力大小可将其分高活力组(扁蓿豆、小叶锦鸡儿)、中活力组(冰草、黄柳)、低活力组(胡枝子、猪毛菜、差不嘎蒿)。高活力组均为豆科植物。呼伦贝尔沙地高活力组日均POD活力较中和低活力组分别高2.3和8.6倍。松嫩沙地高活力组日均POD活力较中和低活力组分别高93%和6.3倍。 两沙地均以扁蓿豆叶片日均POD活力为最高。呼伦贝尔沙地扁蓿豆叶片日均POD活力分别较活力最低的差不嘎蒿和胡枝子高11和15倍。 松嫩沙地扁蓿豆叶片日均POD活力也较差不嘎蒿和胡枝子高6.6和8倍。除松嫩沙地黄柳叶片日均POD活力明显高于呼伦贝尔沙地外,两沙地其他6种沙生植物叶片日均POD活力差异较小。
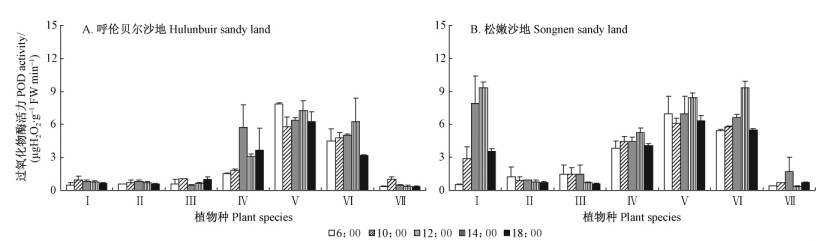 |
图 3 自然条件下呼伦贝尔沙地、松嫩沙地不同科属沙漠植物叶片POD对日温变化的响应 Fig. 3 Comparison of the daily changes in POD activity in leaves of psammophytes in different families and genera in Hulunbuir sandy land,Songnen sandy land under natural environment |
自然状况下,日间7种沙生植物叶片CAT 活力变化略有不同,但波动幅度较小,只有冰草日间叶片CAT活力变化较大(图 4)。 同样,7种沙生植物日均叶片CAT活力差异极显著(P <0.01)。按叶片日均CAT 活力大小可将7种沙生植物分为日间CAT高活力组(冰草、扁蓿豆)、中活力组(小叶锦鸡儿)和低活力组(黄柳、胡枝子、差不嘎蒿、猪毛菜)。其中呼伦贝尔沙地高活力组叶片日均CAT活力较中和低活力组分别高49%和2.4倍,松嫩沙地高活力组比中和低CAT 活力组分别高1.4和2.5倍。同样,两沙地均以冰草叶片日均CAT活力为最高。呼伦贝尔冰草叶片日均CAT活力较差不嘎蒿和猪毛菜分别高2.4和3.3倍; 松嫩沙地冰草较猪毛菜和差不嘎蒿分别高4.1倍和4.6倍。两沙地除了扁蓿豆和冰草叶片日均CAT活力略有差异,其他5种沙生植物差异不明显。
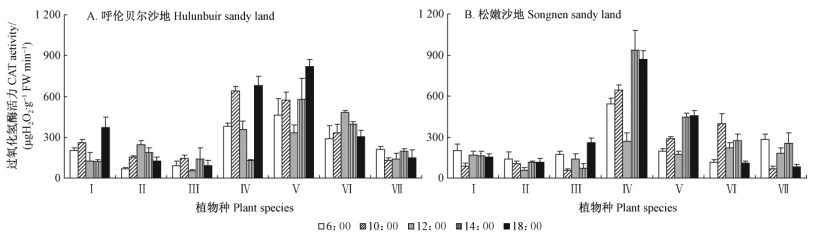 |
图 4 自然条件下呼伦贝尔沙地、松嫩沙地不同科属沙生植物叶片CAT对日温变化的响应 Fig. 4 Comparison of the daily changes in CAT activity in leaves of psammophytes in different families and genera in Hulunbuir sandy land,Songnen sandy land under natural environment |
对短期水分、盐胁迫处理研究发现,植物会在短时间内快速积累脯氨酸和可溶性糖等渗透调节物质,它们可维护细胞水分平衡、防止细胞伤害和蛋白质变性(王邦锡等,1989; Zhu et al.,2002)。但对长期适应干旱环境生长的沙生植物体内渗透调节物变化不了解。 本研究表明,自然状况下,日间沙生植物叶片脯氨酸含量略有波动,在中午气温高时增加(图 5)。但是两沙地种间日均脯氨酸含量差异显著(P < 0.05)。两沙地均以小叶锦鸡儿日均脯氨酸含量最高,黄柳最低。呼伦贝尔沙地小叶锦鸡儿日均脯氨酸含量是黄柳的38倍,比其他5种沙生植物日均含量高7.3倍。松嫩沙地小叶锦鸡儿日均脯氨酸含量是黄柳的33倍,比其他5种植物日均含量高7.3倍。
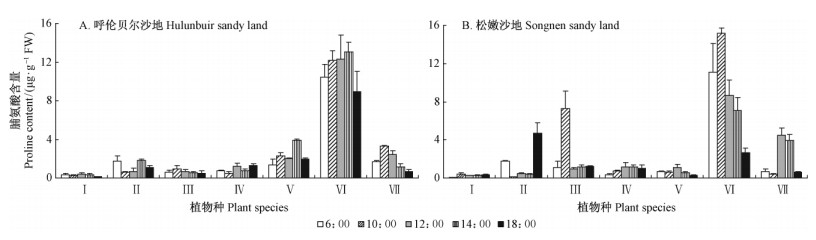 |
图 5 自然条件下呼伦贝尔沙地、松嫩沙地不同科属沙生植物叶片脯氨酸对日温变化的响应 Fig. 5 Comparison of the daily changes in the content of proline in leaves of psammophytes in different families and genera in Hulunbuir sandy land and Songnen sandy land under natural environment |
7种沙生植物叶片可溶性蛋白质含量虽然日间呈不同波动方式,但变化不显著(图 6)。种间叶片日均可溶性蛋白质含量差异显著(P < 0.05)。两沙地均以2个豆科植物(扁蓿豆和小叶锦鸡儿)叶片日均可溶性蛋白质含量最高,其分别比呼伦贝尔沙地含量最低的猪毛菜高1.4和1.1倍,比松嫩沙地最低的黄柳分别高65%和96%。
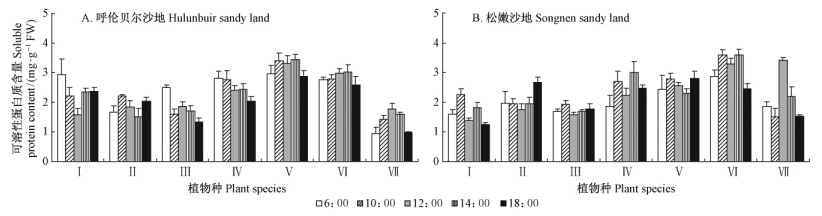 |
图 6 自然条件下呼伦贝尔沙地、松嫩沙地不同科属沙生植物叶片可溶性蛋白质对日温变化响应 Fig. 6 Comparison of the daily changes in the content of soluble protein in leaves of psammophytes in different families and genera in Hulunbuir sandy land and Songnen sandy land under natural environment |
自然状况下,日间叶片可溶性糖含量在中午气温高时较高,但日间可溶性糖含量变化不显著(除黄柳和冰草)(图 7)。种间叶片日均可溶性糖含量差异显著(P < 0.05)。按叶片日均可溶性糖含量的多少可将7种沙生植物分为高糖组(黄柳、冰草)和低糖组(猪毛菜、差不嘎蒿、扁蓿豆、小叶锦鸡儿、胡枝子)。两沙地均以黄柳和冰草日均含量最高,其余5种日均含量很低(且差异不显著)。 呼伦贝尔沙地冰草和黄柳日均可溶性糖含量分别比其余5种高2.2和2.0倍,松嫩沙地的冰草和黄柳日均可溶性糖含量也分别比其余5种分别高1.4和2.7倍。两沙地中,呼伦贝尔沙地猪毛菜和冰草叶片可溶性糖含量明显高于松嫩沙地。
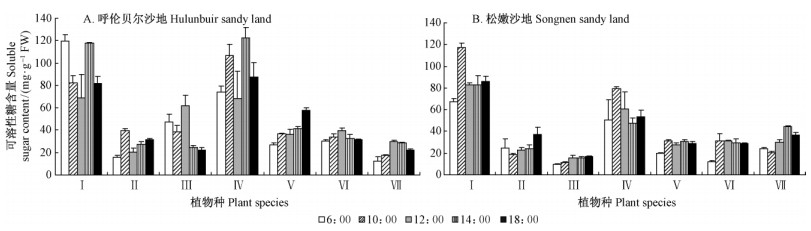 |
图 7 自然条件下呼伦贝尔沙地、松嫩沙地不同科属沙生植物叶片可溶性糖对日温变化响应 Fig. 7 Comparison of the daily changes in the content of soluble sugar in leaves of psammophytes in different families and genera in Hulunbuir sandy land and Songnen sandy land under natural environment |
极端温度(Mishra et al.,1992;Zhang et al.,1995)、干旱(Zhang et al.,1994;Smirnoff,1993)和高辐射(Neill et al.,2003)胁迫会引起植物体内活性氧自由基积累,引发膜脂过氧化而使MDA含量增加。在正常和胁迫条件下抗逆性强的野生甜菜(Beta vulgaris)(Bor et al.,2003)和耐盐的无芒虎尾草(Chloris gayana)体内MDA含量明显较低(Luna et al.,2000)。逆境条件下,细胞内MDA含量与植物存活和抗逆性成负相关(Luna et al.,2000)。因此,测定细胞内MDA含量已成为筛选植物抗逆品种的一个工具(Luna et al.,2000;Cavalcanti,2004)。对呼伦贝尔和松嫩沙地自然条件下生长的几种不同科属沙生植物日间叶片MDA含量分析表明: 7种不同科属沙生植物叶片日间膜脂过氧化程度不同,种间MDA含量差异显著(P < 0.05)。两沙地叶片日均MDA含量均以豆科植物(扁蓿豆、小叶锦鸡儿)为最高,猪毛菜、黄柳和差不嘎蒿最低,前组比后组高2~3倍。如果以叶片日均MDA含量高低衡量沙生植物抗逆性大小,猪毛菜、黄柳和差不嘎蒿抗逆性最强。日间维持较低的膜脂过氧化水平,可能是其在沙漠环境下维护细胞膜的完整性、适应沙漠环境成为沙漠优势植物的重要生理原因。
沙漠环境下维持细胞低氧自由基浓度和低膜脂过氧化水平对维护细胞膜完整性、日间光合作用、植物的生存有重要作用。由于抗氧化酶是诱导酶(Smirnoff,1993),日间猪毛菜和差不嘎蒿叶片内较低的氧自由基浓度可能是其抗氧化酶活力较低的原因。叶内细胞膜脂过氧化水平与抗氧化酶活力和渗透调节能力成正相关。通过抗氧化酶和渗透调节物抑制膜脂过氧化对维护细胞内氧自由基代谢平衡和沙生植物适应沙漠环境也是十分重要的。此外,不同科属沙生植物在适应沙漠环境生长中所需的抗氧化酶种类和渗透调节物种类不同。Sairam等(2000;2002)也研究发现,2个抗逆性强的小麦(Triticum aestivum)品种,一个品种抗坏血酸过氧化物酶(APX)活力高,而另一个则SOD和CAT活力较高,APX活力较低。小粒咖啡(Coffea arabica)幼苗根在冷胁迫下,APX和CAT活力没有改变,但POD活力大幅度增加(Queiroz,1998)。抗氧化酶活力在种间和基因型间存在明显差异(Cavalcanti et al.,2004)。本研究发现,在抑制膜脂过氧化维护氧自由基代谢平衡上,黄柳主要依赖可溶性糖和SOD;冰草依赖可溶性糖和POD及CAT。同科不同属的豆科植物(扁蓿豆、胡枝子、小叶锦鸡儿),它们除了在可溶性糖含量上没有差异外,日间叶片膜脂过氧化程度和其他生理指标均存在差异。扁蓿豆叶片日均MDA含量、POD和CAT活力均最高,它们分别比小叶锦鸡儿、胡枝子高35%和75%,28%,50%和11倍、1.5倍。但小叶锦鸡儿叶片日均脯氨酸含量最高,分别比扁蓿豆、胡枝子高5.8倍、4.4倍。而胡枝子叶片日均MDA含量、POD和CAT活力、可溶性蛋白均较低,但SOD活力较高,分别比扁蓿豆和小叶锦鸡儿高85%和2.8倍。虽然植物抗逆性与植物抗氧化酶活力的维持和增高相关(Sairam et al.,2000;Lascano et al.,2001;Blokhina et al.,2003),但在漫长的沙漠环境适应过程中,不同科属沙生植物渗透调节机制和控制膜脂过氧化机制有差异。
不同科属沙生植物渗透调节物种类的差异可能与其科属间植物基础代谢不同有关。豆科植物蛋白质含量丰富,日间它将光合作用固定的碳主要用于蛋白质合成。因此,日间气温变化易使叶片蛋白质代谢受到影响,导致脯氨酸氧化受抑而积累(Delauney et al.,1993)。相反,黄柳和冰草日间叶片光合作用固定的C主要用于淀粉合成,日间气温增高、叶片缺水、代谢受阻时便发生可溶性糖积累导致日间可溶性糖含量较高。因此,豆科植物在长期适应沙漠干旱中以积累脯氨酸以维持叶片水分平衡并抑制膜脂过氧化; 禾本科的冰草和杨柳科的黄柳以积累可溶性糖维持叶片水分平衡。
不同科属沙生植物抗逆机制的不同还与其光合代谢途径和生物学特性有关。本研究结果表明,猪毛菜为C4植物,其表皮较厚的角质层和发达的薄壁组织提高了水分储存能力(高松等,2009; Voznesenskaya et al.,1986)。另外猪毛菜和差不嘎蒿均为丝状条形叶,该种叶片具有较强的保水和散热能力,有利于维护日间细胞水分平衡,降低了氧自由基产生的速率,故抗氧化酶活力和渗透调节物含量均较低。差不嘎蒿这种高效维持叶片水分平衡的能力,可能是其成为科尔沁和呼伦贝尔地区流动、半固定沙地植被建群种和十分优良的固沙植物原因之一(周海燕,2004)。相反,扁蓿豆和胡枝子叶片相对较大,均具有旱生解剖结构(石凤翎等,2005; 崔秀萍,2008),但由于其茎斜卧地面(0.3 m)使其光合叶片距地表较黄柳(1.2 m)近,叶片易遭受沙漠地表热辐射导致叶片水分蒸腾快、水分饱和亏缺度增加引起细胞氧自由基积累、膜脂过氧化加剧、MDA含量增高。但同时扁蓿豆POD和CAT活力增强,胡枝子SOD活力增强抑制膜脂过氧化,说明其生命力较强(朱志梅等,2004)。
生长在同一沙漠环境的不同科属沙生植物,它们适应高温干旱沙漠环境的生理调控机制不同。猪毛菜和差不嘎蒿属于形态保水抗旱类型; 其他豆科植物、杨柳科黄柳和禾本科冰草则属生理调节型,即通过抗氧化酶和渗透调节物抑制膜脂过氧化、维护氧自由基代谢平衡、维持细胞水分平衡而维持生存和生长。
综上所述,生活在沙漠环境的不同科属沙生植物,在长期适应沙漠环境中形成了各自特有的生物学特征和生理代谢途径。 它们特有的生物学特性对防止水分丢失、维持水分平衡起重要作用,是沙生植物维持水分平衡的外部调控策略。 同时,不同科属植物充分利用自身代谢特性快速积累脯氨酸(小叶锦鸡儿)和可溶性糖(黄柳和冰草)以维持细胞渗透压和水分平衡,这是沙生植物维持细胞水分的内部调控策略。另外,不同科属沙生植物抗氧化酶活力与其MDA 含量成正相关。这进一步表明,在漫长的沙生植物适应沙漠环境生长的进化中,不同科属沙生植物的渗透调节机制和控制膜脂过氧化机制发生分异,但维持细胞水分平衡和氧自由基代谢平衡、防止膜脂过氧化是沙生植物维持细胞完整而生存的生理调控对策。
| [1] |
崔秀萍.2008.浑善达克沙地黄柳生理生态适应性研究.呼和浩特:内蒙古农业大学博士学位论文.( 2) 2)
|
| [2] |
高松,苏培玺,严巧娣,等.2009.C4荒漠植物猪毛菜与木本猪毛菜的叶片解剖结构及光合生理特征.植物生态学报,33(2): 347-354.( 1) 1)
|
| [3] |
高天明,闫志坚,高丽.2008.四种沙漠植物的抗旱研究.中国农业科技导报,10(2): 105-109.( 1) 1)
|
| [4] |
石凤翎,郭晓霞,李红.2005.扁蓿豆抗旱形态解剖结构观察与分析.干旱地区农业研究,23(2): 115-118.( 1) 1)
|
| [5] |
王邦锡,黄久常,王辉.1989.不同植物在水分胁迫条件下脯氨酸的积累与抗旱性的关系.植物生理学报,15(1): 46-51.( 2) 2)
|
| [6] |
张志良,瞿伟菁.2003.植物生理学实验指导.北京:高等教育出版社.( 1) 1)
|
| [7] |
张治安,张美善,蔚荣海.2004.植物生理学实验指导.北京:中国农业科学技术出版社.( 1) 1)
|
| [8] |
赵哈林.2012.沙漠生态学.北京:科学出版社.( 1) 1)
|
| [9] |
周海燕,李胜功,李新荣,等.2004.科尔沁沙地两种沙生植物冷蒿和差不嘎蒿竞争策略的生理生态学依据.植物学报,46(3):284-293.( 1) 1)
|
| [10] |
周瑞莲,王海鸥.1999.在干旱高温胁迫中沙生植物抗脱水性与膜脂过氧化关系的研究.中国沙漠,19(supp1): 59-64.( 1) 1)
|
| [11] |
朱志梅,杨持.2004.沙漠化过程中四个共有种的生长和抗氧化系统酶类变化.应用生态学报,15(12): 2261-2266.( 2) 2)
|
| [12] |
Blokhina O,Virolainen E,Fagerstedt K V.2003.Antioxidants,oxidative damage and oxygen deprivation stress: a Review.Acta Ecologica Sinica,91: 179-194.( 1) 1)
|
| [13] |
Bor M,Ozdemit F,Turkan I.2003.The effect of salt stress on lipid perioxidation and antioxidants in leaves of sugar beet Beta vulgaris L.and wild beet Beta maritima L.Plant Sci,164:77-84.( 1) 1)
|
| [14] |
Cavalcanti F R,Oliveira J T A,Martins-Miranda A S.2004.Superoxide dismutase,catalase and peroxidase activities do not confer protection against oxidative damage in salt-stressed cowpea leaves.New Phytol,163(3):563-571.( 2) 2)
|
| [15] |
Delauney A J,Verma D P S,Krupa Z.1993.Proline biosynthesis and osmoregulation in plants.Plant J,4(2): 215-223.( 1) 1)
|
| [16] |
Drazkiewicz M,Skórzyńska-Polit E,Krupa Z, et al. 2004.Copper-induced oxidative stress and antioxidant defence in Arabidopsis thaliana. BioMetals,17(4): 379-387.( 1) 1)
|
| [17] |
Lascano H R,Antonicelli G E,Luna C M,et al. 2001.Antioxidant system response of different wheat cultivars under drought:field and in vitro studies.Ause J Agric Res,28(11):1095-1102.( 1) 1)
|
| [18] |
Luna C M,Garcia-Seffino L,Arias C,et al. 2000.Oxidative stress indicators as selection tools for salt tolerance in Chloris gayana. Plang Breed,119(4):341-345.( 2) 2)
|
| [19] |
Luo Y Y,Zhao X Y,Zhou R L,et al. 2011.Physiological acclimation of two psammophytes to repeated soil drought and rewatering.Acta Physiologiae Plantarum,33: 79-91.( 1) 1)
|
| [20] |
Mishra R K,Singhal G S.1992.Function of photosynthesis apparatus of intact wheat leaves under high light and heat stress and its relationship with peroxidation of thylakoid lipids.Plant Physiol,98:1-6.( 1) 1)
|
| [21] |
Neill S O,Gould K S.2003.Anthocyanins in leaves: Light attenuators or antioxidants Funct.Plant Biol,30(8): 865-873.( 1) 1)
|
| [22] |
Queiroz C G S,Alonso A,Mares G M,et al. 1998.Chilling-induced changes in membrance fluidity and antioxidant enyzyme activities in Coffea arabica L.roots.Bio Plant,41(3):403-413.( 1) 1)
|
| [23] |
Sairam R K,Srivastava G C,Saxena D C.2000.Increased antioxidant activity under elevated temperatures: A mechanism of heat stress tolerance in wheat genotypes.Biol Plant,43(2):245-251.( 2) 2)
|
| [24] |
Sairam R K,Veerabhadra R K,Srivastava G C,et al. 2002.Differential response of wheat genotypes to long term salinity stress in relation to oxidative stress,antioxidant acivity and osmolyte concentration.Plant Sci,163(5):1037-1064.( 1) 1)
|
| [25] |
Smirnoff N.1993.The role of active oxygen in the response of plants to water deficit and desiccation.New Phytol,125:27-58.( 2) 2)
|
| [26] |
Sundar D,Perianayaguy B,Reddy A.2004.Localization of antioxidant enzymes in the cellular compartments of sorghum leaves.Plant Growth Regulation,44(2): 157-163.( 1) 1)
|
| [27] |
Voznesenshaya E V,Gamaley Y V.1986.The ultrastructural characteristics of leaf types with Kranz anatomy.Botanicheskii Zhurnal,71: 1291-1307.( 1) 1)
|
| [28] |
Zhang J,Kirkham M B.1994.Drought-stress-induced changes in activites of superoxide dismutase,catalase and peroxidase in wheat species.Plant Cell Physoil,35(5): 785-791.( 1) 1)
|
| [29] |
Zhang J,Cui S,Li J,et al.Protoplasmic factors,antioxidant reponses,and chilling resistance in maize.Plant Physiol Bioche,33: 567-575.( 1) 1)
|
| [30] |
Zhu J H,Dong C H H,Zhu J K.2007.Interplay between cold-responsive gene regulation,metabolism and RNA processing during plant cold acclimation.Current Opinion in Plant Biology,10(3): 290-295.( 1) 1)
|
| [31] |
Zhu J K.2002.Salt and drought stress signal transduction in plant.Ann Rev Plant Bol,53:247-273.( 2) 2)
|
 2014, Vol. 50
2014, Vol. 50
